表达犬瘟热病毒融合蛋白基因重组腺病毒的构建与鉴定
2010-03-07鞠会艳高玉伟杨松涛夏咸柱
鞠会艳,高玉伟,杨松涛,夏咸柱*
(1.吉林大学农学部,长春 130062;2.军事医学科学院军事兽医研究所,长春 130062)
犬瘟热病毒(Canine distemper virus,CDV)是急性传染病-犬瘟热(Canine distemper,CD) 的病原,CD传染性强,病率高,常引起大批犬、貂、狐等动物发病,病死率30%~80%,雪貂高达100%,经济损失惨重[1-2]。疫苗接种是预防CD的有效途径。近年来,国内外学者已着手于CDV基因疫苗、亚单位多肽苗和重组活载体疫苗等新型疫苗的研究[3]。
犬瘟热病毒融合蛋白(F蛋白)是CDV的主要表面糖蛋白,能诱导中和抗体的产生,F蛋白诱导的免疫反应能阻止病毒感染,并且在有病毒增殖的情况下抑制症状的发生[4-5]。因此,选择F蛋白基因作为目的基因构建重组活载体疫苗对预防犬瘟热暴发有十分重要的意义。军事医学科学院军事兽医研究所利用长期驯化致弱的CAV-2 SY株构建的含CAV-2 SY株全基因组的pPoly2-CAV-2的犬2型腺病毒载体,免疫原性好、安全性好以及良好的遗传稳定性等特点。本试验以其为载体构建表达犬瘟热病毒F蛋白基因的重组犬2型腺病毒,为进一步研究预防CD爆发的重组疫苗奠定了基础。
1 材料与方法
1.1 材料
1.1.1 病毒、细胞、细菌和质粒
CDV LP株和CAV-2 SY株由本实验室分离、鉴定和保存;MDCK细胞、E.coli JM109感受态细胞、pPoly2CAV-2载体质粒(含CAV-2 SY全基因组)均由本实验室保存;转移质粒pVAXΔE3(含CAV-2的E3区)和真核表达载体pVAXLPF(含CDV F基因表达盒)由本实验室构建与保存。
1.1.2 主要试剂
T4DNA连接酶和AMV Reverse Transcriptase(购自Promega公司);Ex TaqTM、小牛肠碱性磷酸酶(CIAP)、各种限制性内切酶、mRNA提取试剂盒和DNA Blunting kit(购自 TaKaRa公司产品);AscⅠ(购自纽英伦生物技术(北京)有限公司);脂质体转染试剂Lipofectamine 2000和DMEM细胞培养基(购自Invitrogen公司);质粒提取试剂盒和DNA凝胶回收试剂盒(购自Vitagene公司);鼠抗CDV F蛋白单克隆抗体(本实验室制备);辣根过氧化物酶标记山羊抗鼠IgG(购自Sigma公司)。
1.2 方法
1.2.1 酶切DNA片段末端平滑化
用 DNA补平试剂盒(DNA Blunting kit)对MluⅠ和SphⅠ双酶切后的真核表达载体pVAXLPF的DNA片段末端进行平滑化,以便用平端连接的方法将含F基因的表达盒克隆入pVAXΔE3的E3区缺失处。具体操作见DNA补平试剂盒的说明书。
1.2.2 pVAXΔE3的E3区缺失及DNA片段5′端去磷酸化
由于F基因的表达盒较大,约为3010bp,因此,用DraⅢ和SspⅠ对pVAXΔE3进行双酶切,对其E3区缺失了1044bp,以便使pVAXΔE3的E3缺失区能容纳下较大的F基因表达盒。pVAXΔE3经DraⅢ酶切后产生了缺口,所以必须进行补平使其末端平滑化,补平、回收后,再用SspⅠ酶切、回收,这样酶切、回收的pVAXΔE3片段具有平滑末端,便于与平末端的F基因表达盒连接。转移质粒pVAXΔE3经DraⅢ和SspⅠ酶切、回收后,其5′端需去磷酸化,以防止载体自身连接,从而降低细菌转化时的背景。
1.2.3 犬瘟热病毒融合蛋白基因重组腺病毒的构建
1.2.3.1 穿梭质粒pVAXΔE3LPF的构建
真核表达载体pVAXLPF经MluⅠ和SphⅠ双酶切后,回收目的片段CDV F基因表达盒(pCMVF-poly(A)),并利用DNA补平试剂盒对该目的片段两末端进行平滑化。转移载体质粒pVAXΔE3经DraⅢ酶切、回收后,用DNA补平试剂盒对其末端进行平滑化,再用SspⅠ酶切,回收。然后,用小牛肠碱性磷酸酶(CIAP)对酶切、回收的pVAXΔE3片段5′端去磷酸化。利用T4DNA连接酶,将CDV F基因表达盒平连到pVAXΔE3的E3区缺失处,并筛选CDV F基因表达盒方向与E3区转录方向一致的重组子,获得了含CDV F基因表达盒的穿梭质粒,命名为pVAXΔE3LPF。用多种限制性内切酶对所获得的重组子进行酶切鉴定。
1.2.3.2 重组质粒pCAV-2-pVAXLPF的构建
重组质粒pCAV-2-pVAXLPF的构建策略为NruⅠ和SalⅠ双酶切穿梭质粒pVAXΔE3LPF后,回收目的基因片段。利用粘端连接方法,在T4连接酶作用下将目的基因片段定向克隆入预先用NruⅠ和SalⅠ双酶切骨架质粒pPoly2-CAV-2后回收的大片段中,构建重组质粒pCAV-2-pVAXLPF。用多种限制性内切酶分别对重组子pCAV-2-pVAXLPF进行酶切鉴定。
1.2.3.3 重组质粒pCAV-2-pVAXLPF转染MDCK细胞
重组质粒pCAV-2-pVAXLPF经AscⅠ酶切后,获得了线性基因组CAV-2-pVAXLPF。用NruⅠ和SalⅠ分别酶切CAV-2 SY全基因组,用NruⅠ酶切的回收大片段,用SalⅠ酶切的回收小片段。这两个片段与线性的重组基因组CAV-2-pVAXLPF按摩尔比1∶1∶1混合,利用脂质体介导共转染MDCK细胞。转染后,如果不出现致细胞病变作用(Cytopathic effect,CPE),则按常规细胞进行传代培养,每传1次则重复转染1次,如果重复转染5次,仍不出现CPE,则视为转染失败。如出现CPE,则进行常规病毒增殖,并将获得的重组病毒命名为CAV-2-pVAXLPF,即为犬瘟热病毒融合蛋白重组犬2型腺病毒已被成功构建。
1.2.4 表达犬瘟热病毒融合蛋白重组犬腺病毒的鉴定
1.2.4.1 形态学观察
用第四代重组病毒CAV-2-pVAXLPF接种一瓶单层MDCK细胞,37℃静置培养至80%细胞出现典型的葡萄串样CPE。取上清用0.5%的磷钨酸负染,进行电镜观察;无菌将细胞刮下以戊二醛与锇酸双固定,用F812环氧树脂包埋、切片、染色,作电镜超微结构观察。
1.2.4.2 酶切鉴定
用重组病毒的第四代细胞培养物接种一瓶MDCK细胞,37℃静置培养至80%细胞出现CPE,但是仍未脱落,按照提取腺病毒全基因组的方法提取重组病毒的全基因组,用不同的限制性内切酶对其进行酶切鉴定。
1.2.4.3 PCR鉴定与表达盒的克隆测序
根据GenBank中登录号为U77082的CAV-2 Toronto A26/61株的E3序列设计引物,上游引物(E3F): 5′TGAGGAGAGCATGGACCAGGTGGAG G TGAA3′; 下 游 引 物(E3R):5′GTCATAATTTGCA GGTAGAGCTCTTCGTGT3′。以重组病毒基因组DNA为模板,利用PCR反应扩增既含有CDV F基因表达盒,pVAX载体序列,在两侧又含有E3区的部分序列的核酸片段。将PCR产物以1%琼脂糖凝胶电泳。回收PCR产物,将其克隆入pMD18-T载体中,利用不同的限制性内切酶对重组子进行酶切鉴定,将鉴定正确的重组子送上海联合基因生物公司进行序列测定。
1.2.5 重组病毒中犬瘟热病毒融合蛋白表达的检测
1.2.5.1 F基因转录水平的检测
用第4代重组病毒接种一瓶MDCK细胞,置37℃温箱培养35 h,弃上清,用mRNA提取试剂盒提取mRNA,将提取的mRNA用F基因引物进行RT-PCR,以检测F基因是否转录。同时,用CAV-2感染的MDCK细胞培养物作为阴性对照。
1.2.5.2 F蛋白表达的检测
色谱柱:SinoChrom ODS-BP(250 mm×4.6 mm,5 μm);流动相:乙腈(A)-0.75%冰醋酸溶液(B),梯度洗脱(洗脱程序见表2);流速:1.0 mL/min;检测波长:275 nm;柱温:30 ℃;进样量:10 μL[14]。
用第4代重组病毒接种一瓶MDCK细胞,同时用CAV-2接种另一瓶MDCK细胞作为阴性对照。37℃静置培养至大多数细胞出现CPE,但是仍未脱落,倒掉细胞培养液,并用0.01 mol·L-1pH 7.2的PBS溶液轻轻洗涤细胞3次,以除去培养液中的血清蛋白。然后,加入适量的PBS液,反复冻融3次,5000 r·min-1离心10 min,弃去细胞碎片,收集上清液。将上清用Millipore公司生产的超滤离心管除盐和浓缩;取浓缩产物10μL与等体积的2×上样缓冲液混匀100℃煮沸5 min,用10%的分离胶进行SDS-PAGE电泳。电泳完毕后转膜,进行Western blot分析。一抗为鼠抗CDV F蛋白单克隆抗体,以辣根过氧化物酶标记的山羊抗鼠IgG为第二抗体。
1.2.6 重组病毒CAV-2-pVAXLPF遗传稳定性
将重组病毒CAV-2-pVAXLPF接种MDCK细胞进行传代培养,当传代至第30代时分别对第5、10、15、20、25和 30代重组病毒 CAV-2-pVAXLPF的细胞培养物进行PCR扩增,鉴定重组病毒CAV-2-pVAXLPF的遗传稳定性。
2 结果与分析
2.1 犬瘟热病毒融合蛋白重组犬腺病毒的构建
2.1.1 犬瘟热病毒F基因表达盒的回收
含犬瘟热病毒F蛋白的真核表达载体pVAXLPF经MluⅠ和SphⅠ双酶切后,切出大小约3010、1270和730bp的3个片段(见图1),其中第2泳道3010bp的DNA片段即为要回收的CDV F基因表达盒片段。进行凝胶电泳回收目的片段CDV F基因表达盒(pCMV-F-polyA)(见图2),第1泳道的DNA片段即为已回收的CDV F基因表达盒。
2.1.2 穿梭质粒pVAXΔE3LPF的酶切鉴定
CDV F基因表达盒被连接到转移载体pVAXΔE3的E3区缺失处,获得了CDV F基因表达盒方向与E3区转录方向一致的穿梭质粒pVAXΔE3LPF。该质粒经NruⅠ和SalⅠ、HindⅢ、EcoRⅤ、PstⅠ、KpnⅠ和XbaⅠ分别酶切鉴定。NruⅠ和SalⅠ双酶切后得到大小为6112、2400和1315bp的3个片段,其中6112bp的片段即为要回收的含CDV F基因表达盒的片段;HindⅢ切出大小为6728、1574、913和612bp的4个片段;Eco RⅤ酶切后得到大小为6553和3274bp的2个片段;PstⅠ酶切后得到大小为6269和3558bp的2个片段;KpnⅠ酶切后得到大小为4336、2999和2492bp的3个片段;XbaⅠ酶切后得到大小为4294、3200和2333bp的3个片段(见图3)。酶切鉴定结果与利用DNAStar软件计算的理论值一致,表明穿梭质粒pVAXΔE3LPF已被成功构建。
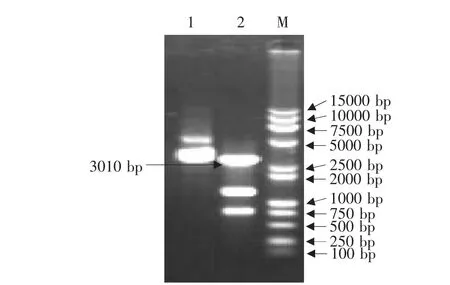
图1 真核表达载体pVAXLPF的酶切Fig.1 Enzyme digestion of pVAXLPF

图2 犬瘟热病毒F蛋白基因表达盒的回收Fig.2 The extraction of CDV F expression cassette

图3 pVAXΔE3LPF质粒的酶切鉴定Fig.3 Identification of pVAXΔE3LPF plasmid by restriction endonuclease digestion
2.1.3 重组质粒pCAV-2-pVAXLPF的酶切鉴定
构建的重组质粒pCAV-2-pVAXLPF经多种限制性内切酶酶切后,NruⅠ和SalⅠ双酶切后得到大小为29176bp和含CDV F基因表达盒的6113bp的2个片段;经PvuⅠ、SalⅠ和AscⅠ分别单酶切后,将重组质粒pCAV-2-pVAXLPF线性化;其余各种限制性内切酶如KpnⅠ、Bam HⅠ、EcoR V、PstⅠ、XhoⅠ、HindⅢ及KpnⅠ和XbaⅠ双酶切后,得到的DNA片段的数量及大小皆与理论值一致(见图4),表明构建的重组质粒pCAV-2-pVAXLPF正确。
2.1.4 重组病毒CAV-2-pVAXLPF的包装
重组质粒pCAV-2-pVAXLPF经AscⅠ酶切后,获得了线性基因组CAV-2-pVAXLPF,利用脂质体介导法转染MDCK细胞,重复转染3次后,正常的MDCK细胞(见图5)出现典型的CAV-2样CPE,开始时细胞圆肿发亮,逐渐聚集成葡萄串样,最后从瓶壁上脱落。表明重组基因组CAV-2-pVAXLPF转染MDCK细胞成功,已获得重组病毒CAV-2-pVAXLPF(见图6),犬瘟热病毒融合蛋白重组犬腺病毒构建成功。
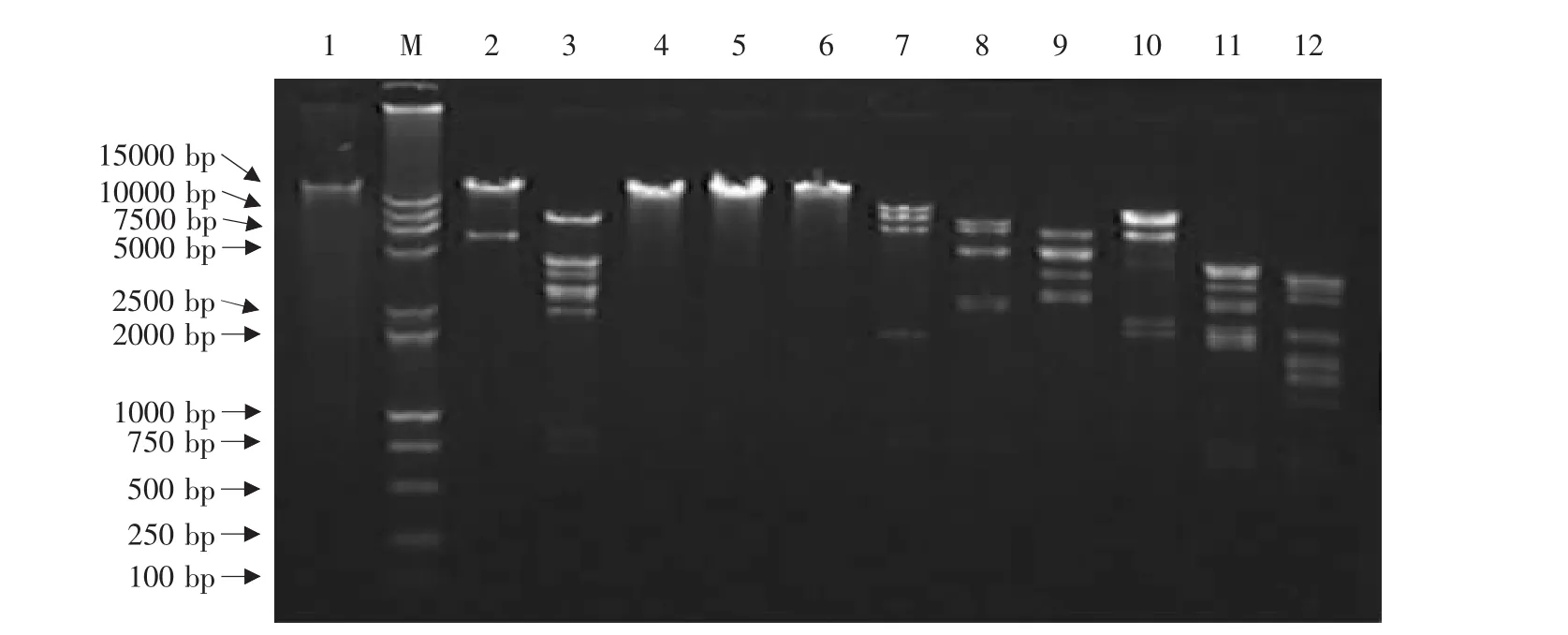
图4 重组质粒pCAV-2-pVAXLPF的酶切鉴定Fig.4 Identification of pCAV-2-pVAXLPF plasmid by restriction endonuclease digestion

图5 正常MDCK细胞(100×)Fig.5 Normal MDCK cell(100×)
图6 重组病毒CAV-2-pVAXLPF引起的MDCK 细胞病变(100×)Fig.6 Cytopathic effects of CAV-2-pVAXLPF in MDCK cell(100×)
2.2 犬瘟热病毒融合蛋白重组犬腺病毒的鉴定
2.2.1 重组病毒CAV-2-pVAXLPF形态学观察
利用第5代重组病毒CAV-2-pVAXLPF的上清作电镜负染观察,可看到20面立体对称、直径约80nm、表面具有排列整齐壳粒的腺病毒样粒子(见图7)。在感染细胞超薄切片中,细胞核内可见有呈排列整齐的晶格样病毒粒子,与腺病毒形态学完全相符(见图8)。

图7 CAV-2-pVAXLPF的负染电镜照片(80000×)Fig.7 Photograph of CAV-2-pVAXLPF negatively stained in electron microscopy(80000×)
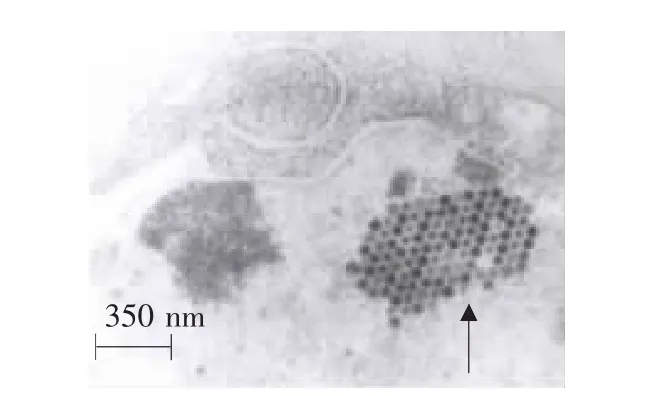
图8 CAV-2-pVAXLPF的电镜超微结构照片(40000×)Fig.8 Ultramicroscopic structure photograph of CAV-2-pVAXLPF in electron microscopy(40000×)
2.2.2 重组病毒CAV-2-pVAXLPF基因组酶切鉴定
利用各种限制性内切酶对提取的第5代重组病毒CAV-2-pVAXLPF全基因组进行酶切鉴定,用NruⅠ和SalⅠ双酶切后可得大小为23903、6113和3273bp的3条DNA片段;KpnⅠ和XbaⅠ双酶切与分别单酶切以及Bam HⅠ、HindⅢ分别单酶切所获得的DNA片段的数量及大小皆与与理论值一致,表明构建的重组病毒正确(见图9)。
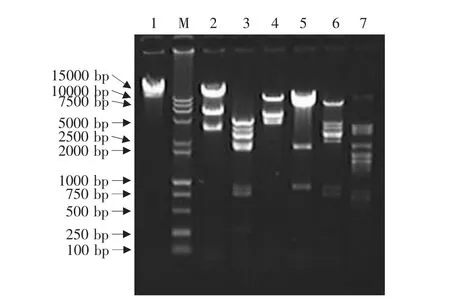
图9 CAV-2-pVAXLPF病毒基因组的酶切鉴定Fig.9 Identification of CAV-2-pVAXLPF virus genosome by restriction endonuclease digestio
2.2.3 重组病毒CAV-2-pVAXLPF PCR扩增鉴定及其产物序列测定
重组病毒CAV-2-pVAXLPF的PCR扩增表明以提取的重组病毒基因组DNA为模板,用CAV-2 E3特异性引物扩增出3677bp大小片段(第3泳道),该片段经回收、纯化后进行测序,测序结果表明该序列中包含CAV-2 E3区相关序列、pVAX1相关序列和CDV F基因序列,表明所构建的重组病毒CAV-2-pVAXLPF完全正确(测序结果略)。而正常CAV-2只能扩增出1500bp大小片段(第4泳道);用CDV F基因特异性引物从重组病毒DNA中扩增出2000bp大小的F基因片段(第2泳道),而正常的CAV-2扩增结果为阴性(第1泳道)(见图 10)。
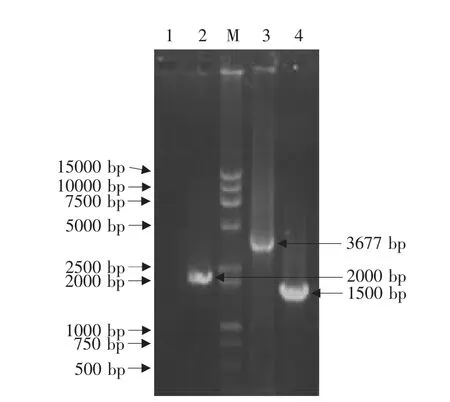
图10 重组病毒CAV-2-pVAXLPF PCR扩增鉴定Fig.10 Identification of recombinant virus CAV-2-pVAXLPF by PCR
2.3 犬瘟热病毒融合蛋白在重组犬腺病毒中表达的检测
2.3.1 重组病毒中F基因转录水平的检测
以CDV F基因特异性引物用RT-PCR法从重组病毒CAV-2-pVAXLPF的mRNA中扩增出F基因特异性片段,F基因片段大小为2000bp(第2泳道),而从正常CAV-2感染的MDCK细胞中扩增的结果为阴性(见图11)。
2.3.2 重组病毒CAV-2-pVAXLPF中F蛋白表达的检测
利用Western blot方法检测了重组病毒CAV-2-pVAXLPF中F蛋白的表达。以预染蛋白分子质量标准为参照标准,以便在转膜后能清晰看到分子质量标准条带。试验结果表明重组病毒CAV-2-pVAXLPF表达的F蛋白可被抗CDV F蛋白的单克隆抗体所识别,表达蛋白分子质量约为72 ku,与预期的分子质量相符,而正常的腺病毒阴性对照却无此特异性条带(见图12)。

图11 重组病毒CAV-2-pVAXLPF中F基因转录的检测Fig.11 F gene transcription identification of CAV-2-pVAXLPF

图12 重组病毒CAV-2-pVAXLPF表达的F蛋白Fig.12 Expresstion F protein of recombinant virus CAV-2-pVAXLPF
2.4 重组病毒CAV-2-pVAXLPF的遗传稳定性
对重组病毒CAV-2-pVAXLPF第5、10、15、20、25和30代MDCK细胞培养物进行PCR鉴定,结果均可从重组病毒CAV-2-pVAXLPF基因组中扩增出大小约2000bp的CDV F基因片段,表明该病毒具有良好的遗传稳定性(见图13)。

图13 重组病毒CAV-2-pVAXLPF的遗传稳定性Fig.13 Genetic stability of recombinant virus CAV-2-pVAXLPF
3 讨论
3.1 CDV融合蛋白基因(F基因)作为目的基因的选择
在CDV的结构蛋白中,F蛋白位于病毒的表面,是诱导中和抗体产生的主要糖蛋白,在病毒免疫中占有重要地位。F蛋白上存在着两个重要的辅助性T淋巴细胞表位,此辅助性T淋巴细胞表位可能是犬抗原提呈细胞(APCs)最优先识别和提呈的位点[6]。与Onderstepoort弱毒疫苗株F蛋白含有4个潜在的N-联糖基化位点相比,本试验的CDV LP野毒株推导的F蛋白氨基酸序列中含有5个潜在的N-联糖基化位点,其中108~110位氨基酸残基上所形成的潜在糖基化位点是CDV LP野毒株拥有而Onderstepoort弱毒株所没有的。与Onderstepoort弱毒株相比,CDV LP野毒株在105~115位和365~375位氨基酸处有明显Jameson-Wolf抗原表位优势,这种抗原表位差异显示CDV LP毒株F蛋白的免疫原性可能要优于Onderstepoort弱毒株[7]。另外,在麻疹病毒成员中,F蛋白为异型免疫的主要交叉抗原。F蛋白诱导的免疫反应能阻止病毒感染,并且在有病毒增殖的情况下抑制疾病的发生[8]。因此,本试验选择CDV LP毒株F蛋白全基因作为目的基因,利用犬2型腺病毒载体系统构建了表达犬瘟热病毒融合蛋白的重组腺病毒,旨在表达的F蛋白能对犬起到免疫、保护作用,在一定程度上抵抗CDV对犬的攻击。
3.2 CAV-2 E3区的缺失对病毒复制和包装的影响
CAV-2 E3区全长1491bp,位于CAV-2腺病毒基因组的24920~26411bp处,包括两个ORF即 ORF1(24920-25279bp) 和 ORF2(25317-26411bp)。E3区编码的蛋白质与病毒逃避宿主免疫监视机制有关,可减弱感染细胞被机体免疫识别的几率,然而删除E3区对病毒感染却没有明显的影响。E3区是腺病毒生长非必需区,对E3区进行缺失可以增加插入的外源DNA的容量,缺失或取代E3区的腺病毒仍能够在细胞上生长,所以E3区常被用来作为外源基因的插入位点,插入外源基因构建重组疫苗。若将CAV-2 E3区全部缺失,以HAd5腺病毒载体为例进行计算,则CAV-2外源基因的容量可达3.0 kb左右。然而,E3区全部缺失可能会对CAV-2的复制与包装产生不利的影响。从目前报道来看,构建CAV-2重组病毒时并未将E3区全部缺失。由于CAV-2 E3区缺失的大小直接影响其容纳外源基因的容量,因此须尽可能最大限度地缺失E3区,然而,对E3区可缺失DNA片段的最大极限还不十分清楚。但显然不能延续到位于E3区侧翼的结构蛋白基因,因为E3区侧翼序列的缺失可能会影响其上下游蛋白基因的转录与表达,从而影响CVA-2的复制或包装[9-10]。本试验插入E3区的F基因表达盒较大,约为3010bp。因此,采用了DraⅢ和SspⅠ对pVAXΔE3进行双酶切,对其E3区缺失了1044bp,以便使pVAXΔE3的E3缺失区能容纳下较大的F基因表达盒。本试验中表达CDV F基因的重组腺病毒成功构建证明了对CAV-2 E3区缺失1044bp后,并未影响位于E3区侧翼的结构蛋白基因,也没有影响CAV-2的复制与包装。
4 结论
利用脂质体介导共转染MDCK细胞方法,成功构建了含CDV LP株融合蛋白基因的重组犬腺病毒CAV-2-pVAXLPF。并通过Western blot证实重组病毒CAV-2-pVAXLPF能够表达CDV F蛋白,其蛋白分子质量为72 ku。而且,重组病毒在MDCK细胞中连续传30代后,仍含有F基因,表明重组病毒CAV-2-pVAXLPF具有良好的遗传稳定性。
[1]Deem S L,Spelman L H,Yates R A,et al.Canine distemper in terrestrial carnivores:a review[J].J Zoo Wildl Med,2000,31(4):441-451.
[2]Von Messling V,Oezguen N,Zheng Q,et al.Nearby clusters of hemagglutinin residues sustain SLAM-dependent canine distemper virus entry in peripheral blood mononuclear cells[J].J Virol,2005,79(9):5857-5862.
[3]李建军,丁巧玲.我国犬瘟热研究进展[J].中国兽医杂志,2003,39(1):34-38.
[4]Obeid O E,Partidos C D,Howard C R,et al.Protection against morbillivirus-induced encephalitis by immunization with a rationally designed synthetic peptide vaccine containing B-and T-cell epitopes from the fusion protein of measles virus[J].J Virol,1995,69(3):1420-1428.
[5]Plattet P,Rivals J P,Zuber B,et al.The fusion protein of wild-type canine distemper virus is amajor determinant of persistent infection[J].Virology,2005,337(2):312-326.
[6]高娃,杨敬.犬瘟热病毒分子生物学研究进展[J].中国比较医学杂志,2004,14(4):241-244.
[7]鞠会艳.犬瘟热病毒基因疫苗与重组犬腺病毒的构建及其实验免疫研究[D].长春:吉林大学,2006:55-60.
[8]Pardo M C,Bauman J E,mackowiak M.Protection of dogs against canine distemper by vaccination with a canarypox virus recombinant expressing canine distemper virus fusion and hemagglutinin glycoproteins[J].Am J Vet Res,1997,58(8):833-836.
[9]王永志,张守峰,扈荣良,等.表达狂犬病病毒糖蛋白膜外区重组犬2型腺病毒的构建及其免疫原性研究[J].微生物学报,2005,45(2):213-217.
[10]LinnéT.Differencesinthe E3regions of the canineadeno-virus type 1 and type 2[J].Virus Res,1992,23(2):119-133.
