用均匀设计优选苦参半仿生提取法工艺条件*
2010-02-28王英姿惠建国张兆旺孙秀梅
王英姿,惠建国,张兆旺,孙秀梅
(1.北京中医药大学中药学院,北京 100102;2.山东中医药大学药学院,济南 250014)
用均匀设计优选苦参半仿生提取法工艺条件*
王英姿1,惠建国2,张兆旺2,孙秀梅2
(1.北京中医药大学中药学院,北京 100102;2.山东中医药大学药学院,济南 250014)
[目的]优选苦参的半仿生提取法工艺条件。[方法]采用UL(91×33)均匀实验设计,以苦参碱、氧化苦参碱、苦参总碱、高效液相色谱(HPLC)总面积、干浸膏为指标综合评判,优选苦参半仿生提取的工艺条件。[结果]3煎用水的pH值依次为2.200 8、7.468 5、8.989 0;3煎总计时间为3.918 0 h。[结论]结合生产实际,确定3煎用水的pH值依次为2.0、7.5、9.0;提取时间依次为 2.0、1.0、1.0 h。
苦参;半仿生提取法;均匀设计;多成分指标;综合评判
苦参为清热燥湿,杀虫,利尿药。主含苦参碱、氧化苦参碱等生物碱以及黄酮等成分。苦参碱、氧化苦参碱及苦参总碱具有抑菌、抗炎、抗病毒、抗心律失常、抗肿瘤等多方面药理作用。为体现其整体功能,根据半仿生提取法(SBE法)的理论[1-3],以苦参碱、氧化苦参碱、苦参总碱、高效液相色谱(HPLC)总面积、浸膏得率为综合评判指标,采用均匀设计优选其SBE法的工艺条件。
1 仪器与材料
pHS-3C型精密pH计(上海雷磁仪器厂);MA110型电子分析天平(上海第二分析仪器厂);LXJ-Ⅲ型离心沉淀机(上海医疗器械三厂);Agilent 1100高效液相色谱仪。
苦参经张兆旺教授鉴定,为豆科植物苦参Sophora flavescens Ait.的干燥根经加工制成的饮片。苦参碱对照品(批号:0805-200005,供含量测定用)、氧化苦参碱对照品(批号:0780-200004,供含量测定用)均购自中国药品生物制品检定所;乙腈为色谱纯,水为重蒸水,其余试剂均为分析纯。
2 实验方法与结果
2.1 实验设计 根据SBE法理论,在药材粒度、煎煮温度、煎煮用水量、滤过等条件相同的前提下,确定考察的主要因素及水平,选用均匀设计法(UL)(91×33)表(中国航天工业总公司第三研究院提供)安排实验方案,见表1。
2.2 样品液的制备 称取苦参粗粉(10~20目之间)20.0 g,常压加热回流提取3次(加水量分别为苦参重量的10,8,8倍,溶剂水的pH值及提取时间按表2),提取液用4层纱布加100目筛分别滤过,离心(3 000r/min,15min),合并上清液,定容至 500 mL,即得1~9号样品液(每毫升相当于苦参0.04 g)。

表 1 UL(91×33)实验设计表Tab.1 Chart of UL(91×33)design
2.3 对照液的制备 精密称取苦参碱对照品15.60 mg,用乙腈-无水乙醇(80∶20)溶解并定容至25 mL,制成对照液A(每毫升含苦参碱0.624 mg)。
精密称取氧化苦参碱对照品17.68 mg,加乙腈-无水乙醇(80∶20)溶解并定容至 10 mL,制成对照液B(每毫升含苦参碱 1.768 mg)。
2.4 供试液的制备 精密量取2.2项下样品液10mL,加氨水调 pH 9~10,用氯仿萃取(20 mL,6次),合并萃取液,回收溶剂至干,残渣加无水乙醇适量使溶解,转移至25 mL量瓶中,加无水乙醇稀释至刻度,摇匀,即得1~9号供试液(每毫升相当于苦参0.016g)。
2.5 苦参碱及氧化苦参碱的含量测定
2.5.1 色谱条件[4]色谱柱:Lanbo NH2柱(250×4.6 mm,5 μm);流动相:乙腈-无水乙醇-3%磷酸溶液(80∶10∶10);流速:1 mL/min;检测波长:220 nm;柱温:30 ℃;进样量:20 μL。
2.5.2 线性关系考察
2.5.2.1 苦参碱线性关系考察 精密吸取2.3项下对照液 A,用乙腈-无水乙醇(80∶20)稀释成 0.015 6、0.031 2、0.046 8、0.062 4、0.07 8、0.093 6 g/L 的对照液A1~6,按2.5.1项下色谱条件,依法测定。以进样浓度为横坐标,峰面积为纵坐标,得回归方程为:Y=11740X-32.585,r=0.999 6,表明在0.0156~0.0936g/L浓度范围内线性关系良好。
2.5.2.2 氧化苦参碱线性关系考察 精密吸取2.3项下对照液B,用乙腈-无水乙醇(80∶20)稀释成0.044 2、0.132 6、0.221、0.309 4、0.397 8、0.486 2 g/L的对照液B1~6。按2.5.1项下色谱条件,依法测定。以进样浓度为横坐标,峰面积为纵坐标,得一条不过原点的直线,回归方程为:Y=10 524X+58.726,r=0.999 2,表明在0.044 2~0.486 2 g/L范围内线性关系良好。
2.5.3 精密度实验
2.5.3.1 苦参碱精密度实验 取2.5.2.1项下苦参碱对照液 A3(0.046 8 g/L),按 2.5.1 项下色谱条件,重复进样6次,结果表明精密度良好,RSD=0.48%。
2.5.3.2 氧化苦参碱精密度实验 取2.5.2.2项下氧化苦参碱对照液 B3(0.221 g/L),按 2.5.1项下色谱条件,重复进样6次,结果表明精密度良好,RSD=0.72%。
2.5.4 稳定性实验 取2.4项下1号供试液,于0、2、4、6、8 h按2.5.1项下色谱条件,测定苦参碱和氧化苦参碱峰面积,结果表明稳定性较好,RSD分别为0.41%、0.55%。
2.5.5 重复性实验 取2.2项下1号样品液,按2.4项下供试液的制备方法平行提取5次,按2.5.1项下色谱条件,测定苦参碱和氧化苦参碱峰面积,结果表明重现性较好,RSD分别为0.71%、0.93%。
2.5.6 样品测定 吸取2.4项下供试液,按2.5.1项下色谱条件,依法测定,结果见表2。
2.5.7 加样回收实验
2.5.7.1 苦参碱加样回收实验 取2.2项下1号样品液4.5 mL(含苦参碱0.576 7 mg),加入2.3项下对照液A 1.0 mL,按2.4项下方法制备成供试液,测定苦参碱含量,计算回收率,结果回收率为97.52%,RSD 为 1.32%(n=5)。
2.5.7.2 氧化苦参碱加样回收实验 取2.2项下1号样品液5 mL(含氧化苦参碱3.036 4 mg),加入2.3项下对照液B 1.70 mL,按2.4项下方法制备成供试液,测定苦参碱含量,计算回收率,结果回收率为98.21%,RSD为1.51%(n=5)。
2.6 苦参总碱的含量测定 取2.4项下供试液15mL(相当于苦参0.24 g),置于三角瓶中,水浴蒸干,残渣加乙醚5 mL使溶解。精密加0.01 mol/L硫酸液10 mL,摇匀,水浴加热使残渣完全溶解,并除尽乙醚后放冷。加新沸过的冷蒸馏水15 mL与甲基红指示液2滴,用0.020 84 mol/L氢氧化钠试液滴定至黄色,即得。以乙醇15 mL和0.01 mol/L硫酸液10 mL作空白对照。按下式计算苦参总碱的含量(mg/g),结果见表2。苦参总碱含量(mg/g)=

式中:c―氢氧化钠滴定液摩尔浓度;v1―空白液消耗氢氧化钠滴定液毫升数;v―供试液消耗氢氧化钠滴定液毫升数;248―苦参碱(C15H24N2O)分子量。
2.7 HPLC总面积测定 取2.4项下供试液,按2.5.1项下色谱条件测定,记录总积分面积,结果见表2。
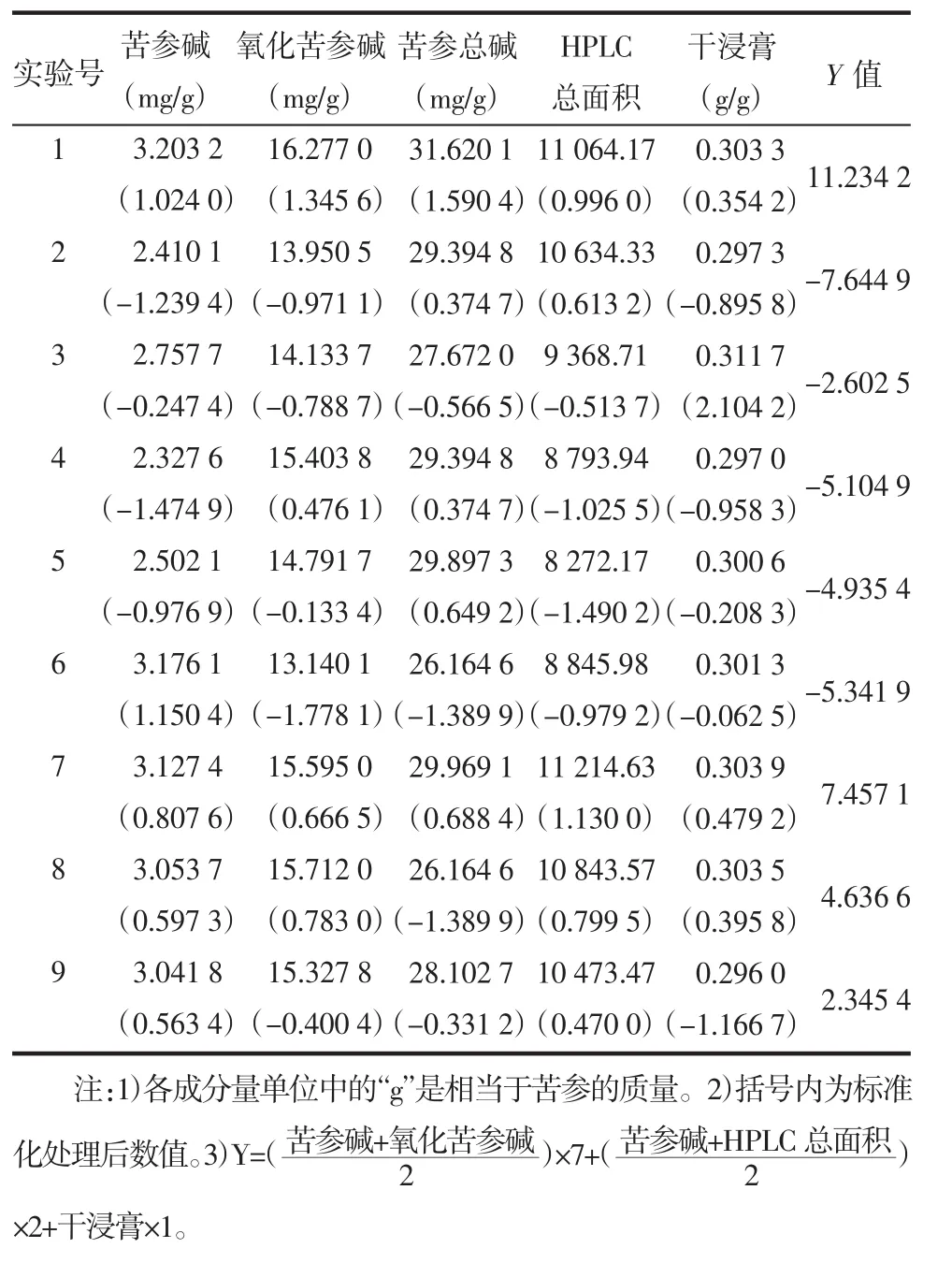
表2 综合各指标成分含量及标准化处理结果Tab.2 Results of the content of each ingredient and itscontent after the standard processing
2.8 干浸膏的测定 精密吸取2.2项下样品液各20 mL,置蒸发皿中,水浴蒸干,于105℃烘至恒质量,计算干浸膏含量。结果见表2(n=3)。
2.9 实验结果的处理 将苦参碱、氧化苦参碱、苦参总碱、HPLC总面积、干浸膏5个指标测定的数据按公式进行标准化处理。为标准化后的值,为样品液i中成分j的含量,为样品中i种成分j的平均值,为成分j的标准差。根据各指标在提取工艺选择中的主次地位,给予不同的加权系数,以标准化后的值加权后求和,即得综合评价Y值,结果见表2。
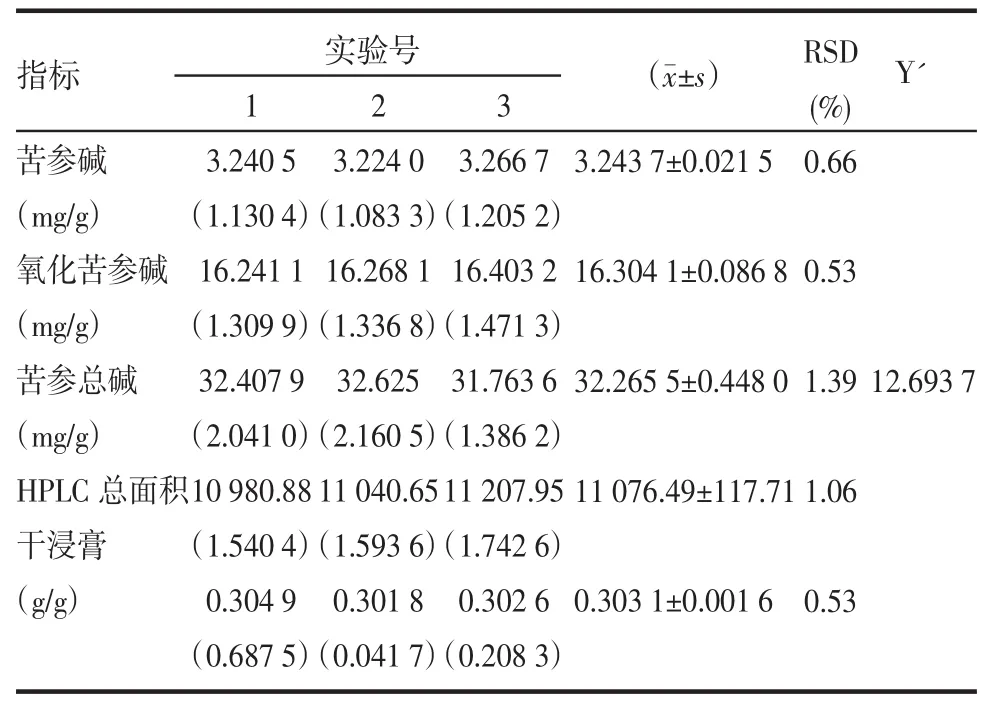
将表1中各实验水平的4个因素及表9中相应实验水平的综合指标Y值输入计算机,用JYSYSJ的数据分析模块处理,用二次多项式逐步回归,得回归方程:F=7.441 501-36.100 98×D+0.5288 306 ×A×A-0.703 579 2×C×C-4.506 316×D×D-0.475 532 7 ×A×C+1.087 29×B×B+7.035 472×C×D,r=0.999 998 5,F=49 066.55。查 F 值表 F0.05(7,1)=236.8,F0.05(7,1) 2.10 验证优化条件 按照2.9项下优选出的工艺条件,依2.5~2.8项下各指标的测定方法,依法进行3次重复实验,结果见表3。结果表明,验证实验提取液综合评价Y’值接近预测值(Y=12.723 5)。 1)以苦参碱、氧化苦参碱、苦参总碱、HPLC总面积、干浸膏为指标,采用均匀设计法对药材SBE法工艺条件进行优选,结果:3煎用水pH依次为2.200 8、7.468 5、8.989 0,3 煎总计时间为 3.918 0 h。结合生产实际,确定其SBE法工艺条件为:3煎用水pH 依次为 2.0、7.5、9.0;提取时间依次为 2.0、1.0、1.0 h。验证实验结果接近预测值,说明优选条件可行。 表3 验证实验提取液中各指标成分含量的标准化值及综合评价值Tab 3 The standard and evaluated content of each ingredient in the extracting liquid 2)实验结果是按照半仿生提取法“有成分论,不惟成分论”理论,充分考虑到单体成分和活性混合物(多种成分),根据各指标在工艺选择中的主次,给予不同的加权系数,确定综合评价Y值的关系式,并对5个指标数据进行标准化处理,以消除各指标单位和量纲的不同,以及各指标变量范围相差悬殊造成的影响,以标准化指标加权后求和得Y值作为综合指标,优选出SBE法最佳条件,这样更科学,更合理。 [1] 张兆旺,孙秀梅.试论“半仿生提取法”制备中药口服制剂[J].中国中药杂志,1995,20(11):670-673. [2] 张瑞亭,张兆旺,孙秀梅.思维方式的转换与中药“半仿生提取法”[J].中国中药杂志,1997,22(9):542-544. [3]张兆旺,孙秀梅.“半仿生提取法”的特点与应用[J].世界科学技术-中药现代化,2000,2(1):35-38. [4] 中华人民共和国国家药典委员会.中国药典[S].北京:化学工业出版社,2005:141-141. Even-designed and optimized technology for semi-bionic extraction of Sophora Flavescens WANG Ying-zi1,HUI Jian-Guo2,ZHANG Zhao-wang2,et al [Objective]To optimize the technique of semi-bionic extraction(SBE)for Sophora Flavescens.[Methods]Based on the UL(91×33)even-design,matrine,oxymatrine,total alkaloids,total area of HPLC and dry extract were used as indexes to optimize the technology of SBE for Sophora Flavescens.[Results]The pH value of 3 times of extraction is 2.2008,7.4685 and 8.9890,respectively.The total extracting time is 3.9180 hours.[Conclusion]Based on the manufacture practice,the pH value of extraction of 3 times is 2.0,7.5 and 9.0,respectively and the extracting time is 2 hours,1 hour and 1 hour in turn. Sophora Flavescens;semi-bionic extraction;even-design;multi-component indexes;comprehensive evaluation R284.2 A 1672-1519(2010)01-0066-03 国家自然科学基金课题(30701110)。 王英姿(1975-),女,博士,副教授,主要研究方向为中药制剂新剂型与新技术。 2009-09-26)3 小结与讨论
(1.Beijing University of TCM,Beijing 100102,China;2.Shandong University of TCM,Jinan 250014,China)
