肝硬化患者腰椎骨密度CT定量评价
2010-02-27王翔,薛雁山,孟辉强等
肝硬化为临床常见病和多发病,常并发全身各脏器的损害,患者常可并发肝性骨营养不良(hepatic osteodystrophy,HOD),也称肝性骨病(hepatic bone disease,HBD)。病理改变以骨量减少(osteopenia)和骨质疏松(osteoporosis,OP)为主,临床除有慢性肝病的表现外,还伴有骨质疏松的临床表现[1]。常见于原发性胆汁性肝硬化(PBC)、酒精性肝硬化以及肝炎后肝硬化。WHO将骨质疏松定义为全身骨量减少、骨组织的微细结构被破坏、骨脆性增加、骨强度降低、容易发生骨折等。但是早期不易发现,往往在骨折发生后才作出回顾性诊断。本文通过对肝硬化患者骨密度测定结果进行分析,初步探讨肝硬化患者骨密度测定的临床意义。
1 材料和方法
1.1 研究对象 收集2008-11~2009-10于山西医科大学第二医院行CT检查的肝硬化患者70例,其中男37例,女33例,年龄26~78岁,平均54.96±13.56岁。为消除年龄对骨代谢的影响,以50岁为界分为两组。其中乙型肝炎后肝硬化36例,酒精性肝硬化9例,胆汁淤积性肝硬化4例,药物性肝硬化3例,丙型肝炎后肝硬化5例,混合性肝硬化10例,自身免疫性肝硬化3例。所有肝硬化患者的纳入根据2005年12月10日中华医学会肝病学分会和中华医学会感染病学分会联合制定的《慢性乙型肝炎防治指南》标准进行临床分期和诊断,并且根据肝硬化患者入院时的初次化验室检查及影像学检查结果、临床症状体征等进行综合判断。所选病例要求无大量腹水,未进行过激素替代治疗,未使用影响骨代谢的药物,且排除合并糖尿病、甲状腺功能亢进、甲状旁腺功能亢进等可能影响骨密度疾病的患者。按照肝功能Child-Pugh分级:A级19例、B级37例、C级14例。对照组为70例医院健康体检人员,且经临床综合检查无肝硬化及其他影响或可疑影响骨密度的疾病,其中男36例,女34例,年龄28~79岁,平均54.84±19.20岁。对照组按照年龄及性别比例与病例组进行匹配,以消除年龄及性别这两个重要的混杂因素。
1.2 检查方法及骨密度测定 70例肝硬化患者及70例健康对照组均使用GElightspeed16排螺旋CT扫描仪对位于校准模型区域的L1~L4椎骨进行侧面拍片及轴向的扫描。扫描参数:管电压120k V,管电流70mA,层厚10mm,扫描野48cm,准直器宽度16× 1.25mm,螺距1.375,患者的定位与腰椎扫描步骤相同。轴向扫描避开有骨折、压缩变形、临近外科夹以及其它受到损伤的椎骨。扫描层面通过以一定角度平行于终板并穿过椎骨中心的平行线。避免患者的移动及呼吸运动而导致层面穿过终板,导致读数偏高。且每周通过QCT校准模型对QA躯干模型进行定期体模测定,保证检测的准确性,数据采集如图1、2所示。
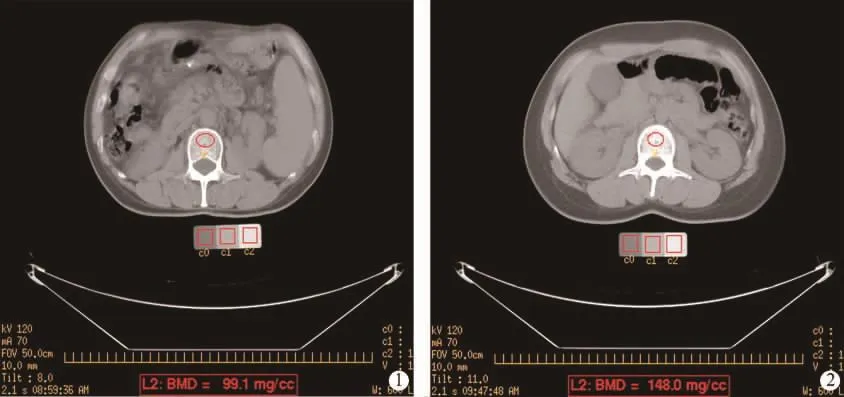
图1 男性,45岁,肝硬化,Child-Pugh B级,L2椎体:BMD=99.1mg/cc。 图2 男性,47岁,正常对照,L2椎体:BMD=148.0mg/cc。将感兴趣区域放置于椎骨的松质骨部位,获得松质骨中最大的采样范围。软件基于同时由模型提供的标定值计算骨密度值,并以mg/cc(等量于羟基磷灰石钙)单位表示。计算出的骨密度值以注释的形式显示于图像的底部
1.3 统计学分析 所有数据计量资料用均数±标准差表示,应用spss12.0统计软件包处理数据。比较肝硬化组和对照组各参数之间有无差异采用完全随机设计两样本均数比较t检验统计分析;利用方差分析统计肝硬化患者的肝功能(Child-Pugh分级)各级参数之间有无差异,并用LSD法进行两两比较;比较肝硬化组和对照组间OP发生率、不同类型肝硬化间OP发生率的差异用χ2分析,P<0.05时具有统计学意义。
2 结果
2.1 组间性别均衡性检验 由表1可知肝硬化组与健康对照组间及不同肝硬化程度间男女性别具有均衡性。
2.2 肝硬化组与健康对照组间骨密度(mg/cc)的比较结果 不同年龄段在L2~L4椎体部位肝硬化患者BMD与正常对照组BMD均有显著性差异,肝硬化组明显低于对照组(P<0.05);而不同年龄段在L1椎体部位肝硬化患者BMD均低于健康对照组BMD,有下降的趋势,但差异无统计学意义(P=0.461,P=1,P>0.05),见表2。
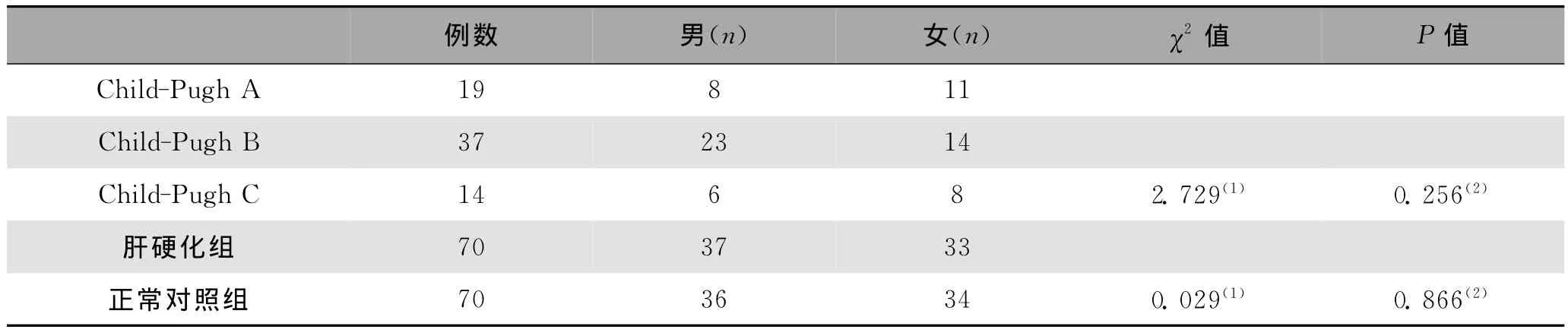
表1 各组间性别均衡性检验
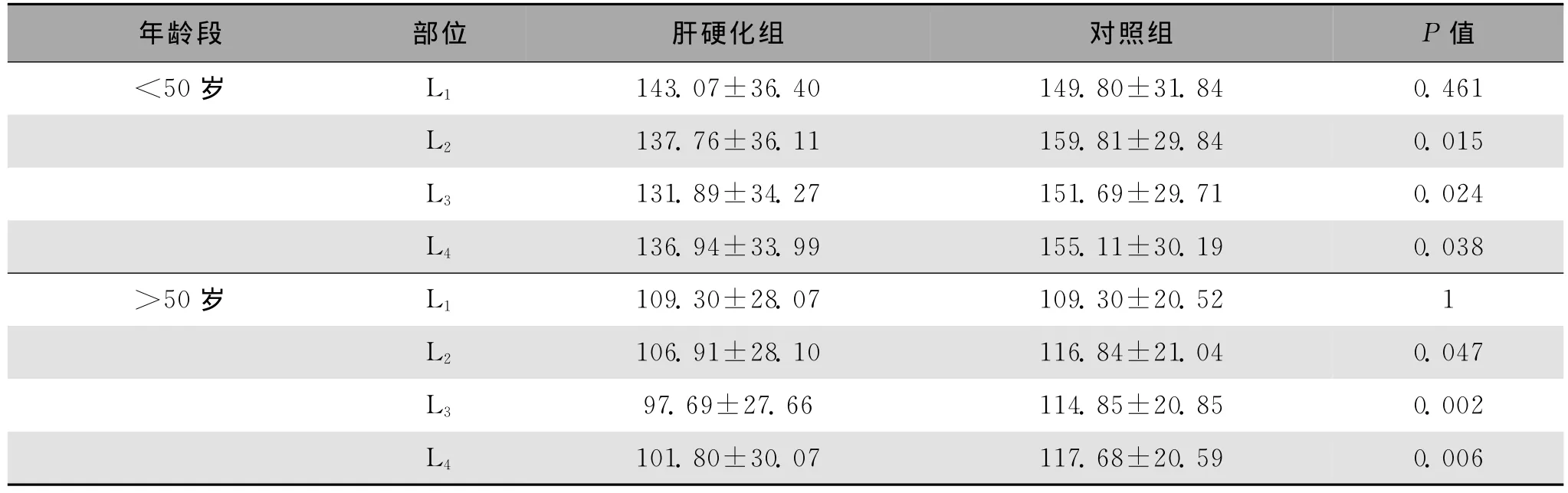
表2 不同年龄段肝硬化与正常对照间的各椎体BMD比较
2.3 不同肝硬化程度间骨密度(mg/cc)的比较结果
肝功能Child分级,随着A~C级,不同年龄段腰椎的平均骨密度均有逐渐下降的趋势,经过方差分析及两两LSD比较,<50岁年龄组各级差异均具有统计学意义(P=0.022,P=0.007,P=0.049,P<0.05),>50岁年龄组Child A、B级间BMD比较差异无统计学意义(P=0.238>0.05),A级与C级、B级与C级间差异有显著性(P=0.000,P=0.000),见表3。
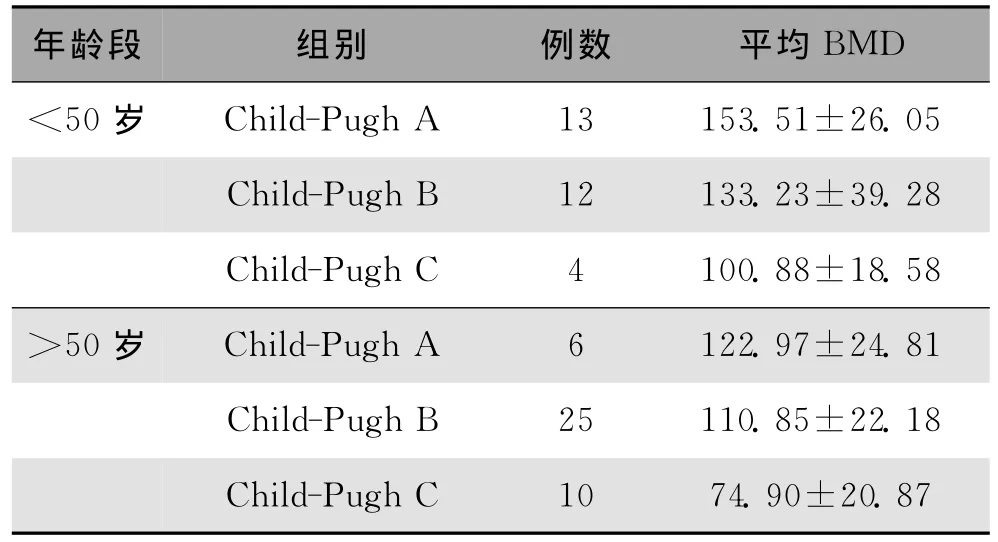
表3 不同年龄段肝硬化Child分级A、B、C间椎体平均BMD的比较
2.4 肝硬化组与正常对照组OP发生率的比较结果
参考以BMD峰值减低2.5s作为诊断骨质疏松症的标准[2],肝硬化组OP的发生率为38.6%;正常健康对照组OP的发生率为15.7%。二者差异具有显著性(P<0.05),肝硬化组的OP发生率明显高于正常健康对照组(表4)。

表4 肝硬化与正常对照间OP发生率的比较
2.5 乙型肝炎后肝硬化与非乙型肝炎后肝硬化间OP发生率的比较结果 乙型病毒性肝炎(乙肝)肝硬化组OP发生率略高于非乙肝肝硬化组,但差异无统计学意义(P=0.584,>0.05),见表5。
表5 乙肝型肝硬化与非乙肝型肝硬化间BMD的比较结果
3 讨论
3.1 DXA检测方法以及QCT评价骨密度的优势目前,临床常采用双能X线吸收仪(DXA)来评价骨质疏松患者骨密度的变化情况,但DXA测量不能区分皮质骨和松质骨[3],所有DXA测量结果均是皮质骨和小梁骨的总和,且测量结果均为二维结构骨密度,骨骼厚度(后前位直径)无法得到校正,因此采用面积BMD使指标可能会对结果的解释出现偏差[4]。成人骨松质体积和骨量虽仅占骨骼的20%,但其表面积却占骨总表面积的60%以上,故骨松质的面积/体积比(surface/volume ratio,SVR)和面积/质量比(surface/mass ratio,SMR)是骨密质的8~10倍。反映出骨密质和骨松质在骨代谢过程中所起的作用不同,这也是骨质疏松较易和较早发生于骨松质的原因之一。Ruegsegger[5]等也研究发现,松质骨骨密度会随年龄增长而减少,而皮质骨则有所不同,其骨密度值在20~70岁会保持在一个相对恒定的水平。故测定椎体松质骨骨密度对腰椎骨质疏松具有很高的预测能力。而定量CT(quantitative CT,QCT)可以,选择性的测量松质骨和骨皮质的骨密度,对骨量变化的敏感性有很大优势,可以较早的反映体内骨无机物含量的变化,在早期骨质疏松发生及监测疗效时,有其独特的作用。Masala[6]等人应用DXA及QCT两种方法对10例骨质疏松病人及10例健康对照组进行BMD测定,结果显示采用QCT(CV=1.8%)测量比DXA(CV=3.8%)更精确,且测量结果不受软组织影响。而且研究发现通过应用DXA和QCT两种方法测量的骨密度结果与应用HRCT观察小梁骨结构得到的骨的病理程度进行对比发现,应用QCT的Z值得到的分类结果与通过骨小梁数目的所得结果更具一致性,提示在对骨状态的评价方面,QCT也要优于DXA[7]。腰椎是QCT骨密度测量的最敏感部位,目前QCT测定BMD在临床应用已经较为成熟,因此本研究主要选择腰椎作为研究测量选择的部位。
3.2 肝硬化患者骨密度降低的原因 本研究显示不同年龄组肝硬化患者骨密度与正常对照组骨密度相比,均存在显著差异,肝硬化患者骨密度较同年龄段正常人明显降低。而L1椎体平均骨密度值相对于正常对照组有下降的趋势,但是差异均没有统计学意义,这可能与L1靠近胸椎、活动度较小有关。L1与L2~L4相比较,其生物力学特性比较特殊。此外扫描L1椎体时需要倾斜的角度也较大,不易保证扫描线平行于终板并穿过椎骨中心,可能影响到BMD值的测定,从而影响统计学分析的结果。Giouleme[8]等人对不同类型肝硬化患者进行研究发现、引起骨质疏松的原因及骨量减少的程度与肝病的严重程度有关,而与肝病的类型无关。本研究结果显示随着肝硬化肝功能损害加重,其BMD也逐渐降低,这提示BMD变化可以在一定程度上反映肝的病理变化,肝硬化患者骨量减少的程度及OP发生的原因与肝病的严重程度有关,使得BMD作为骨质量的一个重要标志,可以反映肝硬化患者OP程度,为预测骨折危险性提供重要依据。但是在50岁以上年龄组,A级与B级间差异没有统计学意义,这可能与该年龄段A级病例数较少有关。此外,不同肝硬化OP发生率间无统计学差异,虽各种肝硬化的病因有很大差异,非乙肝型肝硬化往往存在其他影响钙磷代谢的全身因素或并发症,但结果提示OP原因与肝硬化类型无关。肝硬化患者OP发生率(38.6%)远高于正常对照组发生率(15.7%),但文献报道肝硬化的OP发生率为30%~50%[8~12],范围较宽,这可能与不同研究在肝硬化病例募集的方法、OP诊断标准的选择、BMD测量的方法以及对照组的选择不同有关。
肝硬化性骨病的病因复杂,肝硬化患者存在着多种影响骨代谢的因素。其影响是多层次、多因素逐渐形成的,发病机理复杂,目前尚未完全阐明。Cijevschi[12]等对150名酒精性及病毒性肝炎肝硬化患者进行研究发现,38%的患者存在OP或骨量减少,且骨量变化与体质指数BMI<20kg/m2、胆汁淤积、Child C级及疾病的持续时间(>10年)等因素显著相关。而Aziza[13]等对女性PBC患者研究,认为BMI、绝经状态、疾病持续时间、维生素D缺乏是该类肝病OP发生的主要危险因子。近年来在肝硬化性OP的病因研究方面,对钙-PTH-维生素D轴异常的研究逐渐减少,而调节骨构塑和骨重建的生长因子、细胞因子,如NK-κB受体活化因子配体(receptor activator of nuclear factor k B ligand,RANKL)/护骨素(osteoprotegerin,OPG)(RANKL/OPG系统)、骨钙素(BGP)、瘦素(leptin)等,以及维生素D受体VDRG多态性、可溶性肿瘤坏死因子受体(s TNFR)等基因因素在肝硬化性OP发病中的作用受到越来越多的关注,更深入的研究此类因素的致病机制,将有助于疾病的防治,但这些危险因素以及他们的致病机制仍在争论中。
3.3 正确认识肝硬化患者BMD检查的临床意义近年来,随着医疗诊断和治疗水平的提高,慢性肝病患者的生存期延长,肝硬化性骨质疏松症的患病率也在逐年上升,因此早期诊断和治疗也就显得尤为重要。研究发现慢性肝病患者非外伤性骨折的发生率高达20%[14],在本研究结果中38.6%的患者存在骨质疏松,肝硬化骨质疏松患者中有5例检测时发现腰椎椎体存在不同程度的压缩,呈楔样改变,骨折发生率也达到18.5%,但只有1例患者述有腰部不适的感觉,说明OP表现较为隐匿,医患双方均易忽视。患者症状明显时,腰椎骨折可能已累及到数个椎体,严重者造成脊柱变形,患者也会因长期卧床而产生一系列的并发症致其生活质量明显下降。因此对于肝硬化病人,提请临床医师在治疗原发病的同时,关注患者伴发的骨病,及时给予相应的治疗,这对防止肝性骨病的发生、发展有极为重要的临床意义。此外,致病机理的不明确无疑也增加了该疾病的防治困难,这也使得BMD这一直观指标的测定显得尤为重要。而CT技术能提供被扫描层面骨密度分布的客观定量信息,并具有良好的密度分辨率,可以选择性的测量松质骨BMD,可以较早的反映体内骨骼无机物含量的变化。此外,伴随着高分辨率技术和三维重建技术发展,以及有限元分析模型的引入,大大拓展了CT在OP研究领域的能力,无论是BMD的测量还是骨微结构及骨强度的检测,CT都有自己独特的优势,使其能够更为准确地反映肝硬化患者的骨代谢状况,对早期发现肝性骨病具有无创、准确、敏感、患者易接受的优点,值得临床推广应用。相信随着CT技术的不断进步,其在肝硬化性OP诊断以及治疗后评价的作用会越来越大。
[1] 代云群,曹优文 .肝性骨病的研究进展 .现代医药卫生,2006,22(10):1479-1480.
[2] 聂四平 .我国骨质疏松症诊断标准的制定原则及方法探讨.中国骨质疏松杂志,2008,14(4):270-284.
[3]G.Harry van Lenthe,Thomas L.Mueller,Andreas J.Wirth,et al.Quanti fication Cation of Bone Structural Parameters and Mechanical Competence at the Distal Ra-dius.J Orthop Trauma,2008,22(S):66-72.
[4]Seeman E.From density to structure:growing up and growing old on the surfaces of bone.J Bone Miner Bes,1997,12(4):509-521.
[5]Ruegsegger P,Durand E,Dambacher MA.Localization of reginal forearm bone loss from high resolution computed tomographic images.Osteoporos Int,1991,1(1):76-80.
[6]Masala S,Tarantino U,Marinetti A,et al.DXA vs QCT:in vitro and in vivo studies.Acta Diabetol,2003,40(S):86-88.
[7]Mylona M,Leotsinides M,Alexandrides T,et al.Comparison of DXA,QCT and trabecular structure inβthalassaemia.Eur J Haematol,2005,74(5):430-437.
[8]Giouleme OI,Vyzantiadis TA,Nikolaidis NL,et al.Pathogenesis of osteoporosis in liver cirrhosis.Hepatogastroenterology,2006,53(72):938-943.
[9]Schiefke I,Fach A,Wiedmann M,et al.Reduced bone mineral density and altered bone turnover markers in patients with non-cirrhotic chronic hepatitis B or C infection.World J Gastroenterol,2005,11(12):1843-1847.
[10]Guichelaar MMJ,Malinchoc M,Sibonga J,et al.Bone metabolism in advanced cholestatic liver disease:analysis by bone histomorphometry.Hepatology,2002,36(4):895-903.
[11]王义国,刘倩,王文奇,等 .乙型肝炎肝硬化骨代谢异常的临床研究.中华肝脏病杂志,2006,14(1):33-36.
[12]Cijevschi C,Mihai C,Zbranca E,et al.Osteoporosis in liver cirrhosis.Rom J Gastroenterol,2005,14(4):337-341.
[13]Aziza Mounach,Zhor Ouzzif,Ghizlance Wariaghli,et al.Primary biliary cirrhosis and osteoporosis:a case-control study.J Bone Miner Metab,2008,26(4):379-384.
[14]Gasser RW.Cholestasis and metabolic bone disease-a clinical review.Wien Med Wochenschr.2008,158(17-18):553-557.
