5株无花果叶内生真菌的分离鉴定和抗菌活性的研究
2010-02-25马养民张弘弛
刘 瑞, 马养民, 张弘弛
(1.山西大同大学农学与生命科学学院, 山西 大同 037009; 2.陕西科技大学化学与化工学院, 陕西 西安 710021)
0 引言
内生真菌(endophytic fungi)是指那些在其生活史的一定阶段或全部阶段生活于健康植物的各种组织和器官内部的真菌,被感染的宿主植物不表现出外在病症[1],可通过组织学方法或从严格表面消毒的植物组织中分离,或从植物组织内直接扩增出微生物DNA的方法来证明其内生.内生真菌与宿主形成长期的共生关系,代谢产物十分丰富,它是筛选新型抗生素和其它生理活性物质的重要资源[2,3].
无花果(Ficuscarice)是桑科落叶小乔木或灌木,成熟或近成熟的花序托内藏花和瘦果,故名无花果.无花果营养丰富,含有丰富的有机酸、氨基酸、糖类、维生素、果胶以及无花果元酶、微量元素等[4,5],还有提高人体免疫力、延缓衰老和抑制多种癌细胞发生或发展的特殊功效.目前已经从无花果中分离出13种抗癌活性成分,对治疗多种癌症有明显效果[5].我们已从无花果中分离得到64株内生真菌并进行了初步筛选[6],本文将对5株无花果叶高活性内生真菌进行进一步研究,为开发利用无花果内生真菌资源提供依据.
1 材料与方法
1.1 材料
(1)植物材料及来源:无花果材料采自西北农林科技大学西林苗圃.
(2)培养基:分离培养基为PDA固体培养基;发酵用培养基为察氏液体培养基;细菌指示菌培养基为牛肉膏蛋白胨培养基;植物病原菌和酵母菌指示菌用PDA固体培养基.灭菌条件为121 ℃、30 min.
(3)指示菌株及来源:革兰氏阳性菌选用金色葡萄球菌(Staphylococcusaureus);革兰氏阴性菌选用大肠杆菌(Escherichiacoli);植物病原菌选用白菜黑斑病菌(Alternariabrassicae)、番茄灰霉病菌(Botrytiscinerea)、辣椒疫霉病菌(Phytophthoracapsici)、苹果腐烂病菌(Valsamali)、西瓜枯萎病菌(Fusariumoxysporumf.sp.niveum)、 烟草赤星病菌(Alternariaalternata); 酵母菌用假丝酵母菌(Candiasp.)和红酵母(Rhodotorulasp.).以上菌种由西北农林科技大学资源与环境学院微生物实验室提供.
1.2 方法
(1)内生真菌的分离纯化:取健康无花果叶,用无菌水冲洗干净,晾干水分后,用剪刀剪成0.5 cm×0.5 cm小块,采用下述方法进行表面消毒:75%乙醇消毒30 s,用3%次氯酸钠消毒5 min,再用75%乙醇消毒1 min,无菌水冲洗2~3次.以上材料分别置于已倒好的PDA培养基上,放置在28 ℃培养3~7 d后,观察皿中材料切口处长出菌丝(菌落),挑取植物组织周围的菌落转接入PDA斜面中,经纯化后即得内生真菌,转接至新PDA培养基上培养并对菌株进行编号,保存.采用漂洗液检验法[7]和组织印迹法[8]进行灭菌效果的检验.
(2)内生真菌的培养及发酵产物的提取:将分离的无花果叶内生真菌,无菌接种于制备好的培养平板上,28 ℃,培养3 d后,无菌操作从培养平板取0.6 cm的内生真菌菌饼,接种至含400 mL查氏液体培养基1 000 mL的锥形瓶中,于28 ℃,130 r/min摇床上振荡培养12~15 d后从摇床中取出培养物,4层纱布过滤得菌丝和发酵滤液.发酵液用乙酸乙酯萃取3次,乙酸乙酯萃取液减压浓缩后得到粗品代谢物,备用.菌丝于45 ℃烘干,研磨成粉,称取各菌株菌丝0.1 g,用丙酮超声萃取3次,萃取液减压浓缩后得到粗品代谢物,备用.
(3)抑菌活性测试
测试培养基的制作:测试菌用5 mL无菌生理盐水直接冲洗受试菌的斜面,摇匀后,滴一滴于血球计数器载玻片小室内,盖上盖玻片(注意排除气泡),显微镜下进行计数,然后稀释到浓度为106个/mL的菌悬液.将1 mL菌悬液快速倒入40~50 ℃融化的9 mL培养基中,摇匀后迅速装到培养皿中,冷却后得到含有不同测试菌的培养基.
代谢产物抗菌活性筛选(滤纸片法)[9]:将1.2(1)中所得粗品代谢物分别配成10 mg/mL的丙酮溶液,然后取滤纸片(Φ=0.6 cm,已灭菌)浸没于粗品丙酮溶液中,使其充分饱和,略微风干后,接于含有测试菌的培养皿中,各内生真菌的粗品代谢物对测试菌分别作3个重复.以丙酮作为CK,将制好后的培养皿在28 ℃恒温培养2~4 d后观察,测其抑菌圈的大小.
(4)内生真菌的鉴定:采用插片培养方法,对有高活性的无花果叶内生真菌进行分类鉴定,分类鉴定参照文献[10,11].
2 结果与分析
2.1 表面消毒效果的检查
经漂洗液检验法和组织印迹法的检验发现对照周围无菌落出现,证明该样品表面灭菌彻底,证明分离得到的无花果叶的内生真菌真菌来源于植物组织内部,而非植株表面附生菌或其它杂菌.
2.2 内生真菌的分离结果及形态学特征
从无花果叶中分离到的5株内生真菌经显微形态观察,形态描述见表1,初步鉴定5株内生真菌分别属于1目,2科,3属(见表2).

表1 5株无花果叶内生真菌的菌落特征及细胞形态

表2 5株无花果叶内生真菌鉴定结果
2.3 无花果叶内生真菌菌丝丙酮提取物的抑制作用
生物活性实验结果表明(见表3),5株无花果叶内生真菌菌丝丙酮提取物具有广谱抑菌性,从抑菌效果来看,对大肠杆菌和金黄色葡萄球菌的抑制作用效果最明显(见图1),对烟草赤星病菌的抑制作用最低.从广谱抑菌结果来看,抑菌效果最显著的是编号为FL24和FL25两株无花果内生真菌,而且重复实验结果稳定.
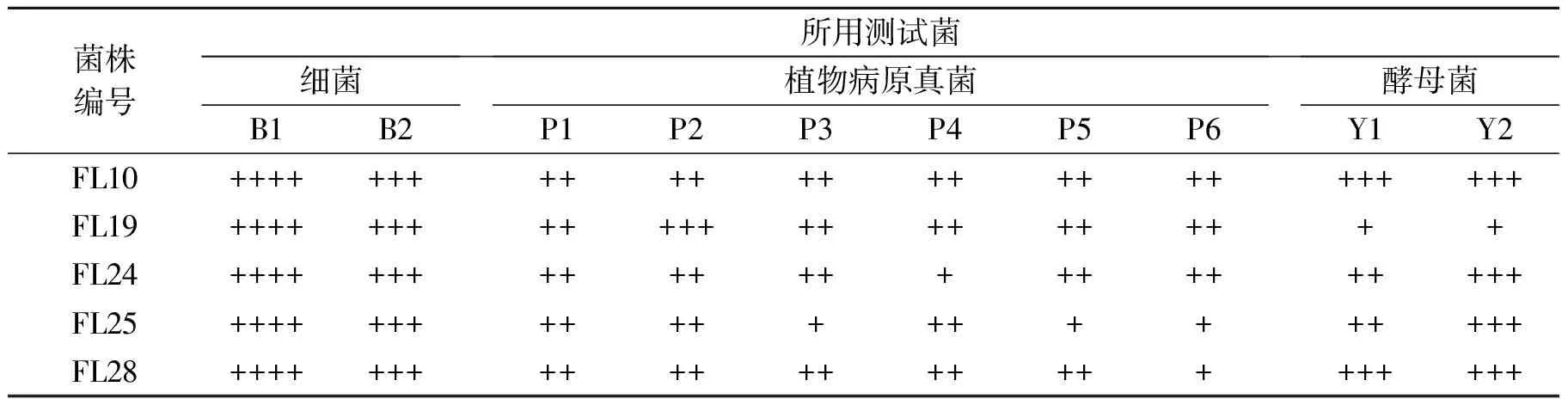
表3 内生真菌菌丝丙酮提取物的抑制效果
注:① F表示无花果,L表示叶部;②-:0<Φ(平均抑菌圈直径) <6 mm; +:6 mm≤Φ<10 mm; ++:10 mm≤Φ<16 mm;+++:16 mm≤Φ<26 mm; ++++:Φ≥26 mm;③B1金色葡萄球菌(Staphylococcusaureus),B2大肠杆菌(Escherichiacoli),P1白菜黑斑病菌(Alternariabrassicae),P2番茄灰霉病菌(Botrytiscinerea),P3辣椒疫霉病菌(Phytophthoracapsici),P4苹果腐烂病菌(Valsamali),P5西瓜枯萎病菌(Fusariumoxysporumf.sp.niveum),P6烟草赤星病菌(Alternariaalternata),Y1假丝酵母菌(Candiasp.),Y2红酵母(Rhodotorulasp.).
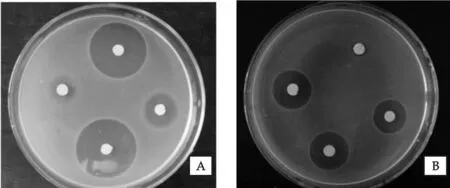
图1 内生真菌菌丝丙酮提取物的抑菌效果A,B为内生真菌菌丝丙酮提取物分别对金黄色葡萄球菌和大肠杆菌的抑菌圈
2.4 无花果叶内生真菌发酵液乙酸乙酯提取物的抑制作用
表4的结果表明,5株无花果叶内生真菌发酵液乙酸乙酯提取物同样具有广谱抑菌性,对细菌和酵母菌表现出很强的抑制活性,某些菌种的发酵液乙酸乙酯提取物对植物病原菌表现出很强的抑制活性.综合比较抑制效果,5株内生真菌的发酵液抑菌活性明显高于菌丝体丙酮提取液,由此可以确定,无花果叶内生真菌的抑菌活性物质主要富集在真菌发酵液中.
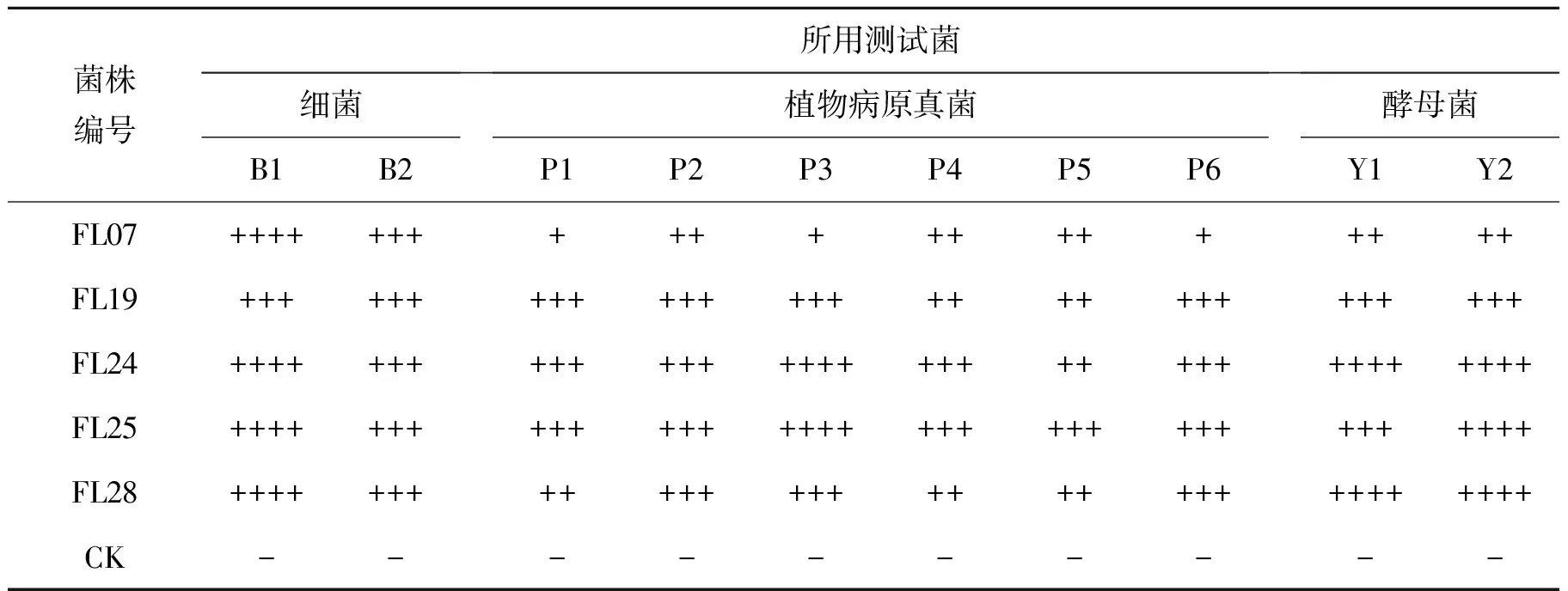
表4 内生真菌发酵液乙酸乙酯提取物的抑制效果
注:① F表示无花果,L表示叶部;②-:0<Φ(平均抑菌圈直径) <6 mm; +:6 mm≤Φ<10 mm; ++:10 mm≤Φ<16 mm;+++:16 mm≤Φ<26 mm; ++++:Φ≥26 mm;③B1金色葡萄球菌(Staphylococcusaureus),B2大肠杆菌(Escherichiacoli),P1白菜黑斑病菌(Alternariabrassicae),P2番茄灰霉病菌(Botrytiscinerea),P3辣椒疫霉病菌(Phytophthoracapsici),P4苹果腐烂病菌(Valsamali),P5西瓜枯萎病菌(Fusariumoxysporumf.sp.niveum),P6烟草赤星病菌(Alternariaalternata),Y1假丝酵母菌(Candiasp.),Y2红酵母(Rhodotorulasp.).
抑菌效果最显著的是编号为FL24的无花果叶内生真菌,FL24菌株的发酵液活性成分对金黄色葡萄球菌和红酵母的抑菌圈直径可达34.7 mm和37.8 mm,对假丝酵母、辣椒疫霉菌和大肠杆菌的抑菌圈直径分别可达28.1 mm,26.4 mm和25.2 mm,而对白菜黑斑病菌、番茄灰霉病菌、苹果腐烂病菌、烟草赤星病菌4种测试菌的抑菌圈直径在16~24 mm范围内(见图2),表现出明显的拮抗活性作用,而且重复实验结果稳定.
3 结论
(1)5株无花果叶内生真菌中存在着具有高活性的抑菌活性物质,经形态学分类,这些真菌分布在3个属的真菌分类类群中,说明具有抗菌作用的内生真菌的属种分布具有多样性.
(2)5株无花果叶内生真菌的代谢产物的抑菌效果非常好,具有广谱抗菌性,其抑菌物质主要富集于发酵液中.
(3)确定编号为FL24的菌种为目标菌株,对其发酵液中的活性成分具有很强的抑菌活性,表现出具有一定的应用潜力,为新型抗菌物质的开发提供了丰富的资源,因此有必要对其内生真菌代谢产物进行系统深入研究.
[1] Petrini O. Fungal endophytes of tree leave. In: Andrews J H, Hirano S S. Microbial Ecology of Leaves[M]. New York: Springer-Verlag,1991:179-197.
[2] 邹文欣,谭仁祥.植物内生菌研究新进展[J].植物学报,2001,43(9):881-892..
[3] 马养民,冯成亮,植物内生真菌抗肿瘤活性成分研究进展[J]. 有机化学,2009,29(8): 1 182-1 191.
[4] 李彬成.无花果杏果抽提物抗癌疗效显著[J]. 国外科技,1987,(4):32.
[5] 毛新伟,陈友地,杨 伦,等.无花果抗癌研究综述[J]. 林产化工通讯,1998,(5):13-15.
[6] 张弘弛,马养民,刘 瑞,等,无花果内生真菌的研究Ⅰ. 抗植物病原真菌活性的筛选[J]. 西北农业学报,2007 ,16 (2) :232-236.
[7] Mclnroy. Survey of indigenous bacterial endophytes from cotton and sweet corn[J]. Plant and Soil,1995,173:337-342.
[8] Sturz A V. Biodiversity of endophytic bacteria which colonize red clover nodules ,roots, stems and foliage and their influence on host growth[J]. Plant Pathology, 1997,48:360-369.
[9] 施巧琴,吴松刚.工业微生物育种学(第二版)[M].北京:科学出版社,2003:69-72.
[10] 魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1982:129-649.
[11] H.L巴尼特,B.B亨特著,沈崇尧译.半知菌属图解[M].北京:科学出版社,1977:41-197.
