茶多酚对ACC-M细胞株Fas、Fasl表达的影响*
2010-02-21杨志刚文国容
李 萍,杨志刚,文国容,魏 丹,宋 琦
(遵义医学院附属口腔医院,贵州563003)
茶多酚是茶叶最主要组成成分,也是茶叶的主要活性成分,具有抗氧化、抗炎、抗病毒、清除自由基、抗肿瘤等多种生物学活性和药理功能。茶多酚抗肿瘤作用的机制多集中于胃癌、大肠癌、肝癌的研究,对口腔肿瘤的研究较少,特别是茶多酚对具有明显侵袭性的口腔腺样囊性癌生长的研究少见。Fas属于肿瘤坏死因子及神经生长因子受体家族成员,是细胞凋亡信号受体,与其配体Fasl结合,在肿瘤凋亡及肿瘤免疫方面起重要作用。本文采用体外试验研究茶多酚对肺高转移性腺样囊性癌细胞株(adenoid cystic carcinoma cell clones highly metastatic to the lung,ACC-M)生长以及Fas及其配体Fasl表达的影响。
1 材料与方法
1.1 药品与试剂 ACC-M(中科院上海细胞库),RPMI1640培养液(Sigma,美国),鼠抗人Fas、Fasl、S-P染色试剂盒(北京中杉金桥生物技术有限公司),MTT试剂(北京华美生物工程公司),全自动酶标检测仪(BIO-TEK,美国)等。
1.2 实验方法
1.2.1 细胞培养 ACC-M复苏后于10%小牛血清的RPMI1640培养液、5%CO2饱和湿度、恒温37℃条件下培养,按1∶3细胞比例传代,选择对数生长期细胞进行试验。
1.2.2 茶多酚对ACC-M生长的影响(M TT法) 将对数期细胞调整至5×104个,接种于96孔板,5%CO2、37℃、孵育24h,细胞单层铺满孔底,加入0.00、0.05、0.1、0.15、0.2g/L浓度茶多酚,5%CO2,37℃培养,分别于24、48、72h时间段观察细胞形态,并弃上清液,加入0.5%M TT 20μ L,培养4h,加入150μ L二甲基亚砜(DMSO),用酶联免疫检测仪(测定波长490nm)测定各孔吸光密度值(optical delnsity,OD值),记录结果。细胞增殖抑制率(%)=(1-实验组平均OD值/对照组平均OD值)×100%。
1.2.3 免疫组化(SP法) 将对数期生长的ACC-M细胞胰酶消化,制成细胞悬液,以每孔约5×104个细胞接种于6孔板内盖玻片上,在5%CO2饱和湿度、恒温37℃培养箱中培养24h后加入0.00、0.05、0.1、0.15、0.2g/L浓度茶多酚。用PBS液冲洗,4%多聚甲醛室温固定,操作方法严格按照SP试剂盒说明进行。鼠抗人Fas浓度为1∶40,鼠抗人Fasl浓度为1∶100。
1.2.4 判定标准 阳性细胞必须具备:(1)细胞结构清晰;(2)阳性棕黄色颗粒定位于细胞膜或细胞浆;(3)着色明显高于背景;(4)采用 PBS代替一抗为空白对照组。用Image-proplus 6.0图像分析软件进行图像分析,计算平均OD,然后求视野平均值作为该标本的表达量。
1.3 统计学方法 采用SPSS13.0统计软件进行数据分析,实验结果以±s表示,组间差异比较采用ANOVA单因素方差分析检验法,以P<0.05为差异有统计学意义。
表1 不同浓度茶多酚对ACC-M细胞作用后OD值及抑制率比较(±s)
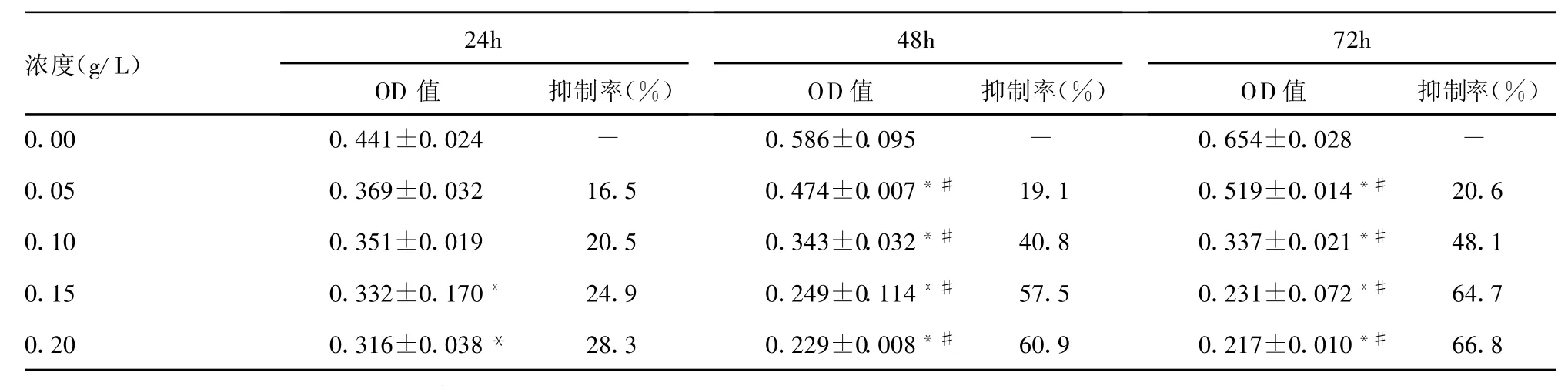
表1 不同浓度茶多酚对ACC-M细胞作用后OD值及抑制率比较(±s)
*:与同期对照组比较,P<0.05;#:与24h同浓度组比较,P<0.05。-:表示无此项。
浓度(g/L)24h OD值 抑制率(%)48h OD值 抑制率(%)72h OD值 抑制率(%)0.00 0.441±0.024 - 0.586±0.095 - 0.654±0.028 -0.05 0.369±0.032 16.5 0.474±0.007*# 19.1 0.519±0.014*# 20.60.10 0.351±0.019 20.5 0.343±0.032*# 40.8 0.337±0.021*# 48.10.15 0.332±0.170* 24.9 0.249±0.114*# 57.5 0.231±0.072*# 64.70.20 0.316±0.038* 28.3 0.229±0.008*# 60.9 0.217±0.010*# 66.8
2 结果
2.1 细胞形态 未经茶多酚处理的ACC-M细胞融合致密成单层,呈鹅卵石样镶嵌排列,细胞间连接紧密,细胞呈多边形,界清,胞浆丰富,并可见多个处于分裂相的细胞。经不同浓度茶多酚处理后,细胞呈不规则状,细胞间隙增大,细胞数量、分裂相细胞数目减少,细胞内空泡形成,尤以0.2g/L茶多酚处理72h后明显。
2.2 细胞抑制率 茶多酚对ACC-M细胞生长抑制随浓度增加,抑制作用逐渐明显,差异有统计学意义(P<0.05),同时随茶多酚作用时间逐渐延长,抑制细胞生长亦越明显,差异有统计学意义(P<0.05),见表1。
2.3 Fas、Fasl在ACC-M细胞的表达 对照组Fas蛋白在ACC-M细胞胞浆中微弱甚至无阳性染色;经不同浓度茶多酚作用后ACC-M细胞胞浆可见棕黄色颗粒,弥漫分布于胞浆沿核膜周边,0.05、0.1、0.15、0.2g/L茶多酚作用组表达明显高于对照组,差异有统计学意义,见插页Ⅰ彩图4。对照组Fasl蛋白在ACC-M细胞胞膜、胞浆中有明显棕黄色染色,其细胞形态正常;经不同浓度茶多酚作用后ACC-M细胞在胞膜、胞浆内仍可见阳性表达,但数量明显减少,且阳性程度减弱,0. 05、0.1、0.15、0.2g/L茶多酚作用组明显低于对照组,差异有统计学意义,见插页Ⅰ彩图5。
3 讨论
茶多酚是茶叶的主要活性成分,由茶叶提取物儿茶素、黄酮类、酚酸类、花色素等30多种物质组成,具有抗氧化、抗炎、抗病毒、清除自由基、抗肿瘤等多种生物学活性和药理功能,茶多酚对多种肿瘤生长具有明显抑制作用,不仅可抑制肿瘤形成,还可以减少已形成肿瘤的数量、大小。Hwang等[1]发现茶多酚主要活性成分——没食子儿茶素、没食子酸酯可通过抑制COX-2表达、诱导细胞凋亡、调节细胞周期调节蛋白表达等多个途径发挥抗大肠癌作用。韩丽娟[2]的实验证明没食子儿茶素、没食子酸酯可抑制人卵巢癌C0C1细胞株增殖,延长细胞增殖周期,诱导细胞凋亡。杜春华等[3]发现茶多酚使人肺癌细胞株SPC-AI细胞周期阻滞于G0期,抑制肺癌细胞增殖。本实验结果显示在茶多酚作用后ACC-M细胞形态、数量发生改变,细胞数量减少,细胞间隙增大,分裂相细胞数目减少,细胞内空泡形成。同时,各时间段实验组与对照组比较,增殖活性明显下降,差异有统计学意义(P<0.05);而在同一浓度的茶多酚作用下,随着时间延长,ACC-M细胞增殖能力也逐渐下降,72h组较24、48h组的ACC-M细胞存活率明显下降,差异有统计学意义(P<0.05)。表明0.05~0.2g/L茶多酚可抑制ACC-M细胞增殖,并有明显量效和时效依赖关系。茶多酚主要可能通过以下几种方式抑制肿瘤生长:(1)抑制肿瘤细胞DNA复制,一方面茶多酚通过影响修复系统促进DNA损伤的修复,并通过与DNA聚合酶相互作用而增加DNA复制的准确性;另一方面还可以通过抑制DNA拓扑异构酶和抑制与DNA合成有关的酶与DNA结合而抑制肿瘤细胞DNA复制,从而抑制肿瘤生长。(2)阻滞肿瘤细胞进入细胞周期,茶多酚可使肿瘤细胞分裂相明显减少,细胞增殖受到抑制,生存率下降;S期细胞明显减少,G0/G1细胞所占比率增加,细胞出现G1/S阻滞。
Fas系统在细胞凋亡的信号转导过程中具有重要作用,Fas属Ⅰ型跨膜蛋白,是肿瘤坏死因子超家族成员,当膜表面Fas蛋白与其配体Fasl结合后,导致Fas空间构象改变,引起死亡诱导信号复合体形成,进而激活caspase-8,启动蛋白级联反应,诱导携带Fas细胞凋亡,这是细胞凋亡的主要途径之一[4]。本研究发现随着茶多酚浓度增加,ACC-M细胞中Fas蛋白表达逐渐增多,明显高于对照组,差异有统计学意义(P<0.05),并且Fas蛋白表达随着茶多酚浓度递增而逐渐增强;同时不同浓度茶多酚作用后,ACC-M细胞中Fasl蛋白表达低于对照组,差异有统计学意义(P<0.05),并且Fasl蛋白表达随着茶多酚浓度递增而逐渐降低,尤其是胞浆中表达明显减少。说明茶多酚引起ACC-M细胞凋亡的机制可能与Fas/Fasl途径有关,可能是通过上调Fas,下降Fasl,启动Fas/Fasl介导的细胞凋亡通路。肿瘤细胞表达Fasl蛋白还可诱导其周围Fas阳性表达的淋巴细胞与之结合,导致肿瘤内淋巴细胞凋亡,得以逃避免疫系统的监视和攻击,肿瘤细胞凋亡受到抑制[5]。同时,作者认为茶多酚还可使ACC-M肿瘤细胞Fas表达增高,Fasl表达降低,使肿瘤周围Fasl阳性表达的淋巴细胞与之结合,启动机体免疫系统的监视和攻击,促进肿瘤细胞凋亡。
但茶多酚并不能完全抑制ACC-M细胞活力,即使茶多酚浓度达到0.2g/L,细胞仍有部分存活,这可能是因为在ACCM细胞中除Fas/Fasl凋亡途径外,还可能存在其他信号转导途径,这是一个复杂的信号网络系统[6]。因此茶多酚抗肿瘤作用的分子机制与其他信号通路之间的关系还需进一步研究。
[1]Hwang JT,Ha J,Park IJ,et a1.Apoptotic effect of EGCG in HT-29colon cancer cells via AM PK signal pathway [J].Cancer Lett,2007,247(1):115.
[2]韩丽娟.表没食子儿茶素没食子酸酯抑制人卵巢癌CoCl细胞生长[J].长治医学院学报,2008,22(5):333.
[3]杜春华,成炜,胡晓玲,等.茶多酚对肺癌SPC A1细胞增殖的影响[J].山东医药,2007,47(31):1.
[4]Baskin-Bey ES,Gores GJ.Caspase-8,death-receptor signaling,and hepatocarcinogenesis:the Fas and the furious [J].Gastroenterol,2005,129(5):1790.
[5]徐银祥,蒋耀光,林一丹,等.非小细胞肺癌fas异常表达与肿瘤浸润性淋巴细胞凋亡的关系[J].重庆医学,2007,36(5):441.
[6]Yu C,Friday BB,Lai JP,et al.Cytotoxic synergy between the multikinase inhibitor sorafenib and the proteasome inhibitor bortezomib in vitro:induction of apoptosis through Akt and c-Jun NH2-terminal kinase pathways[J].Mol Cancer Ther,2006,5(9):2378.
