L-丙交酯与ε-己内酯共聚物微观结构与热力学性能研究
2010-02-15熊左春张胜蓝熊成东陈栋梁
鲁 越,熊左春,张胜蓝,熊成东,陈栋梁*
(1.中国科学院成都有机化学所,四川成都610041;2.中国科学院研究生院,北京100039)
0 前言
聚L-丙交酯(PLLA)和聚己内酯(PCL)由于具有良好的生物相容性、可降解吸收性,因而在生物医学材料中得到了广泛应用,尤其是用高相对分子质量的PLLA材料制作成的骨螺钉已经在市场上有销售。它们的共聚物(PLCA)作为潜在的新的生物医用材料近年来也成为研究热点,其原因在于其结合了PLLA材料的强度高和降解速率较快[1]以及 PCL材料柔韧性好[2]的特点,能研发出新用途的医疗产品,如软骨修复支架[3]、手术缝合线[4]、血管支架[5]等。
PLCA的性能与其微观结构和热力学性能有着密切联系,其组分不同,材料的微观结构和热力学性能相差很大,这些特性将直接影响材料的力学性能、加工性能和降解性能。目前,国内外对PLCA微观结构研究与热力学性能关系的研究很少,因此研究它们的关系对指导PLCA合成及其加工和应用均具有重要意义。本文以辛酸亚锡为催化剂,采用本体开环无规共聚的方法,制备一系列不同组成的 PLCA共聚物,对不同组成的共聚物微观结构和热力学性能进行研究,建立起一定的联系,为PLCA材料的应用提供理论基础。
1 实验部分
1.1 主要原料
L-LA,纯度99.9%,成都迪康制药有限公司;
ε-CL,纯度99%,用氢化钙浸泡24 h,减压蒸馏后待用,Aldrich公司;
辛酸亚锡,纯度95%,Sigma公司;
三氯甲烷,分析纯,广州市金华大化学试剂有限公司;
无水乙醇,分析纯,广州市金华大化学试剂有限公司。
1.2 主要设备及仪器
NMR核磁共振仪(1H-NMR),BRU KER AVANCE 300M,德国Bruker公司;
差示扫描量热仪,Q20,美国 TA公司。
1.3 聚合过程
将L-LA、ε-CL按不同摩尔比投料到圆底烧瓶中,并加入计量的辛酸亚锡催化剂,且单体与催化剂的摩尔比为5000∶1。反应体系经过干燥后,置换几次氮气,并抽真空后封口。反应物在130℃烘箱中反应48 h之后停止聚合反应。产物用三氯甲烷溶解,聚合物溶液用过量的无水乙醇沉淀、过滤、洗涤后得到白色产物。该产物放入真空烘箱中干燥至恒重即得PLCA共聚物。
1.4 性能测试与结构表征
共聚物各单元组成由NMR核磁共振仪测定,以四甲基硅为内标,氘代氯仿为溶剂;
特性黏度([η])用乌氏黏度计测定,氯仿为溶剂,温度为25℃;
热性能采用差示扫描量热仪测定,通高纯氮气50.0 mL/min,升温速率为10.0℃/min,测试温度为-80~200 ℃。
2 结果与讨论
2.1 共聚物微观结构分析
按L-LA和ε-CL的摩尔比为 90∶10、80∶20、70∶30、60∶40、50∶50方式投料,合成了一系列不同组成的共聚物,其共聚物组成通过1H-NMR表征,核磁图谱中特征峰情况如图1所示,共聚物的其他分析结果如表1所示。
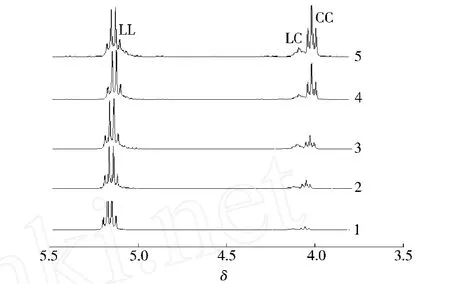
图1 所合成的PLCA共聚物核磁图谱部分特征峰演变图Fig.1 Evolution of part signal in the1H-NMR spectra of the obtained PLCA copolymers

表1 PLCA系列共聚物的表征结果Tab.1 Characterization of the PLCA copolymers
从图1可以看出,无论那一种投料组分,所合成的聚合物在5.16处均出现了来自L-LA的双乳酰结构(LL)中氢原子的次甲基峰;在4.05处均出现了来自邻近己内酰的己内酰结构(CC)中的羟亚甲基峰(—OCH2—);以及在4.14处均出现了来自邻近乳酰单元的己内酰(LC)中的受影响的—OCH2—单元的峰[5,6]。通过这些特征峰面积的比较,可以计算出共聚物中己内酰组分比例(FCL)。同时根据下列公式可以计算出所合成的共聚物分子链中的C和LL序列的嵌段平均长度(即实验长度)[7-12],其结果如表1中的和所示。[C]/[L]其中[]代表1H-NMR测得的共聚物中相应序列共振峰的积分强度。
为了进行比较,C和LL序列在完全无规链中嵌段平均长度(即理论长度)则根据下列方程进行计算,其结果如表1中的所示。
从表1可以看出,无论是哪一种投料比例进行的聚合反应,根据1H-NMR谱计算出的共聚物中己内酰组成分数(FCL)与单体ε-CL投料分数(fCL)也均比较接近,且所得共聚物相对分子质量也较高。并且C序列实验长度比其理论长度要长也有同样的变化规律。这说明所合成的共聚物并非是完全无规,而是有一些微嵌段的共聚物。这种反应规律与反应物L-LA和ε-CL的开环聚合反应活性有着密切关系;在相同反应条件下,L-LA的反应活性比ε-CL的要高,如在130℃下,两种反应物的竞聚率分别为:rLA=34.7,rCL=0.24[10]。反应物竞聚率的差异造成了LL微嵌段结构首先生成,随着聚合反应的继续进行,C的微嵌段也就随着形成。从表1还可以看出,随着共聚物中己内酰含量的增加,共聚物中LL序列平均长度逐渐减少,C序列平均长度不断增大。不仅如此,由图2还可以看出,随着共聚物中FCL增大,聚合物中降低的幅度要大得多,而增加的幅度要大得多。

图2 FCL与序列平均长度的关系Fig.2 Relationship betweenε-caprolactone mole fraction in copolymer(FCL)and average sequence lengths
2.2 共聚物热性能分析
从图3(a)可以看出,不同组分的共聚物在第一次升温时均出现了熔融峰,根据熔点判断是 PLLA嵌段的晶体熔融峰,而且随着FCL的增加,熔点逐渐下降,峰型也变的更宽,相应熔融焓也变的更小。
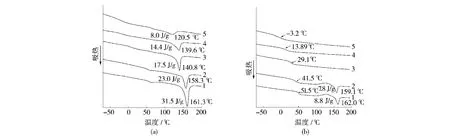
图3 各种PLCA共聚物的DSC曲线Fig.3 DSC curves for PLCA copolymers
从图3(b)可以看出,降温后第二次升温时,图中3、4、5曲线中的熔融峰消失。这是由于晶体熔融后,冷却过程中不能结晶或者来不及结晶,其结晶能力比较弱造成第二次升温后熔点消失。在图3(b)还可以看出,随着FCL的增加,Tg也在逐渐下降。Tg的下降与聚合物中链上己内酰结构单元增加导致聚合物的柔性增加有关。另外从图4可以看出,随着FCL的增加,Tg几乎呈线性下降趋势,从而根据这种变化规律可以预测PLCA共聚物其他组成的Tg。
2.3 微观结构与热力学性能之间的联系
由图5(a)可以看出,随着LL序列实验长度的降低,Tm和ΔHm呈下降趋势。这是由于LL序列实验长度越小,导致 PLLA微晶区结晶能力越差,从而造成Tm和ΔHm下降。但是LL序列实验长度小到一定程度,PLLA微晶区结晶能力变得极差,表现为无Tm和ΔHm。图5(b)展现了C序列实验长度与Tm、ΔHm的关系。同样,由于共聚物中C序列实验长度过小,导致PCL微晶区结晶能力极差,表现为无Tm和ΔHm。
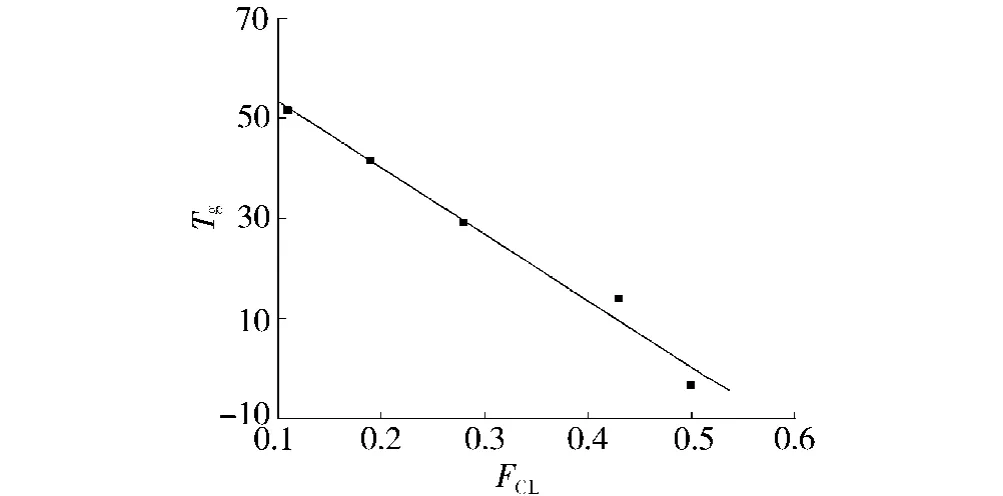
图4 FCL与 Tg的关系Fig.4 Relationship betweenε-caprolactone mole fraction in copolymer(FCL))andTg

图5
3 结论
(1)通过比较序列平均长度,证实所合成的共聚物具有一些微嵌段,并非完全无规。随着共聚物中己内酰含量的增加,C序列长度增大,LL序列长度减小;
(2)随着共聚物中己内酰含量增加,共聚物的Tm和ΔHm逐渐降低,Tg成线性下降趋势;
(3)随着序列实验长度的降低,Tm和ΔHm呈下降趋势,且序列实验长度过小,表现为无Tm和ΔHm。
[1] 潘 璞.高相对分子质量聚乳酸共聚物的制备及性能研究[J].中国塑料,2007,21(8):13-19.
[2] 崔广军,王 扬,李海东.聚己内酯的非等温结晶动力学的研究[J].中国塑料,2008,22(11):15-18.
[3] Youngmee J,Soo H K,Hee J Y,et al.Application of an Elastic Biodegradable Poly(L-LActide-co-epsiv-caprolactone)Scaffold for Cartilage Tissue Regeneration[J].J Biomater Sci,PolymEd,2008,19(8):1073-1085.
[4] Baimark Y,Molloy R,Molloy N,et al.Synthesis,Characterization and Melt Spinning of a Block Copolymer of L-lactide and Epsilon-caprolactone for Potential Use as an Absorbable Mon ofilament Surgical Suture[J].J Mater Sci Mater Med,2005,16(8):699-707.
[5] Hiroyuki I,Eiko I,Takehisa M,et al.Mechanical Responses of a Compliant Electrospun Poly(L-lactide-co-εcaprolactone)Small-diameter Vascular Graft[J].Biomaterials,2006,27(8):1470-1478.
[6] Grijpma D W,Albert J,Penning P.(Co)Polymers of L-lactide,1.Synthesis,The rmal Properties and Hydrolytic Degradation[J].Macromol ChemPhys,1994,195(5):1633-1647.
[7] Contreras J,Darymar D.Ring-opening Copolymerization of L-lactide withε-caprolactone Initiated by Diphenylzinc[J].PolymInt,2006,55(9):1049-1056.
[8] Kasperczyk J,Bero M.Coordination Polymerization of Lactides,4a)the Role of Transesterification in the Copoly-merization of L,L-lactide andε-caprolactone[J].Makromol Chem,1993,194(3):913-925.
[9] Kasperczyk J.Copolymerization of Glycolide andε-caprolactone,1.Analysis of the Copolymer Microstructure by Means of1H and13C NMR Spectroscopy[J].Macromol ChemPhys,1999,200(4):903-910.
[10] Dobrzynski,Suming L,Kasperczyk I,et al.Structureproperty Relationships of Copolymers Obtained by Ringopening Polymerization of Glycolide andε-caprolactone.Part 1.Synthesis and Characterization[J].Biomacromolecules,2005,6(1):483-488.
[11] Nalampang K,Molloy R,PunyodomW.Synthesis and Characterization of Poly (L-lactide-co-ε-caprolactone)Copolymers:Influence of Sequential Monomer Addition on Chain Microstructure[J].PolymAdv Technol,2007,18(3):240-248.
[12] Wei Zhiyong,Liu Lian,Qu Chao,et al.Microstructure Analysis and The rmal Properties of L-lactide/ε-caprolactone Copolymers Obtained with MagnesiumOctoate[J].Polymer,2009,50(6):1423-1429.
