美托洛尔对异丙基肾上腺素诱导心力衰竭大鼠心肌细胞凋亡的影响
2010-02-10赵智明焦东东
赵智明,郭 寒,焦东东,陆 乐,蔡 辉
(南京军区南京总医院中西医结合科,南京 210002)
美托洛尔对异丙基肾上腺素诱导心力衰竭大鼠心肌细胞凋亡的影响
赵智明,郭 寒,焦东东,陆 乐,蔡 辉
(南京军区南京总医院中西医结合科,南京 210002)
目的探讨美托洛尔对充血性心力衰竭大鼠心肌细胞凋亡的影响。方法实验选用清洁级雄性SD大鼠60只,随机分为空白组(n=15),模型组(n=45)皮下注射异丙基肾上腺素2次(170 mg/kg),6周后应用超声心动图检测,以左室射血分数(LVEF)小于或等于45%确定造模成功,将心力衰竭大鼠模型随机分为对照组(n=13)、美托洛尔治疗组(n=14)8 mg◦kg-1◦d-1,18周使用左心导管进行血流动力学检查,并利用琼脂糖凝胶电泳法检测DNA断片化和免疫印迹分析法检测Bcl-2、Bax、caspase-9和caspase-3的表达。结果(1)与空白组相比,对照组血流动力学指标明显恶化,心室质量指数(VWI)、左心室质量指数(LVWI)显著升高,心肌细胞凋亡率增加;(2)与对照组比较,美托洛尔组心率(HR)、左心室舒张末压力(LVEDP)、VWI及LVWI明显降低(P<0.05)和±dp/dtmax明显升高(P<0.05),左心室重量指数明显降低(P<0.05),心肌细胞凋亡率下降。结论
美托洛尔能抑制心力衰竭大鼠心肌细胞凋亡,改善心功能,逆转心室重构。
美托洛尔;充血性心力衰竭;SD大鼠;异丙基肾上腺素;心肌细胞凋亡
充血性心力衰竭(congestive heart failure,CHF)是各种心血管疾病的共同转归,严重威胁着人类的健康。在心力衰竭(心衰)发生过程中,心肌细胞凋亡可能起了重要作用。本研究以心衰大鼠为实验模型,观察美托洛尔对心肌细胞凋亡的影响,并探讨其意义,从而为临床防治心衰提供理论依据。
1 资料与方法
1.1 实验动物与试剂 9周龄清洁级雄性SD大鼠(体质量230~280 g),购于南京中医药大学动物中心。药品:美托洛尔(AstraZeneca,批号:0604045);盐酸异丙基肾上腺素(ISO)购自美国SIGMA公司(批号:I5627)。RPMI 1640培养基(Life Technologies,Grand Island,NY),New bovine serum(NBS,杭州四季青),dithiothreitol(DTT,Sigma),Mouse anti-Bcl-2 monoclonal antibody,mouse anti-Bax monoclonal antibody and anti--tubulin(购自 Santa Cruz Biotechnology公司);Cleaved caspase-3 and cleaved caspase-9 antibody购自 Cell Signaling Technology公司。
1.2 实验方法及分组 模型组45只,皮下注射ISO 0.25 mL(170 mg/kg,分2次,间隔24 h);正常组15只,皮下注射生理盐水0.25 mL[1]。饲养环境(22±2)℃,常规饲料喂养,自由饮水。于实验第6周应用彩色超声监测仪(型号:HPsonos 5500,探头频率7.5 MHz,产地:美国)测量左室射血分数(LEVF)。测定值为5个心动周期的均值。以LVEF≤45%为造模成功(n=41)[2]。将造模成功大鼠随机分为心衰对照组(NS 0.1 mL◦kg-1◦d-1灌胃,n=13)和美托洛尔组(metoprolol 8 mg◦kg-1◦ d-1灌胃,n=14),饲养 18周,观察大鼠的饮食、毛色、活动、发绀、水肿等一般性状,每周称体质量(BW)。
表1 2组大鼠血流动力学结果(±s)

表1 2组大鼠血流动力学结果(±s)
*:与正常组比较,P<0.05;#:与心衰对照组比较,P<0.05。
组别 n HR LVEDP LVSP dp/dtmax -dp/dtmax正常组 15 400.5±13.3 1.2±0.6 120.2±2.3 3.82±0.05 -3.61±0.02心衰对照组 13 453.3±10.8* 11.1±0.6* 104.8±1.7 2.33±0.05* -1.90±0.07*美托洛尔组 14 347.5±9.9*# 5.4±0.3*# 100.1±1.5 3.37±0.04*# -2.84±0.04*#
1.3 血流动力学检测 18周实验结束,将大鼠以戊巴比妥钠30 mg/kg腹腔注射麻醉后,应用左心导管插入左心室,通过压力换能器输入BL-410生物机能实验系统(成都泰盟科技有限公司),由实验系统软件处理获得左心室舒张末压力(LVEDP)、左心室内压峰值(LVSP)、左心室压力上升/下降最大速率(±dp/dtmax)心率(HR)。
1.4 心脏质量指数测量 血流动力学检测完毕后迅速打开胸腔摘取心脏,肉眼观察后,剪去周围大血管,在冰生理盐水中洗净血液,滤纸吸干,沿房室交界处去除左右心房,用电子天平(精确度0.000 1 g)称取心室质量(VW),再剪去右心室游离壁,保留左心室及室间隔,称取左心室质量(LVW),分别计算:心室质量指数 VWI(VW/BW)、左心室质量指数 LVWI(LVW/BW)。称完后在乳头肌水平下方室间隔及左室游离壁分别取全层心肌组织4~6块(备用)。
1.5 心脏病理评分 所有标本于10%甲醛中固定24 h(4℃),常规取材、脱水、石蜡包埋,沿左室长轴线每隔 1 mm横断面切取5张(层厚4 μ m)切片,切片经 HE染色,Masson三色染色。光学显微镜下观察:(1)心肌纤维有无肥大、变性、坏死;(2)间质有无充血、水肿、炎细胞浸润、结缔组织增生;(3)心内膜和心外膜有无充血、水肿、炎细胞浸润。各种病变由轻到重的程度分别评分为1、2、3、4分,无病变为0分[3],累加每组每只动物所有分数,并进行统计学处理。
1.6 琼脂糖凝胶电泳测定DNA断片化 将所取心肌组织匀浆,蛋白裂解,进行 DNA沉淀溶解后,在含有5 μ g/mL EB的1%agrose凝胶上电泳1 h后,用 UVP成像系统进行拍照。电泳过程中用DNA maker指示DNA片段。
1.7 免疫印迹分析(Western blot analysis) 取冰冻心肌组织融化匀浆,蛋白裂解,离心,取上清液。蛋白定量用BCA蛋白定量试剂盒(Pierce)进行测定,具体定量方法见试剂盒的说明书。不同分子质量的蛋白样品经7.5%~15%的SDS-PAGE电泳分离,用半干法转至PVDF(Millipore,USA)。转移完后膜用丽春红S(0.5%ponceaus S in 1%acetic acid)染色,洗涤,与化学发光底物(LumiGLO chemiluminescent substract system,KPL,Guildford,UK)共孵,然后与X光胶片在暗盒曝光5~30 min。冲洗胶片,扫描仪获取图像。动物实验的相关规程严格按照实验动物使用和操作指南(中国科学技术部2006年颁布)以及本院制定的相关伦理规则,旨在减轻动物所受痛苦并减少动物的使用数量。
1.8 统计学方法 采用SPSS11.5软件包进行统计学分析。计量资料以x±s表示,两组间均数的比较采用方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 一般性状 与正常组相比,对照组大鼠普遍出现以下现象:毛色暗黄,纳食减少,体质量先增加,后下降,运动缓慢,口、鼻发绀有血性分泌物,呼吸有明显气喘,足爪水肿,活动减少,抓取反应差。美托洛尔组经治疗后心衰症状较对照组好转。
2.2 血流动力学检测结果 血流动力学检测结果见表1。与正常组相比对照组大鼠HR、LVEDP显著增加(P<0.01),LVSP及±dp/dtmax明显下降(P<0.01);美托洛尔组与对照组大鼠相比 HR、LVEDP明显下降(P<0.05),±dp/dtmax明显上升(P<0.05)。
2.3 各组大鼠VWI、LVWI及病理评分 VWI结果与正常组比较,对照组VWI、LVWI显著增加,差异有统计学意义(P<0.01),左室重塑明显;美托洛尔组 VWI、LVWI明显增加,差异有统计学意义(P<0.05);与对照组比较,美托洛尔组VWI、LVWI明显下降,差异有统计学意义(P<0.05),见图1。病理评分结果,与对照组比较,对照组评分显著增加,差异有统计学意义(P<0.01);美托洛尔组较对照组评分显著下降(P<0.01),见图 1。

图1 大鼠的VWI/LVWI结果及病理评分

图2 各组大鼠肌细胞凋亡蛋白的改变
2.4 美托洛尔对心衰大鼠心肌凋亡相关蛋白的影响 如图2所示,对照组大鼠心肌相关凋亡蛋白被明显激活,Bax、活化形式的caspase-9和活化形式的caspase-3的合成均明显增加,Bcl-2的合成则明显下降。而美托洛尔明显提高了抗凋亡蛋白Bcl-2的合成,以及下调了促凋亡蛋白Bax的合成,并且凋亡通路中关键的分子caspase-9和caspase-3的活化均被药物不同程度下调。
2.5 3组大鼠心肌DNA断片化的改变 如图3所示,与对照组相比美托洛尔组降低大鼠心肌组织的DNA梯状条带(DNA ladder)的出现。
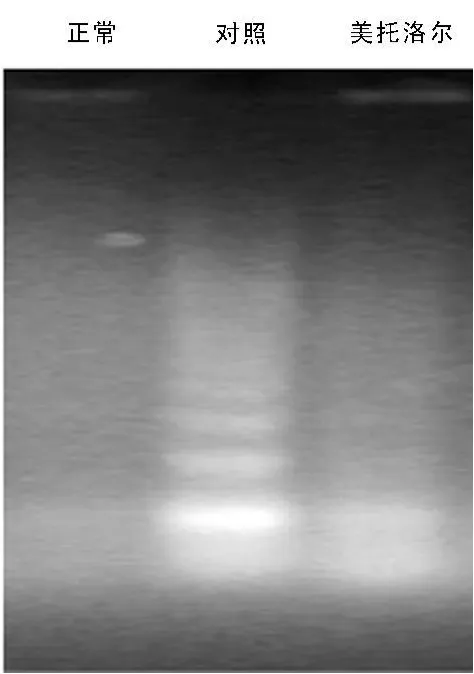
图3 各组大鼠心肌细胞DNA断片化的改变
3 讨 论
CHE是各种心血管疾病的终末阶段,预后严峻,文献报道心衰的5年生存率与恶性肿瘤相仿[4]。心肌细胞是终末分化细胞,细胞增殖相对较少,因此心肌细胞单元数量的稳定对维持心功能具有重要的意义。在哺乳动物,心肌细胞再生极为有限,一定数量心肌细胞的死亡,会影响整个心脏功能[5]。心衰的实质是心室重构,而细胞凋亡在心室重构过程中发挥了关键作用[6-7]。细胞凋亡是引起心室重构及心功能下降的主要原因[8-9]。
细胞凋亡是遗传基因控制的细胞自主性死亡过程,是机体清除严重受损的细胞、不在需要的细胞和癌变细胞的自身防御性机制[10]。心肌细胞凋亡受包括Bcl-2家族蛋白的调控和胱氨酸蛋白酶、丝氨酸蛋白酶等的激活和调控[11]。在Bcl-2家族蛋白中,Bcl-2、Mcl-1、Bcl-W 以及 Bcl-xl具有抑制细胞凋亡作用;而Bax、Bcl-xs、bak及bad则促进细胞的凋亡。Bcl-2 protoonco-gene是一个抑制凋亡的原癌基因,而 Bax proto-oncogene是一个诱导细胞凋亡的原癌基因,Bax与Bcl-2结合,阻止Bcl-2的激活,从而促进凋亡,所以Bax、Bcl-2是调控心肌细胞的关键凋亡基因,两者的比例决定心肌细胞在受到凋亡刺激后是死亡还是存活[8]。而氧自由基、细胞内钙离子超负荷和血管紧张素(AngⅡ)、醛固酮(ALD)、内皮素(ET)等神经内分泌激素的持续异常激活以及细胞因子如 TNF、干扰素-γ、IL-1、表皮生长因子、转化生长因子-β1等众多因素也是引起细胞凋亡的重要因素[12]。而β受体阻滞剂美托洛尔能通过对调节凋亡蛋白及交感神经活性、抑制循环中的儿茶酚胺类物质的释放、拮抗 ET-1、TNF-α等的活性,扩张外周血管,阻断粗细胞凋亡蛋白的合成,逆转心室肥厚,延缓心衰的进程[13-14]。
本实验采用皮下注射大剂量ISO方法复制CHF大鼠模型[15],对照组大鼠 LVSP、±dp/dtmax明显下降(P<0.01),HR、LVEDP及VWI明显上升(P<0.01),并出现心室肥大。心肌DNA断片化及心肌凋亡相关蛋白表达提高,心功能明显受损,证实CHF的心肌有大量的心肌细胞凋亡。在应用美托洛尔干预CHF大鼠后心肌细胞凋亡率减少。大鼠LVSP、±dp/dtmax明显上升(P<0.01);HR、LVEDP及 VWI明显下降(P<0.01);心室肥大明显好转,心肌DNA断片化改变及心肌凋亡相关蛋白表达下降,心功能明显改善,说明心肌凋亡是CHF心肌细胞死亡及心功能下降的主要原因之一。
本研究发现,异丙基肾上腺素诱导CHF大鼠的心肌细胞凋亡显著上调,提示心肌细胞凋亡在实验性CHF的发病机制中发挥着重要作用。而美托洛尔具有抑制促细胞凋亡蛋白合成,从而降低心肌细胞凋亡,改善在实验性CHF大鼠的心功能及心室重构。
[1] Teerlink JR,Pfeffer JM,Pfeffer MA.Progressive ventricular remodeling in response to diffuse isoproterenol-induced necrosis inrats[J].Circ Res,1994,75(1):105.
[2] Davani S,Marandin A,Mersin N,et al.Mesenchymal progenitor cells differentiate into an endothelial phenotype,enhance vascular density,and improve heart function in a rat cellular cardiomyoplasty model[J].Circulation,2003,108:253.
[3] Rona G,Chappel GI,Balazs T,et al.An infarct-like myocardial lesion and other toxic manifestations produced by isoproterenol in the rat[J].Arch Pathol,1959,67:443.
[4] 中华医学会心血管病分会,中华心血管病杂志编辑委员会.慢性收缩性心力衰竭治疗建议[J].中华心血管病杂志,2002,30(1):7.
[5] Sarkar S,Chawla-Sarkar M,Young D,et al.Myocardial cell death and regeneration during progression of cardiac hypertrophy to heart failure[J].J Biol Chem,2004,279(50):52630.
[6] Garg S,Narula J,Chandrashekhar Y.Apoptosis and heart failure:clinical relevance and therapeutic target[J].J M ol Cell Cardiol,2005,38(1):73.
[7] Van Empel VP,De Windt LJ.Myocyte hypertrophy and apoptosis:a balancing act[J].Cardiovasc Res,2004,63(3):487.
[8] Dorn GW 2nd.Apoptotic and non-apoptotic programmed cardiomyocyte death in ventricular remodelling[J].Cardiovasc Res,2009,81(3):465.
[9] Narula J,Haider N,Arbustini E,et al.Mechanisms of disease:apoptosis in heart failure-seeing hope in death[J].Nat Clin Pract Cardiovasc Med,2006,3(12):681.
[10]Yamashita M,Mizusawa N,Hojo M,et al.Extensive apoptosis and abnormal morphogenesis in pro-caspase-3 transgenic zebrafish during development[J].J Exp Biol,2008,211(Pt12):1874.
[11]Shimojo N,Jesmin S,Zaedi S,et al.Changes in important apoptosis-related molecules in the endothelin-1-induced hypertrophied cardiomyocytes:effect of the pretreatment with eicosapentaenoic Acid[J].Exp Biol Med(Maywood),2006,231(6):932.
[12]Gustafsson AB,Gottlieb RA.Mechanisms of apoptosis in the heart[J].J Clin Immunol,2003,23(6):447.
[13]Nagatomo Y,Yoshikawa T,Kohno T,et al.A pilot study on the role of autoantibody targeting the beta1-adrenergic receptor in the response to betablocker therapy for congestive heart failure[J].J Card Fail,2009,15(3):224.
[14]Prabhu SD,Wang G,Luo J,et al.Beta-adrenergic receptor blockade modulates Bcl-X(S)expression and reduces apoptosis in failing myocardium[J].J Mol Cell Cardiol,2003,35(5):483.
[15]Rona G,Chappel GI,Balazs T,et al.An infarct-like myocardial lesion and other toxic manifestations produced by isoproterenol in the rat[J].Arch Pathol,1959,67(4):443.
Effect of metoprolol on myocardial cell apoptosis in rats with ISO-induced congestive heart failure
ZHAOZhi-ming,GUO Han,J IAODong-dong,et al.
(Departmentof Integrated Traditional Chinese and Western Medicine,Nanjing General Hospital of Nanjing Military Region,Nanjing,J iangsu210002,China)
ObjectiveTo explore the effect of metoprolol on myocardial cell apoptosis in rats with heart failure.Methods60 male Sprague-Dawley rats were randomly allocated to the ISO-induced chronic heart failure group(n=45)receiving two subcutaneous injections of 170 mg ISO per-kilogram of body and the healthy normal group(NOR group,n=15)receiving two subcutaneous injections of 0.25 mL normal saline.At 6-week,the left ventricular ejection fraction(LVEF)was measured by echocardiogram,the remaining rats,with left ventricular ejection fraction≤45%,were randomly divided into two groups:control group(n=13),metoprolol group(8 mg◦kg-1◦ d-1,n=14),the drugs were given by gastric perfusion.At 18-week,then the hemodynamic parameters were detected,including heart rate,left ventricular end diastolic pressure,LV systolic pressure,LVWI was measured after LV morphopathological examination.The DNA fragmentation was detected by agarose gel electrophoresis method and the Bax,cleaved caspase-9 and cleaved caspase-3 were detected by Western blot analysis method.Results(1)Compared with the NOR group,the HR,LVEDP,LVWI and the DNA fragmentation Bcl-2,Bax,cleaved caspase-9 and cleaved caspase-3 in the myocardial cells were significantly increased(P<0.01).But LVSP and±dp/dtmaxand Bcl-2 were significantly decreased in the CON group.(2)Compared with the CON group,the HR,LVEDP,LVWI and the DNA fragmentation Bcl-2,Bax,cleaved caspase-9 and cleaved caspase-3 in the myocardial cells were significantly decreased.The LVSP and±dp/dtmax and Bcl-2,significantly increased(P<0.01)in the metoprolol group.ConclusionMetoprolol can inhibit myocardial cell apoptosis,improve heart function and reverse ventricular remodeling in rats with congestive heart failure.
metoprolol;congestive heart failure;SD rats;ISO;myocardial cell apoptosis
R365.541
A
1671-8348(2010)09-1039-03
2009-08-27
2009-09-06)
◦论 著◦
