野生型p53基因调控膀胱移行细胞癌中心体异常的实验研究
2010-02-03王明王连渠谭毅
王明,王连渠,谭毅
(重庆医科大学 附属第一医院泌尿外科,重庆 400016)
野生型p53基因调控膀胱移行细胞癌中心体异常的实验研究
王明,王连渠,谭毅
(重庆医科大学 附属第一医院泌尿外科,重庆 400016)
目的 研究野生型p53基因抑制膀胱癌细胞中心体异常的作用。方法 将野生型p53基因重组腺病毒载体转染人膀胱癌细胞T24,应用免疫荧光化学法检测膀胱癌细胞中心体异常变化情况。结果 野生型p53基因可抑制膀胱移行细胞癌T24细胞中心体异常。结论p53基因可能是膀胱移行细胞癌中心体异常的一个重要调控因子,p53基因失活可能引起肿瘤细胞染色体不稳,从而促进肿瘤的发生和发展。
野生型p53基因;膀胱癌细胞株;中心体异常;染色体不稳
中心体异常是恶性肿瘤细胞的一个重要特征,它引起肿瘤细胞极性的改变和细胞的异常分裂如多极分裂,从而导致染色体分离异常(非整倍体),使肿瘤细胞表现为复杂的染色体和基因组改变,并随着肿瘤的发生、发展而不断的向更复杂的方向演变。中心体异常已经成为近年来研究的热点。中心体正常的结构、功能和复制的维系有赖于多个调控因子之间的协调。野生型p53基因是一种与人类肿瘤相关性最高的抑癌基因,有研究报道p53蛋白也是中心体异常的一个重要调控因子。本研究通过转染野生型p53基因对膀胱移行细胞癌(bladder transitional cell carcinoma,BTCC)T24细胞系细胞中心体异常的变化进行研究和分析,以探讨p53对BTCC细胞中心体的调控作用。
1 材料与方法
1.1 研究对象、主要试剂和染色方法
BTCCT24细胞系,由本实验室保存;野生型p53基因重组腺病毒载体(Ad-CMVp53)和含有绿色荧光蛋白(green fluorescent protein,GFP)的对照载体(AdCMV-GFP),由国家人类基因组北方研究中心提供,病毒滴度为5×1010IFU/ml。第一抗体单克隆鼠抗人γ微管蛋白抗体(GTU88)、单克隆鼠抗人p53抗体(DO-1),美国Sigma公司产品;第二抗体FITC标记山羊抗鼠IgG、SP-9002免疫组化染色试剂盒、碘化丙锭(PI)、DAB显色试剂盒、封闭用正常山羊血清工作液、包被玻片用多聚赖氨酸,均为北京中杉金桥生物试剂公司产品。
1.2 细胞培养
应用RPMI1640培养基(含10%小牛血清、100IU/ml青霉素、0.2mg/ml链霉素),在37℃、5%CO2培养箱、载玻片24孔板中培养。细胞大体生长状态在倒置显微镜下观察,当玻片80%~90%为细胞贴壁覆盖时,收获载玻片。
1.3 病毒转染
先用AdCMV-GFP做预实验,用不同稀释倍数的AdCMV-GFP感染细胞,在感染1~2d后检测感染效率。通过在荧光显微镜下观察细胞的GFP的表达情况来确定,可达到100%感染效率但又不会引起细胞表型变化病毒浓度范围。将细胞接种于放有1cm×1cm载玻片的24孔板中,24h后换液,并加入Ad-CMVp53和AdCMV-GFP,同时设立空白对照组,24h后再换液,继续培养2d,分别进行转染的鉴定和中心体的检测。
1.4 转染的鉴定
1.4.1 腺病毒转染的效率:在荧光显微镜下,通过观察转染对照腺病毒AdCMV-GFP的细胞GFP的表达情况来确定腺病毒转染的效率。
1.4.2 野生型p53蛋白表达:用免疫细胞化学法检测Wtp53蛋白表达来检测野生型p53蛋白表达,检测使用的抗体为单克隆鼠抗人p53抗体,光镜下观察,同时培养的未转染的T24细胞做对照。
1.5 应用免疫荧光细胞化学法检测中心体
将含有细胞的载玻片经PBS清洗,多聚甲醇溶液固定,空气干燥,PBS再水化,山羊血清封闭,加入单克隆鼠抗γ微管蛋白抗体∶阻滞液(1∶40)孵育,PBS清洗,FITC标记山羊抗鼠IgG∶阻滞液(1∶50)孵育,PBS清洗,PI副染,PBS清洗。染色完成后的切片立即置于荧光显微镜下观察,不能及时观察的玻片置于4℃冰箱内避光保存。同时随机抽取2~4张玻片,以PBS代替一抗的同步染色作为阴性对照。
1.6 结果判断
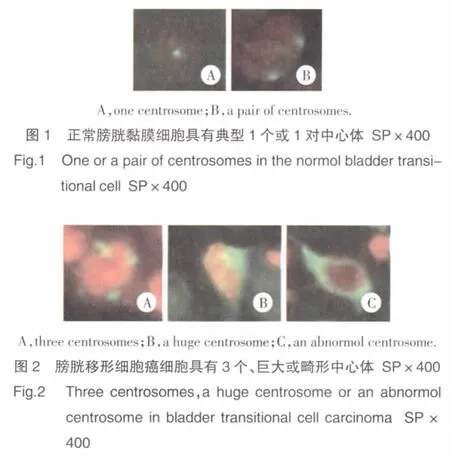
中心体异常阳性的判定:荧光显微镜下观察,正常膀胱黏膜上皮细胞具有典型的一个或一对中心体。BTCC细胞中经常可见到多个巨大或者畸形的中心体。我们把具有以下特征之一的中心体判断为异常中心体:(1)1个细胞内观察到3个或者多个中心体;(2)中心体的直径为阴性对照的正常膀胱黏膜上皮细胞中心体直径的2倍及以上,甚至出现巨块状中心体;(3)中心体形状异常,成长条形或线状。分别转染3次,每转染1次观察3个玻片,每个玻片观察150个细胞。在荧光显微镜下观察,计算含异常中心体细胞的百分比;其图像用Olympus Bx15显微图像采集系统采集,中心体平均面积和光密度用Image-pro plus 5.0.21软件专业图像分析软件(Media Cybernetics誖)分析。
1.7 统计学分析
采用SPSS13.0统计软件进行t检验。P<0.05为差异有统计学意义。
2 结果
2.1 正常膀胱黏膜上皮和BTCC细胞中心体的观察
正常膀胱黏膜上皮细胞具有典型的1个或1对中心体(图1),BTCC细胞中可见到多个巨大或者畸形的中心体(图2)。
2.2 腺病毒载体转染效率
当腺病毒滴度为1×108IFU/ml时,AdCMV-GFP基因转染的细胞24h后在荧光显微镜下观察几乎100%的T24细胞核着绿色荧光,表明用腺病毒载体已高效转染(图3)。

2.2 Wtp53蛋白的表达
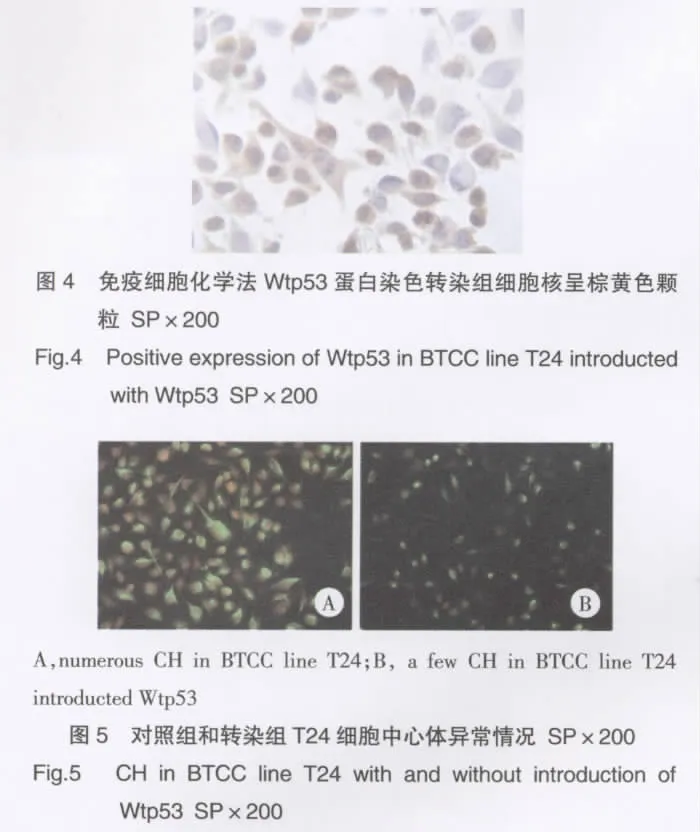
对照组T24细胞核着蓝色表示阴性,在腺病毒滴度为1×108IFU/ml时,野生型p53基因重组腺病毒载体(Ad-CMVp53)基因转染的细胞经免疫细胞化学染色后显微镜下观察有80%以上T24细胞核着棕色或棕黄色,野生型p53基因蛋白表达阳性,说明外源野生型p53基因转染成功(图4)。
2.3 中心体异常的检测
正常对照组T24细胞中心体免疫荧光分析发现部分T24细胞内含有3个、4个、多个,甚至巨型的中心体聚集,平均占总体细胞的百分比为(6.37±1.21)%,中心体平均面积为 130.56±5.57,光密度为6990.22±138.21。而野生型p53基因重组腺病毒载体(Ad-CMVp53)基因转染组细胞出现异常的中心体数目明显减少,其平均占总体细胞的百分比为(3.18±1.14)%,中心体平均面积为 73.22±10.28,光密度为4908.67±804.34。转染组和对照组进行比较,野生型p53基因重组腺病毒载体(Ad-CMVp53)基因转染组组异常中心体数目显著低于对照组(P<0.01)。见图 5。
3 讨论
中心体是细胞内一种微小非膜型细胞器,由一对互相垂直的短筒状中心粒和中心粒周围物质组成。它的功能是在间期及有丝分裂期的细胞中作为主要的微管组织中心。在有丝分裂过程中它建立两极纺锤体,纺锤体的微管牵引染色体向两极运动,从而确保复制后的染色体分配到两个子细胞中去,以维持基因组的稳定[1]。
中心体结构和功能异常至少有两个功能性的后果可能在肿瘤发生、发展中起着重要作用:(1)中心体复制异常形成的多中心体可能导致细胞极性改变、细胞及组织的分化异常;(2)中心体异常导致的有丝分裂纺锤体缺陷可能导致染色体分离错误,中心体的过度复制会形成多极纺锤体,后者使复制后的两套染色体分配到两个以上的子细胞中去。而且多极纺锤体施加在单个染色体上的多方向的力会引起染色体断裂,中心体复制或分裂失败形成单极纺锤体,从而引起染色体不分离。在上述情况下,子细胞都会得到异常数目的染色体而形成非整倍体,即染色体不稳(chromosome instability,CIN)表型。因此中心体的异常与肿瘤基因非整倍体的发生可能存在直接机制上的联系。Yamamoto等[2]对8株膀胱癌细胞株中心体数目与染色体数目的关系研究中发现,在中心体异常的细胞中其染色体数目也异常。目前认为染色体基因不稳定是人类肿瘤发生发展中的中心环节,CIN是恶性肿瘤中最常见的基因不稳定形式,其中以细胞染色体数目不成倍数的增加或减少为表现的非整倍体是CIN最常见的表现形式[3]。
目前调控中心体功能的因素和导致中心体异常的机制还不清楚。已知的调节机制主要涉及以下几个方面:(1)中心体相关激酶;(2)泛素—蛋白酶降解途径相关物质;(3)癌基因和抑癌基因等。野生型p53癌基因作为癌抑制基因,在大多数肿瘤中都有突变。野生型p53癌基因突变后,可导致肿瘤细胞中心体异常,引起肿瘤细胞CIN,从而促进肿瘤的发生和发展[3]。许多资料已显示,p53与膀胱移行细胞癌细胞中心体异常有关。Kawamura等[4]对20例膀胱移行细胞癌的研究中发现,在非整倍型DNA体肿瘤中p53异常达78%,而在双倍体DNA肿瘤中p53异常仅为10%,说明p53异常导致了膀胱肿瘤DNA非整倍性。Kawamura等[5]还对3种膀胱移行细胞癌细胞株的研究中发现,在含有野生型p53的细胞株(RT-4)中显示出良好的中心体复制循环,而在突变型p53的细胞株(HT-1197和HT-13r)中发现中心体异常扩增。王连渠等[6]的研究也表明中心体异常与膀胱移行细胞癌的恶性程度有关。当p53癌基因功能正常时,可以抑制肿瘤细胞中心体的异常,从而抑制癌细胞的生长。Ouyang等[7]研究发现,将野生型p53导入前列腺癌细胞株,可使细胞株中心体异常发生减少。本研究也证明,转染野生型p53可抑制膀胱移行细胞癌细胞中中心体异常。目前猜测p53可能是通过转激活—非依赖性和转激活—依赖性机制完成对中心体复制循环的调控。前者可能是通过影响中心体上的激酶Aurora-A完成,后者通过cyclin E-CDK2复合体使中心体扩增失调控。Park等[8]研究发现,在膀胱移行细胞癌癌组织和尿沉渣细胞中均发现Aurora-A蛋白表达增高。Yamamoto等[2]也发现膀胱癌细胞株中Aurora-A和p53蛋白均过表达。Kawamura等[9]发现在人类膀胱肿瘤细胞,cyclin E高表达协同p53基因突变,导致中心体的扩增和CIN。以前学者认为转染野生型p53癌基因可诱导膀胱癌细胞的凋亡从而抑制癌细胞的生长。根据本研究结果,我们认为野生型p53癌基因可能是通过抑制膀胱癌细胞中心体的异常,以减少多极分裂和诱导癌细胞的凋亡共同作用,从而抑制癌细胞的生长。
膀胱肿瘤是泌尿外科的常见肿瘤,且术后易复发,因而目前在临床上寻找一种切实有效的预后指标和新的治疗方法尤为重要。随着对中心体研究的逐步深入,在不久的将来,人类可能将探明原癌基因的激活、抑癌基因的失活和细胞周期检测点失调节在肿瘤发生发展中的作用,为临床上基因治疗膀胱肿瘤提供新的理论根据。中心体亦可能作为恶性肿瘤的化学治疗和基因治疗的一个新靶点,从而在临床上为膀胱肿瘤的治疗提供一条新途径。
[1]SchuylerSC,PellmanD.Search,captureandsignal:gamesmicrotubules and centrosomes play[J].Cell Sci,2001,114(2):247-255.
[2]Yamamoto Y,Eguchi S,Junpei A,et al.Intercellular centrosome number is correlated with the copy number of chromosomes in bladder cancer[J].Cancer Genet Cytogenet,2009,191(1):38-42.
[3]Kramer A,Neben K,Ho AD.Centrosome replication,genomic instability and cancer[J].Leukemia,2002,16(5):767-775.
[4]Kawamura K,Ikeda R,Suzuki K.The relationships among ploidy type determined by laser scanning cytometry,the overexpression of p53protein and the numerical aberrations of chromosome 7in bladder cancer[J].Hinyokika Kiko,2000,46(6):377-383.
[5]Kawamura K,Moriyama M,Suga K,et al.Centrosome isolation from cultured bladder cancer cells-p53mutation and centrosome hyperamplification[J].Hinyokika Kiko,2003,49(2):69-74.
[6]王连渠,王明,谭毅.膀胱癌细胞中心体异常与肿瘤预后关系的实验研究[J].中国现代医学杂志,2008,18(22):3290-3296.
[7]Ouyang X,Wang X,Xu K,et a1.Effect of p53on centrosome amplification in prostate cancer cells[J].Biochim Biophys Acta,2001,1543(3):212-220.
[8]Park HS,Park WS,Bondaruk J,et al.Quantitation of Aurora kinase Agene copy number in urine sediments and bladder cancer detection[J].JNatl Cancer Inst,2008,100(23):1740-1740.
[9]Kawamura K,Izumi H,Ma Z,et al.Induction of centrosome amplification and chromosome instability in human bladder cancer cells by p53mutation and cyclin Eoverexpression[J].Cancer Res,2004,64(14):4800-4809.
(编辑 陈 姜,英文编辑 王又冬)
Effect of Wild Typep53Gene on Inhibiting the Centrosome Hyperamplification in Bladder Cancer Cell Line
WANGMing,WANGLian-qu,TANYi
(Department of Urology,The First Affiliated Hospital,Chongqing University of Medical Sciences,Chongqing 400016,China)
ObjectiveTo study the effect of wild typep53gene on centrosome hyperamplification in bladder cancer cells.MethodsAwild typep53gene recombinant adenovirus vector AdCMVp53was constructed,and then transfected into the human bladder cancer cell line T24.The cells were stained with the monoclonal antibody against pericentrin by indirect immunofluorescence method.The change of centrosome hyperamplification was observed under the fluorescence microspcope.ResultsIntroduction of wild typep53could suppress the centrosome amplification of T24cell line.Conclusionp53might play an important role in the regulation of centrosome hyperamplification.The loss ofp53might be one of the mechanisms involved in chromosome instability and contribute to the genesis and development of the bladder carcinoma.
wild typep53gene;bladder cancer cell line;centrosome hyperamplification;chromosome instability
R737.14
A
0258-4646(2010)02-0128-04
王明(1963-),男,副教授,硕士.E-mail:wangming1963666@163.com
2009-07-06
