海昆肾喜对慢性肾衰竭大鼠肾脏保护作用及其机制探讨
2010-02-02张学凯赵宗江杨美娟解放军第309医院肾内科北京100091北京中医药大学基础医学院北京10001
李 杨,张学凯,赵宗江,杨美娟(1.解放军第309医院肾内科,北京 100091;.北京中医药大学基础医学院,北京 10001)
慢性肾衰竭(chronic renal failure,CRF)是目前严重危害人类健康的多发病和常见病,肾脏纤维化(包括肾小球硬化和肾间质纤维化)是各种肾脏疾病进入终末期的进行性、不可逆的共同病理损害[1],对于寻找肾脏纤维化的各种治疗措施是当前肾脏病研究领域的重点与热点。各种中成药在临床慢性肾衰竭治疗应用广泛[2],且疗效显著,而其具体作用机制并不明了。在研究中,观察海昆肾喜对于慢性肾衰竭模型大鼠的肾脏保护作用,并初步探讨其可能的作用机制。
1 材料与方法
1.1 实验材料
雄性Wistar健康大鼠45只,6周龄,清洁级,体重(200±20)g,购自中国医学科学院实验动物研究所 (SCXR京:200520013)。海昆肾喜胶囊,吉林辉南长龙生化药业股份有限公司提供(批号:20030052);腺嘌呤,购自北京化学试剂公司,用前加蒸馏水配成20 mg·mL-1的混悬液。
1.2 实验方法
1.2.1 实验分组:成年Wistar雄性大鼠45只,购进后饲以普通饲料观察1周,一般状态良好后按体重随机分组。正常对照组15只;模型组15只:给予腺嘌呤悬浊液灌胃200 mg·kg-1·d-1;海昆治疗组15只:腺嘌呤悬浊液灌胃200 mg·kg-1·d-1,同时给予海昆肾喜溶液 200 mg·kg-1·d-1灌胃。以上各组大鼠给予普通饲料喂养,自由饮食活动。
1.2.2 取材方法:于每周末将实验动物称重、入代谢笼,留取24 h尿、测定尿蛋白。第4周末处死,按40 mg·kg-1体重水合氯醛腹腔注射麻醉后,用取血10 mL应用自动分析仪测定血肌酐、尿素氮。开腹取出左侧肾脏,用0.9%氯化钠注射液冲洗后,分离肾皮质,固定于10%中性甲醛溶液。
1.2.3 HE染色方法:切片脱蜡,梯度酒精进水,自来水冲洗;Harris氏苏木素浸泡10~20 min,自来水冲洗;1%盐酸酒精分化,自来水冲洗;1%伊红浸泡10 min,自来水冲洗;梯度酒精脱水,二甲苯透明,环氧树脂封片。
1.2.4 免疫组化染色:(1)石蜡切片常规脱蜡入水;(2)过氧化氢-甲醇孵育20 min以消除内源性过氧化物酶的活性;(3)抗原修复:微波修复90℃ ~98℃ 20 min;(4)正常山羊血清室温封闭20 min;(5)加入一抗(1∶200),4℃过夜;(6)加入生物素标记的二抗,37℃孵育30 min;(7)加入 SABC,37℃下孵育30 min;(8)DAB室温下显色5 min;(9)升梯度乙醇脱水,二甲苯透明,中性树胶封片。阴性对照,一抗用代替。在200倍光镜下检测随机切片10个不重叠视野,应用ICMIAS病理图像分析系统,计算每个视野阳性染色面积和整个视野面积的比值,并进行统计分析。
1.3 统计学方法
用SPSS 11.5软件包进行数据分析,所有计量数据以(±s)表示,差异显著性检验采用单因素方差分析,组间差异比较用Q检验,P<0.05为有统计学差异。
2 结果
2.1 各组大鼠一般状况及存活情况
正常对照组大鼠在整个实验周期中表现机警、反应快,皮毛致密而有光泽,生长、进食及活动情况均无明显异常。模型组大鼠从第2周起已经出现明显的精神萎靡,活动迟缓,皮毛脱落、无光泽。与模型组相比,治疗组大鼠出现上述症状的时间有不同程度的延迟。
2.2 各组大鼠体重的变化
随着喂养时间的延长,正常对照组大鼠体重逐渐增加,而模型组大鼠体重逐渐减轻,模型组大鼠体重明显低于正常对照组(P<0.05),其中第4周显著差异(P<0.01);海昆治疗组大鼠体重较同期CRF模型组普遍偏高,其中第4周时,两组间体重有统计学差异(P<0.05),见表1。
2.3 各组大鼠尿蛋白的变化
造模大鼠给予腺嘌呤灌胃2周后,大鼠出现明显的蛋白尿,与正常对照组比较,具有统计学差异(P<0.01);而海昆治疗组大鼠24 h尿蛋白排泄较模型组明显减少,在第4周末更明显(P <0.01),见表1。
2.4 各组大鼠肾功能的变化
造模各组大鼠血肌酐、尿素氮水平较正常对照组均明显升高(P<0.01),但治疗组大鼠与模型组相比,血肌酐水平无明显差异(P>0.05),见表2。
2.5 病理学变化
肉眼观察正常组大鼠肾脏大小正常,被膜光滑,不易剥脱,褐色、有光泽。模型组大鼠肾脏肿胀,体积增大,质地松软,呈灰白色,缺乏光泽,包膜易剥脱,皮髓质界限不清,为典型的“大白肾”。海昆治疗组大鼠肾脏肿胀,体积较模型组小,质地稍松软,表面呈浅红色,不光滑,缺乏光泽,皮髓质界限清晰,被膜结合紧,不易剥脱。
光镜下观察各组大鼠肾组织HE染色切片,正常对照组动物肾脏皮髓质分界清晰,肾小球数目正常,肾小管上皮完好,肾间质未见炎症细胞浸润及纤维化;模型组动物肾小球数目明显减少,残存的肾小球囊腔扩张,包曼氏囊壁增厚,近曲小管浑浊肿胀,远曲小管和集合管扩张,腔内可见大量金黄色腺嘌呤结晶、蛋白管型、细胞管型,肾间质纤维化,大量炎细胞浸润。治疗组病理变化均较模型组减轻,肾小管中度扩张,肾小管内见少量金黄色结晶,轻度间质纤维化。
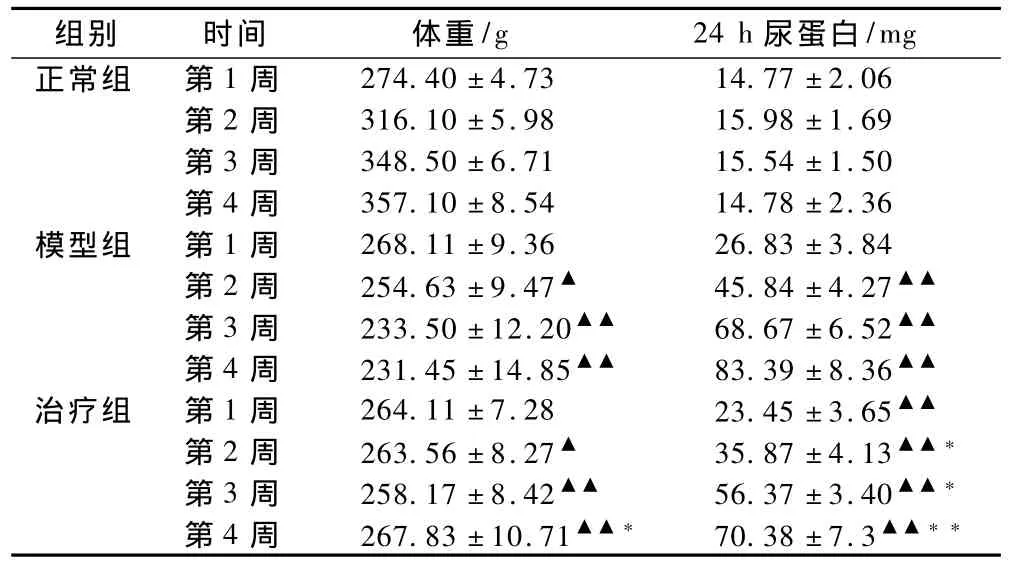
表1 各组大鼠每周体重及24 h尿蛋白变化Tab 1 Body weight and 24-hour urine protein level of each group at each week

表2 各组大鼠血清肌酐、尿素氮变化Tab 2 Change in serum creatinine and UN levels in each group
2.6 各组大鼠肾组织CTGF蛋白的表达
在200倍光镜下观察切片,正常组大鼠肾组织中肾小管上皮细胞、肾间质细胞及肾小球系膜细胞胞浆中有CTGF蛋白少量的表达;模型组与正常组相比较,肾小管上皮细胞和肾间质细胞中CTGF蛋白强阳性表达,也有一些肾小球系膜细胞胞浆内CTGF蛋白表达上调;治疗组CTGF蛋白的表达与模型组相比显著减少(P<0.01),见表3。

表3 大鼠肾组织中CTGF蛋白的表达Tab 3 Expression level of CTGF protein in renal tissues of rats
3 讨论
腺嘌呤致慢性肾衰竭大鼠模型在肾病的研究中应用广泛。腺嘌呤经消化道吸收入血后,在肝脏内代谢形成极难溶于水的2,8-二羟基腺嘌呤,在肾内大量沉积形成结晶,阻塞、压迫肾小管,引起肾小管上皮损伤,晚期出现肾小管间质纤维化,造成肾功能损害,这种慢性肾衰竭模型与人类慢性肾衰竭所表现出来的代谢紊乱十分接近[3]。因此,本文应用这种模型来研究海昆肾喜对慢性肾病的作用及其机制。
结缔组织生长因子(connective tissue growth factor,CTGF)是一种新近发现的致纤维化因子,是转化生长因子-β(transforming growth factor-β,TGF-β)的下游因子[4]。TGF-β是肾脏疾病中公认的引起肾小球硬化和小管间质纤维化的关键因子,但是由于TGF-β生物学功能比较复杂,单纯抑制其生物活性可能引起许多难以预计的不良反应[5]。研究表明,在组织纤维化过程中,TGF-β负面效应主要由 CTGF途径介导,而正面效应则由非 CTGF途径介导[6]。因此干预 CTGF蛋白表达,既能保留TGF-β某些不依赖 CTGF的有益作用,又能消除其纤维增生作用,可能为肾纤维化的防治提供了一个新的、更安全的治疗靶点,为慢性肾脏疾病的治疗开辟新的道路。
海昆肾喜胶囊的主要成分是褐藻多糖硫酸酯,它是一种从海带中提取的生物活性物质,属水溶性杂聚糖,其主要成分是L-岩藻糖-4-硫酸酯[7],是一种高效吸附剂,可充分吸附大中小毒素物质并将其直接排出体外,同时可以改善肾血流量,清除活性氧自由基而具有体内抗氧化作用,降低血脂、降血糖以及免疫调节等多种作用[8]。既往实验研究标明海昆肾喜对于临床慢性肾衰竭患者能够降低 SCr、BUN,提高患者生活质量,推迟开始透析时间,且无明显毒副作用,患者耐受性好[9,10]。本实验研究结果显示,海昆肾喜可以明显改善慢性肾衰竭模型大鼠摄食、精神状态,增加尿量和体重减少等一般状态;可以明显减少慢性肾衰竭模型大鼠尿蛋白的排泄、降低血肌酐和尿素氮,改善肾功能,明显减轻肾脏的组织病理损害,从而起到对肾脏的保护作用,其可能的作用机理是通过下调CTGF蛋白的表达从而减轻肾纤维化的病程进展。
[1] 郑春霞,秦卫松.肾脏纤维化的发生机制及治疗新观点[J].肾脏病与透析肾移植杂志,2006,15(4):360.
[2] 李 英,罗朝利,赵 倩.2006—2008年我院肾病中心中成药应用分析[J].中国医院用药评价与分析,2009,9(4):247.
[3] Eto N,Miyata Y,Ohno H,et al.Nicotinamide prevents the development of hyperphosphataemia by suppressing intestinal sodium-dependent phosphate transporter in rats with adenine-induced renal failure[J].Nephrol Dial Transplant,2005,20(7):1378.
[4] Gore-Hyer E,Shegogue D,Markiewicz M,et al.TGF-beta and CTGF have overlapping and distinct fibrogenic effects on human renal cells[J].Am J Physiol Renal Physiol,2002,283(4):F707.
[5] GoumenosDS,Tsamandas AC,Oldroyd S,etal.Transforming growth factor-beta(1)and myofibroblasts:a potentialpathway towards renalscarring in human glomerular disease[J].Nephron,2001,87(3):240.
[6] 李 雄,柳 飞,付 平.TGF-β/CTGF在肾脏纤维化机制中的作用及中药治疗影响[J].中国中西医结合肾病杂志,2006,7(6):370.
[7] 崔艳秋,罗鼎真,王晓民.褐藻多糖硫酸酯的抗炎与抗氧 化 活 性 研 究 进 展 [J].药 学 学 报,2008,43(12):1186.
[8] 李 涛,吉爱国.褐藻多糖硫酸酯的药理活性及作用机制研究进展[J].中国生化药物杂志,2008,29(3):216.
[9] 朱佩君,金小福,徐 芳.海昆肾喜胶囊治疗慢性肾功能衰竭疗效观察[J].现代中西医结合杂志,2008,17(28):4408.
[10] 杜 兵,何自育.海昆肾喜胶囊治疗慢性肾功能不全的临床观察[J].西南军医,2008,10(3):44.
