陕北白绒山羊H-FABP基因内含子3的遗传多态性分析
2010-01-30余刚
余 刚
(西宁市畜牧兽医站,青海 810003)
脂肪酸结合蛋白(fatty acid-binding protein,FABPs)家族是由一些小的、存在于细胞内的蛋白质组成,在机体中参与细胞内脂肪酸的摄取,并能协助将动物组织细胞内的脂肪酸从胞膜处运至其进行β-氧化的场所或甘油三酯和磷酯合成部位,促进心肌和脂肪细胞中甘油三酯的沉积,对体脂的沉积及动员等具有重要调控作用[1-3]。Huang等[4]研究发现,30~90日龄的公哈萨克绵羊肌肉组织中H-FABP的表达水平与肌间脂肪(intramuscular fat,IMF)含量呈极显著的强正相关。目前普遍认为FABP是影响肌内脂肪沉积的候选基因,在肉质性状的形成中具有重要的生物学功能,因此将H-FABP基因作为候选基因来研究其与动物生产性状的关系,对动物分子育种和标记辅助选择具有一定的理论意义和实际应用价值。
陕北白绒山羊为著名的绒肉兼用型培育山羊品种,除产绒性能优良外还具有肉质细嫩、肉中胆固醇含量少、膻味轻等特点,但由于体型稍小,其产肉性能有待提高。本研究通过分析陕北白绒山羊H-FABP基因的SNPs及其对生长和胴体性状的影响,探讨陕北白绒山羊群体的遗传特性,为陕北白绒山羊的选育提高和分子标记辅助选择等提供理论依据。
1 材料与方法
1.1 血样采集及基因组DNA的提取 从陕西省横山县狄青原陕北白绒山羊原种场随机抽取原种周岁陕北白绒山羊253只,颈静脉采血,ACD抗凝,并参照文献[5]的方法,提取血液基因组DNA。
1.2 胴体和体尺指标测定 周岁陕北白绒山羊眼肌面积和背膘厚的测定参考Silva等[6]的方法,应用加拿大AMI-900型便携式兽用B超仪测定。实验羊体重及主要体尺指标参考张沅等[7]的方法,由同一人实地测量,并记录被测个体的出生重和5月龄断奶重。
1.3 引物设计与PCR反应扩增 参照绵羊 HFABP基因的序列(ACCESSION AY157617)设计引物,序列如下:
Forward:5'-AGCCTTCGT TTCATCCTC-3'
Reverse:5'-AGCAAGTAT TTGGTCCTGT-3'
由上海生工生物工程技术服务有限公司合成。PCR 反应体系25 μ L:Taq DNA Polymerase(MBI产,0.5 u/μ L)2.0 μ L,2.5 mmol/L MgCl22.0 μ L,10 ×Buffer 2.5 μ L,2.5 mmol/L dNTPs 2.5 μ L,50 ~ 100 ng 模板 DNA,10 pmol/μ L 上下游引物各 0.4 μ L,加水至25 μ L。PCR反应程序:95℃5 min;94℃40 s,48.9℃50 s,72℃1 min,共35个循环;最后72℃延伸10 min,4℃保存备用。
1.4 扩增产物的SSCP分析 利用垂直凝胶电泳法进行PCR-SSCP分析。将5 μ L的 PCR产物加入5 μ L的上样缓冲液(Loading Buffer)中 98℃变性 10 min,立即冰浴10 min后点样于预冷的10%聚丙烯酰胺凝胶中,以5 V/cm电压于20℃的1×TBE电泳液中电泳12~14 h,最后银染照相。
1.5 扩增产物的回收测序 经SSCP分析后不同基因型的PCR扩增产物用柱式胶回收试剂盒(购自杭州博日科技有限公司)回收纯化,回收后的DNA片段送交上海捷瑞生物工程有限公司进行正反双向测序。
1.6 数据的统计分析 对该位点基因型的分布进行Hardy-Weinberg平衡的卡方适合性检验,依据最小二乘分析原理,用SAS统计软件的一般线性模型GLM程序对群体 H-FABP基因型效应进行分析,采用Duncan氏法进行多重比较。依据影响生长和胴体性状的因素,并考虑本实验的实际情况(所有参试周岁羊均采用半舍饲半放牧的饲养管理方式并在相同条件下饲养),引入下列参数并建立以下模型:
Yij=μ+Gi+Sj+Gi×Sj+Eij
式中Yij为性状表型值,μ为群体平均值,Gi为基因型效应,Sj为性别效应,Gi×Sj是基因型与性别之间的互作效应,Eij为残差效应。
2 结果与分析
2.1 超声波测定 本实验所得到的超声波扫描切面影像图的灰度、对比度、增益度等较适宜,图像清晰,且测量部位受体位变化影响小,代表性强,易于定位和操作,故根据所测超声波影像计算的背膘厚度和眼肌面积接近真值。
2.2 PCR扩增 扩增产物用1.5%的琼脂糖凝胶电泳检测,扩增片段与目的片段大小一致(526 bp),且目的条带清晰、特异性好,可直接用于SSCP分析(图1)。
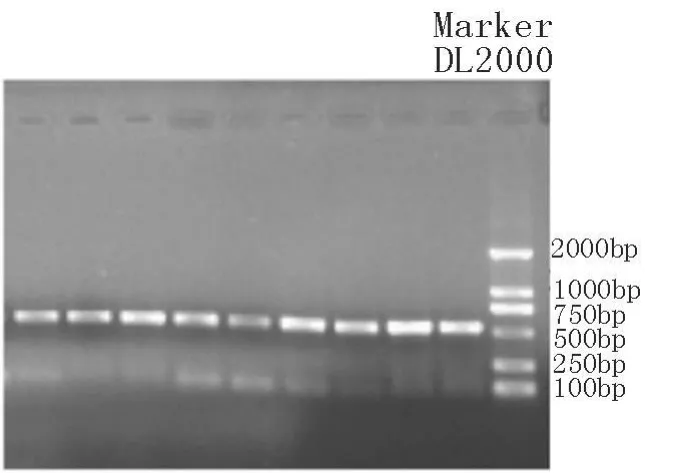
图1 陕北白绒山羊H-FABP基因PCR产物
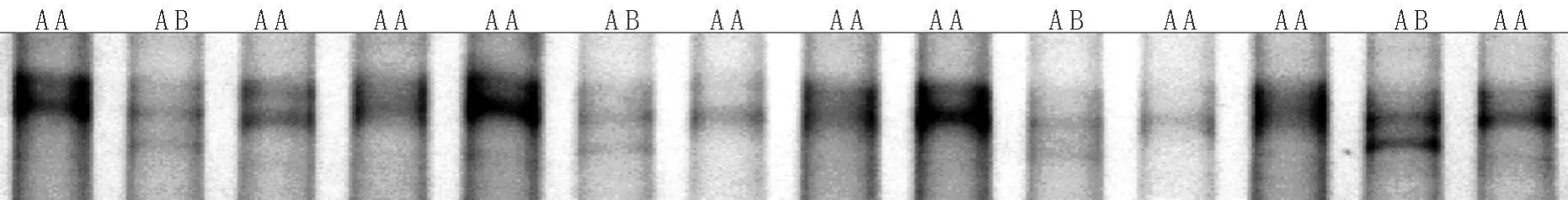
图2 陕北白绒山羊H-FABP基因SSCP电泳结果
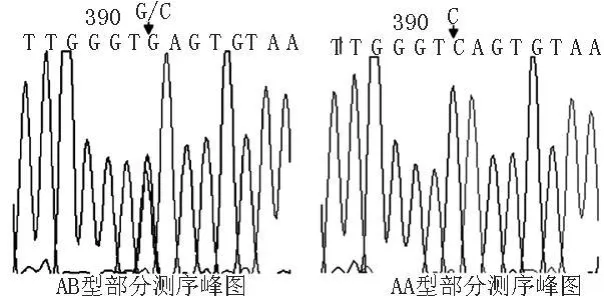
图3 陕北白绒山羊H-FABP基因2种基因型序列分析
2.3 SSCP分析 对扩增产物进行SSCP检测,发现有一对等位基因“A和B”以及两种基因型“AA、AB”,尚未检测到BB型个体,如图2所示。
2.4 不同基因型个体的测序 以SSCP检测的2种基因型AA、AB型为样本,分别测序(如图3)。通过比对发现在H-FABP基因位点存在一处突变,为G→C,因该位点位于内含子区,故不引起氨基酸序列改变。
2.5 H-FABP基因多态位点的遗传分析 由表1可以看出,在所研究的群体中,AA型为优势基因型,A等位基因在群体中为优势基因,B等位基因频率较低,两者差异显著(P<0.05),群体处于Hardy-Weinberg非平衡状态。
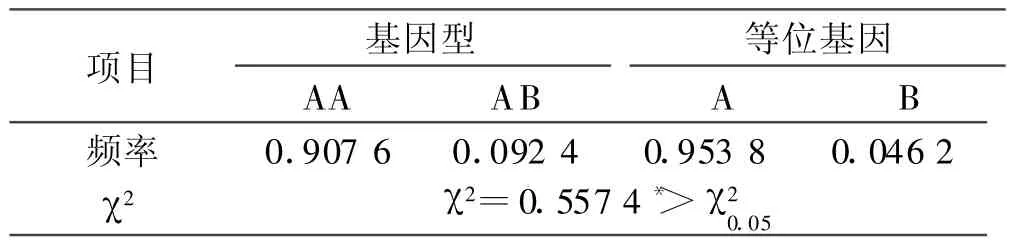
表1 陕北白绒山羊H-FABP基因SSCP的基因频率和基因型频率
由表2可看出,其PIC值为0.084 4<0.25可知,说明该位点为低度多态性,表明该基因此位点多态性较差。

表2 陕北白绒山羊H-FABP基因多态性分析
2.6 H-FABP基因的SNPs与生长发育及胴体性状的相关分析 运用两因素互作模型,对253只周岁陕北白绒山羊不同基因型个体生长及胴体性状进行了差异显著性检验。结果表明(表3),AA型和AB型之间在陕北白绒山羊的胸围和体高上差异显著(P<0.05);在其他性状上,2种基因型间均差异不显著(P>0.05);除在体斜长和背膘厚上表现AB>AA,在其他性状上均表现AA>AB,纯合基因型个体各性状的表型值相对较高。本实验还发现,性别对除出生重、体长、眼肌面积和背膘厚外的其他指标均无显著影响,互作效应除背膘厚外差异均不显著。
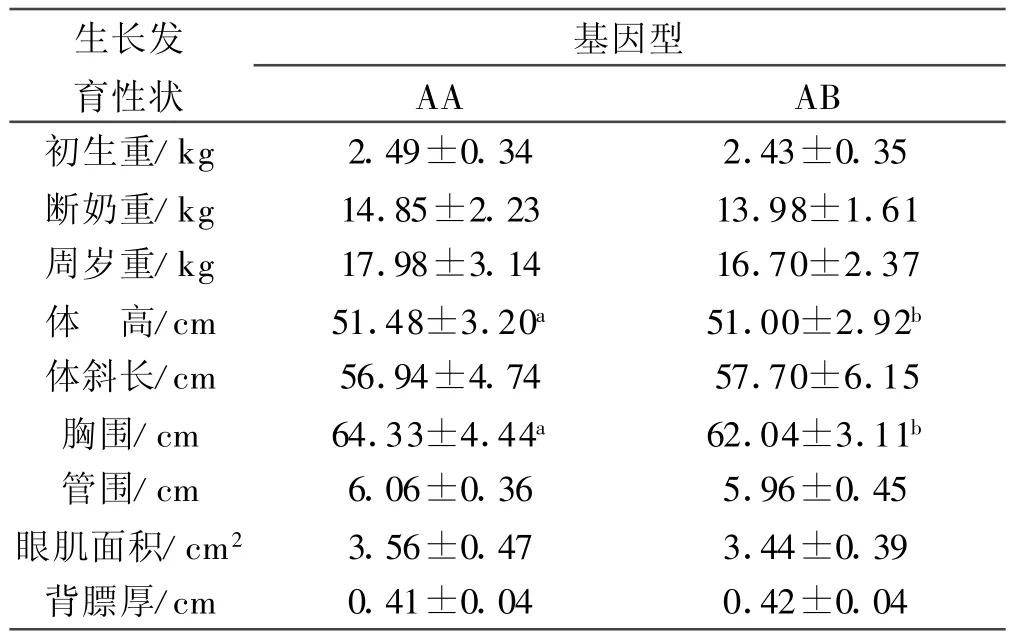
表3 H-FABP基因位点不同基因型对陕北白绒山羊生长及胴体性状的影响
3 结论与讨论
3.1 H-FABP基因第3内含子多态性分析 本实验对H-FABP基因第3内含子的多态性进行分析发现,周岁陕北白绒山羊群体在H-FABP基因第3内含子座位上存在1对等位基因,其中A等位基因为优势基因;该群体在该位点处于Hardy-Weinberg非平衡状态,即该群体在人工选择、迁徙和遗传漂变等因素作用下,该基因座处于非平衡状态中;该群体在该位点的遗传多态性处于低度多态水平(其PIC<0.25)。造成上述情况的原因,可能主要与该群体在长期而系统的闭锁繁育中,受高强度的人工选择导致其高度近交,造成部分等位基因流失有关。
3.2 H-FABP基因多态性与生长及胴体性状关系的分析 有关H-FABP基因与动物生产性状之间关系的研究,在国内外已有大量报道。Brockmann等[8]研究认为猪第4号染色体上存在影响脂肪沉积(包括背膘厚和腹脂)以及生长速度的QTL;而H-F ABP基因恰好位于猪4号染色体上,且它本身又在脂肪细胞中表达并影响甘油三酯的生成与分解[9]。Calvo等[10]采用基因组步移技术对绵羊H-FABP基因进行了克隆并将其定位于2号染色体遗传标记CSRD 2115与BM 2113之间,在对4个绵羊品种(Ovis aries)和欧洲摩弗伦(Mouflon)羊的H-FABP基因外显子2和内含子3的研究中各发现1个SNPs位点。本研究结果新发现陕北白绒山羊H-FABP基因在内含子3内存在G→C的突变,尽管该突变未引起氨基酸的改变,但这可能是造成了2种基因型的陕北白绒山羊在部分生长及胴体性状上存在差异的原因。从本研究结果来看,HFABP基因AA型和AB型之间在陕北白绒山羊的胸围和体高上差异显著(P<0.05),且除在体斜长和背膘厚上表现AB>AA外,在其他性状上均表现AA>AB,这说明H-FABP基因与绒山羊生长发育及胴体性状相关,AA型个体为有利基因型,这可能与AA型个体的H-FABP具有较高的利用脂肪的能力有关,还可能是因为本实验样本数有限以及AB型个体样本数太少所致。H-FABP基因内含子区的变异可能影响到H-FABP的活性及基因表达,调控机体脂肪代谢,进而影响动物生长发育及胴体性状,因此H-FABP可能是影响绒山羊脂肪代谢等的主效基因或与主效基因相连锁,并且可能是通过MAS(标记辅助选择)进行部分生长发育性状等改良的理想基因。本研究结果还显示 ,通过提高AA型的频率可望增加绒山羊的胸围和体高且可能改善绒山羊的生长发育及胴体性状,不过,这需在更多群体中检验G→C突变位点能否用于山羊相关性状等的分子标记辅助选择。本文仅初步分析了不同H-FABP基因型与陕北白绒山羊相关性状的关系,H-FABP基因是否确实影响绒山羊的生长发育及胴体性状,是否与山羊肉IMF含量、嫩度、风味等肉质性状相关,还有待进一步研究。
[1]Vander Horst D J,vanDoorn J M,Passier P C,et al.Role of fatty acid-binding protein in lipid metabolism of insect flight muscle[J].Molecular and Cellular Biochemistry,1993,123:145-152.
[2]Fischer H,Gustafsson T,Sundberg C J,et al.Fatty acid binding protein 4 in human skeletal muscle[J].Biochemical and Biophysical Research Communications,2006,346:125-130.
[3]Richieri G V,Low P J,Ogata R T,et al.Thermodynamics of fatty acid binding to engineered mutants of the adipocyte and intestinal fatty acid-binding proteins[J].The Journal of Biological Chemistry,1998,273(13):7397-7405.
[4]Huang Z G,Xiong L,Liu Z S,et al.T he developmental changes and effect on IM F content of H-FABP and PPARγmRNA expression in sheep muscle[J].Acta Cenetica Sinica,2006,33(6):507-514.
[5]萨姆布鲁克J,拉塞尔DW.分子克隆实验指南[M].黄培堂等译.3版.北京:科学出版社,2002:483-485.
[6]Silva S R,Gomes M J,Dias-da-Silva A,et al.Estimation in vivo of the body and carcass chemical composition of growing lambs by real-time ultrasonography[J].Journal of Animal Science,2005,83:350-357.
[7]张沅.家畜育种学[M].北京:中国农业出版社,2001:99.
[8]Brockmann G,Timtchenko D,Das P,et al.Detection of Q TL for body weight and body fat content in mice using genetic markers[J].Journal of Animal Breeding and Genetics,1996,113:373-379.
[9]Chmurzynska A.T he multigene family of fatty acid-binding proteins(FABPs):Function,structure and polymorphism[J].Journal of Applied Genetics,2006,47(1):39-48.
[10]Calvo J H,Vaiman D,Saidi-Mehtar N,et al.Characterization,genetic variation and chromosomal assignment to sheep chromosome 2 of the ovine heart fatty acid-binding protein gene(FABP3)[J].Cytogenetic and Genome Research,2002,98:270-273.
