MiR-145调控下的基因 CDK6的 3’非编码区片段的克隆与分子生物学检测
2010-01-29宋静文
宋静文
(麦吉尔大学解剖与细胞生物学系,魁北克蒙特利尔 H3A 2B2)
在动植物基因组中广泛存在一类非编码蛋白的 RNA基因,产生长度大约为 21-24个核苷酸的 RNA,它们被命名为microRNA。这是一类具有调节其他基因表达活性的小RNA,在生物的发育过程中发挥着重要作用。最近的研究表明,miR-145有可能调节了多个 G1期阻滞基因包括 CCND2、CDK6和多个下游调节其他细胞周期的基因。所以认为miR-145的失活可能导致某些癌症的发展。其中 CDK6基因的编码产物调节控制细胞周期,特别是 G1到 S期的过渡。当细胞受到刺激时,G1期 cyclinD表达,并与 CDK4,CDK6结合,使它们磷酸化,再使下游的蛋白质如 Rb磷酸化,磷酸化的 Rb释放出转录因子 E2F,促使许多基因的转录,从而允许 G1/S期转换与 DNA合成。当 CDK6活性下降或者是被抑制时,可使 pRb由磷酸化变成低磷酸化状态,在此状态 pRb与转录因子 E2F结合,使 Rb基因对转录因子的抑制不能解除,从而阻止细胞从 G1期进入 S期,抑制细胞增殖,阻止细胞增长。本课题拟对人类基因组中的 CDK6的3’非编码区 (Untranscription Region)片段进行克隆,并构建pMD-18T原核表达载体,再与 pGL-4载体进行连接,测序正确后转化入 Hela细胞,同时把 miR-145转入 Hela细胞进行荧光素酶系统的检测,并为后续研究其与肿瘤细胞内重要 microRNA分子的调控关系提供材料。
1.实验部分
1.1 试剂和仪器
pMD-18T,T4 DNA Ligase,ExTaqDNA polymerase,SacI,XhoI,DL2000、DL15000 DNA marker,10 ×DNA Loading Buffer,6×DNA Loading Buffer,GENE F INDER核酸染料,均由Takara公司生产
全血基因组DNA提取试剂盒,胶回收试剂盒,质粒DNA小量提取试剂盒,PCR产物纯化试剂盒,由 Tiangen公司生产
THZ-312型台式恒温振荡器,TGL-16G台式离心机,DK-S24型电热恒温水浴锅 JY-SPFT型水平电泳槽,JY-600C型电泳仪,ZF-90型暗箱式紫外透射仪,DNA凝胶电泳仪,MG48+型基因扩增仪,S W-CJ-2F型双面净化台SPX-150BS-II型生化培养箱
1.2 从全血基因组中提取目的基因 (实验步骤详见Tiangen试剂盒说明书)
1.3 引物设计
用 Primer5遵循引物设计原则来设计引物。再用BLAST通过序列比对,看此引物特异性的优劣。
根据我们要克隆的 CDK6 3’UTR的碱基序列和上述方法设计的引物序列:
5’TC GAGCTC TGTAAACGACAAGAATAA 3’(SacI,加2个保护碱基)
5’CCGCTCGAGCTCTACTCATTTAAAATTCT3’(XhoI,加 3个保护碱基)
1.4 PCR反应,克隆目的基因
以全血基因组为模板,以 CDK6的 3’UTR引物做 PCR反应 ,如表 1、表 2所示。
1.5 电泳检测
在 140 V,110 mA,30 min条件下电泳,利用 GENE-Finder染料得到条带与 marker比对,判断基因是否成功得到。
1.6 电泳所得基因胶回收 (实验步骤详见 Tiangen试剂盒说明书)
1.7 T质粒构建
人类 CDK6基因包含miRNA结合位点的序列 (CDK6 3’UTR)片段用 PCR的方法从人血基因组 (最好模板用新鲜提取的基因组 DNA,模板质量对于 PCR结果的影响较大)中克隆出来 (克隆时可能需要做梯度 PCR,摸索最佳的退火温度,从而得到特异的产物,若无此实验条件,需要做多次 PCR),PCR产物跑胶,切下特异条带,经过胶回收试剂盒回收。

表 1 PCR反应体系

表 2 PCR反应条件
目的基因与 PMD-18T用一定体系 (插入片段 2.5μL,pMD-18T 0.5μL,Solution 2.0μL)连接 (16℃反应 30 min)后转化入感受态细胞,1小时复苏后涂板过夜培养,在长出菌落的氨苄培养基上挑取单菌落,进行菌落 PCR,同时在另一个氨苄培养基的板上备份,若菌落 PCR为阳性,则挑取相应备份板上的菌落扩大培养后用 Tiangen试剂盒小量提取质粒,然后用 SacI和 XhoI进行双酶切,之后电泳检测,若有切开的空 T载体和目的条带,则对提取的质粒进行测序。
1.8 质粒 DNA的小量提取 (实验步骤详见 Tiangen试剂盒说明书)
2.结果与讨论
2.1 CDK63’UTR克隆反应
设退火温度 55℃,延伸时间改为 2分钟,一共 29循环,引物浓度稀释 10倍后各取 1μL,以全血基因组为模板PCR。电泳结果出现明显的目的条带。如图 1所示。
分析影响 PCR反应的因素:
(1)模板。①模板保存时间过长已经被降解,②模板中含有 Taq酶抑制剂,③模板中蛋白质没有消化除净,特别是染色体中的组蛋白,④在提取制备模板时丢失过多,或吸入酚,⑤模板核酸变性不彻底。在酶和引物质量好时,不出现扩增带,极有可能是标本的消化处理,模板核酸提取过程出了毛病,因而要配制有效而稳定的消化处理液,其程序亦应固定不宜随意更改。
(2)酶失活。需更换新酶,或新旧两种酶同时使用,以分析是否因酶的活性丧失或不够而导致假阴性。需注意的是有时忘加 Taq酶或溴乙锭。
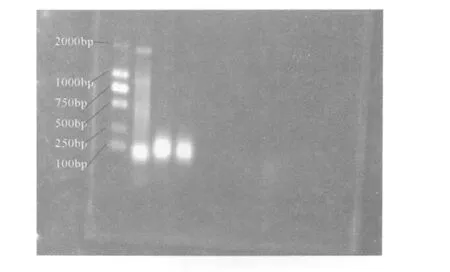
图 1 CDK63’UTR的 PCR反应 (泳道 2)
(3)引物。引物质量、引物的浓度、两条引物的浓度是否对称,是 PCR失败或扩增条带不理想、容易弥散的常见原因。有些批号的引物合成质量有问题,两条引物一条浓度高,一条浓度低,造成低效率的不对称扩增,对策为:①选定一个好的引物合成单位。②引物的浓度不仅要看 OD值,更要注重引物原液做琼脂糖凝胶电泳,一定要有引物条带出现,而且两引物带的亮度应大体一致,如一条引物有条带,一条引物无条带,此时做 PCR有可能失败,应和引物合成单位协商解决。如一条引物亮度高,一条亮度低,在稀释引物时要平衡其浓度。③引物应高浓度小量分装保存,防止多次冻融或长期放冰箱冷藏部分,导致引物变质降解失效。④引物设计不合理,如引物长度不够,引物之间形成二聚体等。
(4)Mg2+浓度。Mg2+离子浓度对 PCR扩增效率影响很大,浓度过高可降低 PCR扩增的特异性,浓度过低则影响PCR扩增产量甚至使 PCR扩增失败而不出扩增条带。
(5)反应体积的改变。通常进行 PCR扩增采用的体积为 20μL、30μL、50μL、100μL,应用多大体积进行 PCR扩增 ,是根据科研和临床检测不同目的而设定,在做小体积如20μL后,再做大体积时,一定要模索条件,否则容易失败。
(6)物理原因。变性对 PCR扩增来说相当重要,如变性温度低,变性时间短,极有可能出现假阴性;退火温度过低,可致非特异性扩增而降低特异性扩增效率退火温度过高影响引物与模板的结合而降低 PCR扩增效率。有时还有必要用标准的温度计,检测一下扩增仪或水溶锅内的变性、退火和延伸温度,这也是 PCR失败的原因之一。
(7)靶序列变异。如靶序列发生突变或缺失,影响引物与模板特异性结合,或因靶序列某段缺失使引物与模板失去互补序列,其 PCR扩增是不会成功的。
(8)退火温度 (在无数次改变条件尝试后,本人发现在PCR条件优化最重要的因素是退火温度,故后期着重研究退火温度)。根据所使用的公式及引物序列的不同,Tm会差异很大。因为大部分公式提供一个估算的 Tm值,所有退火温度只是一个起始点。可以通过分析几个逐步提高退火温度的反应以提高特异性。开始低于估算的 Tm 5℃,以 2℃为增量,逐步提高退火温度。较高的退火温度会减少引物二聚体和非特异性产物的形成。
2.2 与 T载体连接
把 PCR产物胶回收后与 PMD-18T载体连接,转化入制备好的感受态细胞中,铺在平板上过夜。平板上长出的菌落如图 2所示。

图 2 过夜培养后平板上长出的单菌落
分析连接不成功的可能因素:
(1)T载体浓度过低。T载体不能稀释,就用原倍的,50 ng/μL。
(2)PCR产物胶回收后浓度过低:PCR产物胶回收之后要电泳定量,且胶回收时洗脱缓冲液不能过量 (一般 50μL即可),T载体长度大概是 2600 bp,目的片段长度约 1900 bp,目的片段最终量应该在 80~200 ng之间,以达到目的片段和 T载体摩尔数比大约为 4:1~10:1。
(3)连接酶失活。用 T4 DNA连接酶没问题,但 T4 Buffer有可能是反复冻溶的,里面的ATP可能失效了,需要补加 ATP。
2.3 菌落 PCR
在连入 CDK的 T载体的平板上挑单菌落进行 PCR,同时,把同一菌落用接种环挑在相应的平板上划线培养,以做备份。CDK菌落 PCR电泳结果如图 3所示。

图 3 重组质粒菌落 PCR电泳结果 (自泳道 2至 9)
从图 3中可见,前九孔为本次 PCR,除了 marker共挑单菌落 8个,其中第 1,3,6,7个单菌落均有目的条带出现,菌落能在氨苄培养基上生长,说明有 T载体转化,但不能排除空载体的存在,而有 CCDK目的条带的出现说明此四菌落中,CDK基因已成功转化至 T载体。
菌落 PCR很容易污染,造成假阳性。在做转化时加入了连接产物,涂板,连接产物可能并未全部转化,还有部分残留,可能附着在平板及菌落上了,在做菌落 PCR时,这些连接产物就会成为模板,造成假阳性。
2.4 质粒提取
把成功重组的 T质粒用 Tiangen质粒小提试剂盒提取,电泳图如图 4所示。
图中泳道 3,4,5为重组成功的质粒。但条带非常浅,且大多在 5k左右。推测是提取质粒菌体量过少。
未成功提取出质粒的原因有很多:
(1)平板上的菌是杂菌,可以从菌落的颜色大小和生长时间进行判断。
(2)提取质粒所用菌液量太少,最少应用 5μL来小提质粒。
(3)质粒提取液不正常,尤其是溶液 II,是否出现沉淀,如果出现沉淀应加热使其澄清 (如果菌非杂菌很有可能是溶液 II的问题造成的)。
(4)操作不正确,裂解时震荡用力过大造成大肠杆菌基因组断裂。
2.5 酶切
用 XhoI和 SacI双酶切提取的质粒,检测是否有目的条带。电泳结果如图 5。

图 5 重组 T质粒双酶切
图中泳道 1为 DL5000marker,泳道 6,7为双酶切后的质粒,从图中看出,酶切后无目的条带。
核酶限制性内切酶作用于底物 DNA时,受到许多要素的制约,主要有以下几个:
(1)底物 DNA样品的纯度。在制备 DNA样品中,由于各种条件的影响,存在着一些非 DNA物质,这些物质有的对酶切反应影响较大,如抽提过程中,有机物质的残留成份:酚、氯仿、酒精,都会破坏酶的活性,另外未除去的蛋白质,也会干扰酶的反应,残留的染色体 DNA则会相对降低酶对底物DNA的浓度。
(2)离子浓度。限制性核酸内切酶专一性需要镁离子,以作为辅基。并且要求一定的盐离子浓度,在使用上,通常把限制性核酸内切酶对盐离子的要求分为三类:高盐、中盐和低盐,它们所需的 Na+分别为 100 mmol/L、50 mmol/L和0。如果离子浓度使用不当,酶反应不完全或会使酶的识别位点发生改变。
(3)底物 DNA的量。商品限制性内切酶以酶单位计算,一个酶单位的定义:在规定的温度和缓冲液内,于 20微升反应液内 1小时完全消化 1微克DNA所需要的酶量。所以若是底物DNA的量超过酶的酶单位所规定的消化量,则反应不能完全。不过商品酶多是浓溶液,每微升含 10单位以上,价格昂贵,所以使用时要尽量节省。
(4)酶反应温度与酶反应终止。大部分限制性核酸内切酶最适的反应温度在 37℃,极个别在 60℃,所以酶反应后要使酶的活性失活时,可把反应液置于 65℃内保温 10~15分钟,以终止酶反应,但此法对个别酶 (最适温度在 60℃的酶)不适合。本实验因为采用双酶切,有小片段产生,为了不让小片段影响后续的连接实验,我们采用 PCR反应体系中的 10×LoadingBuffer来终止酶切反应,清除小片段。
(5)酶反应时间。酶消化时间通常依酶的浓度,底物的浓度和纯度而定,通常是 30分钟到 2个小时,甚至更长些,但不能过长。因为商品酶极有可能含有杂酶,时间过久,微量杂酶的酶反应也会积累到干扰整个酶反应的程度。
3.结果与讨论
3.1 已取得成果
(1)设计克隆 CDK6 3’UTR引物,克隆出 CDK6基因的3’UTR,电泳检验大小正确,有待测序验证其序列正确性;
(2)胶回收的 PCR产物与 T载体相连;
(3)在平板上长出形态正常的单菌落;
(4)菌落 PCR显阳性。
3.2 待解决问题
(1)与 T载体连接后提取重组质粒大小不对,或条带过暗;
(2)重组质粒提取后酶切无目的条带。
[1]李成梅,郑继刚,杜桂森.MiRNA:一种新的基因表达调节子[J].遗传,2004,26(1).
[2]纪虹,孙开来.小 RNA的研究现状 [J].国际遗传学杂志,2006,29(1).
[3]吴丹,胡兰.miRNA及其研究进展 [J].中国畜牧兽医,2006,33(1).
[4]Tingting Du,Phillip D Z.microPrimer:the biogenesis and function ofmicroRNA[J].Pr imer,2005(16).
[5]马中良,杨怀义,等.真核生物中的微小 RNA及其功能研究进展[J].遗传学报,2003,30(7).
[6]冯起平,李云峰,等.miRNA的研究进展 [J].生命科学,2003,15(4).
[7]周凡,葛振华,任彦.慢性浅表性胃炎脾胃湿热证患者舌苔脱落细胞 CDK4和 CDK6的表达及意义[J].福建中医学院学报,2004(11).
[8]周坤福,詹臻,侯亮,等.表皮生长因子 EGF影响舌苔形成的分子机制[J].南京中医药大学学报:自然科学版,2002,18(5).
[9]储琳,钱旻,严缘昌.细胞周期蛋白依赖性激酶活化激酶(CAK)的研究进展[J].生命科学,2006,18(2).
[10]刘辰.E2F转录因子肿瘤基因治疗 [J].国外医学:肿瘤学分册,2004,31(7).
