趋化因子受体CCR7在非小细胞肺癌中的表达及其与淋巴结转移的关系*1
2010-01-25孔凡华
孔凡华 王 鹏
(1.泰山医学院,山东 泰安 271016;2.泰山医学院附属泰山医院,山东 泰安 271000)
转移是恶性肿瘤最主要的生物学特征,肿瘤的转移又有嗜器官性。越来越多的证据表明,趋化因子受体CCR7的表达在恶性肿瘤生长、淋巴结转移中发挥重要作用。有报道,乳腺癌[1]、胃癌[2]、甲状腺癌[3]中CCR7的表达与淋巴管浸润和淋巴结转移关系密切,但有关肺癌组织中CCR7的表达与其淋巴结转移的关系报道较少,我们通过免疫组化和RT-PCR法检测40例非小细胞肺癌中CCR7蛋白和CCR7 mRNA的表达及其与其淋巴结转移的关系。
1 材料和方法
1.1 材料 收集泰山医学院附属泰山医院2008年10月~2009年4月行肺癌根治性切除加淋巴结清扫的40例非小细胞肺癌患者的肺癌组织及相应癌旁正常肺组织20例(距肿瘤边缘5 cm以上),TNM分期依照2002年国际抗癌联盟(UICC)标准[4]。免疫组化实验标本用中性甲醛固定,RT-PCR实验标本保存于-80℃低温冰箱中,共120份标本,所有患者术前均未行放疗、化疗。所有40例肺癌患者中,男性28例,女性12例,年龄32~78岁,中位年龄60岁;高分化12例,中分化21例,低分化7例;肺鳞癌23例,腺癌14例,腺鳞癌3例;淋巴结转移22例,无转移18例;TNM分期:Ⅰ期10例,Ⅱ期19例,Ⅲ期10例,Ⅳ期1例。全部病例均经病理证实。
1.2 试剂 兔抗人CCR7多克隆抗体、即用型SABC免疫组化试剂盒由武汉博士德生物工程有限公司提供。 M-MLV逆转录酶、5×First-Stand Buffer、0.1 M DTT、TaqDNA聚合酶、dNTP、10×PCR反应缓冲液、MgCl2、DNA标准分子量Marker均由上海生工生物工程技术服务有限公司提供。Oligo(dT)18引物由Invitrogen公司提供。
1.3 方法
1.3.1 免疫组化染色 采用SABC法,将组织制成4 μm厚的切片,经二甲苯和梯度乙醇脱蜡至水,在H2O2溶液中室温孵育以消除内源性过氧化物酶活性,在枸橼酸缓冲液(pH=6. 0)中进行抗原修复,滴加BSA封闭液室温孵育10 min,倾去血清,滴加一抗(兔抗人CCR7多克隆抗体, 1︰100稀释), 4℃过夜,PBS冲洗后滴加生物素标记山羊抗兔IgG, 37℃孵育20 min,PBS冲洗,滴加SABC工作液, 37℃孵育20 min,PBS冲洗3次,DAB显色,自来水冲洗,苏木素复染,脱水透明,常规封片,用PBS代替一抗做阴性对照。
结果判断:由两位病理医师双盲阅片,以细胞膜或细胞浆出现棕黄色颗粒为阳性表达, 按肿瘤细胞阳性细胞率和着色强度分别进行记分。着色强度记分标准:不着色为0分,轻度着色为1分,中度着色为2分,强着色为3分;肿瘤细胞阳性细胞率记分标准:阳性细胞≤5%为0分,阳性细胞6%~25%为1分,阳性细胞26% ~50%为2分,阳性细胞51%~75%为3分,> 75%为4分。结果以染色强度与阳性细胞率记分的乘积表示CCR7的表达强度, 0分为(-) , 1~3分为(+) , 4~6分为(++),7~10分为(+++),≥4分者称为CCR7阳性表达, <4分为阴性表达。
1.3.2 RT-PCR法 取100 mg非小细胞肺癌组织或癌旁正常组织,采用液氮法匀浆后用Trizol试剂提取组织总RNA,逆转录合成cDNA,PCR扩增CCR7,同时扩增β-actin作为内部参照。CCR7引物设计参考Schimanski等[5]文献。CCR7引物序列(529 bp): 正义,5′-TCCTTCTCATCAGCAAGCTGTC-3′;反义, 5′- GAGGCAGCCCAGGTCCTTGAA-3′。β-actin引物序列(280 bp):正义,5′- CTCCATCCTGGCCTCGCTGT- 3′;反义,5′- GCTGTCACCTTCACCGTTCC- 3′。将配制好的反应体系置于合适的PCR仪中,先94℃预变性5 min,开始30个循环(94℃变性1min, 62℃退火1 min, 72℃延伸2 min),最后于72℃延伸10 min。
观察和成像:扩增产物在1.5%琼脂糖凝胶上电泳分离,在波长为260 nm的长波紫外灯下观察电泳胶板,DNA存在处显示出肉眼可辨的白色荧光条带,根据DNA分子量标准,判断PCR产物目的条带的分子量大小,并通过凝胶成像系统成像。1.4 统计学处理 应用SPSS13.0统计分析软件,将患者的临床资料、病理学特征以及实验结果共同建立数据库。应用四格表χ2检验比较CCR7在各组标本中表达的差异情况,P≤0.05表示有统计学意义。
2 结 果
2.1 CCR7在非小细胞肺癌及癌旁正常肺组织中的表达 免疫组化结果显示,CCR7蛋白主要定位于胞质和(或)胞膜,见图1,2。CCR7蛋白在62.5%(25/40)非小细胞肺癌组织中阳性表达,其中弱阳性7例,阳性6例,强阳性12例,而在正常肺组织中仅有5%(1/20)弱阳性表达。CCR7蛋白在肺癌组织中的阳性表达率明显高于正常肺组织(χ2=17.952,P=0.000)。RT-PCR结果见图3。CCR7 mRNA在72.5%(29/40)非小细胞肺癌组织中表达,明显高于正常肺组织的10%(2/20)(χ2=20.857,P=0.000)。并且CCR7 mRNA和CCR7蛋白表达具有较高同源性,只有3例非小细胞肺癌有CCR7mRNA表达而无CCR7蛋白表达。

图1 肺鳞癌(×400倍,强阳性)

图2 肺腺癌(×400倍,强阳性)

图3 PT-PCR结果
M:Marker,1:空白对照,2、3:癌旁正常肺组织, 4~7:有淋巴结转移的肺癌组织,8、9:无淋巴结转移的肺癌组织。
2.2 不同病理类型肺癌组织中CCR7阳性表达 鳞癌、腺癌、腺鳞癌组织中CCR7阳性率免疫组化分别为:65.2%,57.1%,66.7%;RT-PCR分别为: 73.9%、71.4%、66.7%,三组间CCR7的表达无明显差异(P﹥0.05),见表1。

表1 不同病理类型肺癌组织中CCR7表达
2.3 CCR7与非小细胞肺癌临床病理因素的关系 CCR7表达与TNM分期、淋巴结转移、局部浸润、分化程度有关(P﹤0.01或P﹤0.05,表2),但与年龄、性别、肿瘤大小和病理类型无关。两种方法显示CCR7表达对肺癌淋巴结转移判断的敏感性、特异性、阳性预测值及阴性预测值分别为95.9%(100%)、77.8%(61.1%)、84%(75.9%)、93.3%(100%)。
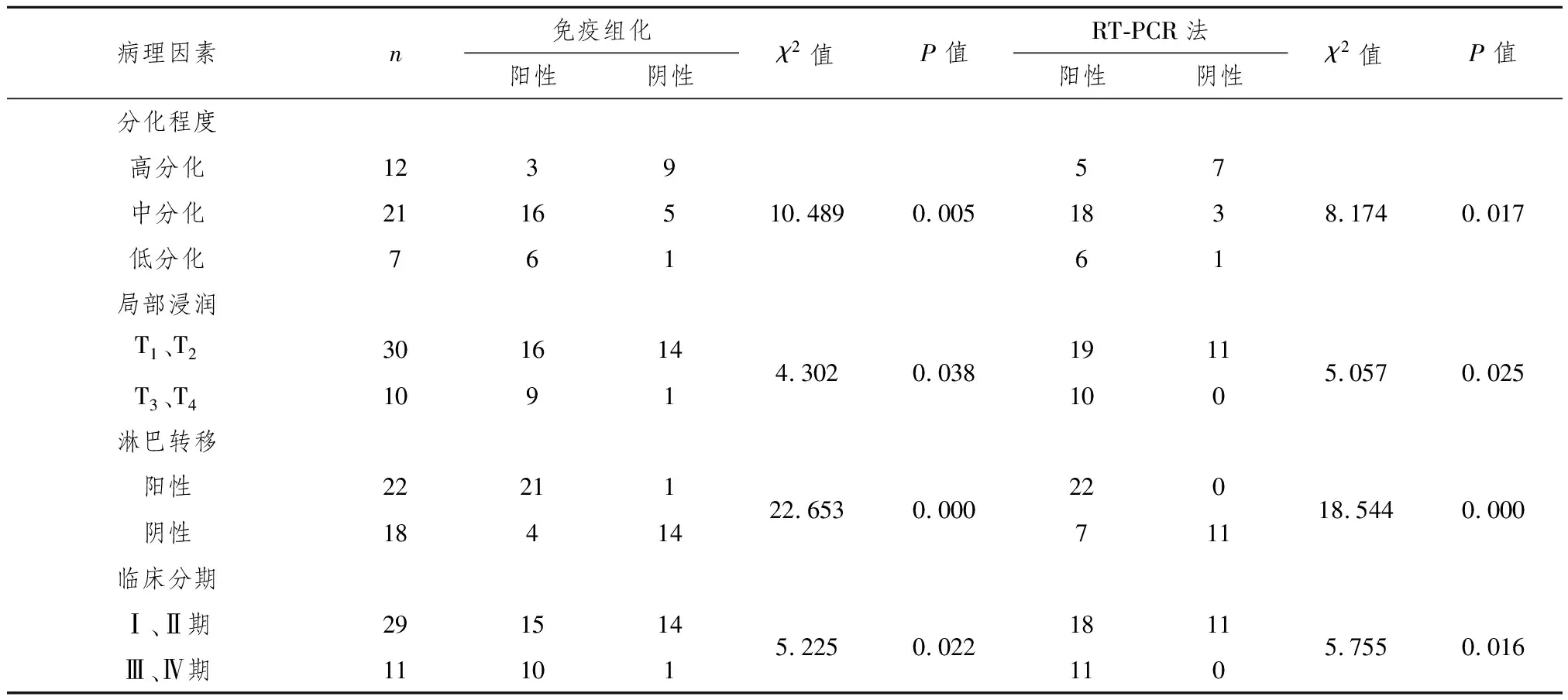
表2 CCR7表达与非小细胞肺癌临床病理因素的关系
3 讨 论
肺癌是世界各国最常见的恶性肿瘤,并成为我国首位恶性肿瘤死亡原因。其中非小细胞肺癌占全部肺癌的80%左右。肺癌转移是一个多步骤、多因素参与的复杂过程。淋巴道转移在肺癌的分期、诊断、治疗中扮演着重要的角色,也是最重要的临床预后预测指标之一。但是,肺癌淋巴结转移的具体作用机理仍处于探索之中。
趋化因子是一类对白细胞有趋化作用的分泌型单链蛋白质, 根据其N端CYS顺序可分为4类:CXC(α)、CC(β)、C(γ)、CX3C(δ)趋化因子,其中CXC(α)和CC(β)最为多见[6]。趋化因子受体是一类表达于不同类型细胞,能与趋化因子结合的含有7个跨膜区的G蛋白偶联受体(G protein-coupled receptor, GPCR),根据其对相应趋化因子作用的不同特性,可以分为4类: CXCR1-CXCR6[7-9], CCR1-CCR11[10-11], XCR以及CX3CR[12]。
近年来,作用于淋巴管内皮的趋化因子CCL21/19及其受体CCR7成为研究热点,为研究淋巴道转移开辟了新的途径。CCR7是CC类趋化因子受体的成员之一[6],含有氨基酸378个,基因定位于17q12-q21.2,其配体CCL21/19,特异的高表达于淋巴结、扁桃体、非淋巴组织的内皮淋巴导管以及脾的T细胞富集区及淋巴内皮中。CCR7最初是由于B细胞感染EB病毒而被发现的,后发现在幼稚T细胞(naive T)、B细胞及树突状细胞(dendritic cell ,DC)等表面表达。生理状况下, CCR7 能使它们正确定位在外周淋巴器官的T、B细胞区,CCR7缺陷鼠就表现为明显的T细胞分布紊乱,所以CCR7在介导机体内淋巴细胞的迁移和定位过程中发挥重要作用。
2001年Muller等[1]研究发现人乳腺癌的CCR7和CXCR4表达比正常乳腺组织高得多,而乳腺癌最常见的转移部位淋巴结、肺、肝脏和骨骼高水平地表达这两种受体的配体CXCL12以及CCL21,而在不常转移的小肠、皮肤、骨骼肌和脑等组织则是明显的低表达,他们首次提出,趋化因子及其受体的表达在决定肿瘤转移的部位上起着非常关键的作用。后研究发现CCR7与肿瘤的淋巴管浸润和淋巴结转移呈正相关,并在乳腺癌、胃癌、食管癌中得到证实,显示出良好的临床应用前景。
本研究发现CCR7在非小细胞肺癌组织中高表达,而在癌旁正常肺组织中低表达,差异具有显著统计学意义(P<0.01)。CCR7阳性表达与肿瘤的TNM分期、淋巴结转移、局部浸润、分化程度关系密切。淋巴结转移组CCR7阳性表达明显高于无淋巴结转移组,差异具有显著统计学意义(P<0.01),并且免疫组化和RT-PCR法显示,CCR7表达对肺癌淋巴结转移判断的敏感性、特异性、阳性预测值及阴性预测值分别为95.9%(100%)、77.8%(61.1%)、84%(75.9%)、93.3%(100%)。
淋巴结转移是肺癌患者的重要预后因素,也是术前肺癌分期的重要指标,通过对CCR7与淋巴结转移相关性的研究,将有助于准确的进行临床分期,预测肺癌淋巴结转移及决定淋巴结清扫的手术范围。CCR7可能成为恶性肿瘤治疗的新靶点,进一步研究在肿瘤生长及淋巴结转移中的作用,将为肿瘤疾病的治疗开辟新的前景。
[1] Muller A, Homey B, Soto H, et al. Involvement of chemokine receptors in breast cancer metastasis[J]. Nature, 2001, 410 (6824):50-56.
[2] Ishigami S, Natsugoe S, Nakajo A,et al, Prognostic value of CCR7 expression in gastric cancer[J]. Hepatogastroenterology, 2007, 54 (76):1025-1028.
[3] Wagner PL, Moo TA, Arora N,et al. The chemokine receptors CXCR4 and CCR7 are associated with tumor size and pathologic indicators of tumor aggressiveness in papillary thyroid carcinoma [J]. Ann Surg Oncol, 2008, 15 (10):2833-2841.
[4] UICC. TNM classification of malignant tumours[M]. 6th eds. Geneva: UICC, 2002.
[5] Schimanski CC, Schwald S, Simiantonaki N, et al. Effect of chemokine receptors CXCR4 and CCR7 on the metastatic behavior of human colorectal cancer[J]. Clin Cancer Res, 2005, 11(5): 1743-1750.
[6] Zlotnik A, Yoshie O. Chemokines: a new classification system and their role in immunity[J]. Immunity, 2000, 12:121-127.
[7] Rubie C, Frick VO, Wagner M, et al. Chemokineexpression in hepatocellular carcinoma versuscolorectal liver metastases[J]. World J Gastroenterol, 2006, 12: 6627-6633.
[8] Salvucci O, Bouchard A, Baccarelli A, et al. The role of CXCR4 receptor expression in breast cancer: a largetissue microarray study[J]. Breast Cancer Res Treat, 2006, 97: 275-283.
[9] Kawada K, Hosogi H, Sonoshita M, et al. Chemokine receptor CXCR3 promotes colon cancer metastasis to lymph nodes[J]. Oncogene, 2007, 26: 4679-4688.
[10] Singh S, Singh UP, Stiles JK, et al. Expression and functional role of CCR9 in prostate cancer cell migration and invasion[J]. Clin Cancer Res, 2004, 10: 8743-8750.
[11] Mori T, Kim J, Yamano T, et al. Epigenetic upregulation of C-C chemokine receptor 7 and C-X-C chemokine receptor 4 expression in melanoma cells[J].Cancer Res, 2005, 65: 1800-1807.
[12] Oca'a E, Delgado-Pérez L, Campos-Caro A, et al. The prognostic role of CXCR3 expression by chronic lymphocytic leukemia B cells[J]. Haematologica, 2007, 92: 349-356.
