一个常染色体显性遗传低频感音神经性聋家系听力学及遗传学特征分析*
2010-01-25孙艺卢宇朱玉华程静李建忠冀飞王荣光袁慧军
孙艺 卢宇朱玉华程静 李建忠冀飞 王荣光袁慧军
目前常染色体显性非综合征型耳聋的致病基因位点已经排序到DFNA57[1],定位了46个DFNA基因位点。非综合征型耳聋主要影响高频,低频感音神经性耳聋(low frequency sensorineural hearing loss,LFSNHL)相对少见,仅有4个位点,DFNA1,DFNA6/14/38、DFNA11、DFNA54与LFSNHL有关。迄今为止,成功克隆致病基因的DFNA位点有21个,基因23个,其中与低频听力损失相关的仅有DIAPH、WFS1和MYO7A三个基因。本课题组收集了一个常染色体显性遗传性聋家系,发病初期表现为低频感音神经性聋,现将其临床听力学及遗传学特征以及应用微卫星标记对DFNA21个位点23个基因进行初步筛查的结果报道如下。
1 资料与方法
1.1家系资料的采集 先证者来自中国人民解放军总医院耳鼻咽喉-头颈外科门诊,此家系命名为BJ-L046家系。2009年4月由专业研究人员赴患者居住地现场采集临床资料。调查中对寻访到的28名家系成员进行了详细问卷式调查、耳鼻咽喉专科检查、全身体格检查及听力学检查 ,未寻访到或已故成员情况由亲属补充叙述。调查问卷内容包括:姓名、性别、出生年月、永久居住地址、联系电话、耳聋详细病史、用药史、既往史,以排除外伤、爆震、中耳炎、耳毒性药物等所致听力下降。该项目的伦理论证由解放军总医院伦理委员会完成,参加者均签署了知情同意书(18岁以下成员由其父母代签),并抽取 5~10 ml外周静脉血用于基因组DNA的提取和后期研究。
1.2检查方法 对全部家系成员进行纯音听阈检查[Madsen 502 便携式听力计(丹麦) ,耳机为EAR - 3A 插入式耳机(美国)];声导抗检查(Madsen 901,丹麦);耳声发射检测(丹麦,Madsen CAPELLA);听性脑干反应检测(Intelligent Hearing Systems SmartEP, America) 。应用温度、前庭诱发性肌源性电位进行前庭功能检查,对其中5名患者进行了耳声发射、听性脑干反应检查,2名患者进行了前庭功能及颞骨CT扫描检查。
1.3耳聋表型的分析判断标准 参照Van Camp等2003年9月倡导的《关于非综合征型遗传性聋家系遗传学及听力学描述术语建议案》[2]:①根据是否伴有全身其他器官系统的异常分为非综合征型聋、综合征型聋; ②根据听力损失的性质分为传导性聋、感音神经性聋及混合性聋;③根据语言发育阶段分为语前聋、语后聋;④根据听力损失的频率分为:高频听力损失型(2~8 kHz 听力下降为主)、低频听力损失型(0. 25~0.5kHz听力下降为主)、中频听力损失型(0. 5~2 kHz听力下降为主)、全频听力损失型(0. 25~8 kHz 听力下降);⑤听力损失程度按照两耳中听力较好耳的平均听阈(0. 5~4 kHz 听阈的平均值) 来评估: 20~40 dB HL为轻度听力损失;41~70dB HL为中度,71~ 95 dB HL为重度; > 95 dB HL为极重度。
1.4选取微卫星标记(STR Marker)作为遗传标记进行DFNA21个位点23个已知耳聋基因筛查
1.4.1微卫星标记的选择 在http://genome.ucsc.edu/网站中查询DFNA位点中已经克隆了的23个耳聋基因在染色体特定区域内的物理距离,在http://www.marshfieldclinic.org/research/pages/index.aspx网站中查询并选取与每个基因物理距离最近的微卫星标记1~2个,对每个微卫星标记的上游引物的5’端用FAM荧光染料标记(上海英俊生物技术有限公司合成)。
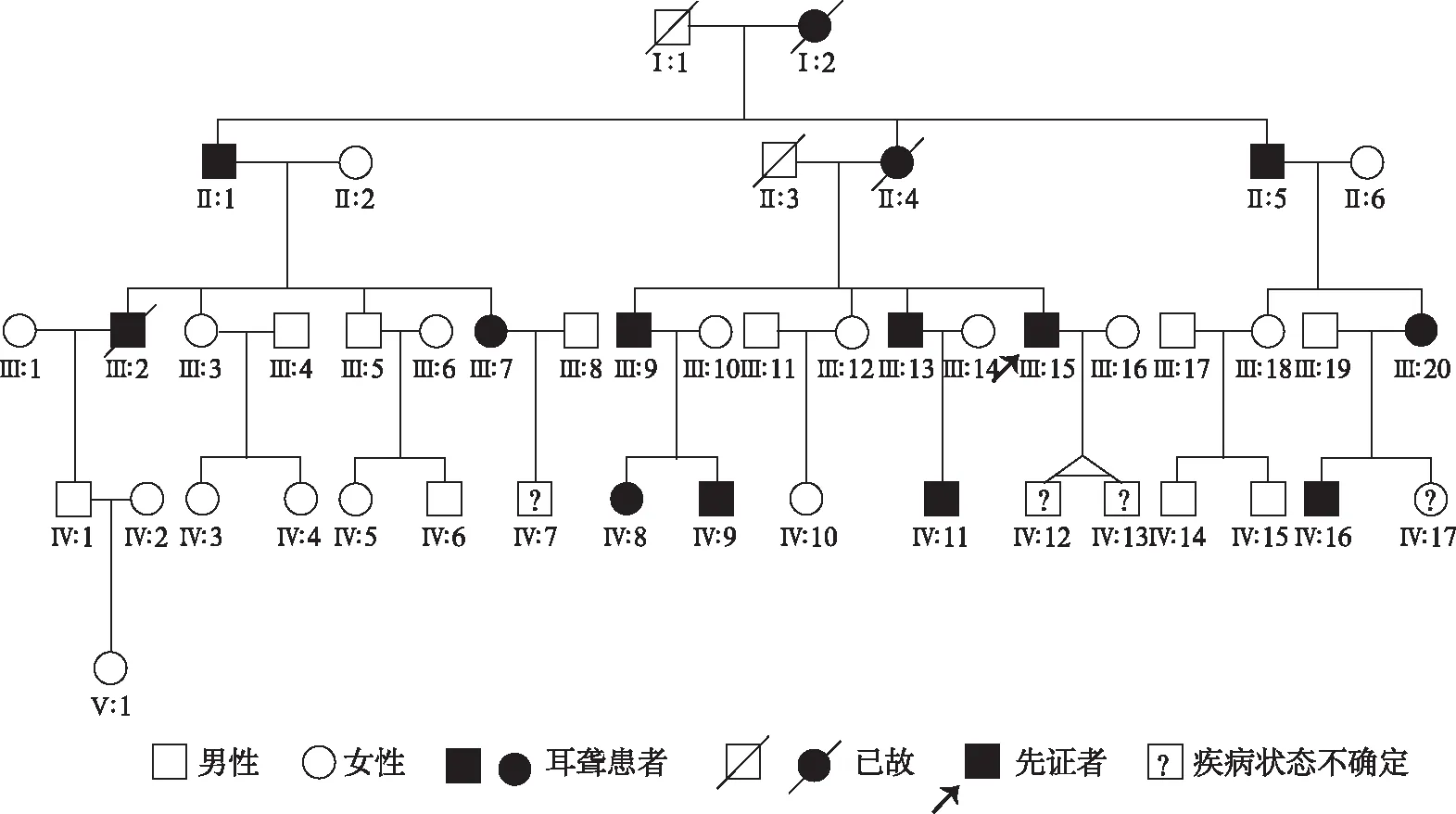
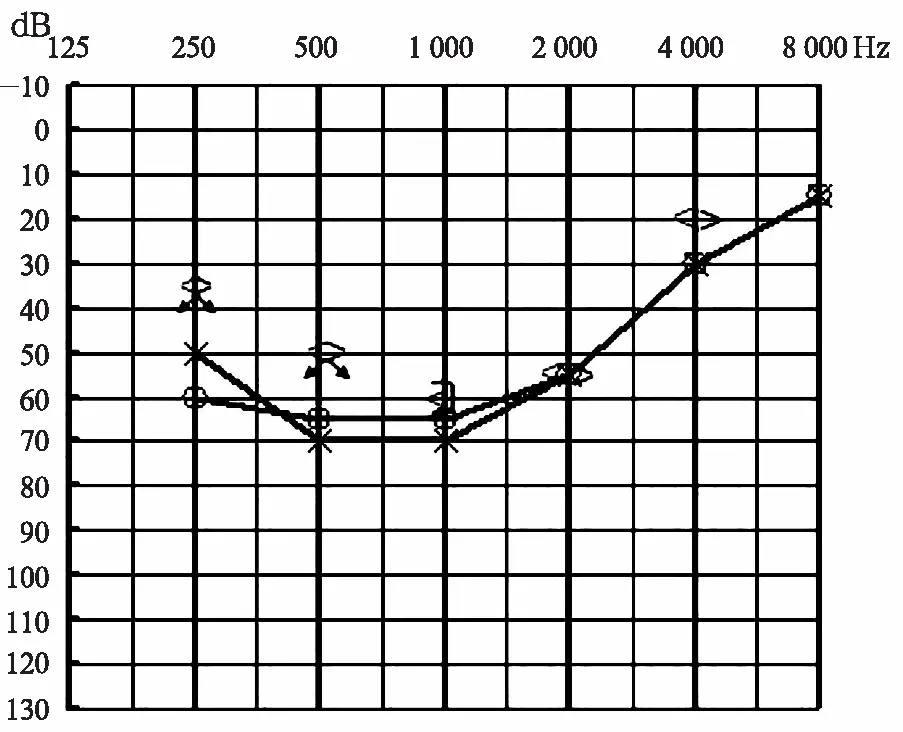
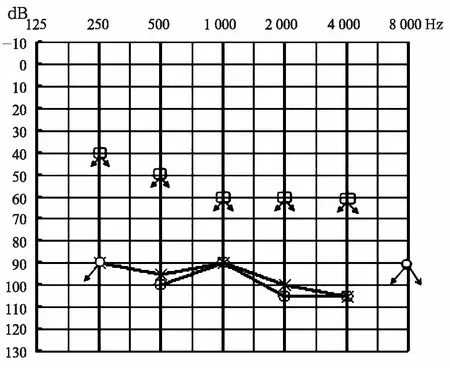
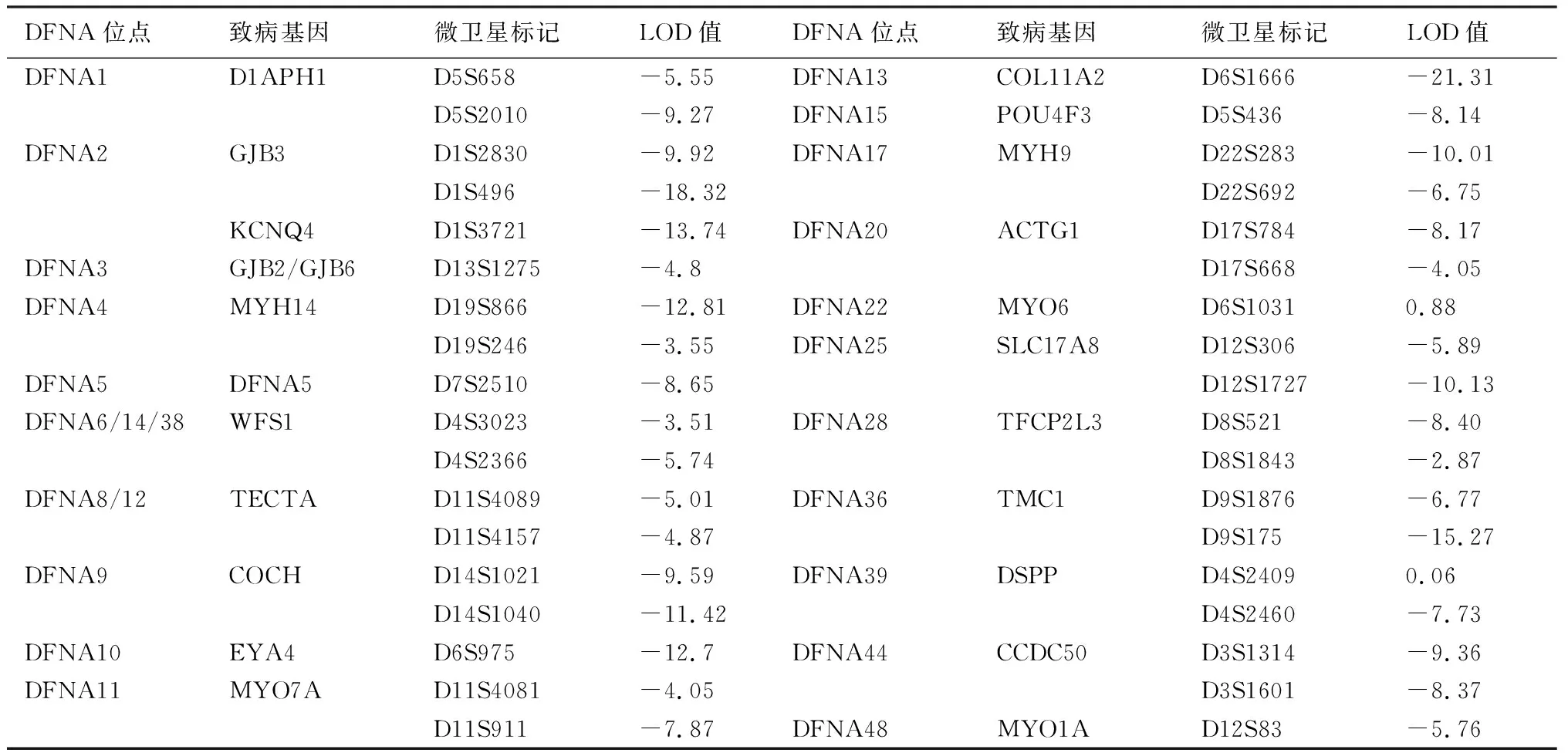
1.4.2微卫星标记的分析流程 ①PCR扩增体系 5 μl反应体积内包含10 ng DNA, 每对引物0.000 25 nmoL, 0.25 U 的 HotStar Taq DNA 聚合酶 (QIAGEN GmbH, Hilden, Germany),3 mmol的Mg2+以及0.32 μmoL dNTP;②PCR扩增条件 PCR仪采用 Veriti型 ( Applied Biosystems, USA)。热循环条件采用“Touchdown”方式;③PCR扩增产物变性和上样 将50 μl的GeneScanTM-400HD ROXTM Size Standard和900ul Hi-DiTM甲酰胺混合配制分子量内标混合液;每1 μl PCR扩增产物加入4 μl分子量内标混合液,PCR仪95℃变性5分钟,迅速入冰,加入ABI 3130xl Genetic Analysis测序仪运行Gene Scan毛细管凝胶电泳;④微卫星标记分析 应用GeneMarker(version 1.65)软件进行微卫星等位片段大小分析,同时进行人工检查校正;分析结果输入LINKAGE DESIGNER软件分析后输出*.pre、 *.dat、 *.mdf 参数文件;应用LINKAGE(5.1 version)软件进行连锁分析[3],计算LOD值,LOD值≥3提示肯定连锁,-2 2.1BJ-L046家系的基本资料及家系谱图 该家系五代居住于北京市,调查家系成员28人,年龄10~79岁。其中有11人被明确诊断为感音神经性聋;耳聋患者症状以耳聋、耳鸣为主,未见其他器官系统的异常。家系谱图见图1。家系患者Ⅲ:20有氨基糖苷类药物用药史,患者Ⅲ:9、Ⅳ:9有环境噪声接触史,BJ-L046家系每代的患病率见表1。通过家系的系谱图分析可知,BJ-L046家系共5代,各代连续发病,每代中男女均可患病,男女发病比例为9∶5,现存患者分布于第II至第Ⅳ代,系谱图中最初患者为女性(Ⅰ:2),其后裔Ⅱ代的子女全部为耳聋患者,患病率达100%(表1);第Ⅲ代共10个子女,其中6个患病,患病率达60%,第Ⅳ代共16个子女,其中4个患病,患病率为25%,其患病率下降可能由于其中第Ⅳ代成员Ⅳ:7、Ⅳ:12、Ⅳ:13及Ⅳ:17尚未到发病年龄而将其疾病状态定为“不确定”所致;该家系每一代的耳聋发病年龄相似,在10~20岁(表2),未见明显逐代提前或延后的趋势。由此可见,BJ-L046家系完全符合典型的常染色体显性遗传特点。 图1 BJ-L046家系系谱图 表1 BJ-LO46家系每代的患病率(例) 2.2BJ-L046家系中耳聋患者的听力学特征 该家系现存11例患者表现为感音神经性聋,听力损失程度从轻度到中、极重度不等,轻度为6例,中度3例,极重度2例,听力损失呈上升型曲线4例,平坦-上升型4例,平坦型3例。听阈及与年龄的关系:该家系耳聋表型特征为学语后的、迟发的、低频听力损失为主的渐进性听力损失。家系中每代患者的平均发病年龄为10~20岁,11位患者的听力损失程度与年龄的关系见表2,可见各代随着年龄的增加,听力损失程度逐渐加重,低频(250~1 kHz)听力损失可达重度。 表2 BJ-L046家系现存耳聋患者的听阈及与年龄的关系 2.3典型病例 先证者Ⅲ:15,男,39 岁 ,出生后学语正常 ,28岁时发现听力下降并伴有耳鸣 ,此后病情进行性加重 ,无眩晕等伴随症状。纯音测听显示呈低频听力损失为主的上升型听力曲线,听力损失程度为中度(图2)。ABR测试结果示双侧I-V波间期正常,DPOAE检查示右耳6.0~8.0 kHz可引出,其余频率未引出,左耳各频率均未引出,排除了听神经病。前庭功能检查双侧水平半规管功能正常;前庭诱发性肌源性电位检查结果正常;颞骨CT扫描示内耳结构及发育正常,排除了内耳及神经的占位病变。 图2 先证者Ⅲ:15听力图 病例Ⅱ:5,男,70岁,为家系患病成员中年龄第二大者,10岁前发现听力下降,无耳鸣、眩晕等伴随症状。纯音测听显示患者中、高频受累,表现为平坦型听力曲线,听力损失程度为极重度(图3)。患者Ⅲ:20,35岁,5~6岁出现听力下降,25岁时因妇科炎症有氨基糖苷类药物用药史,其听力图特点为平坦-上升型;患者Ⅲ:9,53岁,7岁出现听力下降,30岁左右有环境噪声接触史,其听力图特点为平坦型-上升型;患者Ⅳ:9,23岁,18岁出现听力下降,近2年有环境噪声接触史,其听力图特点为平坦-上升型,以上患者氨基糖苷类药物用药及接触噪声均在发病之后,听力图特点均为低频听力损失为主的平坦-上升型曲线,排除了药物或噪声所致耳聋的可能性。患者Ⅳ:16,17岁,7岁时曾患急性中耳炎,已治愈,12岁出现听力下降,检查双耳鼓膜完整,声导抗检查双耳鼓室导抗图为A型,其听力损失为感音神经性耳聋,听力图特点为上升型,亦排除了中耳炎所致耳聋的可能性。 图3 Ⅱ:5听力图 2.4DFNA位点23个耳聋基因筛查结果见表3。 表3 连锁分析遗传标记间的两点LOD值 由表3可见对DFNA21个位点23个基因通过微卫星标记,数据连锁分析计算LOD值,无阳性发现,可初步排除DFNA21个位点中已克隆的23个基因。 DFNA1是第一个报道以低频听力下降为特征的家系。1981年,Leon[4]首次报道一个哥斯达黎加家系,患者表型特点为10岁左右发病,低频听力下降,进展迅速,30岁左右发展为极重度聋,并累及所有频率。1992年Leon等[ 5]将该家系的致病基因定位于5q31,并命名为DFNA1。1997年,Lynch等[6]发现DFNA1家系的致病基因为DIAPH1,该基因是果蝇透明基因的同源体,其基因产物在肌动蛋白的聚合过程中起重要作用。 DFNA6/14/38[7~10]定位于4p16.3,其致病基因为WFS1,该基因可导致Wolfram综合征,目前认为WFS1基因是常染色体显性遗传LFSNHL的常见原因,但并不是散发LFSNHL患者的常见发病因素[11]。DFNA6/14/38患者的听力损失特点与DFNA1不同,进展缓慢,患者老年时的听阈仍能维持在80 dB HL左右,不会发展成极重度聋。 DFNA11定位于11q13.5,其致病基因为MYO7A,该基因是遗传性聋的“明星基因”,迄今为止已经有90多种MYO7A基因突变可以引起听力下降,这些突变分布于基因的全长,大多数突变能引起Usher综合征1B和不典型Usher综合征,部分突变引起非综合征型常染色体显性遗传性聋(DFNA11)、常染色体隐形遗传性聋(DFNB2)。1997年Liu[12]等报道了第一个DFNA11家系,近10年共报道了5个DFNA11家系。在目前已报道的5个DFNA11家系中有2个家系的听力损失表型特征为低频感音神经性聋,2004年Luijendijk等[13]报道的荷兰家系发病年龄为4~43岁,听力图特点为上升型,6例患者中4例出现轻度的前庭功能障碍及隐匿的视觉功能障碍。同年Street等[14]报道的美国家系发病年龄介于20~30岁之间,听力图特点为上升型,无前庭功能及视觉功能障碍。 2004年,Gurtler等[15]将一个瑞士低频感音神经性聋家系的致病基因定位在与DFNA15重叠的区域,命名为DFNA54,其致病基因目前尚未见报道。该家系临床表型特点为发病年龄5~40岁,进展缓慢,听力损失为轻度到中度,有两例患者偶有眩晕。 本研究的BJ-L046家系遗传性聋家系图谱分析表现为一种常染色体显性的遗传方式,为学语后、迟发的、渐进性、低频听力下降为主的表型特征。该家系共5代,各代连续发病,每代中男女均可患病,男女发病比例为9∶5,早期以低频损失为主,发病时即表现为轻、中度聋,至老年时才发展至极重度聋,听力曲线早期呈上升型,逐步发展呈平坦型。该家系平均发病年龄各代相似,未见明显逐代提前或延后的趋势。由此可见,BJ-L046家系完全符合典型常染色体显性遗传特点。 目前,遗传疾病的研究手段包括功能克隆、表型克隆以及定位克隆。针对本研究报道的BJ-L046家系,选用了定位克隆的研究方法,应用连锁分析(linkage analysis)方法确定耳聋基因在染色体上的未知位置。家系连锁分析方法通过假定遗传模式来决定遗传标记是否与疾病位点连锁。目前最常用的是Lods法 ,即对数优势计分法。对BJ-L046家系的研究策略为首先确认该家系是否与已知DFNA位点相连锁,致病基因是否为已知基因,如果不连锁,提示可能是新的位点,致病基因可能是新的耳聋基因。本研究选取微卫星标记(STR Markers)作为遗传标记筛查DFNA位点中已经成功克隆致病基因的位点21个,基因23个,根据以上连锁分析判定方法,无阳性发现,除了与低频听力损失相关的三个基因DIAPH、WFS1和MYO7A均已被初步排除以外,其它DFNA已知基因也初步被排除。下一步将通过基因芯片技术对家系成员进行全基因组扫描染色体定位,并进一步在定位区域内确定耳聋基因,有望发现新的与低频感音神经性聋相关的基因。 4 参考文献 1 Van Camp G,Smith RJH.2008.Hereditary Hearing Loss Homep-age.Http://webho1.ua.ac.be/hhh/. 2 Van Camp G, Smith RJH . Recommendations for the description of genetic and audiological data for families with nonsyndromic hereditary hearing impairment. Hereditary Hearing Loss Homepage.http://webho1.ua.ac.be/hhh/. 3 Dawn Teare M, Barrett JH.Genetic linkage studies[J]. Lancet,2005, 366: 1 036. 4 Leon PE, Ronilla JA, Sanchez JR, et al. Low frequency hereditary deafness in man with childhood onset[J]. AM J Hum Genet,1981,33:209. 5 Leon PE, Raventos H, Lynch E,et al. The gene for an inherited form of deafness maps to chromosome 5q31[J].Proc Natl Acad Sci USA,1992,89:5 181. 6 Lynch ED, Lee MK, Morrow JE, et al . Nonsyndromic deafness DFNA1 associated with mutation of a human homolog of the Drosophila gene diaphanous[J]. Science,1997,278:1 315. 7 Lesperance MM, Hall JW, Bess FH, et al. A gene for autosomal dominant nonsyndromic hereditary hearing impairment maps to 4p16.3[J].Hum Mol Genet,1995;4:1967. 8 Van Camp G, Kunst H, Flothmann K, et al. A gene for autosomal dominant hearing impairment (DFNA14)maps, to a region on chromosome 4p16.6 that does not overlap the DFNA6 locus[J]. J Med Genet,1999,36:532. 9 Bespaloca IN,Van Camp G,Bom SJ, et al.Mutations in the Wolfram syndrome 1 gene (WFS1) are a common cause of low frequency sensorineural hearing loss[J]. Hum Mol Genet,2001,10 :2 501. 10 Young TL,Ices E, Lynch E, et al . Non - syndromic progressive hearing loss DFNA38 is caused by heterozygous missense mutation in the Wolfram syndrome gene WFS1[J]. Hum Mol Genet,2001,10 :2 509. 11 Cryna K, Pfister M, Pennings RJ,et al. Mutations in the WFS1 gene that cause low-frequency sensorineural hearing loss are small non-inactivating mutations[J]. Hum Genet,2002,110:389. 12 Liu XZ, Walsh J, Mburu P,et al. Mutations in the myosin VIIA gene cause non-syndromic recessive deafness[J].Nat Genet,1997,16:188. 13 Luijendijk MWJ, VanWijk E, Bischoff AMLC, et al. Identification and molecular modelling of a mutation in the motor head domain of myosin VIIA in a family with autosomal dominant hearing impairment (DFNA11)[J]. Hum Genet, 2004,115:149. 14 Street VA, Kallman JC, Kiemele KL. Modifier controls severity of a novel dominant low-frequency myosin VIIA (MYO7A) auditory mutation[J]. J Med Genet,2004,41:e62. 15 Gurtler N , Kim Y, Mhatre A , et al . DFNA54 , a third locus for low - frequency hearing loss[J]. J Mol Med,2004,82:775.2 结果

3 讨论
