根癌农杆菌介导的大麦幼胚遗传转化影响因素研究
2010-01-22李静雯张正英
李静雯 张正英
(甘肃省农业科学院生物技术研究所, 甘肃 兰州 730070)
禾谷类作物的遗传转化现已广泛用于改良作物品质,也是功能基因组学研究的有力手段[1]。大麦作为世界上第四大粮食作物在全球100多个国家广泛种植。除了其自身的重要研究价值,大麦(二倍体)也可作为研究其他遗传背景更为复杂的六倍体禾谷类作物(如小麦)的模式作物。因此建立一个高效、稳定的大麦遗传转化体系是十分必要的。
大麦的遗传转化始于20世纪90年代。1994年Wan等利用基因枪介导法获得了世界上第一例可育转基因大麦[2]。1997年Tingay 等首次建立了农杆菌介导的大麦幼胚遗传转化程序,并成功获得了大麦转基因植株[3]。Trifonova[4]、Wu[5]、Murray[6]、Shrawat[7]、Hensel[8]等相继报道了提高农杆菌转化大麦频率的影响因素,如大麦基因型和外植体、菌株和载体、胚的大小及处理方式、预培养时间、共培养条件、乙酰丁香酮(AS)的作用、培养基成分等。
虽然以花药、小孢子、茎端分生组织、原生质体及剥离的子房做为转化受体相关研究也获得成功[9-12],但是要获得较高的遗传转化效率,幼胚仍然是首选的转化受体[13]。与基因枪介导法相比,农杆菌介导法具有操作简单、成本低、转化效率高、重复性好,可以导入大片段的DNA等优点,而且导入的基因一般为单拷贝整合,获得的转基因株系其后代基因表达更稳定,且转基因沉默现象较少[14]。因此本研究以大麦幼胚为转化受体,选择根癌农杆菌介导大麦遗传转化的几个重要影响因素进行比较和优化,旨在为进一步建立大麦幼胚遗传转化体系奠定基础,促进大麦基因工程育种进程。
1 材料与方法
1.1 试验材料
1.1.1 植物材料。供试大麦品种Golden Promise由中国农科院品资所提供,Schooner,甘啤4号,秀81-47,秀麦1号由甘肃省农科院啤酒原料研究所大麦育种组提供,共计5个大麦品种。大麦种子播种于大田后进行常规的田间管理。
1.1.2 菌株和质粒。根癌农杆菌菌株为C58c1,EHA105。试验所用质粒为pVec-8-gus,从澳大利亚引进。该质粒T-DNA 区带有β-葡萄糖苷酸酶( gus) 基因和新霉素磷酸转移酶(NPTⅡ)基因,分别由CaMV35S 和Ubi启动子驱动。
1.2 试验方法
设计了4 种影响因素,分别为预培养天数、 侵染时间、菌液浓度、共培养基等,在这些因素内依次设置 4、 3、 3和 2 个处理水平。各因素、 各处理包含的个体数目不一致,为了分析方便,逐个比较各因素内不同处理水平。
1.2.1 培养基成分。本试验共用6种培养基,其成份见表1。
1.2.2 大麦幼胚的预培养。大麦开花后12~14d剪下幼穗, 剥出籽粒。70%的酒精表面消毒1min,再用20% 的NaClO消毒8~10min, 无菌水冲洗3~4次。在超净工作台用镊子剥取幼胚,去轴后盾片朝上接种于预培养基,24±1℃暗培养,预培养天数设为1d,4d,5d,6d。
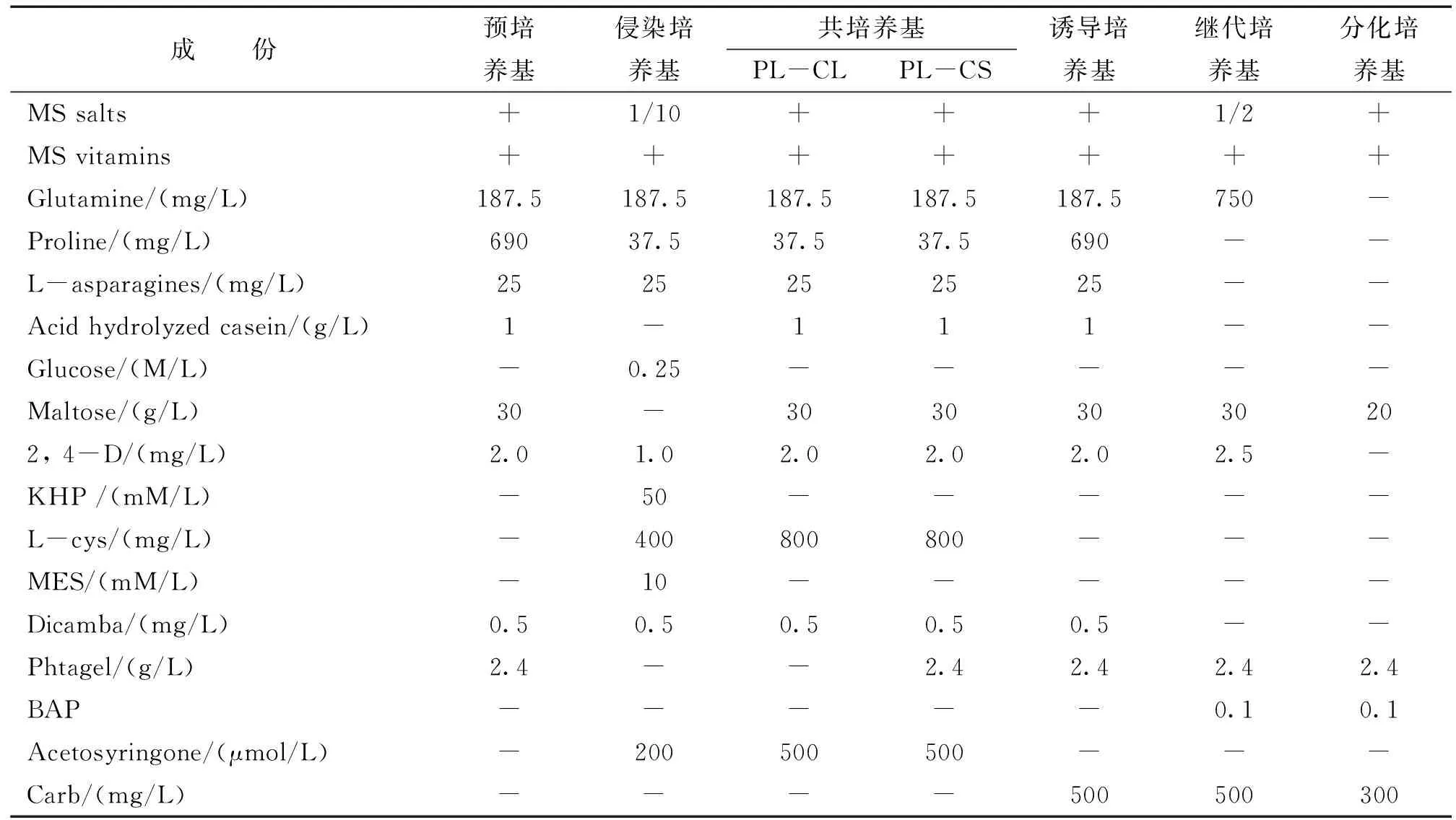
表1 根癌农杆菌介导法遗传转化大麦幼胚所用的培养基成分
1.2.3 农杆菌接种菌液的准备。感染前2~3d 从-70℃冰箱中取出农杆菌,在冰上融化后划线培养,接种于含50mg/L Rif,50mg/L Gta(庆大霉素)或50mg/L Str(链霉素)的YEP 固体培养基中,28 ℃,暗培养2~3d,之后挑取单菌落于28 ℃,200 r/min 过夜培养。吸取2 ml 培养物转入50 ml 含50 mg/L Gta、50 mg/L Rif 的YEP 培养基中,28 ℃、250 r/min 继续暗培养至OD600 = 0.6~1.0 。将菌液转至无菌离心管中,5000 r/ min 离心5min;菌体沉淀用侵染培养基洗涤一次后,再用该培养基重悬,使重悬菌液OD600 = 0.3~1.0 。重悬菌液中加入终浓度为200 μmol/L的AS,用于侵染大麦外植体。
1.2.4 大麦幼胚的侵染和共培养。将转化受体浸入侵染培养基(表1),在24±1℃条件下分别用OD600为0.3,0.6,1.0的菌液分别侵染15min、30min、1h ,用灭菌滤纸吸干后直接转移到共培养基,于 24±1 ℃,暗培养 2~3d。
1.2.5 抗性愈伤组织的诱导和选择。共培养洗菌后的愈伤组织置于诱导培养基24±1 ℃黑暗培养下恢复培养5~7d,然后将愈伤组织转入附加50 mg/L Hyg的诱导培养基上, 同样的条件下培养2~4周,筛选出抗性愈伤组织。之后转入附加25 mg/L Hyg的分化培养基进行24±1 ℃,16h/8h (光/暗) 光照培养,以筛选抗性芽、苗。
1.2.6 gus检测。gus 活性的组织化学染色检测,按 Jefferson 的方法[15]进行。共培养后将幼胚或愈伤组织浸泡在1mM的X-Gluc溶液中,37℃下24h,然后换入70%酒精中保存,肉眼或显微镜下观察gus基因表达情况。
X-Gluc染色液配方中包括38ml 0.2mol/L NaH2PO4, 62ml 0.2 mol/L Na2HPO4, 1ml 0.1 mol/L K3[Fe(CN)6], 1ml 0.1 mol/L K4[Fe(CN)6], 4ml 0.5 mol/L Na2EDTA, 200mg X-Gluc, 50ml 甲醇和120ul Triton-X,定容到250 ml。
gus瞬时表达率 = gus瞬间表达受体组织数/感染总受体组织数 ×100 %。
2 结果与分析
2.1 不同预培养天数对大麦幼胚根癌农杆菌遗传转化的影响
影响T-DNA的转移的因素之一在于幼胚转化前的预培养。预培养时间即介于幼胚剥离培养和农杆菌侵染幼胚的时间段。在以往研究[7]基础上,笔者主要选择预培养1d,及4~6d的幼胚作为受体材料进行比较。经根癌农杆菌侵染后取部分材料进行gus瞬时表达检测。在预培养 1 d 的幼胚和预培养 4~6 d的幼胚愈伤组织中均能检测到 gus瞬时表达(图1A,B),但是随着预培养天数的增加,gus基因的瞬时表达率显著下降(表2)。相对于预培养4~6d的幼胚,预培养1d的幼胚gus瞬时表达蓝点在盾片的分布区域更广。因此,后续实验选用预培养1d的幼胚用于农杆菌侵染。

表2 不同预培养天数幼胚的 gus瞬时表达结果
2.2 侵染时间及菌液浓度对大麦幼胚根癌农杆菌遗传转化的影响
以农杆菌菌株C58c1/pVec-8-gus感染经预培养后的转化受体,分别设计了几种不同的菌液浓度及侵染时间,比较它们对抗性愈伤组织形成的影响(表3,表4)。由表3结果可以看出OD600 =0.5时幼胚抗性愈伤组织获得率最高,达22%,远高于0.3和1.0。且随着菌液浓度增大,得到的抗性愈伤组织相对较少。

表3 农杆菌菌液浓度对大麦抗性愈伤组织形成的影响
农杆菌吸附在细胞表面是T-DNA转移及整合的前提。因此,转化受体在菌液中浸泡的时间对转化率也有一定的影响。由表4 结果可以看出农杆菌侵染时间为30min时,获得的抗性愈伤组织相对较多。随着侵染时间的延长,存活的幼胚数减少,从而抗性愈伤组织获得率明显下降。

表4 侵染时间对大麦抗性愈伤组织形成的影响
2.3 共培养对大麦幼胚根癌农杆菌遗传转化的影响
转化受体与农杆菌的共培养是农杆菌附着和整合到植物细胞的阶段,共培养成功与否是转化的关键。侵染后的大麦幼胚于固体培养基或液体培养基共培养3d,共培养结束后挑取幼胚或愈伤组织进行gus瞬时表达检测,并比较共培养基中添加半胱氨酸和乙酰丁香酮对转化的影响(表5)。结果显示,不同农杆菌侵染大麦幼胚后,液体共培养及固体共培养gus瞬时表达率平均值分别为90%,27%。

表5 共培养对转化效率的影响
注:ASa, 500 uM 乙酰丁香酮; Cysb,800 mg/L半胱氨酸。
半胱氨酸等抗氧化物质可以减弱农杆菌侵染后对幼胚造成的组织坏死和细胞死亡,在液体共培养基中添加了800mg/L 半胱氨酸,结果幼胚表面的褐化显著减少,而且转化效率也相对较高。此外,在共培养基中还添加了500uM乙酰丁香酮(AS)。由于该物质可以诱发农杆菌的转化活力,最终使gus瞬时表达率达到80%。
2.4 高毒力菌株及优良受体基因型的筛选
取Golden Promise,秀81-47,schooner,甘啤4号幼胚愈伤组织作为转化受体,共培养3d后随机挑取受体组织进行组织化学染色,测定gus瞬时表达结果(表6)。从中可看出各菌株的转化结果明显不同,说明不同菌株对转化效果有显著影响。其中EHA105 gus瞬时表达率为52.4%,而C58c1仅为37.3%,相对于C58c1,EHA105为高毒力菌株。

表6 不同菌株转化大麦幼胚愈伤组织的gus瞬时表达结果
本实验用4个大麦品种幼胚或愈伤组织作受体,用农杆菌C58c1,EHA105分别转化结果见表7。 结果表明,不同受体基因型对农杆菌的敏感性各不相同。其中,Schooner和Golden Promise的gus 瞬时表达率均较高,分别为58.3%,56.3%,但是这两个品种均为模式品种,因此在后续实验中还是采用秀81-47和甘啤4号进行遗传转化。

表7 农杆菌EHA105、C58c1在不同受体基因型中的gus瞬时表达结果
2.5 抗性愈伤组织的筛选
共培养后将愈伤组织转移到恢复培养基上(未添加选择压)过渡培养7~14d,愈伤组织生长得到恢复,然后转移到含Hyg 50mg/L的选择培养基上进行第一步筛选,15d左右出现较多的胚性愈伤组织(图1C,D)。胚性愈伤组织转移到第2次选择培养基(Hyg 25mg/L),约5~7d产生抗性芽(图1E,F),同时部分假抗性愈伤组织开始死亡。抗性再生芽再次转移到第2次选择培养基约5~10d,假抗性再生芽逐渐萎缩死亡,同时在Hyg作用下未转化愈伤组织分化形成白苗(图1G,H)。各品种抗性愈伤组织形成见表8。

表8 不同受体基因型大麦抗性愈伤组织形成情况
抗性愈伤组织诱导率为11.2%~58.4%,5种基因型大麦转化30d后获得的抗性愈伤组织占受体总数的34.2%。但是该指标在不同基因型之间存在较大差异,schooner为58.4%,明显高于GP。甘啤4号获得的抗性愈伤组织较多,抗性愈伤组织诱导率为46.4%,明显高于秀81-47和秀麦1号。
3 讨论
大麦以幼胚为外植体进行遗传转化的报道不少[1-4,7-8],但是基因型依赖、转化后再生苗分化频率低的问题仍得不到很好的解决。本试验研究了影响转化的重要因素,并进行了因素优化,初步建立了可用于大麦幼胚的根癌农杆菌转化系统。
在禾谷类作物的遗传转化中幼胚是首选的转化受体,主要是幼胚具有良好的分化和再生能力。有研究表明幼胚经农杆菌侵染10~15min将会降低新鲜剥离幼胚的存活率,而进行了预培养处理的幼胚经侵染后能更好地恢复培养[7]。本研究中预培养1d的幼胚不仅能耐受30min的侵染,而且在盾片区域能形成更多数量的蓝点,这与 Shrawat等的研究结论一致。此外,Shrawat等在预培养5d的幼胚中没有检测到gus表达,但是在本实验中预培养4~6d的幼胚均有gus蓝点分布。这可能是外植体来源差异使得转化受体的感受状态有所不同造成的[16]。因此,通过优化幼胚预培养时间可促进T-DNA转移到幼胚再生能力较强的区域,从而提高转化效率。
本研究所选用的农杆菌和转化受体采用液体共培养的方式,提高了转化效率。相对于固体共培养,液体共培养后幼胚gus瞬时表达率较高,这与Hensel[1]等研究结果一致。此外,此方法还能够转化时一次处理较多的受体组织,有效提高工作效率。尽管采用固体共培养获得的抗性愈伤组织比液体共培养稍多,但是鉴于实际操作的便利性,液体共培养是值得推荐的共培养方法。
进行稳定的大麦遗传转化与所采用的农杆菌菌株有关[17]。大麦幼胚的基因转移一般采用AGL菌系,如AGL0或AGL1[3,18]。本研究中,C58c1是小麦转化中常用的菌株[19],EHA105多数用于单子叶植物的遗传转化。通过用这两种农杆菌对大麦不同基因型进行转化,从gus表达的结果来看,不同农杆菌的致毒力有所不同,尽管两种菌株均有gus表达,但是EHA105相对C58c1表现更为突出。此外,在后续实验中将继续进行AGL1农杆菌的侵染力比较实验。
本研究在共培养基中添加了半胱氨酸和AS以改进培养方法。Olhoft 和Somers[20]首次提出半胱氨酸对经农杆菌侵染后大豆子叶节细胞的坏死反应有正向促进作用。主要是由于这种氨基酸的抗氧化作用使得农杆菌侵染后外植体的防御反应有所减弱。本研究结果也证实了这一观点。因为在添加800 mg/L 半胱氨酸后,侵染后的幼胚不但没有出现组织坏死和细胞凋亡,而且添加了半胱氨酸后转化效率相对较高。
该方法的另一改进在于AS的应用。众所周知,AS作为诱导物能被农杆菌识别并且在T-DNA转移过程中起重要作用。它能诱导细菌向植物组织伤口的趋向运动并到达感受态细胞完成基因转移,而且还能激活Vir区基因。本研究通过在共培养基中添加500 uM AS使得转化效率显著提高(表5)。与早期用幼胚进行遗传转化的有关报道相比,本实验中AS的浓度相对较高,Kumlehn[21]等应用大麦花药进行遗传转化时AS浓度也为500 uM。
供体材料的遗传背景是影响植物遗传转化的另一重要因素。对某些特定种质资源如生长区域不同或拥有某种特殊感病或抗性的育种品系和品种进行稳定的遗传转化是更为必要的。Murray[6]等报道获得Golden Promise 和3个澳大利亚品系的转基因株系。来自德国的 “Igri”是目前采用农杆菌介导的遗传转化成功获得转基因植株的唯一冬性大麦品种。本研究发现春性大麦品种甘啤4号和秀81-47是对农杆菌较为敏感的基因型,抗性愈伤组织获得率分别为46.4%,38.3%,甘啤4号是甘肃省大面积推广的啤酒大麦优良品种,秀81-47是组培特性优良的大麦品种,若以这两个大麦品种进行遗传转化,有望获得品质加以改良的大麦转基因株系。
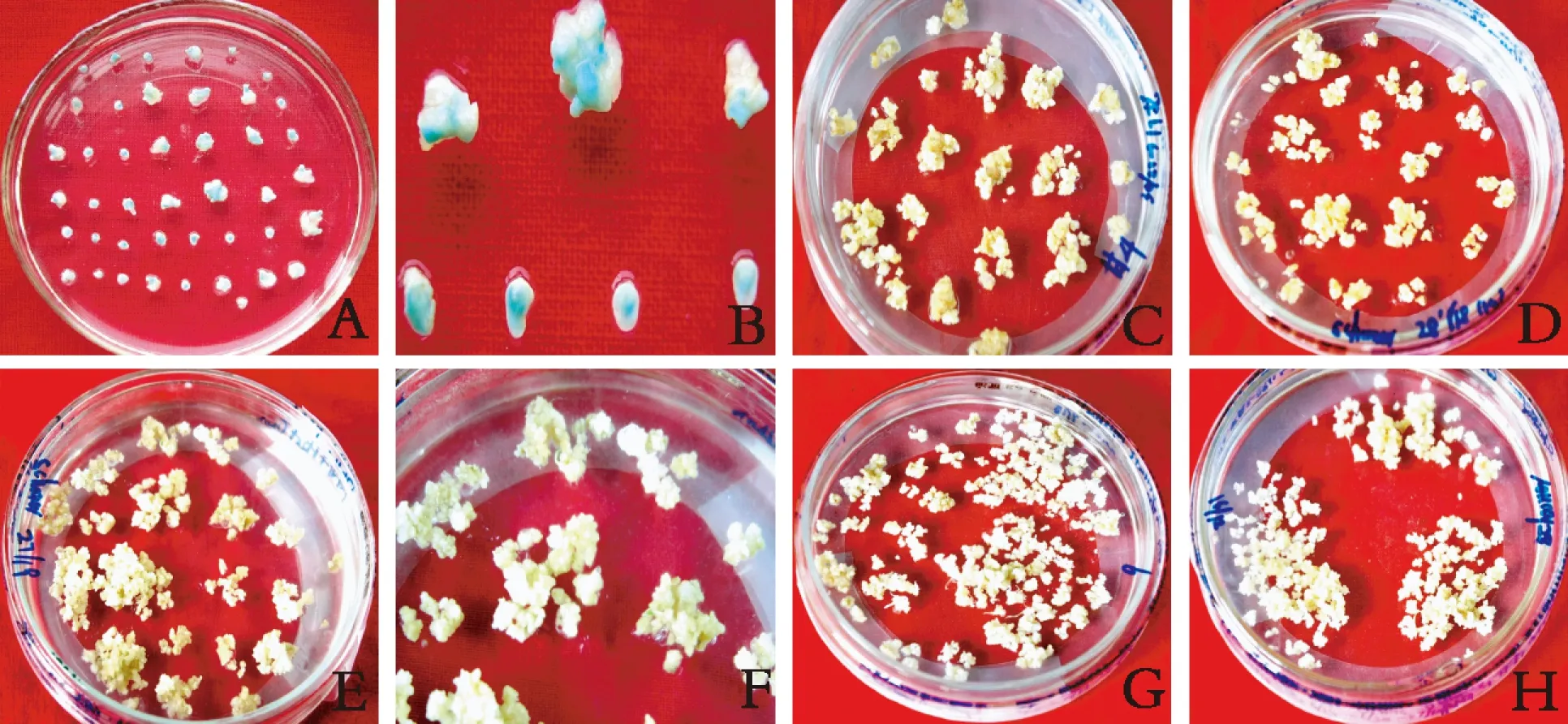
图1 大麦幼胚根癌农杆菌转化后gus表达、抗性愈伤组织形成及抗性芽分化
注:A、B:预培养不同天数幼胚及愈伤组织gus瞬时表达情况;C、D:50mg/L Hyg选择压形成的抗性愈伤组织;E、F:25mg/L Hyg 选择压形成的抗性芽;G、H: 25mg/L Hyg 选择压筛选出的非转化白苗。
[1] G. Hensel, V. Valkov, J. Middlefell-Williams, and J. Kumlehn. E?cient generation of transgenic barley: the way forward to modulate plant-microbe interactions[J]. Journal of Plant Physiology, 2008, 165(1):71-82
[2] Wan Y, Lemaux PG. Generation of large numbers of independently transformed fertile barley plants[J]. Plant Physiol,1994,104:37-48
[3] Tingay S, McElroy D, Kalla R, Feig S, Wang M, Thornton S, et al. Agrobacterium tumefaciens-mediated barley transformation[J]. The Plant Jouranl, 1997,11(6):1369-1376
[4] Trifonova A, Madsen S, Olesen A. Agrobacterium-mediated transgene delivery and integration into barley under a range of in vitro culture conditions[J].Plant Science, 2001, 161:871-80
[5] Wu, H.; Sparks, C.; Amoah, B.; Jones, H.D. Factors influencing successful Agrobacterium-mediated genetic transformation of wheat[J]. Plant Cell Report, 2003, 21:659-668
[6] Murray, F., Brettell, R., Matthews, P., Bishop, D. Jacobsen, J.Comparison of Agrobacterium-mediated transformation of four barley cultivars using the GFP and gus reporter genes[J]. Plant Cell Report, 2004, 22:397-402
[7] Ashok K. Shrawat, Dirk Beckeras and Horst L?rza. Agrobacterium tumefaciens-mediated genetic transformation of barley (Hordeum vulgare L.)[J]. Plant Science, 2007, 172(2):281-290
[8] Goetz Hensel, Vladimir Valkov, Jill Middlefell-Williams and Jochen Kumlehn. Ef?cient generation of transgenic barley: The way forward to modulate plant-microbe interactions[J]. Journal of Plant Physiology, 2008, 165:71-82.
[9] Jaehne, A., Becker, D., Brettschneider, R. and Loerz, H. Regeneration of transgenic, microspore-derived, fertile barley[J].Theor. Appl. Genet, 1994 , 89:525-533
[10] Zhang, S., Cho, M.J., Koprek, T., Yun, R., Bregitzer, P. and Lemaux, P.G. Genetic transformation of commercial cultivars of oat (Avena sativa L.) and barley (Hordeum vulgare L.) using shoot meristematic cultures derived from germinated seedlings[J]. Plant Cell Report, 1999, 18, 959-966
[11] Funatsuki, H., Kuroda, H., Kihara, M., Lazzeri, P.A., Mueller, E., Loerz, H. and Kishinami, I. Fertile transgenic barley generated by direct DNA transfer to protoplasts[J]. Theor. Appl. Genet, 1995, 91, 707-712
[12] Holme IB, Brinch-Pedersen H, Lange M, Holm PB. Transformation of barley (Hordeum vulgare L.) by Agrobacterium tumefaciens infection of in vitro cultured ovules[J]. Plant Cell Report, 2006, 25:1325-1335
[13] Hum D. Jones and Peter R. Shewry. Transgenic Wheat, Barley and Oats [M].2009, 137-147
[14]Travella, S., Ross, S. M., Harden, J., Everett, C., Snape, J.W. and Hardwood, W. A. A comparison of transgenic barley lines produced by particle bombardment and Agrobacterium-mediated techniques[J]. Plant Cell Report, 2005, 23: 780-789
[15] Jefferson RA, Kavanagh TA, Bevan MW.1987 gus fusions: β-glucuronidase as a sensitive and versatile gene fusion marker in higher plants[J]. The EMBO Journal, 1987, 6:3901-3907
[16] Z.Y. Zhao, T. Cai, L. Tagliani, M. Miller, N. Wang, H. Pang, M. Rudert, S. Schroeder, D. Hondred, j. Seltzer and D. Pierce. Agrobacterium-mediated sorghum transformation[J], Plant Mol. Biol, 2000, 44, 789-798
[17] Goedeke S, Hensel G, Kapusi E, Gahrtz M, Kumlehn J.Transgenic barley in fundamental research and bio-technology[J]. Trans Plant, 2007, 1:104-117
[18] Lazo GR, Stein PA, Ludwig RA. A DNA transformation-competent Arabidopsis genomic library in Agrobacterium[J]. Bio/Technology, 1991, 9:963-967
[19] 叶兴国, Shirley Sato, 徐惠君,杜丽璞,Tom Clemente. 小麦农杆菌介导转基因植株的稳定获得和检测[J].中国农业科学, 2001,34(5): 469-497
[20] Olhoft PM, Somers DA. L-Cysteine increases Agrobacterium-mediated T-DNA delivery into soybean cotyledon-ary-node cells[J]. Plant Cell Report, 2001, 20:706-711
