重组hIFN-α-2b-BCG的冻干制备及生物特性的研究*
2010-01-16孙二琳范晓东韩瑞发
孙二琳 赵 杰 范晓东 韩瑞发
重组hIFN-α-2b-BCG的冻干制备及生物特性的研究*
孙二琳 赵 杰 范晓东 韩瑞发△
目的:研究重组hIFN-α-2b-BCG真空冷冻干燥的制备工艺,研究冻干后生物特性的变化。方法:采用真空冷冻干燥法制备重组BCG(rBCG),筛选最佳工艺参数。平板计数法比较冷冻干前后的活菌数,计算存活率。比较冻干前后rBCG的抗酸染色特征与形态,连续测定OD值,绘制生长曲线,酶联免疫吸附测定(ELISA)IFN-α-2b表达水平。PCR和抗性培养分析冻干后的质粒稳定性。结果:冻干后重组BCG为(6.51±0.33)×106CFU/mL,冻干前为(1.02±0.11)×107CFU/mL,存活率约65%,达到BCG生物免疫治疗所需的活菌标准。冻干前后的菌落形态、生长曲线及抗酸染色特征无明显差异。质粒插入基因稳定率91.7%,丢失率为8.3%。冻干前后分泌IFN-α-2b水平差异无统计学意义(P>0.05)。结论:成功制备了重组hIFN-α-2b BCG冻干制剂,活菌数达到生物免疫治疗标准,其生物学特性和质粒稳定性均可耐受冷冻、低温与真空干燥过程中的不利影响。
干扰素α-2b 卡介苗 重组,遗传 质粒 冷冻干燥法 酶联免疫吸附测定
卡介苗(BCG)是一种牛型分枝杆菌减毒活疫苗,作为免疫佐剂在预防膀胱肿瘤复发及治疗原位癌方面已取得较好疗效[1]。利用基因工程技术构建分泌细胞因子的重组BCG可以提高其抗肿瘤活性并减少与剂量有关的不良反应,同时可通过重组BCG持续分泌的细胞因子来克服直接使用细胞因子灌注时半衰期短、水溶性易随尿流失及需反复大量灌注等缺点,成为近几年膀胱肿瘤治疗研究的热点[2]。基因重组BCG因导入外源性质粒,其生物活性能否长期保存就尤为重要。本所已成功构建了分泌型的表达人干扰素(hIFN)-α-2b的重组BCG[3]。目前关于基因重组IFN-α-2b-BCG的冷冻干燥制备及冻干后其生物特性、外源基因表达稳定性的研究少见报道,本文对此进行探讨。
1 材料与方法
1.1材料 重组hIFN-α-2b BCG由本所基因工程室自行构建保存,由hIFN-α-2b片段定向克隆至pMAO-4穿梭质粒形成重组质粒phIFN-α-2b,在DH5α-E.coli富集后提取电转导至BCG构建成,步骤详见参考文献[4]。主要试剂:谷氨酸钠(上海天莲精细化工有限公司),蔗糖(北方天医化学试剂厂),明胶(天津市用大化学试剂开发中心);Middlebrook 7H9 Broth和7H10 Agar购自美国DIFCO;Kanamycin Sulfate为AMRESCO分装;hIFN-α-2b酶联免疫吸附测定(ELISA)试剂盒购自美国Biosource公司。
1.2冻干制备 重组BCG(rBCG)在含卡那抗性的7H9液体培养基中培养7~9 d,取对数生长末期(OD600值为0.85)菌液4 mL离心,双蒸水洗涤,沉淀中加入1 mL保护液(10%蔗糖、1%明胶、1%氯化钾、1%谷氨酸钠),装入西林瓶。在真空冷冻干燥机(Sublimator2-3-3/5)中,经预冻-40℃ 5 h、第一阶段干燥-30℃12 h、第二阶段干燥20℃2 h,真空下压塞制成冻干粉末。
1.3活菌计数 分别取冻前rBCG 1 mL(OD值0.85)、1/4瓶冻干rBCG加入1 mL 7H9溶解,各加入9 mL 7H9液体培养基,依次稀释4、5次(即1:10 000和1∶100 000),各取0.1 mL,7H10固体培养基,2种稀释浓度各接种3个培养皿。置37℃恒温培养箱培养,4~6周后读取生长结果。取同一浓度3支培养基上生长菌落的平均数,计算出每毫升BCG中的活菌数。将冻干rBCG在4℃冰箱保存1个月后,重复上述操作。BCG 活菌数=(1∶10 000 的菌落数×10 万)+(1∶100 000 的菌落数×1 000 000)/2;冻干rBCG存活率=冻后活菌数/冻前活菌数×100%。
1.4质粒稳定性研究 挑取7H10固体培养基上生长的冻干后rBCG单菌落接种于2个24孔板中,每孔中有2 mL 7H9培养基(30 mg/L卡那霉素),37℃震摇培养,1周后观察结果。菌液没有生长者为质粒脱失。随机取10孔菌液抗酸染色。根据hIFN-α-2b序列设计引物,由上海生工生物工程技术服务有限公司合成。引物上游5′-CAAGGGATCCTGTGA TCTGCCTCAAACCCACAG-3′,下游 5′-GCCGGAATTCTCAT TCCTTACTTAAACTTTCTT-3′。取24孔板中扩增的菌液1 mL,离心去上清,洗涤沉淀。加入30 μL双蒸水,煮沸10 min。离心取上清液20 μL作为模板进行PCR反应。PCR反应条件:94℃预变性5 min,94℃变性 30 s,55℃退火50 s,72℃延伸50 s,最后1次72℃延伸7 min,共25个循环。1%琼脂糖凝胶电泳分析。上下游引物双向测序。
1.5冻前与冻后rBCG生长曲线的绘制 将冻前rBCG和冻干rBCG分别接种到3瓶50 mL 7H9液体培养基中,每天取出2~3 mL,测定各瓶在600 nm处的OD值,3瓶测定结果取平均值作为OD值测定结果,至其停止生长为止。以时间为横坐标,OD值为纵坐标,分别制作冻干前后的生长曲线。
1.6ELISA法检测冻干前后hIFN-α-2b表达量 分别取1 mL rBCG(OD 值 0.85)、1/4瓶冻干前后 rBCG(各 3瓶)接种于30 mL 7H9液体培养基中(含有30 mg/L卡那霉素),每天测其OD值。测OD值后取菌液1 mL,10 000 r/min离心10 min,取上清为标本,-20℃冻存。按照ELISA试剂盒说明书测定分泌至上清中的IFN-α-2b。5 min内450 nm处测定。每份样品复孔检测。根据标准曲线计算出样品含量,取平均值作为最终结果。
1.7冻干前后rBCG进行抗酸染色比较 将被检物涂于玻片晾干,加Ⅰ液(碳酸复红液)覆盖,加热,放凉,用水冲洗;加Ⅱ液(3%盐酸乙醇溶液)1 min,用水冲洗;加Ⅲ液(吕弗勒氏碱性美兰液)2 min,用水冲洗。晾干后封片,油镜下观察。
1.8统计学方法 采用SPSS 15.0统计软件进行分析,所有数据采用±s表示。样本均数间的比较采用独立样本t检验,多水平重复测量数据采用单个重复测量因素的方差分析;率的比较采用卡方检验。P<0.05为差异有统计学意义。
2 结果
2.1 冻干rBCG外观形态 冻干粉剂外观为白色疏松粉末,加水后3 min内快速溶解。冻干后rBCG的菌落外观形态和抗酸染色与冻干前相比均无明显变化,见图1。

图1 重组BCG菌落
2.2活菌计数 冻干前检测活菌数为(1.02±0.11)×107CFU/mL(CFU为菌落形成单位,colony formation unit),冻干后为(6.51±0.33)×106CFU/mL;存活率为65%。保存1个月后,冻干rBCG活性菌为(6.04±0.26)×106CFU/mL,存活率 60%,1个月保存对冻干状态的活菌数无明显影响(t=0.465,P > 0.05)。
2.3生长曲线 记录生长1周内的OD值,测量时间与组别(冻干前、后组)之间无交互作用(F=0.507,P=0.605);各测量时间点之间的测量值差别存在统计学意义(F=1 684.54,P<0.001);冻干前、后组rBCG的生长没有明显变化(F=4.102,P=0.113),见图 2。
2.4质粒稳定性结果含卡那霉素的7H9培养基的48孔中,有4孔没有生长,见图3。质粒丢失率为8.3%。其余44孔抗酸染色证明均为抗酸杆菌特征。hIFN-α-2b片段的PCR反应凝胶电泳检测结果显示在500 bp出现目的条带,见图4。测序结果与插入片段序列一致。
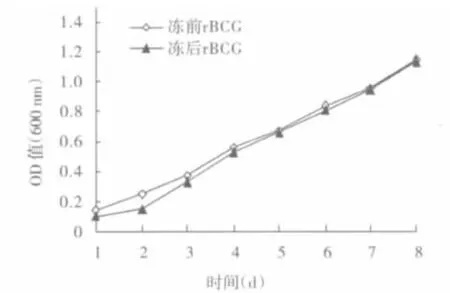
图2 冻干前后rBCG的生长曲线

2.5冻干前后hIFN-α-2b的表达 ELISA法测定冻干前后重组BCG表达hIFN-α-2b的情况,不同OD值测量点与组别之间无交互作用(F=1.249,P=0.326);不同OD值测量时间点的测量值差别存在统计学意义(F=65 331.85,P<0.001);对比培养生长至不同OD时相时,冻干前、后rBCG表达的IFN-α-2b 差异无统计学意义(F=3.084,P = 0.272),见表1。
表1 冻干重组BCG生长过程中IFN-a-2b 的分泌表达

表1 冻干重组BCG生长过程中IFN-a-2b 的分泌表达
组别冻干前组冻干后组0.2 OD 97.5±2.6 93.6±2.1 0.4 OD 179.4±5.9 170.4±6.1 0.6 OD 368.3±8.7 356.6±7.9 0.8 OD 789.4±10.0 780.3±11.2 1.0 OD 1 226.3±14.7 1 210.3±16.3
3 讨论
真空冷冻干燥系将药物溶液在体系共熔点以下预冻成固体,然后在低温低压的条件下,从冻结状态不经过液态而直接升华除去水分的一种干燥方式,是长期保存菌种比较好的一种传统方法。该法不适合于保存娇嫩的菌种,因必须经历应激和DNA损伤,可导致微生物的完全死亡或者某些重要生物功能的丧失或生物突变体的产生。革兰阳性菌冻干后活菌率为80%左右,革兰阴性菌冻干后活菌率为50%左右,可能原因为菌膜结构不同造成的菌龄和细胞浓度对冻干后活菌数有重要影响[5-7]。保存菌种的基本目的是冻干保存后细菌的活菌数、保存时间、保存后生物学特性的变化,研究的中心是选择合适的冻干保护剂配方以及筛选最佳冷冻干燥工艺参数。本试验中涉及保存的菌种是重组卡介苗,含有人工转导的重组质粒,不同于野生型卡介苗。虽然冻干皮内接种的野生型卡介苗已广泛应用于临床,但关于重组卡介苗的冷冻干燥的方法保存,其活菌数、生长状况有无变化,外源蛋白能否顺利表达以及重组质粒能否耐受冷冻干燥的恶劣环境方面少见文献报道,质粒有无脱失对维持良好的免疫原性至关重要。
冷冻干燥保存后细胞活力很高,但质粒编码的生物学活性可能存在丧失现象。国内学者研究了鼠疫杆菌、乳酸菌等冷冻干燥采用复苏后提取质粒电泳或基因扩增的方法证实冻干前后质粒变化[5-6],但未进一步研究质粒脱失率和突变情况。基因工程菌的冷冻干燥更重要的是重组蛋白表达和功能的维持。邓光存等[8]对基因工程菌株 BL21(DE3)(pECBST1)进行了冷冻干燥保存,其存活率和冷冻保存没有明显差别。Sidyakina等[9]对重组大肠杆菌HB101(含有重组质粒pHS35)保存2年发现:冷冻干燥(保存于4℃)后细菌存活率为2%~19%,深低温保藏(-160℃)为 51%~100%,低温保藏(-70℃)为60%~70%,各种方法保存后基因稳定性均为100%。Yoon[10]进行了含自身质粒pKM10/pKM20假单胞菌和人工转染包含pKM20/pKM10双质粒的假单胞菌的冷冻干燥,发现质粒脱失比较严重;自然质粒和人工转染质粒的脱失率无显著差别,随保存时间延长人工转染的质粒更易脱失。最近关于重组BCG的研究大多数包括评价其稳定性。通常通过评价rBCG保持卡那霉素抗性的百分比,作为质粒存在的指标。这种评价方法有其局限性,因为选择标记的存在不能区别那些外源基因缺失而选择性标记存在的突变体。应该通过卡那霉素抗性的保留和目的基因片段的存在双重标准来评价质粒的完整性。
本研究结果显示冷冻干燥能很好的保存基因工程菌hIFN-α-2b-rBCG,分析冷冻干燥过程对hIFN-α-2b-rBCG的影响发现,活菌数满足免疫治疗活菌数>100万的要求。并且证明冷冻干燥后重组BCG仍能很好地表达外源性蛋白—人干扰素-α-2b,相同OD值下表达量与冷冻干燥前没有显著差别。冷冻干燥后的形态、生长情况没有明显变化。外源质粒基本可以耐受冷冻干燥过程中的不利环境,仅发现存在少量质粒脱失现象,质粒未缺失株均可检测到IFN-α-2b完整目的片段,故不影响重组BCG的临床应用。
[1] Lam JS,Benson MC,O’Donnell MA,et al.Bacillus Calmete-Guerin plus interferon-alpha2B intravesical therapy maintains an extended treatment plan for superficial bladder cancer with minimal toxicity[J].Urol Oncol,2003,21(5):354-360.
[2] Dennehya M,Williamson AL.Factors influencing the immune response to foreign antigen expressed in recombinant BCG vaccines[J].Vaccine,2005,23(10):1209-1224.
[3] 孙二琳,刘春雨,韩瑞发,等.重组hIFN-α-2B-BCG的生物学特性的观察[J].中华微生物和免疫学杂志,2010,30(1):46-51.
[4] 刘春雨,韩瑞发.PhIFN-α-2B穿梭质粒在卡介苗中的表达[J].中华泌尿外科杂志,2006,27(4):12-15.
[5] 刘振明,骆承庠.乳酸菌冻干特性的研究 [J].中国乳品工业,2002,30(5):38-42.
[6] 张丽云.冷冻干燥长期低温保存后鼠疫菌某些生物学的研究[J].中国地方病杂志,1996,11(5):43-45.
[7] 郑从义,屈三甫,陶天申,等.极端嗜盐菌冻干保藏及其质粒稳定性的研究[J].武汉大学学报,1995,41(6):56-64.
[8] 邓光存,吕玉玲,王玉炯.基因工程菌株BL21(DE3)(pECB-ST1)菌种的限定代次及保存条件试验[J].宁夏农学院学报,2002,23(2):24-26.
[9] Sidyakina TM,Golimbet VE.Viability and genetic stability of the bacterium escherichia coli HBl101 with the recombinant plasmid during preservation by various methods[J].Cryobiology,1991,28(3):251-254.
[10] Yoon KP.Stabilities of artificially transconjugated plasmids for the bioremediation of cocontaminated sites[J].J Microbiol,2005,43(2):196-203.
Lyophilization-Preparation and Biological Characteristics of Recombinant hIFN-α-2b-BCG
SUN Erlin,ZHAO Jie,FAN Xiaodong,HAN Ruifa
Tianjin Institute of Urology,The second Hospital of Tianjin Medical University,Tianjin 300211,China
Objective:To explore the preparation process of lyophilization of recombinant hIFN-α-2b-BCG(rBCG),and the biological characteristics of lyophilized rBCG thereof.Methods:It was used to determine the optimum process parameters that preparation by vacuum freeze-drying recombinant rBCG.The number of viable cells was compared with the plate count before and after lyophilization to calculate the survival rate.The acid-fast staining characteristics and morphology of the lyophilized rBCG were analyzed.The OD value of freeze-dried rBCG was continuously measured for drawing the growth curve.The level of IFN-α-2b expression was determined by ELISA.The plasmid stability was analysed by PCR.Results:The number of viable rBCG reached (6.51±0.33)×106CFU/mL after lyophilization.The value was (1.02±0.11)×107CFU/mL before freeze-drying,and the survival rate was about 65%.The viable number achieved the required standard of bio-immunotherapy.There were no significant differences in morphology,growth rate and acid-fast staining characteristics of lyophilized rBCG compared with those of un-lyophilized.The stability rate of gene inserted(hIFN-α-2b)was 91.7%,loss rate 8.3%.There was no significant difference in the level of secretion of rIFN-α-2b by rBCG after lyophilization(P>0.05).Conclusion:Freezedried powder of hIFN-α-2b-rBCG was successfully prepared,which was without significant adverse effects on the hIFN-α-2b expression,plasmid insert and bio-characteristics.
interferon alfa-2b BCG vaccine recombination,genetic plasmids freeze drying enzyme-linked immunosorbent assay
*国家科技部“十一五”重大专项新药创建课题(项目编号:2009ZX09103-699);国家自然科学基金资助项目(项目编号:30872587);天津市科技支撑计划重大项目(项目编号:07ZCKFSH03200)
300211 天津医科大学第二医院、天津市泌尿外科研究所
△通讯作者 E-mail:miyansuo@126.com
(2010-07-18收稿 2010-10-08修回)
(本文编辑 李国琪)
