XIAP表达在ATRA诱导APL细胞分化中的意义
2010-01-14陈唐勇万腊根张长林
罗 清 ,王 娜 ,陈唐勇 ,万腊根 ,张长林 *
(1、南昌大学第一附属医院检验科,江西 南昌 330006;2、南昌大学医学院研究生院,江西 南昌 330006)
XIAP表达在ATRA诱导APL细胞分化中的意义
罗 清1,2,王 娜1,2,陈唐勇1,万腊根1,张长林1*
(1、南昌大学第一附属医院检验科,江西 南昌 330006;2、南昌大学医学院研究生院,江西 南昌 330006)
目的探讨X染色体相关凋亡抑制蛋白在全反式维甲酸诱导急性早幼粒细胞白血病细胞分化过程中的表达意义。方法以急性早幼粒白血病细胞NB4为细胞模型,利用细胞计数、瑞氏染色、蛋白质免疫印记等方法,观察细胞经ATRA处理不同时间后细胞分化情况以及XIAP蛋白表达情况。结果1μmol/L的ATRA可抑制NB4细胞的生长,在用药处理72h后细胞出现明显的分化,XIAP蛋白含量明显下降。 结论 在ATRA诱导APL细胞分化过程中,凋亡抑制蛋白XIAP表达明显下调。
细胞分化;凋亡抑制蛋白;全反式维甲酸
急性早幼粒细胞白血病 (Acute Promyelocytic Leukemia,APL)是一种以早幼粒细胞分化受阻为主要细胞生物学特征的急性髓细胞系白血病。研究表明,95%以上APL患者存在非随机染色体易位t(15;17)(q22;q21),该易位使得位于17号染色体上的维甲酸受体 α(Retinoic acid receptorα,RARα)基因与位于15号染色体上的PML(Promyelocytic leukemia)基因发生融合,形成PML-RARα融合基因,并编码相应的融合蛋白[1]。PML-RARα融合蛋白能以“显性负 (Dominant negative)”的方式抑制野生型PML和RARα的正常功能,导致骨髓粒细胞分化受阻,被认为是导致APL发病的主要原因[2]。分化诱导药物全反式维甲酸(All trans retinoic acid,ATRA)可以活化凋亡相关信号通路[3],促进丝氨酸蛋白酶(Caspases)活化并对PML-RAR蛋白剪切,从而使PML-RARα蛋白降解[4],达到治疗APL的作用。但是ATRA活化Caspases的机制并不清楚。
X染色体相关的凋亡抑制蛋白 (X-linked inhibitor of apoptosis protein,XIAP)是凋亡抑制蛋白家族的成员,其能抑制Caspases的活性,阻断内源性和外源性凋亡信号[5]。当XIAP表达过高可以抑制细胞的凋亡,并促进肿瘤的发生。那么,在ATRA诱导APL细胞分化过程中,是否可以抑制XIAP蛋白的表达,进而活化Caspase,从而促进PML-RARα降解。本文就ATRA诱导APL细胞分化过程中XIAP蛋白表达情况做一分析,进一步探讨ATRA诱导APL分化的分子机制。
材料与方法
1 主要试剂
兔抗人多克隆XIAP抗体购自Cell Signaling公司,鼠抗人单克隆β-actin抗体购自Sigma公司,HRP-羊抗兔IgG抗体购自Santa Cruz公司。细胞瑞氏染液购自上海信然生物技术有限公司,ATRA由南昌大学医学院第一附属医院泌外研究所汪泱博士惠赠。
2 细胞培养
APL细胞株NB4细胞由法国圣路易医院Michel Lanotte博士惠赠,细胞在含10%胎牛血清(HyClone,Logan,Utah)的 1640 培养液(GibcoBRL)中常规培养 (37℃,5%CO2), 使细胞维持在 2~5×105cells/ml的最佳生长状态。
3 细胞生长检测
分别在1μmol/L的ATRA处理NB4细胞0、24、48、72h时收集细胞,以细胞计数仪所计数的细胞浓度乘以细胞体积,得到该时间点的细胞总数,并以此绘制细胞生长曲线,分析细胞生长速度的变化。
4 细胞形态观察
收集经ATRA处理不同时间的NB4细胞,经甩片、晾干后,用瑞氏染料染色,在光学显微镜下观察细胞分化情况。
5 蛋白免疫印迹
NB4细胞经ATRA处理不同时间后,分别取2×106细胞,加入 100μl蛋白裂解液(100mmol/L Tris,pH 6.8,4%SDS,0.2%溴酚蓝,20%甘油和 5% β-巯基乙醇)提取蛋白。蛋白经SDS-PAGE电泳分离后,转移到硝酸纤维膜上,然后用XIAP抗体检测XIAP的表达。将免疫印迹结果扫描入计算机用Quantity one软件分析灰度积分,以未经ATRA处理XIAP β-actin为100%,分析加药不同时间XIAP的改变。
结 果
1 ATRA抑制NB4细胞的生长并诱导其分化
研究表明,ATRA可以抑制APL细胞NB4生长,并诱导其分化。我们首先检测了ATRA对NB4细胞的生长的影响。结果显示,1μmol/L的ATRA明显抑制细胞生长(图1),从细胞形态来看,加药48h后,细胞核开始出现凹陷,胞浆染色变淡,表明细胞开始分化,72h分化更加明显(图2)。

图1 ATRA对NB4细胞生长的影响
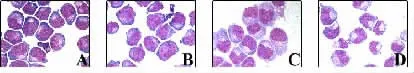
图2 1M ATRA对NB4细胞分化的影响(A:control B:24h C:48h D:72h)
2 ATRA抑制XIAP蛋白表达
研究表明,凋亡抑制蛋白XIAP在多种肿瘤(包括实体瘤和白血病)中表达高于正常细胞,下调XIAP蛋白可以抑制肿瘤细胞生长。我们检测了ATRA诱导APL细胞分化中,XIAP蛋白的表达情况。western blot实验果显示,用药处理48h后,XIAP蛋白含量明显减少(图3)。以未处理的NB4细胞中的XIAP和β-actin蛋白表达比值为100%,通过定量分析,发现ATRA处理细胞72h后,XIAP蛋白的含量减少为未加药时的28%(图3b)。以上结果表明,XIAP蛋白含量随着ATRA诱导的分化而下调。
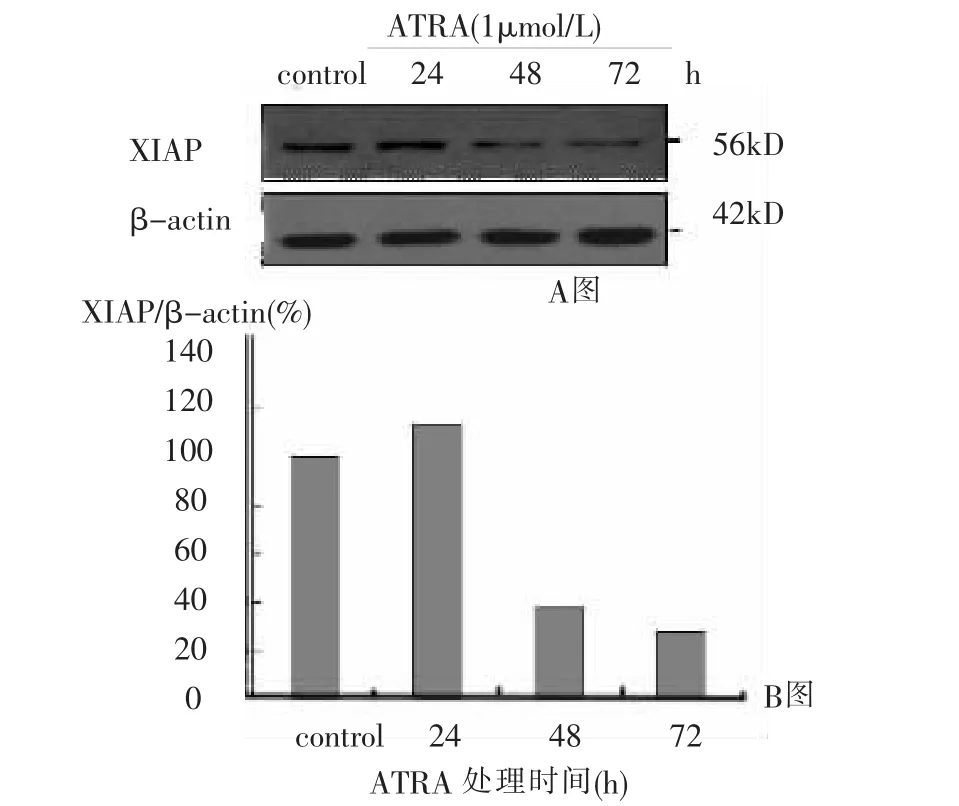
图3 Western blot检测ATRA对XIAP蛋白表达的影响(a:Western blot b:Quantity assay)
讨 论
凋亡抑制蛋白 (Inhibitor of apoptosis protein,IAP)是一系列可抑制细胞凋亡,促进细胞生长、增殖的蛋白分子。现在发现该家族含有8个成员,分别是 HIAP-1、HIAP-2、XIAP、ML-IAP、Survivin、ILP-2/Ts-IAP、NAIP、BRUCEE/apollon[6]。 研究表明,在IAP家族中,XIAP可以直接调控Caspases的活性,是唯一能够同时抑制起始阶段和效应阶段的IAP[5]。XIAP,又称 BIRC4(Baculoviral IAP repeat-containing4),定位于 Xq25,mRNA 全长 8413 bp,编码区位于129 bp-1622 bp之间,其编码的蛋白相对分子量约为57 kDa,主要由3个杆状病毒IAP重复序列BIR1-BIR3 (Baculoviral inhibitorof apoptosis repeat)和一个RING锌指样结构域 (Really new gene Zinc finger domain)组成。不同的BIR结构域可以与不同的Caspase相互作用,进而抑制Caspases的活性[7]。例如,BIR3与Caspase-9单体形成异源二聚体,使Caspase-9保持单体结构,丧失催化活性[8]。BIR2结构域能结合并抑制活化的Caspase-3和Caspase-7,Caspase-3和Caspase-7是作为凋亡信号通路的效应酶,尤其是Caspase-3是细胞膜、线粒体和内质网3条凋亡途径的共同的最终效应酶,抑制了他的活性,也就抑制了细胞的凋亡[9]。此外,XIAP还有具有E3泛素连接酶活性,能够使蛋白泛素化进而加速蛋白质的降解,通过促进降解Caspase-9和Caspase-3以及内源性的XIAP抑制剂SMAC,进而增强XIAP的抗凋亡作用[10]。因此,XIAP可以作为肿瘤治疗的靶点。
研究表明,在AML中,XIAP表达明显高于正常人中,并且其表达的高低与疾病治疗和预后明确相关,例如在成人和儿童的急性髓细胞样白血病(AML)患者中,XIAP低表达的患者的生存率明显高于XIAP高表达的患者[11-12]。ATRA是一种广泛用于肿瘤治疗的脂类分子,可以抑制细胞生长,并促进细胞分化,凋亡。本研究中,我们发现,在ATRA抑制细胞生长过中,XIAP蛋白明显下降,并随着加药时间的增加而逐渐减少。表明XIAP可能是ATRA发挥抗肿瘤作用的一个靶点分子。
正常情况下,ATRA识别并与核受体RARα结合,进而调控一系列基因的表达,使得造血细胞分化成熟。但是,在APL细胞中,由于t(15;17)染色体易位,导致PML与RARα形成PML-RARα融合基因,其产生的PML-RARα融合蛋白可以通过显性负的方式抑制RARα的功能,继而使得细胞阻滞在早幼粒细胞阶段,不能分化成熟[1]。研究表明,药理浓度的ATRA可以促进PML-RARα降解,使得白血病细胞分化成熟。近年来,国内来学者非常关注ATRA诱导PML-RARα降解的机制。现在认为,ATRA可以通过多种途径促进PML-RARα降解:ATRA可以上调UBE1L蛋白,后者可以使PMLRARα融合蛋白中的PML部分发生类泛素化修饰—ISG15ylation,ISG15修饰的PML-RARα可以被蛋白酶降解[13]。另外,ATRA还可以活化凋亡相关信号通路,激活一系列丝氨酸蛋白酶Caspases的活性,进而促进PML-RARα和RARα的剪切[4],而XIAP可以直接调控Caspases的活性。因此ATRA下调XIAP蛋白的表达,也可能是导致PML-RARα降解的原因。
本研究探讨了ATRA诱导分化过程中XIAP蛋白表达的变化情况,但是,ATRA是通过怎样方式调控XIAP的,以及其在APL分化中的作用,还有待进一步研究。
[1]de Thé H,Lavau C,Marchio A,et al.The PML-RAR alpha fusion mRNA generated by the t(15;17)translocation in acute promyelocytic leukemia encodes a functionally altered RAR[J].Cell,1991,66(4):675-684.
[2]Melnick A,Licht JD.Deconstructing a disease:RARalpha,its fusion partners,and their roles in the pathogenesis of acute promyelocytic leukemia[J].Blood,1999,93(10):3167-3215.
[3]Gianni M,Ponzanelli I,Mologni L,U Reichert,A Rambaldi,M Terao and E Garattini Retinoid-dependent growth inhibition,differentiation and apoptosis in acute promyelocytic leukemia cells Expression and activation of caspases[J].Cell Death and Differentiation,2000,7(5):447-460.
[4]Yao CJ,Yang CM,Chuang SE,et al.Targeting PML-RAR{alpha}and Oncogenic Signaling Pathways by Chinese Herbal Mixture Tien-Hsien Liquid in Acute Promyelocytic Leukemia NB4 Cells[J].Evid Based Complement Alternat Med,2009,Nov 23.
[5]Deveraux QL,Takahashi R,Salvesen GS,et al.X-linked IAP is a direct inhibitor of cell-death proteases[J].Nature,1997,388(6639):300-304.
[6]Nachmias B,Ashhab Y,Ben-Yehuda D.The inhibitor of apoptosis protein family(IAPs):an emerging therapeutic target in cancer[J].Semin Cancer Biol,2004,14(4):231-243.
[7]张曙光 刘芝华,张 林.凋亡抑制基因XIAP在肿瘤治疗中的研究进展[J].世界华人消化杂志,2006,14(26):2626-2631.
[8]Shiozaki EN,Chai J,Rigotti DJ,et al.Mechanism of XIAP-mediated inhibition of caspase-9[J].Mol Cell,2003,11(2):519-527.
[9]Scott FL,Denault JB,Riedl SJ,et al.XIAP inhibits caspase-3 and-7 using two binding sites:evolutionarily conserved mechanism of IAPs[J].EMBO J,2005,24(3):645-655.
[10]Morizane Y,Honda R,Fukami K,et al.X-linked inhibitor of apoptosis functions as ubiquitin ligase toward mature caspase-9 and cytosolic Smac/DIABLO[J].J Biochem(Tokyo),2005,137(2):125-132.
[11]Tamm I,Richter S,Oltersdorf D,et al.High expression levels of x-linked inhibitor of apoptosis protein and survivin correlate with poor overall survival in childhood de novo acute myeloid leukemia[J].Clin Cancer Res,2004,10(11):3737-3744.
[12]Tamm I,Richter S,Scholz F,et al.XIAP expression correlates with monocytic differentiation in adult de novo AML:impact on prognosis[J].Hematol J,2004,5(6):489-495.
[13]Shah SJ,Blumen S,Pitha-Rowe I,et al.UBE1L represses PML/RAR{alpha}by targeting the PML domain for ISG15ylation[J].Mol Cancer Ther,2008,7(4):905-14.
The significance of X-linked apoptosis inhibitor protein expression in acute promyelocytic leukemia cells induced by all trans retinoic acid
LOU Qing,WANG Na,CHEN Tangyong,et al.Department of Clinical Laboratory,The First Affiliated Hospital of Nanchang University,Nanchang 330006,China
ObjectiveTo explore the significance of X-linked inhibitor of apoptosis protein(XIAP)expression in the cellular differentiation of acute promyelocytic leukemia(APL)induced by all trans retinoic acid(ATRA).MethodsWith the model of APL cell line NB4,the cell count and Wright stain were applied to observe the morphologic features and the differentiation of the cells induced with ATRA,and XIAP expression was tested by western blot.ReasultsThe growth of NB4 cells was inhibited with 1μmol/L ATRA.As treated with ATRA for 72 hours,NB4 cells differentiation was obvious and XIAP expression was significantly decreased.ConclusionXIAP expression can be inhibited in the differentiation of APL cells induced ATRA.
Cell differentiation;Apoptosis inhibitor protein;All trans retinoic acid
R329.2+8,R733.7
A
1674-1129(2010)06-0546-03
10.3969/j.issn.1674-1129.2010.06.005
南昌大学科技基金项目(编号48),江西省卫生厅科技项目(编号 20091046),
*通讯作者:张长林,男,检验师,硕士。
罗清,男,就读南昌大学医学院,硕士研究生。
