葡萄酒中低产尿素酵母菌的分子生物学鉴定与评价*
2010-01-13刘树文张剑钟其顶熊正河张辉周韩玲
刘树文,张剑,,钟其顶,熊正河,张辉,周韩玲
1(西北农林科技大学葡萄酒学院,陕西 杨凌,712100) 2(中国食品发酵工业研究院,北京,100027)3(中粮酒业有限公司,北京,100020)
酵母发酵产生酒精时,涉及己糖磷酸化、糖裂解、丙酮酸分解和甘油发酵等一系列过程,生成的产物除酒精外,还有很多发酵副产物[1]。其中,葡萄酒中的大部分尿素就是经过酵母菌细胞内精氨酸酶-尿酶(AU)途径将精氨酸代谢而来。
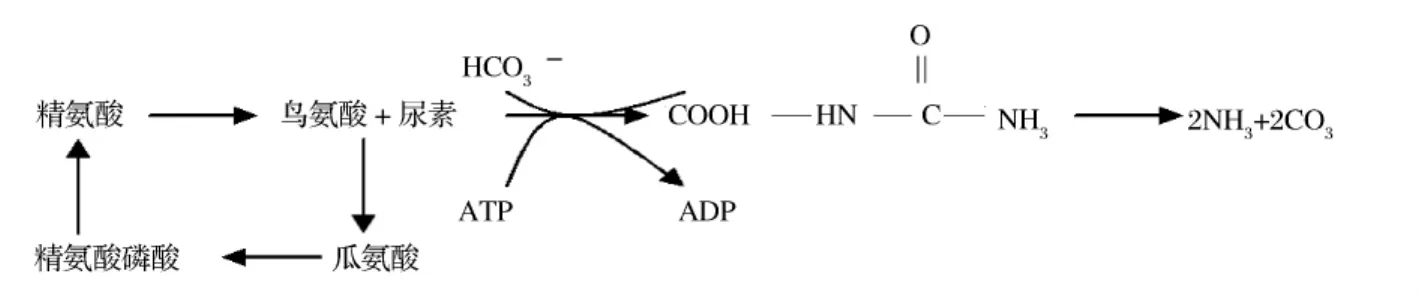
图1 酵母菌的尿素代谢途径
大量研究表明,在葡萄酒中尿素可以和乙醇反应形成氨基甲酸乙酯(ethylcarbamate,简称EC),而EC是国际癌症研究所已经证实的致癌物,世界卫生组织已对软饮料中EC制定了限量标准。葡萄酒中EC主要由此反应而产生,因而尿素也就被认为是形成EC的主要前体物质[2]。Kodama 等[3]人研究表明,葡萄酒中的尿素含量不要超过2 mg/L,否则,佐餐葡萄酒中EC的潜在浓度就可能超过美国非强制性限量标准15 mg/L。Kodama[4]通过添加酸性脲酶来实现对EC 的控制,而 Schehl和 Dahabieh[6]利用基因工程的方法来降低EC的含量。这些方法归根结底就是减少EC的主要前体物质尿素,而尿素主要由酵母代谢产生。本研究是利用分子生物学鉴定技术针对性筛选野生酵母菌株,通过与活性干酵母相对照,评价其产尿素能力,以期选育低产尿素的酵母菌株,提高我国葡萄酒产区酵母安全性和多样性。
酵母菌的传统鉴定方法主要依据形态和生理生化特征,但这些方法测试项目多,耗费时间长,且易受培养条件的影响而出现不确定的结果。随着分子生物学技术的发展,26S rDNA D1/D2区域序列分析,5.8S-ITS区 PCR-RFLP,RAPD,AFLP和种特异性DNA探针等[7-12]方法已用于酵母菌的鉴定,以前两种方法应用得最为广泛。Kurtzman 和 Fell[7-8]测定了有型性与无型性子囊菌酵母和担子菌酵母几乎所有模式菌株的26S rDNA D1/D2区的碱基序列,发现这段序列可以将绝大部分的种区分开来,种内不同菌株碱基差异不大于1%。这些序列均已公布在Gen-Bank/EMBL/DDBJ等国际核酸序列数据库中,为以后酵母菌的分类和鉴定带来了极大的便利。Esteve-Zarzoso等[9]人又根据5.8S-ITS区具有显著的种间差异性特点建立了基于这一序列的PCR-RFLP方法,以此来快速鉴定酵母菌。之后,5.8S-ITS区RFLP的数据库(http://www.yeast-id.com)也因此建立并发展起来。
1 材料与方法
1.1 材料
8株从自然发酵的葡萄酒中分离、纯化得到的野生酵母菌株,即 M8,M18,M24,M39,M42,M53,M59,M66。已知菌株1964,31084,31501均为S.cerevisiae,购于中国工业微生物菌种保藏中心(CICC)。菌株C1,C2,C3,C4,C5为5株工业活性干酵母。
引物 NL1(5'-GCATATCAATAAGCGGAGGAAAAG-3')/NL4(5'-GGTCCGTGTTTC AAGACGG-3'),ITS1(5'-TCCGTAGGTGAACCTGCGG-3')/ITS4(5'-TCCTCCGCTTATTGATATGC-3')由上海生工生物工程技术服务有限公司合成。
1.2 26S rDNA D1/D2区鉴定
挑取活化的酵母菌于30 μL的无菌水中,98℃热激8 min以破碎细胞释放DNA,取上清液作为模板。PCR 反应体系:5 μL 10 × buffer;4 μL dNTP(2.5 mmol/L,TaKaRa);1 μL NL1/NL4(20 μmol/L);Taq酶(TaKaRa)1.5U;模板3 μL;用无菌水稀释至50 μL。PCR 循环为 95℃ 5 min;95℃ 1 min;52℃ 1 min;72℃ 2 min;35次循环;72℃ 10 min。PCR产物送交华大基因公司测序。所得序列在GenBank核酸序列数据库中进行同源序列搜索(blast search),然后比较分离菌株与已知酵母菌相应序列的相似度,并以Clustal X和MEGA4.0软件和Neighbour-Joining方法构建系统发育树。
1.3 5.8S-ITS区PCR-RFLP
使用引物ITS1和ITS4对酵母菌5.8S-ITS区进行扩增。PCR反应体系和条件参考文献[9],PCR产物经 HhaⅠ,HaeⅢ,HinfⅠ(TaKaRa)3 种限制性内切酶消化后,在2%琼脂糖凝胶中电泳分析。
1.4 模拟发酵
酵母菌用灭菌的葡萄汁进行活化,然后接种于150 mL 90℃处理20 min的葡萄汁(23°Brix,pH值3.3)中,在三角瓶中(20±1)℃发酵,发酵完成后将样品保存于-20℃,待分析。
1.5 尿素的测定
尿素的测定参考文献[13]稍加改动。
2 结果与讨论
2.1 酵母菌26S rDNA D1/D2区的鉴定
利用引物NL1和NL4对8株野生酵母26S rDNA的D1/D2区进行PCR扩增,共获得8个序列,其产物在586—601bp之间。每个序列经BLAST分析及序列相似性计算,其26S rRNA D1/D2区基因序列与相关模式菌株信息见表1。
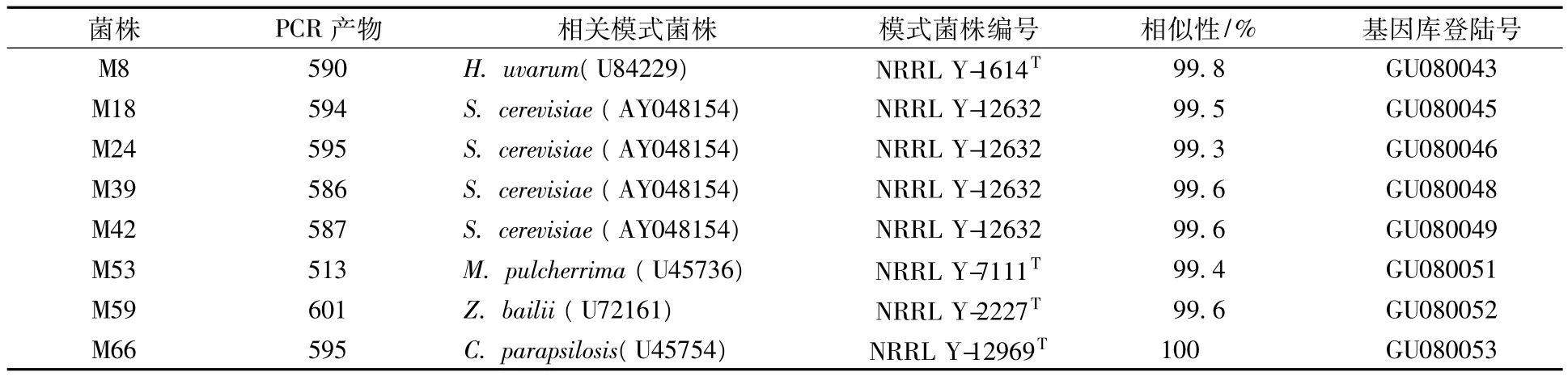
表1 待鉴定菌株26S rRNA D1/D2序列与相关模式菌株的序列相似性
以8株待鉴定的菌株和与5株相关模式菌株构建系统发育树,从而分析菌株间的亲缘关系(见图2)。酵母属(Saccharomyces),接合酵母属(Zygosaccharomyces),有孢汉生酵母属(Hanseniaspora),假丝酵母属(Candida)处于同一个主枝;而梅奇酵母属(Metschnikowia)处于另一个主枝,与它们亲缘关系较远。
M18、M24、M39、M42 与S.cerevisiae以较高置信度聚为一类,且与S.cerevisiaeNRRL Y-12632同源性均高于99.3%,属于同一物种。M59与Z.bailiiNRRL Y-2227T同源性为99.6%,聚在同一分支上。M8与H.uvarumNRRL Y-1614T以较高置信度聚为一类,同源性为99.8%,属于同一物种。而M66与C.parapsilosisNRRL Y-12969T同源性为100%,聚在同一分支,属于同一物种。而M53与这7株亲缘关系较远,与M.pulcherrimaNRRL Y-7111T的同源性为99.4%,以较高置信度聚为一类,可以确定为同一个种。
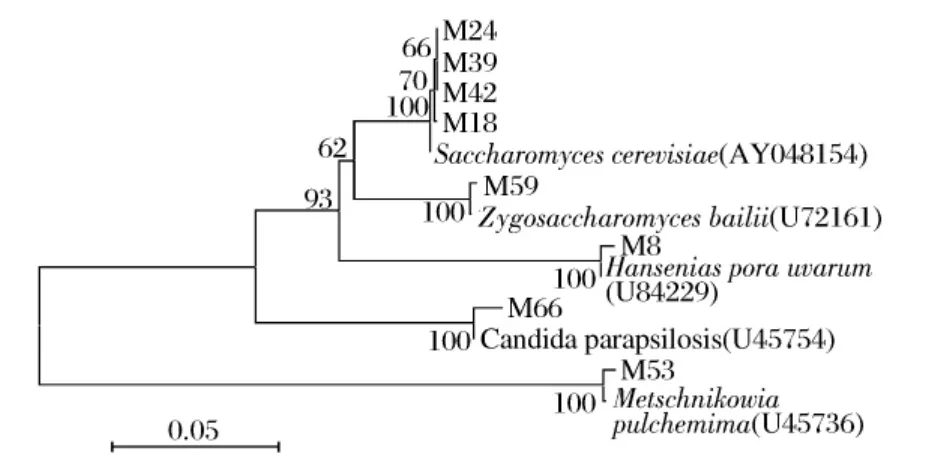
图2 基于酵母菌26S rDNA D1/D2区序列和Neighbor-joining法构建系统发育树
2.2 酵母菌5.8S-ITS区PCR-RFLP鉴定
利用ITS1和ITS4对8株野生酵母和3株已知菌株进行5.8S-ITS区PCR扩增,产物为400-860bp,并分别经过3种限制性内切酶HhaⅠ,HaeⅢ,HinfⅠ进行酶切。
菌株 M18、M24、M39、M42 的 HhaⅠ酶切片段大小为380+360+120,HaeⅢ和HinfⅠ酶切片段大小分别为320+230+180+140,370+370+120,与已知菌株1964,31084,31501酶切类型一致,因此将4株鉴定为S.cerevisiae。菌株M8的扩增片段约750bp,不能被HaeⅢ消化,HhaⅠ和HinfⅠ酶切结果分别为320+320,350+200+180,与数据库中基本一致,被鉴定为H.uvarum。菌株M53和M66扩增片段较小,分别为400bp和550bp,M59扩增片段为780bp,其酶切结果见表2,与数据库中相关菌种的酶切信息基本一致,分别鉴定为 M.pulcherrima、C.parapsilosis和Z.bailii。

表2 酵母菌株5.8S-ITS PCR产物和限制性酶切片段长度
供试的野生酵母采用26S rDNA D1/D2区序列分析和5.8S-ITS区PCR-RFLP两种方法鉴定,其鉴定结果相同。
2.3 不同酵母菌代谢尿素能力的评价
对5株活性干酵母和11株野生酵母进行了模拟发酵并测定其尿素含量(见表3)。
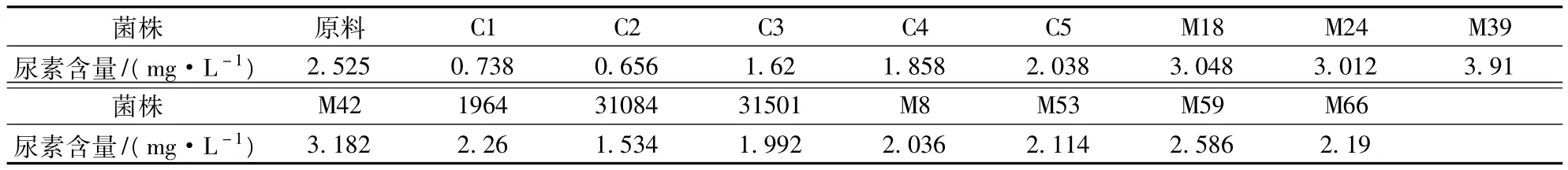
表3 不同酵母菌株代谢尿素的含量
不同酵母代谢尿素的能力存在差异。其中5株活性干酵母代谢尿素含量普遍较低,菌株C1和C2代谢的尿素含量较低,分别为0.738 mg/L和0.656 mg/L,这可能是活性干酵母的代谢活动比野生酵母较为旺盛,发酵能力也较强,消耗葡萄汁中的氮源,尿素也作为氮源而被利用。而野生酵母代谢尿素的含量普遍比活性干酵母高,菌株M39最高为3.91 mg/L,这是由于酵母菌一方面会利用氮源,降解一部分尿素,同时也会代谢精氨酸产生尿素,除了满足自身需要外,多余的尿素被分泌到体外,使得酒中尿素含量增加。
酵母菌代谢尿素不仅与菌株本身有关,还受乙醇、氨基酸等培养条件的影响[14-15]。乙醇抑制了营养物质的转移和酵母的生长,从而影响了酵母代谢产生尿素。氨和谷氨酰胺会明显抑制酵母对尿素的吸收,而不同浓度的苏氨酸、丙氨酸、丝氨酸对酵母菌代谢尿素的影响较小[15]。
2.4 葡萄酒发酵过程中尿素的变化
跟踪了菌株M18在发酵过程中尿素含量变化(见图3)。在发酵前一个星期尿素含量有所减少,这是由于酵母在前期大量繁殖,消耗葡萄汁中的氮源,而尿素作为氮源被利用,但在10 d后葡萄汁中营养大量消耗,酒精大量产生,酵母生长受到抑制,酵母也会通过精氨酸代谢产生尿素,使得发酵液中尿素出现上升趋势。而在带酒泥储存一段时间后,尿素含量也有明显升高的趋势。
2.5 不同精氨酸添加量对发酵后尿素含量的影响
在葡萄汁中分别添加500,1 000,1 500 μg/mL精氨酸后接种M18菌株,跟踪20d和40d的尿素含量变化(见图4)。
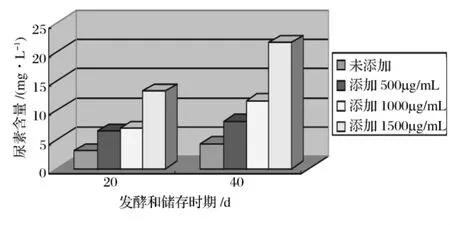
图4 不同精氨酸添加量对尿素代谢的影响
在发酵20 d时,添加精氨酸产生的尿素明显高于未添加精氨酸的含量,添加1 500 μg/mL精氨酸发酵后尿素的含量是未添加的4.36倍,是添加500 mg/L的2.06倍。表明添加精氨酸后尿素的含量会有所升高,且添加越多,尿素的含量也有增加的趋势。这种趋势同样在进入贮存期40 d的情况相一致,且含量都有升高,这些都与酵母菌代谢精氨酸产生尿素密切相关。因此葡萄汁中的精氨酸含量对发酵后葡萄酒中的EC具有潜在的影响,Ough等[16]报道,当葡萄汁中精氨酸浓度超过800~1 000 mg/L时,可认为葡萄园施肥过量。这就需要调整葡萄园的管理,控制其精氨酸的含量,从而降低葡萄酒中尿素含量。
3 结论
采用26S rDNA D1/D2区序列分析和5.8S-ITS区PCR-RFLP两种分子生物学方法对分离于葡萄酒中的8株野生酵母进行了鉴定,其中4株为S.cerevisiae,其余 4 株分别是H.uvarum、M.pulcherrima、Z.bailii、C.parapsilosis。2种方法鉴定结果一致。
评价了8株野生酵母、3株野生酵母和5株工业活性干酵母代谢尿素能力,不同的菌株存在差异性且野生酵母代谢尿素的含量明显高于活性干酵母。在发酵过程中,尿素含量与酵母菌的生长状况密切相关。在发酵开始阶段,尿素含量有所下降,酵母菌利用了一部分尿素,但在随后的发酵过程中,酵母菌代谢精氨酸产生尿素,使葡萄酒中尿素含量增加。另外,葡萄汁中精氨酸的浓度也影响其尿素的含量,因此,控制葡萄汁中精氨酸的含量是降低因酵母代谢而产生尿素的有效途径之一。
[1] 李华.现代葡萄酒工艺学(第二版)[M].西安:陕西人民出版社,2000:52-67.
[2] 高年发,宝菊花.氨基甲酸乙酯的研究进展[J].中国酿造,2006(162):1-4.
[3] Kodama S,Suzuki T,Fujinawa S,et al.,Urea contribution to ethyl carbamate formation in commercial wines during storage[J].American Journal of Enology and Viticulture,1994,45:17-24
[4] Kodama,Yotsuzuka F.Acid Urease:Reduction of ethyl carbamate formation in Sherry under simulated baking conditions[J].Journal of Food Science,1996,61:304 -307.
[5] Schehl B,Senn T,Lachenmeier D W,et al.Contribution of the fermenting yeast strain to ethyl carbamate generation in stone fruit spirits[J].Applied Microbiology and Biotechnology,2007,74:843 -850.
[6] Dahabieh M S,Husnik J I,Van Vuuren.H J J.Functional Expression of the DUR3 Gene in a Wine Yeast Strain to Minimize Ethyl Carbamate in Chardonnay Wine[J].American Journal of Enology and Viticulture,2009,60:537 -541.
[7] Kurtzman C P,Robnett C J.Identification and phylogeny of ascomycetous yeasts from analysis of nuclear large subunit(26S)ribosomal DNA partial sequences[J].Antonie van Leeuwenhoek,1998,73:331-71.
[8] Fell J W,Boekhout T,Fonseca A,et al.Biodiversity and systematics of basidiomycetous yeasts as determined by large-subunit rDNA D1/D2 domain sequence analysis[J].International Journal of Systematic and Evolutionary Microbiology,2000,50:1 351-1 371.
[9] Esteve-Zarzoso B,Belloch C ,Uruburu F,et al.Identification of yeasts by RFLP analysis of the 5.85 rRNA gene and the two ribosomal internal transcribed spacers[J].International Journal of Systematic Bacteriology,1999,49:329-337.
[10] Quesada M P,Cenis J L.Use of random amplified polymorphic DNA(RAPD-PCR)in the characterization of wine yeasts[J].American Journal of Enology and Viticulture,1995,46:204 -208.
[11] Borst A,Theelen B,Reinders E,et al.Use of amplified fragment length polymorphism analysis to identify medically important Candida spp.,including C.dubliniensis[J].Journal of Clinical Microbiology,2003,41:1357 -1362.
[12] Elie C M,Lott T J,Reiss E,et al.Rapid identification of candida species with species-specific DNA probes[J].Journal of Clinical Microbiology,1998,36:3 260-3 265.
[13] Clark S,Francis P S,Conlan X A,et al.Determination of urea using high-performance liquid chromatography with fluorescence detection after automated derivatisation with xanthydrol[J].Journal of Chromatography A,2007,1161:207-213
[14] Henschke P A,Ough C S.Urea accumulation in fermenting grape juice[J].American Journal of Enology and Viticulture,1991,42:317 -321.
[15] An D,Ough C S.Urea excretion and uptake by wine yeasts as affected by various factors[J].American Journal of Enology and Viticulture,1993,44:35 -40.
[16] Ough C S,Stevens D ,Almy J.Preliminary comments on effects of grape vineyard nitrogen fertilization on the subsequent ethyl carbamate formation in wines[J].American Journal of Enology and Viticulture,1989,40:219-220.
