溶液浓度对前驱体FePO4·xH2O及LiFePO4性能的影响
2010-01-13
(中南大学 冶金科学与工程学院,湖南 长沙,410083)
Padhi等[1]发现的橄榄石型LiFePO4不但能够可逆地嵌入⁄脱出Li+,还具有较高的理论容量(170 mA·h/g)和可逆容量的优点,人们对正极材料LiFePO4进行了大量的理论研究和实际应用。目前,LiFePO4的合成方法主要分为固相法和湿化学法两大类,其中:固相法有高温固相法、机械化学法和微波法等[2−6];湿化学法分水热法、共沉淀法、溶胶−凝胶法等[7−10]。丁燕怀等[11]采用固相法制备锂离子电池正极材料并研究了煅烧温度对LiFePO4电化学性能的影响;郑俊超等[12]采用低温固相法研究了 pH对前驱体 FePO4·xH2O和LiFePO4性能的影响;Yu等[13]在采用液相法制备LiFePO4/C过程中分别考察了流速、温度、pH以及压力对产物的影响;Chen等[14]考察了不同的碳源对高温固相合成的LiFePO4/C性能的影响;张宝等[15]采用共沉淀法制备FePO4·xH2O前驱体,然后与乙炔黑混合,在高纯氩气气氛保护下,利用碳热还原法制备LiFePO4/C。目前,有关反应体系溶液浓度对合成前驱体FePO4·xH2O以及LiFePO4性能影响的研究很少,为此,本文作者对其进行研究,同时对浓度与FePO4·xH2O中结晶水数量的关系进行探讨。
1 实验
1.1 材料的制备
将 NH4H2PO4(AR)和 FeSO4·7H2O(AR)按照物质的量比依次配制成浓度为0.1,0.3,0.5,1.0和1.5 mol/L的溶液,以一定的流速同时加入烧杯并放置于恒温水浴槽中强烈搅拌。随后加入过量H2O2,溶液立即出现大量白色沉淀。充分反应后陈化一段时间,洗涤过滤数次后干燥,得到浅黄色 FePO4·xH2O 粉末。将干燥的FePO4·xH2O和Li2CO3按物质的量比混合,并加入过量的葡萄糖(AR),置于行星式球磨机中高速混合球磨一段时间,然后将混合物取出,在真空干燥箱中充分干燥后装入管式炉中煅烧,得到LiFePO4。
1.2 材料的表征
采用日本RIGAKU D/MAX型X线衍射仪对样品的晶体结构进行XRD物相分析。物相分析的条件是:Cu Kα辐射,波长为1.540 6×10−10m,管压为40 kV,管流为300 mA,扫描速度为8 (°)/min,步长为0.02°,扫描范围 2θ为 10°~90°;采用 JEOL 公司的 JSM−5612LV扫描电子显微镜,在电压为20 kV时,分别以不同的放大倍数对样品的表面形貌进行观察;采用美国生产的SDT−Q600型DSC−TGA分析仪进行热重差热分析,温度从 20 ℃升到 1 000 ℃,升温速度为10 ℃/min,保护气氛为99.999%的氩气;采用由美国热电元素公司生产的电感耦合等离子发射光谱仪(型号:Intrepid 11 XSP)分析材料含量。
1.3 电池组装和测试
将活性物质LiFePO4、黏结剂PVDF(聚偏二氟乙烯)和导电剂乙炔黑按质量比 80∶10∶10混合均匀,加入定量溶剂NMP(N-甲基吡咯烷炯),研磨成浆状;再将电极浆料均匀地涂覆于厚度为0.02 mm的铝箔上,经120 ℃鼓风干燥后裁成直径为1.4 cm的正极片;最后于 60 ℃真空干燥 6 h。以金属锂片作负极,Celgard2400为隔膜,1 mol/L LiPF6(EC,DMC和EMC质量比为 1∶l∶1)为电解液,在氩气保护的手套箱内装配完成CR2025型扣式电池。采用深圳市新威尔电子有限公司生产的BTS−51型二次电池性能检测仪对电池的充、放电性能进行测试。
2 结果和讨论
2.1 反应物浓度对FePO4·xH2O的影响
图 1所示为不同浓度条件下合成的 FePO4·xH2O于480 ℃热处理12 h后转化为晶态的FePO4的XRD谱。由图1可见:在所有反应物浓度条件下合成产物的衍射峰与纯相FePO4(JCPDS29−715)谱图吻合,说明合成的FePO4均为纯相,表明浓度为0.1, 0.3, 0.5, 1.0和1.5 mol/L时对合成产物FePO4·xH2O的物相没有影响。
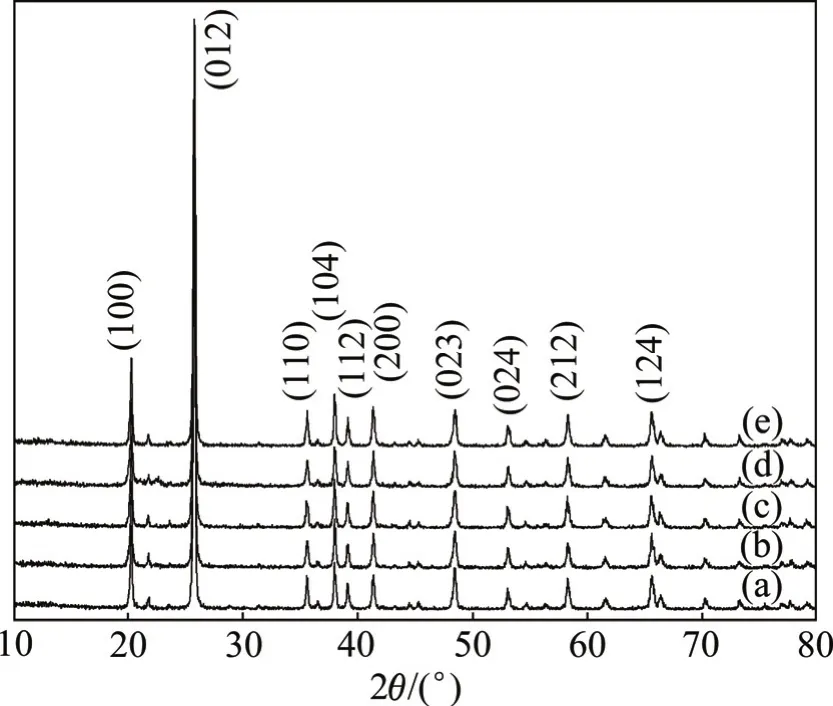
图1 溶液浓度不同时合成的FePO4的XRD谱Fig.1 XRD patterns of FePO4 at various concentrations of solution
图 2所示为不同浓度下合成的 FePO4·xH2O的扫描电镜图。由图2可见:随着溶液浓度的增大,合成的 FePO4·xH2O 颗粒粒径呈增大趋势。其原因可能是随着浓度的增大,溶液中反应粒子之间接触的概率增大,核化速率加快,导致颗粒粒度增大。
表1所示是不同浓度下合成的FePO4·xH2O中Fe含量和结晶水的数量;图3所示是溶液浓度为1 mol/L时合成的前驱体FePO4·xH2O的热重−差热图。由表1可见:随着溶液浓度的逐渐增大,Fe的含量逐渐增大而结晶水的数目逐渐减小。这可能是因为随着溶液浓度的不断增大,颗粒粒度也不断增大,而比表面积和表面吸附力逐渐减小,致使结晶水的含量不断减小。所以,不同浓度下合成FePO4·xH2O中的x不同,且随着溶液浓度增大,x逐渐减小。在溶液浓度为1 mol/L时,FePO4·xH2O中结晶水的数目接近2。由图3可见:当温度为20~500 ℃时,第1次质量损失基本完成,约为19%,而此范围内曲线上只有1个反应峰,即失去结晶水反应峰,此质量损失过程应为磷酸铁失去结晶水的过程。因此,在溶液浓度为1 mol/L时,磷酸铁有2个结晶水,即FePO4·xH2O为FePO4·2H2O。所以,可以通过调节溶液浓度来控制结晶水的含量,为LiFePO4的制备确定Fe源、Li源和C源的物质的量比。

图2 溶液浓度不同时合成的FePO4·xH2O的SEM像Fig.2 SEM images of FePO4·xH2O at various concentrations of solution
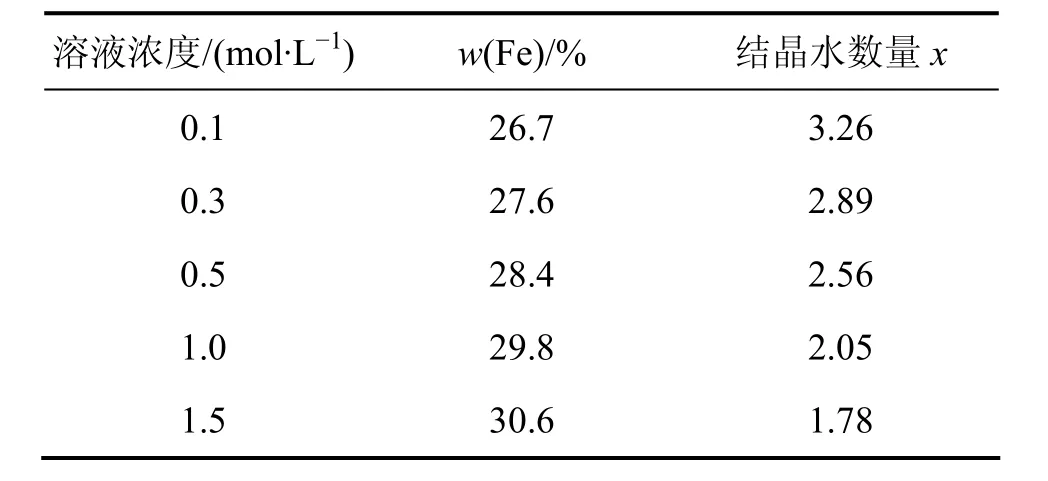
表1 溶液浓度不同时合成的FePO4·xH2O中Fe含量和结晶水的数量Table 1 Content of Fe and number of crystal water of FePO4·xH2O at various concentrations of solution

图3 溶液浓度为1 mol/L时合成的FePO4·xH2O的热重−差热(DSC-TGA)图Fig.3 DSC-TGA curves of FePO4·xH2O at concentration of 1 mol/L
2.2 溶液浓度对LiFePO4性能的影响
图4所示为以不同溶液浓度下合成的FePO4·xH2O为前驱体合成的LiFePO4的XRD谱。由图4可见:在以溶液浓度分别为0.1,0.3,0.5,1.0和1.5 mol/L时合成的FePO4·xH2O为前驱体合成的LiFePO4与标准图谱一致,说明合成的LiFePO4为纯相。而过量的碳以无定形态存在,不会破坏 LiFePO4的晶体结构,LiFePO4仍将保持正交晶系橄榄石型结构。
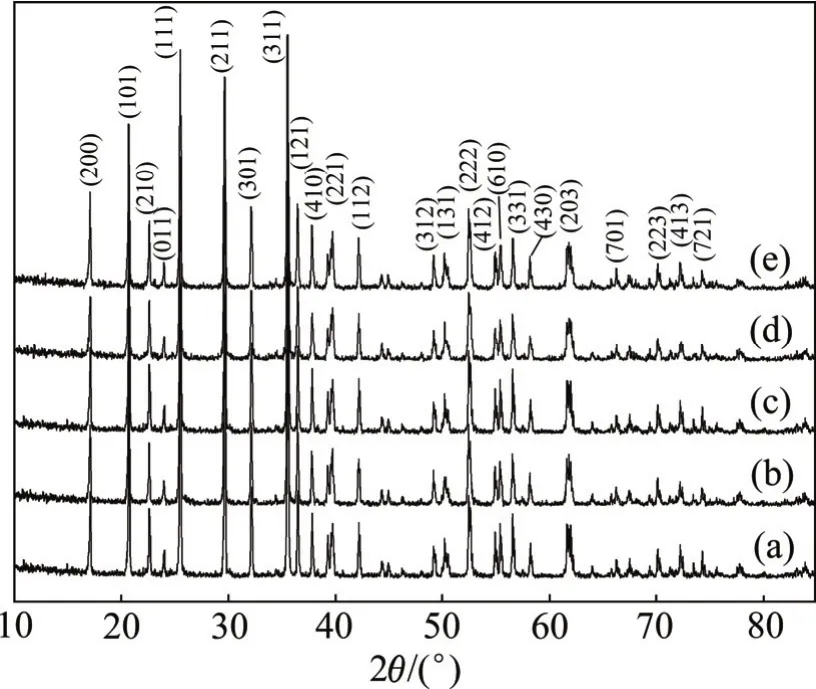
图4 不同溶液浓度下合成的LiFePO4的XRD谱Fig.4 XRD patterns of LiFePO4 at various concentrations of solution

图5 溶液浓度不同时合成的LiFePO4的SEM图像Fig.5 SEM images of LiFePO4 at various concentrations of solution
图5所示为以不同溶液浓度下合成的FePO4·xH2O为前驱体合成的LiFePO4的SEM图。碳源的加入能有效地减小材料的颗粒尺寸,并且材料的电导率比纯LiFePO4的电导率提高5个数量级以上。由图5可见,碳均匀分布于LiFePO4之间,能显著提高LiFePO4的电导率;在溶液浓度为1.0 mol/L时合成的LiFePO4粒子呈类球形(见图 5(d)),其颗粒粒径分布均匀,一次粒径约为0.5 μm,较其他样品粒径小,颗粒粒径减少能提高LiFePO4的利用率;同时,絮状葡萄糖颗粒包覆良好,增强了 LiFePO4的电导性,从而有利于提高LiFePO4的电化学性能。
图6所示为以不同溶液浓度下合成的FePO4·xH2O为前驱体,在氩气气氛下于650 ℃碳热还原12 h得到的LiFePO4在0.1C的倍率下的首次放电曲线(其中,C为充、放电倍率)。由图6可见:当浓度为0.1,0.3,0.5,1.0和1.5 mol/L时,首次放电容量分别为123.8,137.6,144.0,154.4和 110.6 mA·h/g。其中在浓度为1.0 mol/L时合成的LiFePO4首次放电比容量最高。所以,当溶液浓度为 1.0 mol/L时,由该条件下合成的FePO4·xH2O 前驱体制备的 LiFePO4的首次放电性能最佳。

图6 溶液浓度不同时合成LiFePO4的放电曲线Fig.6 Discharge curves of LiFePO4 at various concentrations of solution
图7所示是溶液浓度为1 mol/L时合成的LiFePO4在不同放电倍率下的放电比容量和循环曲线。由图 7可见:在0.1C和1.0C倍率下合成的LiFePO4其首次放电比容量分别为154.4 mA·h/g和137.7 mA·h/g,说明随着放电倍率的增大,首次放电比容量逐渐减小。从图7(b)可见:以1 mol/L条件下合成的LiFePO4在0.1C和1.0C倍率下经过30次循环后,容量保持率分别为99.7%和98.6%,循环性能优良。
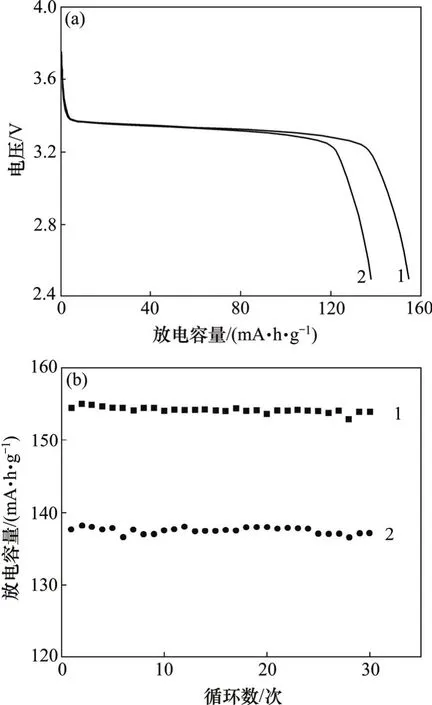
图7 当溶液浓度为1 mol/L时合成的LiFePO4在不同倍率下的放电曲线和循环曲线Fig.7 Discharge curves(a) and cycle performance(b) of LiFePO4 at concentration of 1 mol/L
综上所述,溶液浓度在制备过程中对前驱体FePO4·xH2O以及LiFePO4的性能影响很大,经综合考虑,宜选取溶液浓度为1 mol/L左右。
3 结论
(1) 以 NH4H2PO4和 FeSO4·7H2O 为原料,H2O2为氧化剂,研究了不同浓度的溶液对合成前驱体FePO4·xH2O的影响。当溶液浓度为0.1,0.3,0.5,1.0和1.5 mol/L时,合成的前驱体FePO4·xH2O均为纯相。
(2) 在溶液浓度为 1.0 mol/L时合成的前驱体FePO4·xH2O含2个结晶水,即可以通过调节溶液浓度来控制结晶水的含量,为LiFePO4的制备确定Fe源、Li源和C源的物质的量比。
(3) 以浓度为1 mol/L时合成的FePO4·xH2O为原料制备的LiFePO4其电化学性能优于其他浓度下合成的LiFePO4的电化学性能,该样在0.1C倍率下的首次放电容量为154.4 mA·h/g,30次循环后的容量保持率为99.7%。
[1] Padhi A K, Nanjundaswamy K S, Goodenough J B.Phospho-olivines as positive-electrode materials for rechargeable lithium batteries[J].Electrochemical Society, 1997, 144(4):1188−1194.
[2] Takahashi M, Tobishima S, et al.Characterization of LiFePO4as the cathode material for rechargeable lithium batteries[J].J Power Sources, 2001, 97(98): 508−511.
[3] LIAO Xiao-zhen, MA Zi-feng, HE Yu-shi, et al.Electrochemical behavior of LiFePO4/C cathode material for rechargeable lithium batteries[J].Journal of the Electrochemical Society, 2005,152(10): A1969−A1973.
[4] Amine K, Liu J, Bellharouak I.High-temperature storage and cycling of C-LiFePO4/grap Hite Li-ion cells[J].Electrochemistry Communications, 2005, 7(7): 669−673.
[5] Prosini P P, Zane D.Improved electrochemical performance of a LiFePO4-based composite cathode[J].Electrochemical Acta,2001, 46: 3517−3523.
[6] Masashi H, Katayama K, Azuma Y, et al.Synthesis of LiFePO4cathode material by microwave processing[J].J Power Sources,2003, 119(121): 258−261.
[7] 郑绵平, 文衍宣.一种制备磷酸铁锂的湿化学方法: 中国专利, 03102665.6[P].2003.ZHENG Jin-ping, WEN Yan-xuan.A wet chemical method of preparation of lithium iron phosphate: China Patent,03102665.6[P].2003.
[8] Arnold G, Garche J, Hemmer R, et al.Fine-particle iron phosphate LiFePO4synthesized by a new low-cost aqueous precipitation technique[J].J Power Sources, 2003, 119(121):247−251.
[9] Park K S, Son J T, Chung H T, et a1.Surface modification by silver coating for improving electrochemical properties of LiFePO4[J].Solid State Communications, 2004, 129: 311−314.
[10] HU Yao-qin, Doeff M M, Kostechi R, et al.Electrochemical performance of sol-gel synthesized LiFePO4[J]. J Electrochemical Soc, 2004, 151(12): 1279−1285.
[11] 丁燕怀, 苏光耀, 高德淑, 等.合成温度对 LiFePO4电化学性能的影响[J].电池工业, 2006, 11(1): 33−35.DING Yan-huai, SU Guang-yao, GAO De-shu, et al.Effect of synthesis temperature on the electrochemical performance of LiFePO4[J].Chinese Battery Industry, 2006, 11(1): 33−35.
[12] 郑俊超, 李新海, 王志兴, 等.制备过程pH值对FePO4·xH2O及 LiFePO4性能的影响[J].中国有色金属学报, 2008, 18(5):867−872.ZHENG Jun-chao, LI Xin-hai, WANG Zhi-xing, et al.Effect of pH value on performance of FePO4·xH2O and LiFePO4in synthesis process[J].The Chinese Journal of Nonferrous Metals,2008, 18(5): 867−872.
[13] YU Wen-li, ZHAO Ya-ping, RAO Qun-li.Rapid and continuous production of LiFePO4/C nanoparticles in super heated water[J].Chinese Journal of Chemical Engineering, 2009, 17(1):171−174.
[14] CHEN Zhao-yong, ZHU Hua-li, JI Shan, et al.Influence of carbon sources on electrochemical performances of LiFePO4/C composites[J].Solid State Ionics, 2008, 179(27/32): 1810−1815.
[15] 张宝, 彭春丽, 王志兴, 等.加碳方式对磷酸铁锂动力学及电化学性能的影响[J].中南大学学报: 自然科学版, 2007, 38(5):863−866.ZHANG Bao, PENG Chun-li, WANG Zhi-xing, et al.Electrochemical properties of LiFePO4/C for cathode materials of lithium ion batteries[J].Journal of Central South University:Science and Technology, 2007, 38(5): 863−866.
