合成聚-β-羟基丁酸芽孢杆菌的筛选、鉴定及碳氮源优化*
2010-01-11蒋冬花
周 琴, 蒋冬花, 杨 叶, 嵇 豪
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
聚-β-羟基丁酸(PHB)是细胞内的一类生物聚酯,其力学性质与一些热塑性材料如聚丙烯相似,并且可以被微生物完全降解,因而被称之为“生物可降解塑料”,是真正的环境友好型产品[1-2].研究生物可降解塑料以替代化学合成塑料,可以帮助我们解决塑料污染问题,节约能源,实现资源与环境的可持续发展[3].PHB是微生物在碳、氮等营养失衡的条件下合成的碳源与能源的高分子储存物(分子量为50 000~1 000 000)[4-5].作为微生物合成的可降解材料,PHB除了具有与化学合成高分子相似的理化性质外,还具有一般化学合成高分子所没有的性质,如光学活性、低透氧性、抗紫外辐射、生物可降解性、生物相容性、压电性和抗凝血性等[6-7],在工业、农业、环保、食品、医药等领域具有十分广阔的应用前景.如在医疗领域,PHB可以作为药物基质植入人体,以控制药物的释放,且最终降解产物为β-羟基丁酸,没有任何毒副作用[8-9].目前,PHB生产菌株主要有真养产碱杆菌(Alcaligeneseutrophus),肥大产碱杆菌(Alcaligeneslatus),巨大芽孢杆菌(Bacillusmegaterium),极端嗜盐菌(Halobacterium),等等[10].其中真养产碱杆菌是研究最多的PHB生产菌种,转基因大肠杆菌(Escherichiacoli)将成为PHB生产的重要工程菌种[11].
尽管PHB具有代替石油衍生物生产塑料的优势,但是利用PHB生产可降解塑料的方法受到了限制,原因在于其价格昂贵[12-13].降低PHB生产成本的主要途径有2条:一是通过微生物如巨大芽孢杆菌、重组大肠杆菌的菌体量的提高,以及菌体PHB含量的提高,使提取PHB的成本降低;二是通过降低培养基原料的成本,使PHB生产成本降低.不同的培养基会使PHB积累量不同[14],并且PHB的合成受到了环境中C、N等的限制[15].因此,人们对这类微生物碳氮源优化做了一系列实验研究.一般产物产量的持续提高证明了发酵条件优化的成功性[16].
本实验从环境比较恶劣的污泥中筛选具有良好抗逆性的芽孢杆菌菌株,主要依据是PHB可用作碳源和能源的储备物,并且PHB的存在可以增强细胞对逆境的抵抗力, PHB可以作为碳源被细胞利用,以防止细胞自溶和死亡[5].由于PHB存在的特殊意义,一般抗逆性较强的菌株中PHB比较容易积累,这为筛选得到高产PHB的菌株奠定了一定的基础.本实验通过筛选菌株,得到较高产PHB的菌株;并且通过培养基碳氮源优化,希望能使产PHB的菌株大量生长,PHB含量提高,同时考虑培养基原料成本,以降低PHB生产成本.
1 实验部分
1.1 实验材料
芽孢杆菌菌株分离筛选自浙江省各地(绍兴、宁波、金华、杭州、台州、丽水、温州、嘉兴、嵊州、义乌)采集的土壤.土壤主要来源有河底淤泥、花坛土壤、菜地土壤、排污口岸泥土等.高产聚-β-羟基丁酸的芽孢杆菌从金华排污口岸泥土分离得到.
1.2 主要仪器和试剂
聚-β-羟基丁酸(Sigma公司),苏丹黑(上海生工生物工程有限公司).LRH-280生化培养箱(广东仪器设备厂),C24KC摇床(美国New Brunswick公司),MIKRO-22R离心机(德国Eppendorf公司),PB-10 pH计(德国Sartorius公司),UV-7504分光光度计(上海欣茂仪器有限公司),电子显微镜(德国Leica公司).
1.3 培养基
1)牛肉膏蛋白胨培养基[17]:牛肉膏3 g/L,蛋白胨5 g/L,NaCl 1 g/L,琼脂20 g/L,pH 7.2~7.4.用于菌种分离.
2)种子培养基:牛肉膏25 g/L,蛋白胨10 g/L,NaCl 5 g/L,pH 7.4.
3)发酵培养基[18]:蔗糖10 g/L,牛肉膏5 g/L,MgSO4·7H2O 0.2 g/L,CaCl20.05 g/L,FeCl30.01 g/L,K2HPO40.04 g/L,KH2PO40.03 g/L,NaH2PO4·2H2O 0.05 g/L,H3BO30.005 g/L,pH 7.8.
1.4 菌株分离和培养方法
1.4.1 菌种分离纯化和初筛
取0.2 g污泥土,加入5 mL蒸馏水,85 ℃加热15 min,进行10-1~10-4梯度稀释,选择10-2浓度的溶液100 μL涂布于牛肉膏蛋白胨培养基平板上,30 ℃培养24 h,出现圆形乳白色菌落;挑取单菌落,进一步分离、纯化后,获得纯菌株.用苏丹黑染色初步筛选产生PHB菌株,编号并保存.
1.4.2 种子培养
挑取苏丹黑染色初筛得到的纯菌株单菌落接种于150 mL锥形瓶(含30 mL种子培养基)中,30 ℃,200 r/min培养24 h,用作发酵种子.
1.4.3 发酵培养
将80 mL发酵培养基装入250 mL锥形瓶中,按8%接种发酵种子,30 ℃,200 r/min培养40 h用于PHB的定量分析.
1.5 定量分析
1.5.1 PHB的初步定量
用苏丹黑染色法[5,19].将少许细菌热固定于载玻片上后,用3 g/L苏丹黑乙二醇溶液染色10~15 min,二甲苯浸泡脱色,再用5 g/L番红水溶液复染30 s.置油镜下观察,PHB颗粒呈蓝黑色,菌体呈红色.
1.5.2 PHB的精确定量
按Law和Slepecky法[20]对PHB进行定量分析.经培养、离心获得的菌体细胞用V(CHCl3)∶V(无水乙醇)=2∶1抽提液60 ℃抽提1 h后,用浓硫酸于100 ℃处理10 min,用紫外分光光度计在235 nm波长下测定吸光度值.
经PHB标准品的标准曲线测定,得到标准曲线方程为
Y=0.173 4X,R2=0.998 7.
其中:Y代表吸光度;X代表PHB的质量浓度,单位为μg/L.根据菌体中提取PHB的吸光度,计算菌体中PHB的含量.
1.5.3 菌体干质量的测定
50 mL发酵培养液经10 000 r/min离心5 min,沉淀的菌体用蒸馏水洗3遍,80 ℃烘箱烘干至恒重,之后转化为每1 L发酵液中菌体的质量.
1.6 菌株的鉴定
1.6.1 形态特征观察
牛肉膏蛋白胨培养基平板上28 ℃培养48 h,观察菌落特征;培养24 h进行革兰氏染色,观察菌体形态及染色结果[21].
1.6.2 生理生化实验
Methyl-Red(M. R.)实验、Vagex-Proskauer(V. P.)实验、淀粉水解实验、明胶水解实验、吲哚实验、H2S实验、硝酸还原实验、卵磷脂水解实验、碳源利用实验和氮源利用实验,分别参照文献[21-22]的方法进行.
1.6.3 16S rRNA的PCR扩增、序列测定和系统发育分析
用UNIQ-10细菌基因组DNA抽提试剂盒提取样品的基因组DNA.采用16S rDNA正反向通用引物[23]:5-AGAGTTTGATCCTGGCTCAG-3和5-AAGGAGGTGATCCAGCCGCA-3,用Pfu酶进行PCR扩增.PCR扩增程序为:98 ℃ 5 min,95 ℃ 35 s,55 ℃ 35 s,72 ℃ 1 min,35个循环;72 ℃ 4 min.扩增产物经纯化后连入克隆载体pMD18-T,由上海生物工程技术有限公司完成测序.将测得的基因序列通过Blast程序与GenBank中核酸数据库(http://www.ncbi.nlm.nih.gov/blast)进行对比分析,并利用MEGA4以N-J法绘制系统发育树.
2 结 果
2.1 产PHB芽孢杆菌菌株的分离、纯化和筛选
通过分离、纯化和初步鉴定,共获得416株芽孢杆菌,经苏丹黑染色初步定量,得到产生PHB的量较高的48株芽孢杆菌,筛选得到的最高产PHB的芽孢杆菌Bm-10的苏丹黑染色结果见图1.将筛选出的各菌株接入发酵培养液中培养40 h后,用紫外分光光度计分析测定菌体细胞中PHB含量,每个地区取样泥土中分离筛选得到的最高产PHB菌株中PHB含量的比较见图2.从图2可以看出,不同的芽孢杆菌菌株菌体产生PHB的能力有较大的差异,其中Bm-10菌株PHB产量最高达0.763 g/L.
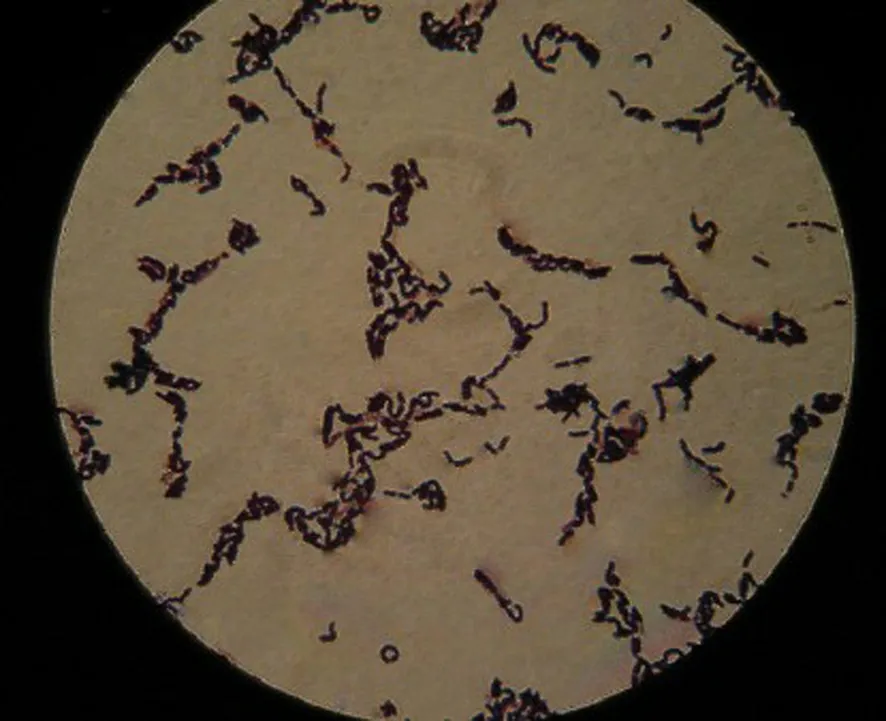
图1 芽孢杆菌Bm-10菌体的苏丹黑染色

图2 10株芽孢杆菌菌体中PHB含量
2.2 碳氮源对Bm-10菌株PHB产量的影响
2.2.1 氮源对Bm-10菌株PHB产量的影响
在发酵培养液中加入不同的氮源,30 ℃摇瓶培养40 h,测定菌体生长量及PHB积累情况.实验结果(见表1)表明:有机氮源有利于菌体生长,牛肉膏相对蛋白胨而言更有利于PHB的积累;一般无机氮源不利于菌体的生长,并且胞内PHB含量相对较低,虽然硝酸钠为氮源时菌体长势良好,但极不利于PHB的积累.由于牛肉膏作为氮源时PHB产率显著高于其他氮源,因此选择牛肉膏作为该菌株积累PHB的氮源.
2.2.2 碳源对Bm-10菌株PHB产量的影响
碳源对Bm-10菌株菌体生长及PHB积累的影响见表2.由表2可见:以葡萄糖为碳源时菌体生长良好,PHB积累量相对较高;而以丁酸为碳源时,菌体生长最差,PHB积累量也较低.从表2可以看出,蔗糖也比较有利于Bm-10菌体的生长与PHB的积累,但是PHB在菌体中所占的比例较低.因此,选择葡萄糖作为最佳碳源.
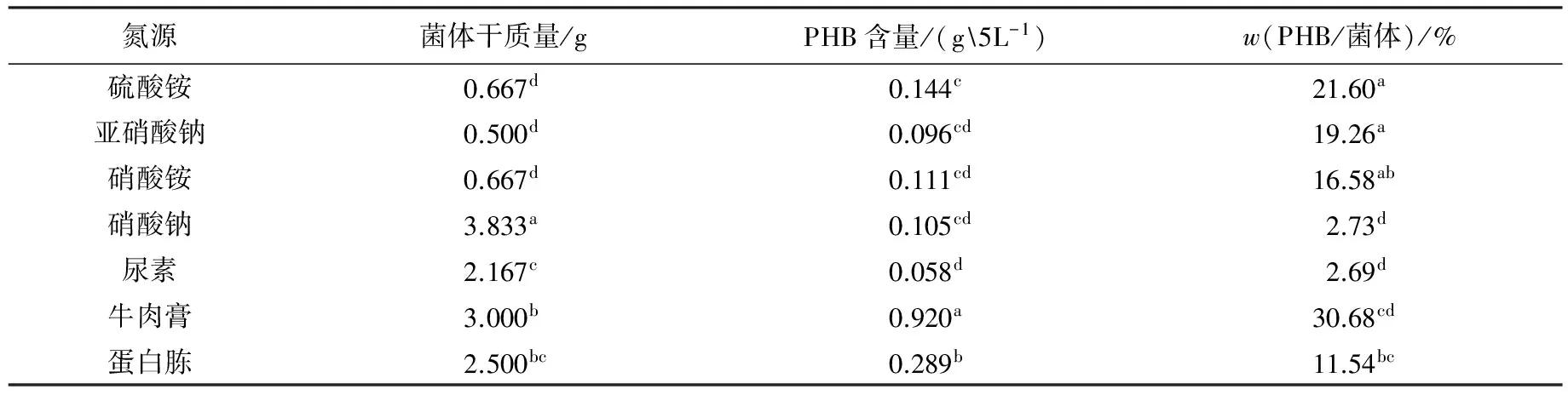
表1 氮源对Bm-10菌株菌体生长及PHB积累的影响
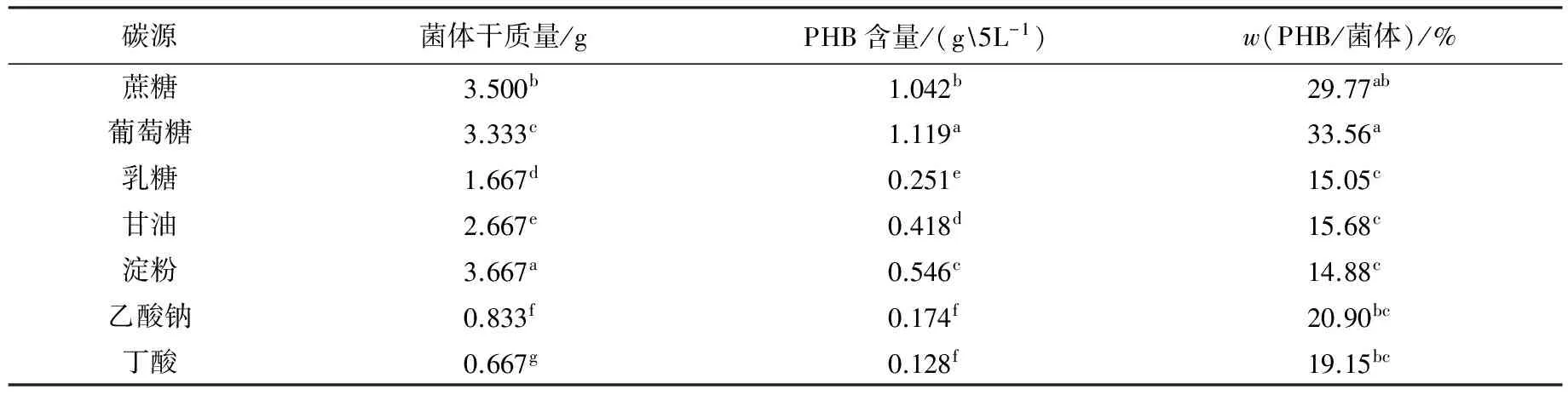
表2 碳源对Bm-10菌株菌体生长及PHB积累的影响
2.3 芽孢杆菌Bm-10菌株的鉴定
2.3.1 形态特征
Bm-10菌株在牛肉膏蛋白胨培养基平板上培养24 h后,菌落呈乳白色,表面和边缘光滑,圆形不透明,直径为0.2~0.4 cm(见图3(a)).显微镜观察菌体细胞呈杆状或近椭圆形杆状,粗大,长度为2.0~4.5 μm,宽度为1.0~1.2 μm,趋于扭曲的短链,周生鞭毛,具运动性(见图3(b)),革兰氏染色呈阳性.
2.3.2 生理生化特征
Bm-10菌株的生理生化特征和生长条件实验结果见表3和表4.根据Bm-10菌株的表型特征、生长条件实验和生理生化特性实验,参考文献[24],初步鉴定Bm-10菌株属于芽孢杆菌科.
2.3.3 16S rDNA基因序列
Bm-10菌株基因组DNA的提取结果见图4(a).采用细菌的16S rDNA通用引物进行PCR扩增,获得一长度为1 513 bp的基因(见图4(b)),序列测定由上海生物工程技术公司完成.
基于16S rDNA 序列分析进行细菌鉴定是国际上通用的鉴定技术.一般认为:16S rRNA序列同源性小于98%,可以认为种不同;同源性小于93%~95%,可以认为属不同[25].将Bm-10菌株16S rDNA基因序列通过Blast比对分析,Bm-10菌株与巨大芽孢杆菌1431的遗传距离最小,同源性高达99.7%.基于16S rDNA基因序列建立的芽孢杆菌属系统发育树见图5.故将Bm-10菌株鉴定为巨大芽孢杆菌(Bacillusmegaterium).

(a)菌落特征

(b)菌体细胞形态

表3 芽孢杆菌Bm-10菌株的生理生化特征

表4 芽孢杆菌Bm-10菌株的生长条件
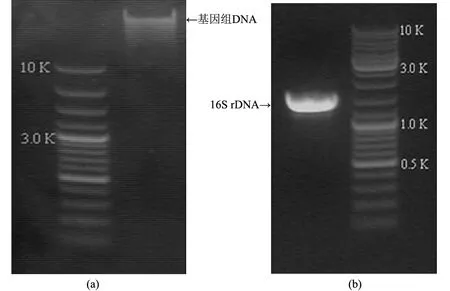
图4 Bm-10菌株电泳分析结果
3 讨 论
从污泥中筛选高产聚-β-羟基丁酸菌株,得到了一株PHB生产能力较好的菌株——芽孢杆菌Bm-10.
在Bm-10菌株氮源优化中,牛肉膏作为氮源时PHB产率显著高于其他氮源,因此选择牛肉膏作为该菌株积累PHB的氮源.牛肉膏作为有机氮源,相对无机氮源而言,含有多种营养成分,有利于菌体的生长及PHB的积累.碳源优化实验结果表明,葡萄糖是Bm-10菌株菌体生长和合成PHB的最适碳源.葡萄糖利于菌体生长和PHB积累的原因可能是葡萄糖容易被细菌利用进入TCA循环,在TCA循环中生成乙酰辅酶A,之后经过PHB合成途径形成PHB.
对Bm-10菌株进行了一般传统方法的鉴定——形态鉴定及生理生化鉴定,并为了得到可靠的结果,对该菌株也进行了16S rDNA基因序列鉴定.经过双重认定,确定该菌株为巨大芽孢杆菌(Bacillusmegaterium).
本实验于浙江金华污泥中分离筛选出一株巨大芽孢杆菌(Bm-10菌株),该菌的16S rRNA基因序列已登录于Genbank,登录号为GQ866974.该菌在牛肉膏蛋白胨培养基中不仅生长迅速,而且胞内能产生大量的PHB聚合物颗粒,PHB的积累量占菌体干质量的33.56%.该菌经过培养基继续优化、上罐条件优化,将有望进一步开发成PHB新型生产菌.
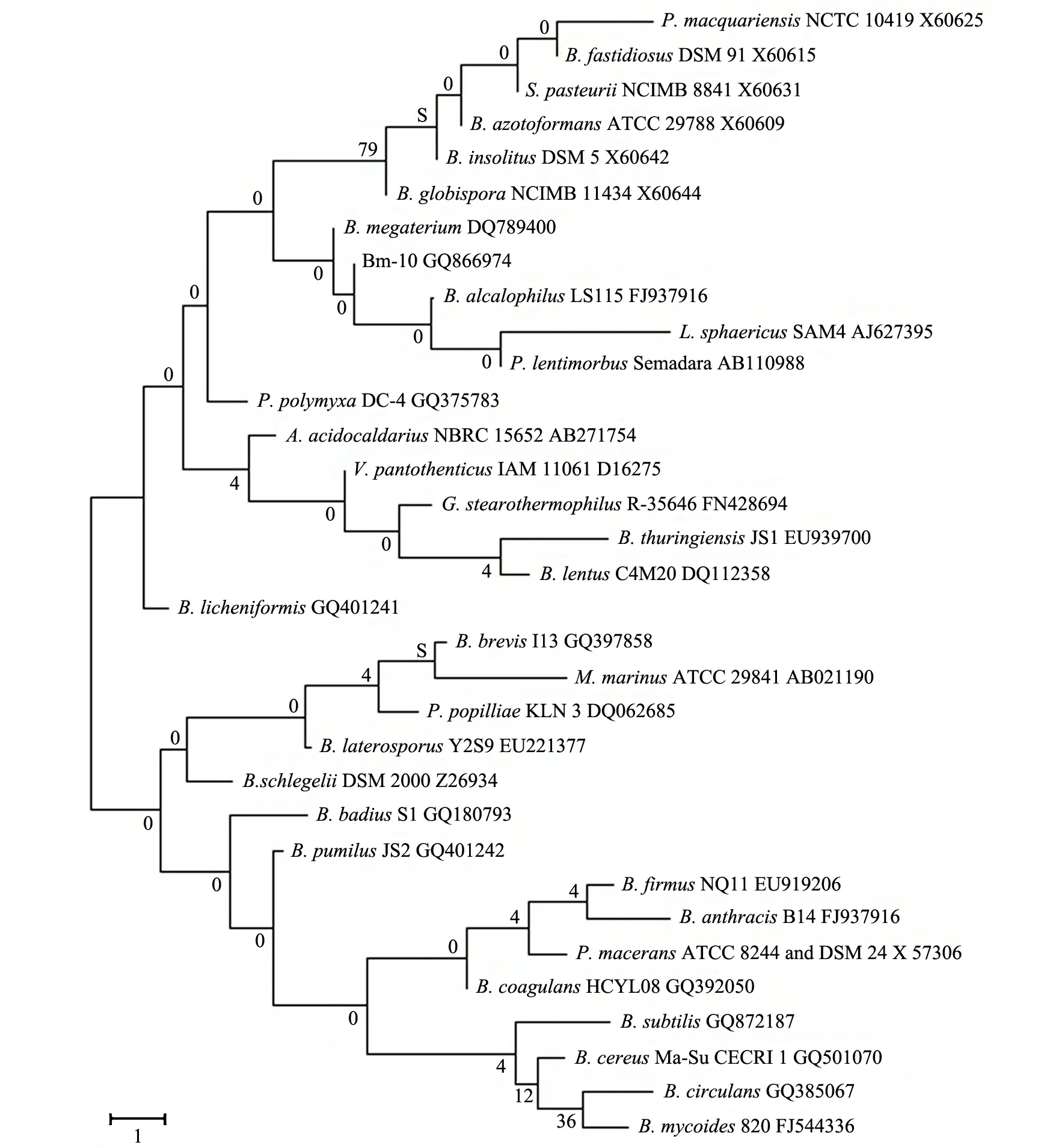
图5 基于16S rDNA基因序列建立的芽孢杆菌属系统发育树
[1]Brandl H,Gross R A,Lenz R W,et al.Plastics from bacteria and for bacteria:poly(β-hydroxyalkanoates) as natural,biocompatible,and biodegradable polyesters[J].Adv Biochem Eng Biotechnol,1990,41:77-93.
[2]Birgit G,Dieter J.Assay of poly(3-hydroxybutyrate) depolymerase activity and product determination[J].Applied and Environmental Microbiology,2006,72(9):6094-6100.
[3]Luengo J M,Garcia B,Sandoval A,et al.Bioplastics from microorganisms[J].Current Opinion in Microbiology,2003,6(3):251-260.
[4]郭秀君,于昕.一种新型生物塑料(PHB)的研究进展和开发前景[J].生物工程进展,1997,17(5):61-65.
[5]Khanna S,Srivastava A K.Recent advances in microbial polyhydroxyalkanoates[J].Process Biochemistry,2005,40(2):607-619.
[6]Bruce A R,Kanda L.Production of poly(3-hydroxybutyric-C0-β-hydroxy-valeric) acids[J].Applied and Environmental Microbiology,1990,56(7):2093-2098.
[7]Roland G L,Gjalt W H,Hans P,et al.Formation of polyesters byPseudomonasoleovorans:effect of substrates on formation and composition of poly-(R)-3-hydroxyalkanoates and poly-(R)-3-hydroxyalkenoates[J].Applied and Environment Microbiology,1988,54(12):2924-2932.
[8]许天开,赵树杰.PHB在生物医学中的应用研究进展[J].应用与环境生物学报,1995,1(1):85-91.
[9]Freed L E.Composition of cell-polymer cartilage implants[J].Biotechnology and Bioengineering,1994,43(7):605-614.
[10]苏涛,周河治,梁静娟.微生物合成可降解塑料聚羟基链烷酸(PHA)[J].工业微生物,1997,27(3):37-44.
[11]Aoyama T,Carlos A J,Saito H,et al.Strain recovery mechanism of PBT/rubber thermoplastic elastomer[J].Polymer,1999,40(13):3657-3663.
[12]Taguchi S,Doi Y.Evolution of polyhydroxyalkanoate (PHA) production system by "enzyme evolution":successful case studies of directed evolution[J].Macromolecular Bioscience,2004,4(3):146-156.
[13]Nomura C T,Taguchi S.PHA synthetase engineering towards super biocatalysts for custom-made biopolymers[J].Applied Microbiology and Biotechnology,2006,73(5):969-979.
[14]Hsieh W C,Wada Y,Chang C P.Fermentation,biodegradation and tensile strength of poly(3-hydroxybutyrateco-4-hydroxybutyrate) synthesized byDelftiaacidovorans[J].Journal of the Taiwan Institute of Chemical Engineers,2009,40(2):143-147.
[15]Braunegg G,Lefebvre G,Genser K F.Polyhydroxyalkanoates,biopolyesters from renewable resources:physiological and engineering aspects[J].Journal of Biotechnology,1998,65(2/3):127-161.
[16]Choi K H,Chisti Y,Moo-Young M.Comparative evaluation of hydrodynamic and gas-liquid mass transfer characteristics in bubble column and airlift slurry reactors[J].The Chemical Engineering Journal,1996,62:223-229.
[17]李顺鹏.微生物学实验指导[M].北京:中国农业出版社,2003:111-112.
[18]陈接锋.产聚β-羟基丁酸球衣菌分离筛选及发酵和提取的研究[D].福州:福建师范大学生物工程学院,2003.
[19]Singheton P,Sainsbury D.Dictionary of Microbiology and Molecular Biology[M].2nd ed.New York:John Wiley and Sons Inc,1988:854.
[20]Law J H,Slepecky R A.Assay of poly-hydroxybutyric acid[J].Journal of Bacteriology,1961,82(1):33-36.
[21]纪忠.微生物分类学[M].上海:复旦大学出版社,1990:4-6.
[22]Priest F G,Goodfellow M,Todd C.A numerical classification of the genus bacillus[J].J Gen Microbiol,1988,134(7):1847-1882.
[23]宋聪,李正国,边万平,等.果实采后病害拮抗菌的筛选及鉴定[J].西南师范大学学报:自然科学版,2007,32(2):76-81.
[24]布坎南 R E,吉本斯 N E.伯杰细菌鉴定手册[M].中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组,译.北京:科学出版社,1984:729-794.
[25]Fry N K,Warwick S,Saunders N A,et al.The use of 16S ribosomal RNA analyses to investigate the phylogeny of the familyLegionellaceae[J].Journal of General Microbiology,1991,137(5):1215-1222.
