酵母转化茄尼醇生成辅酶Q10的超临界CO2体系条件
2010-01-09肖霄倪元颖李淑燕胡锦荣张京声孙君社
肖霄, 倪元颖, 李淑燕, 胡锦荣, 张京声, 孙君社, 刘 萍
(中国农业大学食品科学与营养工程学院,北京 100083)
酵母转化茄尼醇生成辅酶Q10的超临界CO2体系条件
肖霄, 倪元颖, 李淑燕, 胡锦荣, 张京声, 孙君社, 刘 萍*
(中国农业大学食品科学与营养工程学院,北京 100083)
超临界CO2作为非水相介质对酵母转化茄尼醇生成辅酶Q10的底物和产物具有良好的溶解作用,但对微生物的存在会产生一定影响,选择合适的超临界CO2体系条件有利于辅酶Q10产量的提高。通过研究超临界CO2流体的压强、酵母细胞在超临界CO2流体中的反应时间、添加介质种类以及添加量等条件对粟酒裂殖酵母细胞活性和辅酶Q10产量的影响,确定对酵母细胞生存影响较小并显著促进辅酶Q10生产的超临界CO2体系条件为:超临界CO2压强为10.5 M Pa,反应时间为16 h,向菌体中添加菌体湿重3倍的培养基,超临界CO2流体中辅酶Q10的产量达到55.71μg/m L。比液体深层发酵培养辅酶Q10产量提高97.5%。研究结果表明,通过优化酵母转化茄尼醇生成辅酶Q10的超临界CO2体系条件,可以显著提高酵母细胞生成辅酶Q10的能力。
超临界CO2流体;菌体活性;辅酶Q10;茄尼醇;体系条件
辅酶Q10(CoQ10)是呼吸链上一个脂溶性的辅酶,参与呼吸链中的电子和质子传递,且其还原型醌环结构可以有效地清除自由基,被广泛地应用于医药、食品添加剂等领域[1]。茄尼醇与辅酶Q10的侧链——异戊二烯焦磷酸在结构上有一定的相似性,这为茄尼醇作为前体物质实现CoQ10的微生物转化提供了理论基础[2-3]。作者所在的研究组前期研究发现,利用生物转化法可以将茄尼醇直接转化为CoQ10,但由于茄尼醇不溶于水,限制了其进入酵母细胞,显著影响该物质的转化率,而生成的产物辅酶Q10也微溶于水,产物在细胞内的积累显著地抑制其产量的进一步提高。超临界CO2流体具有良好的溶解能力和传质特性,Comp ton等[4]在超临界流体中进行了皱褶假丝酵母(Candidarugosa)脂肪酶催化胆甾醇和乙烯乙酸酯的转酯化反应研究,胆甾醇在超临界乙烷中的溶解度提高了600多倍。因此超临界CO2流体可以一定程度上缓解反应的产物抑制作用,但超临界CO2流体对微生物的发酵过程产生的影响说法不一[5-6]。有关粟酒裂殖酵母在超临界体系中的存活及其转化茄尼醇生产辅酶Q10的情况在国内外未见报道,本研究结果可为辅酶Q10的生产提供新的方法。
1 材料与方法
1.1 材料与设备
粟酒裂殖酵母(Schizosaccharom yce spromb)2·1794,原菌种购自中科院微生物所,经作者所在研究室紫外联合亚硝基胍诱变获得能够转化茄尼醇生成CoQ10的菌株S.prombB2·1794-23。HA 121-50-02超临界设备购自江苏南通华安超临界萃取公司,反应釜体积为5 L。CO2(纯度99.99%)购自北京京城气体。Agilent A 1200液相色谱系统购自安捷伦公司,配有SPD紫外检测器。
1.2 主要培养基
种子活化培养基(组分g/dL):葡萄糖 2,蛋白胨 2,酵母浸提物 1;p H 6.0。
发酵培养基(组分 g/dL):葡萄糖 1.5,蔗糖1.5,蛋白胨 1.0,酵母膏 1.0 ,M gSO40.01,K2HPO40.01,KH2PO40.01;p H 5.0。
1.3 菌体培养物的制备
将粟酒裂殖酵母S.prombB2·1794-23接于种子培养基中,在28 ℃下,以160 r/min振荡培养18 h至对数生长期,以体积分数10%的接种量将种子接入100 mL发酵培养基(装于250 m L三角瓶),28℃条件下以160 r/m in振荡培养18 h至对数生长期。将上述所得发酵液分别装入编好序号的50 m L离心管中,每管30 mL,以4 000 r/min离心收集菌体,用生理盐水洗涤2次,滤纸上倒置10 s,称重。
1.4 细胞存活率的测定方法
血球计数板结合美兰染色法。
1.5 辅酶 Q10的提取及检测方法
从超临界CO2体系中取出的细胞,用生理盐水洗涤一次,以4 000 r/min离心收集菌体,每管中加入10 m L pH 6.0、0.1 mol/L的磷酸缓冲液,加入15 uLβ-巯基乙醇,37℃下置于220 r/min摇床反应1 h;然后每管中加入质量分数2%的蜗牛酶,相同条件摇床中反应3 h。将每管离心收集菌体,加入10 m L丙酮,涡旋混匀后冰浴超声破碎细胞,超声功率300 W,超声5 s,间歇6 s,超声60次。破碎后以4 000 r/min离心,将上清液倒入圆底烧瓶中真空旋转蒸发,用 5 m L无水乙醇定容待测。HPLC检测条件:色谱柱为150 mm×4.6 mm,直径为5μm的Agilent C18柱,流动相为无水V乙醇∶V水=98∶2,流速 1 mL/min,检测波长 275 nm,进样量20μL,柱温28 ℃。
2 结果与讨论
2.1 超临界CO2条件下反应时间对辅酶 Q10产生菌活性以及辅酶Q10产量的影响
在超临界设备反应釜内放入收集到的菌体,在温度为31℃、压强为7.5 M Pa条件下,分别保压1、3、5、8、16、19 h 后 ,按 0.25 M Pa/min 的速度卸压(以此速度卸压可能导致细胞破裂,但由于卸压时预期转化过程已结束,因此不影响所考察过程的结果),测得菌体细胞存活率和辅酶Q10产量。结果表明,在19 h内,细胞存活率变化不大,仅在1~3 h及16~19 h时存活率略低于5~16 h,这可能由于前3个小时是细胞适应高压厌氧环境的过程,16~19 h由于长时间处于超临界CO2高压厌氧环境中,细胞中积累的营养物质被迅速消耗,一些代谢酶活性降低,导致部分细胞死亡,且活细胞的繁殖能力有所下降,因此导致细胞存活率降低。1~16 h辅酶Q10产量一直呈上升趋势,前5小时上升速率较快,可能由于1~3 h细胞处于适应高压厌氧环境的阶段,在胁迫环境中会生成大量辅酶Q10用于保护线粒体呼吸链[7-8]。3 h后,细胞度过适应期并大量繁殖,因此辅酶Q10迅速积累,在16 h时达到42.36μg/m L。16 h后辅酶Q10产量开始下降,可能由于细胞总数、细胞存活率及部分代谢酶活性都在下降而导致,见图1。
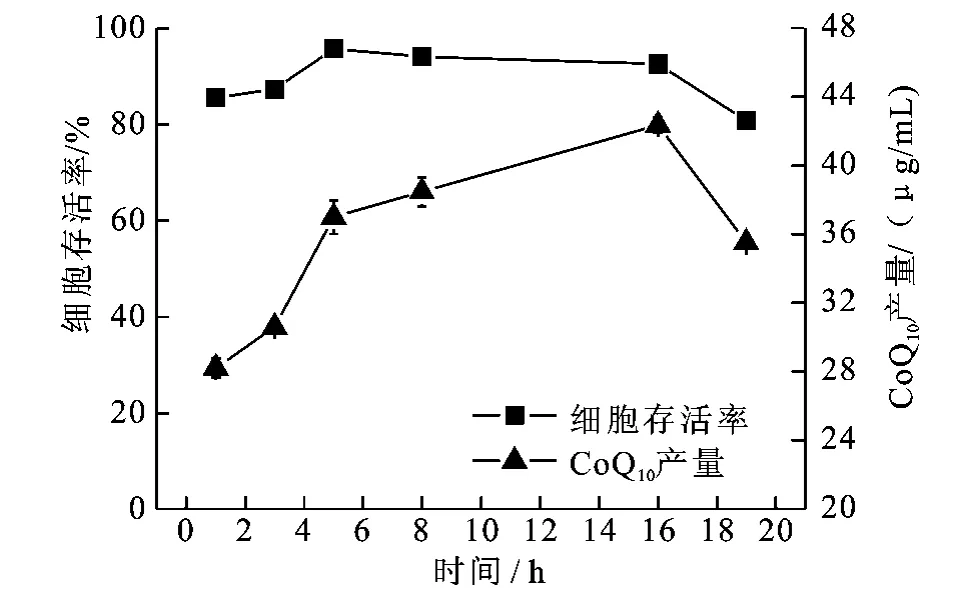
图1 反应时间对细胞存活率及辅酶Q10产量的影响Fig.1 Effects of reaction time in scCO2 on cells survival and CoQ10 yield
2.2 超临界CO2压强对辅酶 Q10产生菌活性以及辅酶 Q10产量的影响
将收集到的细胞放入31℃超临界 CO2体系下 ,分别在压强为 7.5、9、10.5、13.5 M Pa 时保压反应8 h,按0.25 M Pa/m in的速度卸压,然后测定菌体细胞存活率和辅酶Q10产量。结果见图2。
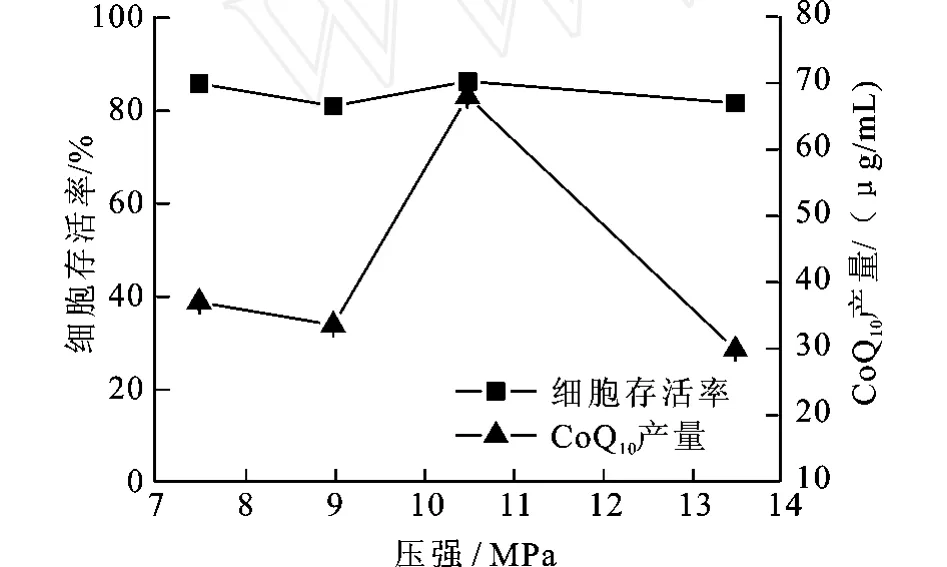
图2 超临界CO2压强对细胞存活率及辅酶 Q10产量的影响Fig.2 Effects of reaction pressure in scCO2 on cells survival and CoQ10 yield
细胞存活率随压强没有明显变化,可能是在31℃条件下,压强达到7.5 M Pa以上,CO2都以超临界流体的形式存在,对细胞存活影响的差异不大。Debs-Louka等人[9]以粪链球菌、啤酒酵母、埃希氏大肠杆菌3种微生物为研究对象,发现3种微生物的失活速度在3.5 M Pa以下对压强的变化不敏感。Lin H-M等人发现不同微生物细胞对CO2作用的抵抗力不同,这可能由于不同微生物的细胞壁、细胞膜特性不同,对CO2分子的透过性不同。在压强低于13.5 M Pa时,粟酒裂殖酵母细胞对压强变化不敏感,细胞存活率维持在80%~86%。辅酶Q10产量在压强为10.5 M Pa时达到最大,可能由于在10.5 M Pa条件下,超临界CO2流体对辅酶Q10的溶解性较好,能更好的消除产物抑制作用,利于辅酶Q10的生成,且在此压强下细胞存活率为86%,说明大部分细胞可以保持良好的生理活性,因此选择超临界CO2体系的压强为10.5 M Pa时进行反应。
2.3 超临界CO2体系中反应介质种类及添加量对辅酶 Q10产生菌活性以及辅酶Q10产量的影响
在收集的菌体中分别加入每管菌体湿重1~4倍的蒸馏水、生理盐水、培养基作为反应介质,将其放在超临界设备反应釜内,在温度31℃、压强7.5 M Pa条件下保持不同时间后,按0.25 M Pa/min的速度卸压,测得菌体细胞存活率和辅酶Q10产量,结果见图3。
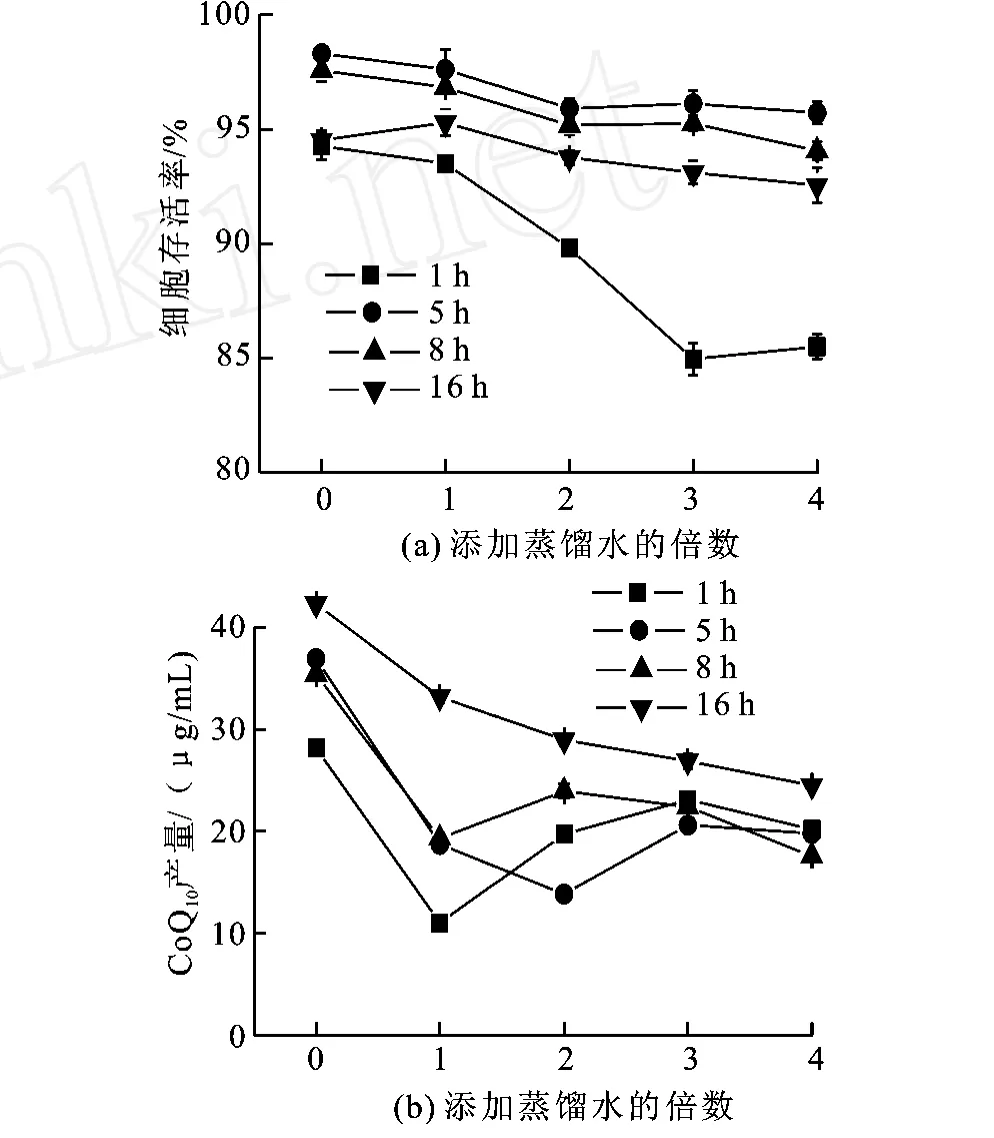
图3 不同反应时间下蒸馏水添加量对细胞存活率及辅酶 Q10产量的影响Fig.3 Effects of distilled water in scCO2 on cellssurvival and CoQ10 yield
随着蒸馏水添加量的增加,细胞存活率与辅酶Q10产量都大致呈下降趋势,在1、5、8 h时,辅酶Q10产量虽有波动,但总体都低于未添加蒸馏水的样品。由此说明,在该超临界CO2体系下,添加蒸馏水不利于菌体保持活性,并相应使辅酶Q10产量减少。原因可能是在超临界状态下含水量增大对细胞膜透性有一定影响,CO2较容易通过细胞膜,进入菌体内,导致细胞内的p H值下降和酶失活。
在1 h和16 h条件下,细胞存活率随着生理盐水添加量的增加呈略微下降趋势;在5 h和8 h条件下,分别在添加3倍和1倍质量的生理盐水时,细胞存活率略有升高。在辅酶Q10产量方面,与对照未添加生理盐水的样品相比,8 h添加2倍生理盐水时,辅酶Q10产量有较大幅度提高,1 h和5 h影响不明显,16 h虽然在添加3倍生理盐水时与其他添加量有明显提高,但比对照未添加生理盐水时作用不明显。出现上述结果的原因可能是在超临界条件下,生理盐水中的钠离子和氯离子在细胞生命代谢中起重要作用,Na+影响细胞内外的渗透压和电化学梯度平衡,刺激代谢产物 H+释放到胞液中,改变细胞内外局部的p H值,影响相关酶活,见图4。

图4 不同反应时间下生理盐水添加量对细胞存活率及辅酶 Q10产量的影响Fig.4 Effects of normal saline in scCO2 on cells survival and CoQ10 yield
在1 h条件下,细胞存活率随着培养基添加量的增加缓慢降低,辅酶Q10产量基本保持平稳;5 h和8 h条件下添加1倍培养基,细胞存活率略高于其他培养基添加量条件,辅酶Q10产量都随培养基添加量升高呈下降趋势后又明显升高。16 h添加1倍培养基时,细胞存活率明显下降,之后随添加量增加变化不大,辅酶Q10产量在添加1倍培养基时亦明显下降,添加3倍培养基时达到最高,为55.71μg/m L。图5可能由于细胞在放入超临界CO2体系较短时间内,未能适应环境变化,另外细胞培养过程中贮存的营养物质还未被消耗掉,所以培养基中营养物质对保持其活性的作用不大。随着反应时间的增长,细胞体内原有的营养物质被消耗,需要培养基补充保持活性和生产辅酶Q10所需营养物质。
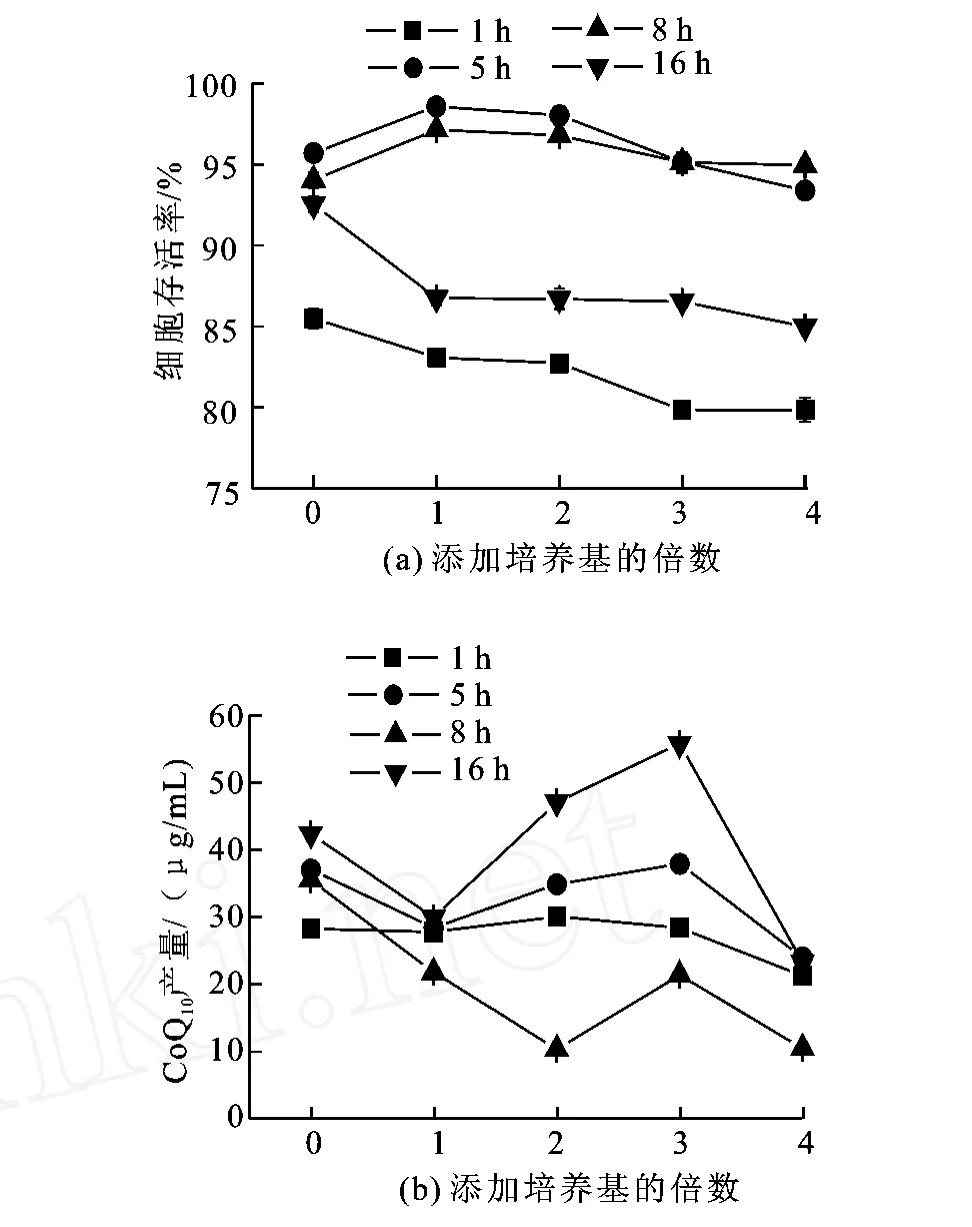
图5 不同反应时间下培养基添加量对细胞存活率及辅酶 Q10产量的影响Fig.5 Effects of culture medium in scCO2 on cells survival and CoQ10 yield
2.4 超临界CO2体系与液体深层培养对辅酶 Q10产生菌活性以及辅酶 Q10产量的影响
将收集到的菌体中加入菌体湿重3倍的培养基,一组放入摇床中于28℃条件下,以160 r/min振荡培养16 h;另外一组放入超临界设备反应釜内,在31 ℃、压强7.5 M Pa条件下保持16 h。将两组取出后测定细胞存活率和辅酶Q10产量,结果见图6。液体深层培养的酵母细胞存活率略高于超临界CO2体系,差异不明显,但超临界 CO2体系中的辅酶Q10产量比液体培养高出97.5%,证明经过优化后的超临界CO2体系条件可以明显地促进辅酶Q10产量的提高。
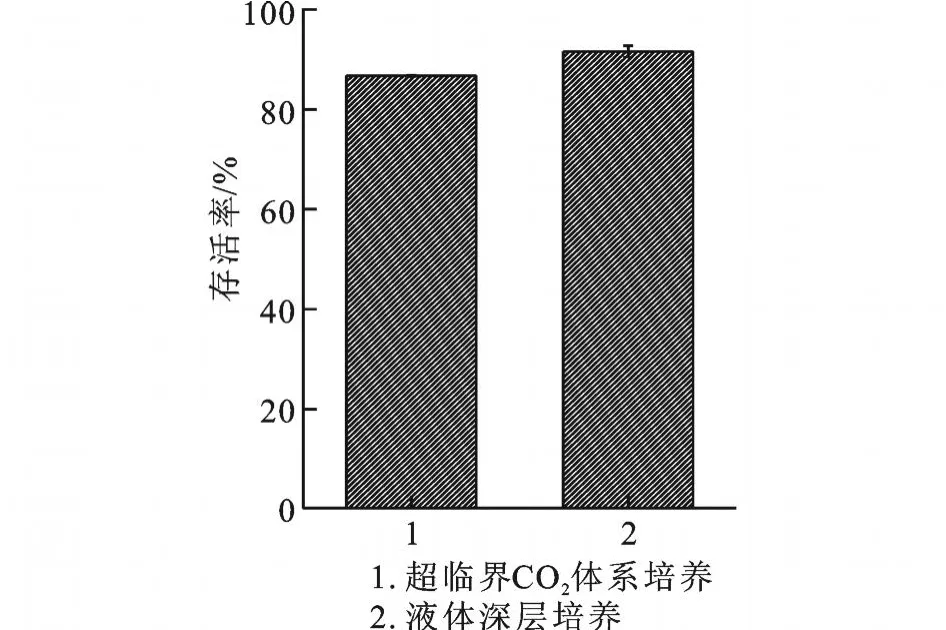

图6 超临界CO2体系与液体深层培养对细胞存活率及辅酶 Q10产量的影响Fig.6 Effects of scCO2 and liquid submerged culture on cells survival and CoQ10 yield
3 结 语
超临界CO2条件下,添加合适的介质如生理盐水和培养基将有利于细胞的存活和辅酶Q10的生成。有利于粟酒裂殖酵母转化茄尼醇生成辅酶Q10的超临界CO2条件是:压强10.5M Pa、反应时间16 h,添加湿菌体质量3倍的培养基,辅酶Q10产量比液体深层培养提高了97.5%。
(References):
[1]廖满媛,闫红,李佩衍.辅酶Q10的合成研究进展[J].北京工业大学学报,2002,28(2):155-159.
L IAO Man-yuan,YAN Hong,L IPei-yan.Progress of researeh on CoQ10synthesis[J].Journal of Beijing Polythchnic U-niversity,2002,28(2):155-159.(in Chinese)
[2]Comp ton D L,King JW.Lipase-catalyzed synthesis of triolein-based sunscreens in supercritical CO2[J].J Am Oil Chem Soc,2001,78(1):43-48.
[3]Wei C I,Balaban M O,Fernando S Y et al.Bacterial effect of high pressure CO2treatment on foods spiked withL isteriaorSalmonella[J].J Food Prot,1991,54(3):189-193.
[4]叶盛英,丁德坤,宋贤良,等.不同参数超临界CO2对乳酸菌活性的影响[J].农业工程学报,2007,23(2):218-222.
YE Sheng-ying,D INGDe-kun,SONG Xian-liang,et al.Effects of different parameters of supercritical CO2treatment on the mcrobial activity ofLactobacillus[J].Transactions of the CSAE,2007,23(2):218-222.(in Chinese)
[5]L IN Ho-mu,YANG Zhi-ying,CHEN Li-fu.Inactivation ofSaccharom yces cerevisiaeby supercritical and subcritical carbon dioxide[J].Biotechnol Prog,1992,8:458-461.
[6]陈坚,堵国成,卫功元,等.微生物重要代谢产物[M].北京:化学工业出版社,2005:149-150.
[7]黄建华,邱然,杨文洲,等.金属离子对啤酒酵母发酵中生成乳酸的影响[J].食品科技,2007,7:122-124.
HUANG Jian-hua,Q IU Ran,YANG Wen-zhou,et al.Effect of metal ionson lactic acid during yeast metabolism[J].Food Science and Technology,2007,7:122-124.(in Chinese)
[8]管敦仪.啤酒工业手册[M].北京:中国轻工业出版社,1998:144.
[9]袁静,魏泓.微生物发酵生产CoQ10的研究进展[J].氨基酸和生物资源,2004,26(1):53-56.
YUAN Jing,WEI Hong.Recent progress of ubiquinone-10 production by microbial fermentation[J].Amino Acids and Biotic Resources,2004,26(1):53-56.(in Chinese)
Supercritical CO2Conditions of CoQ10Biotransformation from Solanesol by Schizosaccharom yces prombe
XIAO Xiao, N I Yuan-ying, L IShu-yan, HU Jin-rong, ZHANG Jing-sheng,
SUN Jun-she, L IU Ping*
(College of Food Science and Nutritional Engineering,China Agricultural University,Beijing 100083,China)
Supercritical CO2(scCO2)as non-aqueous media could well dissolve substrates and products of coenzyme Q10(CoQ10)biotransformation reaction from solanesol,but it also had effects on microbial activity,so appropriate scCO2conditions could imp rove CoQ10yield.The effects of scCO2on the catalytic activity ofSchizosaccharom yces prombe(S.promb)and CoQ10yield in different conditions were studied. The appropriate scCO2conditions which could significantly promote the production of CoQ10and could have little negative effects on the cells survival was:triple of cells’wet weight of culture medium was added into the reaction system.,kept the pressure at 10.5 M Pa for 16 h,the production of CoQ10is 55.71μg/mL,imp roved 97.5%.The results showed that optimization of scCO2reaction system conditions could significantly imp rove the production of CoQ10.
supercritical carbon dioxide,cells activity,CoQ10,solanesol,conditions
*
刘萍(1970-),女,吉林省吉林市人,工学博士,副教授,主要研究方向为发酵工程和生物制药。Email:liuping@cau.edu.cn
TQ 464.8
A
1673-1689(2010)02-0302-05
2009-03-15
北京市自然科学基金项目(5062022)。
(责任编辑:李春丽)
