α2,8-唾液酸转移酶VI过量表达影响小鼠乳腺癌细胞基因表达的研究*
2010-01-08顾玉超于文功
时 瀚,顾玉超,徐 良,于文功
(中国海洋大学医药学院分子生物学实验室,山东青岛266003)
α2,8-唾液酸转移酶VI过量表达影响小鼠乳腺癌细胞基因表达的研究*
时 瀚,顾玉超,徐 良,于文功**
(中国海洋大学医药学院分子生物学实验室,山东青岛266003)
研究α2,8-唾液酸转移酶VI(Sixth type ofα2,8-sialyltransferase,ST8Sia VI)对乳腺癌细胞生物学功能的影响及其作用的分子机制。采用全基因组芯片技术检测ST8Sia VI过表达前后小鼠乳腺癌细胞4T1基因表达谱的差异;利用PathwayExplorer分析ST8Sia VI过表达前后对基因网络的影响。实验结果表明:ST8Sia VI过表达引起201个基因表达有差异,其中22个基因与肿瘤细胞的黏附、生长、运动、免疫和周期有关。另外,PathwayExplorer分析结果显示,差异表达基因涉及的最显著变化的基因网络是“依赖β -arrestin的G蛋白偶联受体(GPCR)信号通路”;进一步的实验结果证明该通路下游Raf蛋白的磷酸化水平在ST8Sia VI过表达细胞显著升高。上述结果为ST8Sia VI生物学功能的深入研究提供了前提。
唾液酸修饰;ST8Sia VI;基因表达;Raf激酶
唾液酸(Sialic acid)是带有负电荷的九碳糖,位于糖蛋白与糖鞘脂寡糖链末端,具有重要的生物学功能[1-2]。α2,8-唾液酸修饰的聚糖存在于脊椎动物成体、形成期和转化期胚胎细胞中[3]。至少有6种α2,8-唾液酸转移酶参与α2,8-唾液酸修饰。目前,多数研究针对糖鞘脂和糖蛋白N-聚糖α2,8-唾液酸修饰[4],而对O-聚糖的α2,8-唾液酸修饰研究较少[5]。O-聚糖在免疫应答、造血系统的发育及精卵结合等方面发挥重要作用[3]。小鼠ST8Sia VI基因2002年被克隆[6],其编码α2,8-唾液酸转移酶家族的1个新成员,也是本家族中第一个被报道的催化O-聚糖唾液酸修饰的糖基转移酶。该酶可在糖蛋白和糖鞘脂糖基非还原端NeuAcα2,3(6)Gal序列上添加1个α2,8连接的唾液酸,形成NeuAcα2,8NeuAc双唾液酸结构,但不形成寡聚或多聚唾液酸结构。另外,ST8Sia VI主要以糖蛋白上的O-聚糖为底物,而催化N-聚糖和糖鞘脂唾液酸修饰的活性较低。2005年,人ST8Sia VI(hST8Sia VI)基因被克隆[7],hST8Sia VI也能催化O-聚糖糖链末端形成双唾液酸结构。迄今为止,对ST8Sia VI的研究仅限于酶学性质方面,没有涉及ST8Sia VI对细胞生物学功能的影响[8]。
本研究首次在小鼠乳腺癌4T1细胞株中实现了ST8Sia VI基因过表达,并利用小鼠基因表达谱寡核苷酸芯片分析了ST8Sia VI过表达细胞株与对照细胞株差异表达的基因,对差异表达基因进行了功能归类,并在现有基因网络数据库搜索了ST8Sia VI显著相关的基因网络。
1 材料与方法
1.1 细胞与培养基
小鼠乳腺癌细胞株4T1[9]为美国Karmanos Cancer Institute的Fred R.Miller教授惠赠。人逆转录病毒包装细胞株Phoenix A为本实验室保存。细胞培养用DME-10培养基(Dulbeccoπs Modified Eagleπs Medium,DMEM,10%胎牛血清和1%非必需氨基酸)。
1.2 仪器及试剂
7500实时荧光定量PCR系统(Applied Biosystems,Singapore);高容量cDNA反转录试剂盒(Applied Biosystems,USA);SYBR-Green Master PCR Mix(Applied Biosystems,USA);Trizol(Invitrogen,USA);细胞膜蛋白提取试剂盒(Biovision,USA);N-糖苷酶F(Takara,Japan);ECL化学发光试剂(GE Healthcare,USA);小鼠单克隆抗体S2-566(Seikagaku Co.,Japan);其它抗体均购自美国Cell Signaling公司。
1.3 过表达细胞株的建立
逆转录病毒载体pMSCVpuro由本实验室保存,小鼠pRc/CMV-ST8Sia VI质粒为日本RIKEN的Takashima教授惠赠。小鼠的ST8Sia VI基因被插入到pMSCVpuro载体的EcoRI位点,获得过表达载体pMSCVpurO-ST8Sia VI。用磷酸钙法将pMSCVpuro和pMSCVpurO-ST8Sia VI质粒分别转染Phoenix A细胞,48 h后收集含有病毒颗粒的培养基上清,然后感染4T1细胞48 h。在含有4μg/mL嘌呤霉素的培养基中筛选两周,从而得到稳定感染的细胞株:稳定表达ST8Sia VI的细胞株4T1-ST8Sia VI及转染空载体的细胞株Control。
1.4 半定量RT-PCR和实时定量PCR
用Trizol试剂提取细胞总RNA,琼脂糖凝胶电泳检测RNA完整性,紫外分光光度计定量,检测纯度。反转录按照反转录试剂盒步骤进行。半定量RT-PCR所用引物为:小鼠β -actin正向引物序列:5′-ATCTGGCACCACACCTTCTAC-3′,反向引物序列:5′-CACACTTCATGATGGAATTGAA-3′。小鼠ST8Sia VI基因正向引物序列:5′-GGCTGTTGATGGA GGGAA-3′,反向引物序列:5′-TTGTGA TGGTCTGGAGGTAGTC-3′;反应条件:94℃预变性4 min,94℃变性30 s,55℃退火30 s,72℃延伸30 s,共进行30个循环后,72℃延伸10 min。以小鼠β -actin基因作为内参。
实时荧光定量PCR反应使用SYBR Green Master PCR mix试剂盒,基因引物见表1,实验操作按照试剂盒说明书进行。反应条件:95℃预变性10 min,95℃变性15 s,60℃退火、延伸60 s,40个循环,72℃延伸5 min。以GAPDH的表达为内参,目的基因相对定量比值为2-(Ct-Cc)。

表1 实时定量PCR基因引物序列Table 1 Primer sequences of genes in real-time RT-PCR
1.5 基因芯片分析
1.5.1 芯片 小鼠16 K基因表达谱寡核苷酸芯片(V1.0)(SBC-R-MO-100-10)是由上海生物芯片有限公司提供。芯片覆盖基因16 463个,寡核苷酸片段长度为70个碱基。
1.5.2 探针的标记 参照Schena等的方法[10],将样品RNA经逆转录反应制成带荧光标记的cDNA探针并纯化,来源于实验组4T1-ST8Sia VI细胞的mRNA用Cy3-dU TP标记制成探针,对照组Control细胞的mRNA用Cy5-dU TP标记制成探针。
1.5.3 杂交和洗片 将探针置于芯片上,用盖玻片覆盖,置于杂交舱中,放入42℃杂交箱内杂交过夜(16~18 h)。杂交结束后,先在42℃含0.2%SDS,2×SSC的液体中洗5 min,而后在0.2×SSC中室温洗5 min,玻片甩干后即可用于扫描。
1.5.4 检测和分析 对基因芯片用Agilent(Axon)扫描仪扫描,用GenePix Pro 3.0图像分析软件对芯片灰度扫描图进行分析。为了校正Cy5、Cy3标记体系间的系统误差,实验数据进行均一化处理,计算Cy3和Cy5的比值。差异基因筛选标准:Cy3/Cy5比值>或=2(上调)及<或=0.5(下调)。
1.5.5 数据分析 对筛选出的差异表达基因进行聚类分析(网址:http://david.abcc.ncifcrf.gov/,http://www.biorag.org/query.php),列出部分基因功能。利用PathwayExplorer(https://pathwayexplorer.genome.tugraz.at/)在线分析工具[11],分别在KEGG、BioCarta和GenMAPP基因网络搜索唾液酸转移酶ST8Sia VI调控的基因显著相关基因网络。PathwayExplorer采用χ2Fisherπs精确性检验和错误发现率(FDR)法进行显著性分析,FDR结果用q值表示。
1.6免疫印迹(Western Blot)分析
蛋白糖基化水平检测:收集细胞,用细胞膜蛋白提取试剂盒提取细胞膜蛋白。膜蛋白样品50μg及N-糖苷酶F(N-glycosidase F)处理的膜蛋白样品50μg经SDS-PAGE凝胶电泳、转膜,依次用抗体S2-566和辣根过氧化物酶标记的山羊抗小鼠IgG+IgM(H+L)抗体孵育,混合ECL试剂进行显影,暗室内胶片感光,然后漂洗定影。
蛋白磷酸化水平检测:用RIPA裂解液(50 mmol/L Tris-HCl p H 7.5,150 mmol/L NaCl,0.1%SDS,1%NP40,0.5%脱氧胆酸钠,100μg/mL PMSF,1μg/mL Aprotinin,2μg/mL Leupeptin,1 mmol/L DTT)裂解细胞,分离上清,取50μg总蛋白进行免疫印迹分析(操作同上),分别与抗phosphorylated(Ser338)Raf(p-Raf),Raf和β -Actin抗体4℃孵育过夜,ECL法检测。实验重复3次以上,所有结果均采用Image-Pro Plus软件(version 6.0;Media Cybernetics,Bethesda,MD,USA)分析。
2 结果
2.1 稳定表达ST8Sia VI细胞株的建立
感染后的细胞经过有限稀释法筛选,获得稳定表达ST8Sia VI的细胞株4T1-ST8Sia VI及转染空载体的4T1细胞株Control(作为对照)。RT-PCR结果表明,Control细胞不表达ST8Sia VI基因,而4T1-ST8Sia VI细胞高表达ST8Sia VI(见图1)。
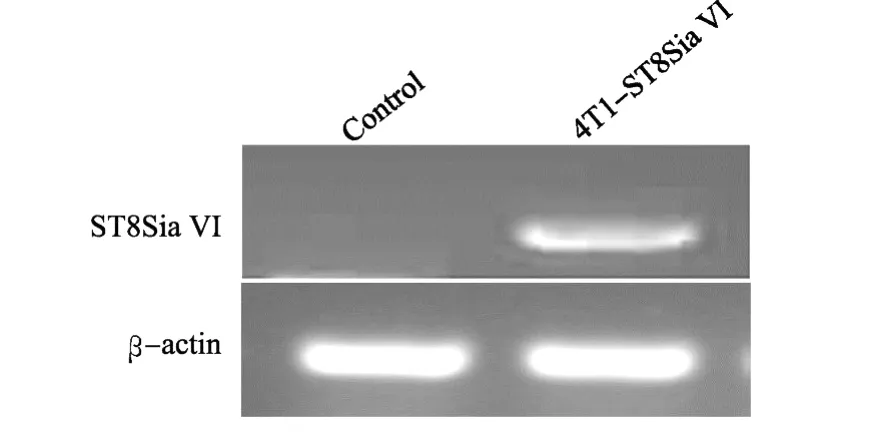
图1 乳腺癌细胞中ST8Sia VI的表达Fig.1 Expression of ST8Sia VI in breast cancer cells
从Control细胞和4T1-ST8Sia VI细胞中制备细胞膜蛋白,利用识别糖链非还原末端NeuAcα2,8NeuAcα2,3Gal结构的单克隆抗体S2-566进行Western Blot实验,分析细胞膜上蛋白的唾液酸修饰。如图2所示,ST8Sia VI过表达细胞(泳道2)膜蛋白含有NeuAcα2,8NeuAcα2,3Gal结构的糖链的量显著高于Control细胞(泳道1)。利用N-糖苷酶F消化去除N-糖链后,Control细胞膜蛋白的大多数条带都消失(泳道3),而4T1-ST8Sia VI细胞仍然存在一些明显的条带(泳道4),表明4T1-ST8Sia VI细胞膜蛋白的O-聚糖α2,8唾液酸修饰显著增加。上述实验结果从mRNA水平和蛋白水平证明了ST8Sia VI过表达细胞株建立成功。
2.2 全基因组芯片分析
为了探讨ST8Sia VI作用的分子基础,利用小鼠全基因组芯片比较分析了对照细胞和ST8Sia VI过表达细胞的基因表达,发现共有201个差异表达的基因,153个在4T1-ST8Sia VI细胞中被上调,48个被下调。其中与肿瘤细胞的生物功能(细胞黏附,细胞生长,细胞运动,免疫和细胞周期)有关的基因共有22个(见表2):与细胞黏附相关的基因共有7个,其中5个上调,2个下调;与细胞运动能力相关的7个基因均上调;与细胞生长相关的Net1上调,Nov下调;与免疫相关的3个基因中有1个下调;调节细胞周期的基因有1个上调,2个下调。
为了证实芯片结果的可信度,采用实时定量PCR技术对从芯片结果中随机选取的4个基因进行验证。4个基因的定量PCR结果与芯片结果基本一致,表明芯片结果可信(见图3)。

图2 免疫印迹分析ST8Sia VI对4T1细胞唾液酸修饰的影响Fig.2 Western blot analysis of the effect of sialic modification by ST8Sia VI on 4T1 cells

图3 定量PCR检测对照细胞和ST8Sia VI过表达细胞中Profilin2,Moesin,Nov和Tgm2的表达量Fig.3 Quantitative PCR analysis of Profilin2,Moesin,Nov and Tgm2 expressions in Control and 4T1-ST8Sia VI cells

表2 4T1-ST8Sia VI与Control细胞间差异表达的基因Table 2 The genes differentially expressed in 4T1-ST8Sia VI and Control cells
2.3 差异表达基因的Pathway分析
以KEGG、Biocarta和GenMAPP基因网络数据库为基础,应用PathwayExplorer在线软件对变化基因进行Pathway分析。与已知的小鼠545条信号通路比对,结果发现,Fisherπs精确性检验P<0.05和FDR明显性检验q<0.05的基因网络只有1个,为依赖β -arrestin的GPCR信号通路(P=0.002,q=0.039),有8个基因与该通路匹配(表3)。
为了进一步探讨唾液酸转移酶ST8Sia VI对依赖β -arrestin的GPCR信号通路的影响,检测该通路下游Raf蛋白的磷酸化水平变化。由图4发现,与Control细胞比较,4T1-ST8Sia VI细胞的Raf蛋白磷酸化水平提高约2.66倍,提高显著(P<0.01)。因此,ST8Sia VI可以调控依赖β -arrestin的GPCR信号通路,与芯片Pathway分析结果相符。
3 讨论
基因芯片技术是1种基于片基表面基因特异性杂交的高通量研究基因表达信息的新技术。基因表达谱或“转录组”是指从基因组DNA转录或表达的基因整体,它决定着细胞蛋白质组的表现型和功能。通过基因表达谱,可以预测基因间的调节机制和生化途径的线索,以及药物在疾病治疗方面的作用靶基因和作用机制[12]。在本研究中,利用基因芯片技术研究了唾液酸转移酶ST8Sia VI对4T1细胞基因表达的影响,发现ST8Sia VI调控的基因涉及到细胞生长、细胞黏附、细胞运动等多方面功能。例如:与细胞生长相关的Net1(神经上皮细胞转化基因1)上调,Net1是1个肿瘤增殖相关蛋白,作为RhoA激活蛋白穿梭于细胞核与细胞质间,在癌细胞浆中积聚赋予了癌细胞更显著的浸润和转移潜能,且在人类一些癌细胞中是过表达的,尤其可作为人类乳腺癌诊断的依据[13]。而与生长相关的Nov(肾母细胞瘤过度表达基因)下调,Nov是1种胰岛素样生长因子(Insulin-like growth factor,IGF)结合蛋白,属于IGF家族的成员。Nov可以抑制肿瘤的生长以及形成,在调节肿瘤细胞的生长方面起着重要的作用[14]。又如芯片结果显示,与细胞运动相关的Moesin(膜组织伸展刺突蛋白)与Profilin2(肌动蛋白抑制蛋白2)上调。Moesin属于ERM(Ezrin,Radixin,Moesin)家族成员之一,对维持细胞形态及运动起重要作用[15]。而Profilin2可与自由单体肌动蛋白和F-actin的末端结合,以影响肌动蛋白的聚合、解聚以及对肌动蛋白细胞骨架结构和功能的改变[16]。此外,ST8Sia VI过表达后,与细胞黏附相关的Tgm2(转谷氨酰胺酶2)被下调。许多ECM蛋白是Tgm2的催化底物,Tgm2可以通过对ECM的催化来抑制血管生成和肿瘤生长[17]。

表3 与GPCR信号通路匹配的基因Table 3 Genes matching GPCR signaling pathway

图4 免疫印迹分析GPCR通路中Raf蛋白的磷酸化变化Fig.4 Western Bolt analysis of Raf phosphorylation in the GPCR pathway
另一方面,基因表达数据隐含基因间的相互作用信息,因而可以通过分析基因表达数据,构建基因调控网络。而基因网络水平的分析能更加具体的揭示机体组织和细胞生理过程或状态的变化及其可能的发展趋势[18]。本研究中,在现有基因网络数据库搜索了唾液酸转移酶ST8Sia VI影响4T1细胞的显著相关的基因网络,发现了依赖β -arrestin的GPCR信号通路,该通路可进一步激活下游的MAPK通路[19]。MAPK通路是细胞内1条十分重要的信号传递途径,该通路的激活与细胞的生长和运动有密切的联系。而Raf是Ras-Raf-MEK-MAPK级联反应中的一个重要蛋白,并且Raf-MAPK的活化可介导增殖和定向性细胞迁移。我们在实验中发现Raf的磷酸化水平有了明显的提高,因此推测唾液酸转移酶ST8Sia VI对于4T1细胞生长和运动的影响可能是通过调节依赖β -arrestin的GPCR信号通路实现的。
总之,本文的研究结果表明,唾液酸转移酶ST8Sia VI可能通过修饰4T1细胞表面的蛋白多糖来直接或者间接调控细胞的生长、运动、黏附、免疫等相关基因及信号传导通路,为深入研究ST8Sia VI作用的分子机制提供了理论基础。
[1] Tsuji S.Molecular cloning and functional analysis of sialyltransferases[J].J Biochem,1996,120(1):1-13.
[2] DallπOlio F,Chiricolo M.Sialyltransferases in cancer[J].Glycoconj J,2001,18(11-12):841-850.
[3] Varki A,张树政.糖生物学基础[M].北京:科学出版社,2003.
[4] Harduin-Lepers A,Mollicone R,Delannoy P,et al.The animal sialyltransferases and sialyltransferase-related genes:a phylogenetic approach[J].Glycobiology,2005,15(8):805-817.
[5] Mungul A,Cooper L,Brockhausen I,et al.Sialylated core 1 based O-linked glycans enhance the growth rate of mammary carcinoma cells in MUC1 transgenic mice[J].Int J Oncol,2004,25(4):937-943.
[6] Takashima S,Ishida H K,Inazu T,et al.Molecular cloning and expression of a sixth type of alpha 2,8-sialyltransferase(ST8Sia VI)that sialylates O-glycans[J].J Biol Chem,2002,277(27):24030-24038.
[7] Teintenier-Lelièvre M,Julien S,Juliant S,et al.Molecular cloning and expression of a human hST8Sia VI(alpha2,8-sialyltransferase)responsible for the synthesis of the diSia motif on O-glycosylproteins[J].Biochem J,2005,392(Pt 3):665-674.
[8] Takashima S,Tsuji S.Unique enzymatic properties of mouse sialyltransferases,ST6GalⅡand ST8Sia VI[J].Trends Glycosci Glycotechnol,2004,16:345-356.
[9] Aslakson C J,Miller F R.Selective events in the metastatic process defined by analysis of the sequential dissemination of subpopulations of a mouse mammary tumor[J].Cancer Res,1992,52(6):1399-1405.
[10] Schena M,Shalon D,Davis R W,et al.Quantitative monitoring of gene expression patterns with a complementary DNA microarray[J].Science,1995,270(5235):467-470.
[11] Mlecnik B,Scheideler M,Hackl H,et al.PathwayExplorer:web service for visualizing highvthroughput expression data on biological pathways[J].Nucleic Acids Res,2005,33:633-637.
[12] Batrakova E V,Kelly D L,Li S,et al.Alteration of genomic responses to doxorubicin and prevention of MDR in breast cancer cells by a polymer excipient:Pluronic P85[J].Mol Pharm,2006,3(2):113-123.
[13] Alberts A S,Qin H,Carr H S,et al.PAK1 negatively regulates the activity of the Rho exchange factor NET1[J].J Biol Chem,2005,280(13):12152-12161.
[14] Fu C T,Bechberger J F,Ozog M A,et al.CCN3(NOV)interacts with connexin43 in C6 glioma cells:possible mechanism of connexin-mediated growth suppression[J].J Biol Chem,2004,279(35):36943-36950.
[15] 林剑国,石淑仙,刘云海.Moesin分子及其特性[J].国外医学分子生物学分册,2001,23(3):168-171.
[16] Gareus R,Di Nardo A,Rybin V,et al.Mouse profilin2 regulates endocytosis and competes with SH3 ligand binding to dynamin 1[J].J Biol Chem,2006,281(5):2803-2811.
[17] Jones R A,Kotsakis P,Johnson T S,et al.Matrix changes induced by transglutaminase 2 lead to inhibition of angiogenesis and tumor growth[J].Cell Death Differ,2006,13(9):1442-1453.
[18] 孙进,常桂芳,乐国伟,等.乳杆菌肽聚糖调节小鼠免疫细胞基因表达的通路分析[J].细胞与分子免疫学杂志,2008,24(6):553-556.
[19] Hupfeld CJ,Dalle S,Olefsky J M.Beta-Arrestin 1 down-regulation after insulin treatment is associated with supersensitization of beta 2 adrenergic receptor Galpha s signaling in 3T3-L1 adipocytes[J].Proc Natl Acad Sci U S A,2003,100(1):161-166.
Study on the Effect of an Over-Expressed Sixth Type ofα2,8-sialyltransferase(ST8Sia VI)on the Gene Expression of Murine Breast Cancer Cells
SHI Han,GU Yu-Chao,XU Liang,YU Wen-Gong
(Department of Molecular Biology,School of Medicine and Pharmacy,Ocean University of China,Qingdao 266003,China)
This study aimed at clarifying the roles and molecular mechanisms of the sixth type of sialyltransferase(ST8Sia VI)in breast cancer cells.In this study,the gene expression of 4T1 cells over-expressed ST8Sia VI and 4T1 cells transfected empty vector were compared by gene chip,and the related signal pathways of differentially expressed genes were determined based on the public databases with PathwayExplorer.The results showed that the expressions of 201 genes were differential in ST8Sia VI over-expressed cells and control cells,of which 22 genes were involved in cell adhesion,growth,locomotion,immune process and cell cycle.The genes expressed differentially were also involved inβ -arrestindependent GPCR signaling pathway.In addition,Raf,a downstream member ofβ -arrestin-dependent GPCR signaling pathway,was found to be highly phosphorylated in 4T1-ST8Sia VI cells.These results lay the foundation for an in-depth study of ST8Sia VI.
sialylated modification;ST8Sia VI;gene expression;Raf
Q786
A
1672-5174(2010)01-047-07
国家重点基础研究发展规划项目(2003CB716402)资助
2008-12-22;
2009-04-20
时 瀚(1980-),女,博士。E-mail:zhtshh@163.com
**通讯作者:Tel:0532-82031680,E-mail:yuwg66@ouc.edu.cn
责任编辑 于 卫
