Spinosyn A对家蝇生长发育及Na+,K+-ATPase、Ca2+,Mg2+-ATPase-ATPase和AChE的影响
2009-11-29徐志红蒋志胜
徐志红 蒋志胜
(长江大学农学院,湖北 荆州 432305) (南开大学元素有机化学研究所,天津 300071)
SpinosynA对家蝇生长发育及Na+,K+-ATPase、Ca2+,Mg2+-ATPase-ATPase和AChE的影响
徐志红 蒋志胜
(长江大学农学院,湖北 荆州 432305) (南开大学元素有机化学研究所,天津 300071)
研究了Spinosyn A对家蝇(MuscadomesticaL.)生长发育及其Na+,K+-ATPase、Ca2+,Mg2+-ATPase和AChE的影响。结果表明,Spinosyn A对家蝇有杀卵作用,且其化蛹率显著下降;Spinosyn A在离体时低浓度抑制家蝇头部Na+,K+-ATPase活性而高浓度酶被激活,活体时在48 h内酶活性都受到明显抑制,并随浓度升高而增强;离体时低浓度抑制家蝇Ca2+,Mg2+-ATPase活性而高浓度时酶被激活;活体时24 h后该酶被激活。离体时对家蝇头部AChE有弱的抑制作用,但不同处理浓度之间无差异,而在活体时48 h内能显著激活AChE活性。
Spinosyn A;Na+,K+-ATPase;Ca2+,Mg2+-ATPase;AChE;生长发育;家蝇(MuscadomesticaL.)
Na+,K+-ATPase广泛存在于各类生物的细胞膜上,它能维持细胞膜两侧电位平衡,保障神经冲动顺利持续地进行。当Na+,K+-ATPase受到抑制时,膜对离子的通透性降低,膜电位发生变化,从而可影响到神经细胞的传导功能。研究表明,高浓度的拟除虫菊酯对昆虫Na+,K+-ATPase有较强的抑制作用[1,2],并推测这可能是该类药剂毒理机制的一部分,至少能间接影响轴突的传导。蒋志胜等[3]探索性的研究了以美洲大蠊的Na+,K+-ATPase为靶标的农药筛选模型。
钙离子在神经活动中的作用十分重要,它可影响轴突传递,神经递质的释放及神经质膜的稳定性;此外,在神经细胞内还有许多被Ca2+活化的受体,如钙调蛋白(CaM)、肌钙蛋白C和钙调素[4]。近代杀虫剂分子毒理学研究发现, Ca2+,Mg2+-ATPase是DDT、拟除虫菊酯类杀虫剂的主要靶标位点之一,并且有些学者提出了DDT、拟除虫菊酯作用于ATPase的靶标学说[5]。
Spinosad是美国陶氏益农公司开发的一类新型杀虫剂,是Spinosyn A和Spinosyn D的混合物(前者占80%,后者占20%),据报道Spinosad作用于烟碱型乙酰胆碱受体(nAChR)和γ-氨基丁酸(GABA)受体使昆虫神经细胞去极化,引起中央神经系统广泛的超活化,导致非功能性肌肉收缩和震颤,逐渐衰竭,瘫痪直至死亡。本研究选取重要的卫生害虫家蝇(MuscadomesticaL.)作为供试昆虫,研究不同方法处理后对害虫生长发育的影响,并以昆虫神经活动中极其重要的Na+,K+-ATPase、Ca2+,Mg2+-ATPase和AChE,分别测定Spinosyn A对其离体和活体酶的影响。
1 材料和方法
1.1 材料与试剂
供试家蝇由天津卫生防病中心提供的敏感品系,按陈年春方法[6]室内人工累代饲养,温度24~26 ℃,L∶D=14∶10。
Spinosyn A:美国陶氏益农公司提供,含量99.2%;93.2%阿维菌素、71%锐劲特、79%甲基对硫磷均由南开大学元素所提供;乌本苷(Ouabain):SERVA;ATP二钠盐:上海生工; MES和牛血清蛋白均由华美生物工程公司提供;二硫双硝基苯甲酸(DTNB):SIGMA Chem. Co;碘化乙酰硫代胆碱(ATCH):Aldrich Chem. Co。 其它试剂均为化学纯。
1.2 Spinosyn A对家蝇卵孵化和化蛹率的影响
(1) Spinosyn A对家蝇卵孵化的影响 取100 mg/L、20 mg/L和5 mg/L 3个浓度的Spinosyn A 20 mL,对照组采用丙酮。将家蝇卵块(产卵24 h内)浸入30 s,取出,待丙酮完全挥发后置于家蝇饲料中[水∶麦麸∶奶粉=34∶12∶1]常规饲养,72 h后检查幼虫的数量,随后记录存活幼虫的化蛹率、蛹重、羽化率和成虫重。
(2) 含Spinosyn A饲料对家蝇化蛹率的影响 取5个100 mL烧杯,每个烧杯中加9 g麦麸,再注入20 mL混合液体(面粉∶奶粉∶啤酒酵母∶水=10∶6.4∶2∶440),分别配成含10 mg/L、5 mg/L、2.5 mg/L和1.25 mg/L Spinosyn A药液的家蝇饲料,对照采用丙酮。接200头初孵24 h幼虫于烧杯中,9 d后检查试验结果,随后记录各实验组的蛹重、羽化率和成虫重。
1.3 蛋白含量的测定
按照文献[7]的方法。
1.4 Pi标准曲线的制作
(1)呈色反应液(AMT)的配制 AMT由1体积A液(4.2%钼酸铵盐酸(4 N)溶液),3体积M液(0.05%孔雀石绿水溶液)混合搅拌30 min,静置10 min后过滤,加入0.01体积1.5%Twe-20制得。AMT现配现用。
(2)Pi测定与曲线的制作 称取在105 ℃烘至恒重的KH2PO4,用蒸馏水配成1 mmol/L KH2PO4母液。将母液稀释20倍,配成50 μmol/L的KH2PO4标准液。取8份不同量(0.1~0.8 mL)标准溶液于8只试管中,另加蒸馏水使各管体积均为1 mL,混匀后成5、10、…、40 μmol/L Pi溶液。从每管中取出溶液0.4 mL,加入2.0 mL AMT液,1 min后再加入0.4 mL 24%柠檬酸钠,混匀后室温放置40 min,测定光密度D660 nm值。重复3次,取平均值,以磷含量(nmol)为横坐标,光密度值为纵坐标,绘制标准曲线和计算回归方程。
1.5 Spinosyn A对家蝇Na+,K+-ATPase及Ca2+,Mg2+-ATPase的影响
(1)Na+,K+-ATPase活力测定 将羽化后3~4 d的家蝇取出,在-18 ℃的低温冰箱中冷冻1 h,取头部,取24头加入到2mL pH7.4 0.32 mmol/L蔗糖缓冲液(1 L中含10 mmol咪唑、1 mmol EDTA、0.32 mmol/L蔗糖)中,匀浆40 s,以TOMY高速离心机在4 ℃,3 000 r/min离心10 min,取上清液,再在13 000 r/min离心30 min,弃上清液,将所得沉淀用2 mL蔗糖缓冲液悬浮,作为酶源备用。
Na+,K+-ATPase活力测定参照徐友涵[8]方法,略有改进。反应系统总体积2 mL,其中含酶源0.4 mL,30 mmol/L MES,30 mmol/L Tris,120 mmol/L NaCl,20 mmol/L KCl,5.0 mmol/L MgCl2,分别添加或不添加0.1 mmol/L乌苯苷,在37 ℃水浴中预保温5 min,加入0.1 mmol/L ATP,混匀后在37 ℃水浴中震荡反应5 min,取出后置于冰浴,从每管中取0.4 mL反应液,加入2.0 mL AMT溶液,摇匀终止酶反应,1 min后加入0.4 mL 24%柠檬酸钠,室温放置40 min,测定光密度D660 nm值,加与不加乌苯苷的光密度值之差即为酶活力。根据标准曲线计算出Pi的生成量,再按照蛋白含量和反应时间转换成酶的比活力。
(2) Spinosyn A对家蝇离体Na+,K+-ATPase的作用 将Spinsyn A溶于丙酮,配成10-5、10-4、10-3的Spinosyn A丙酮溶液,分别取20 μL药液加入反应体系,对照管加20 μL丙酮,其余步骤同酶活性的测定。
(3) Spinosyn A对家蝇活体Na+,K+-ATPase的作用 挑选大小均匀羽化后3~4 d的家蝇成虫,用微量进样器点滴1μL Spinosyn A丙酮液于试虫前胸背板,对照组加1 μL丙酮。置入100 mL烧杯中常规饲料饲养,用纱布保湿。分别在24 h和48 h后制备酶源测活力。
(4)Ca2+,Mg2+-ATPase活力测定 Ca2+,Mg2+-ATPase的测定参考宁黔冀(1996)方法[1]。反应系统中含30 mmol/L MES,30 mmol/LTris,100 mmol/L KCl,5.0 mmol/L MgCl2,0.1 mmol/L CaCl2,0.1 mmol/L 乌苯苷,其余的同Na+,K+-ATPase。
1.6 Spinosyn A对家蝇AChE的影响
(1)牛血清蛋白标准曲线的制作 制作方法同1.4。
(2) 酶源制备 取羽化后3~4 d家蝇成虫25头,在-18 ℃冰冻30 min,取头部置入2.5 mL 0.04 mol/L pH7.6磷酸缓冲液中,匀浆30 s,用两层纱布过滤,4℃ 3 000 r/min下离心15 min,取上清作为酶源置于冰箱中备用。活体试验同样取羽化后3~4 d的家蝇成虫,每头点滴含药的丙酮液1 μL,放入100 mL烧杯中饲养,里面放入成虫饲料,并用纱布保湿,24 h或48 h后取出制备酶源。
(3) AChE活性的测定 参考Gorun[9]改进的Ellman[10]的方法,取酶与药的混合液0.15 mL,加入0.15 mL ATCH (1 mmol/L),28 ℃保温15 min,加2.7 mL DTNB-磷酸缓冲液-乙醇(DTNB-磷酸缓冲液-乙醇的配制方法:12.4 mg DTNB加120 mL 96%乙醇,80 mL蒸馏水,用pH7.6,0.1 mol/L的磷酸缓冲液定容250 mL(此试剂在室温下可保存6个月)终止反应,静置2 min,测定光密度D412 nm值。
1.7 数据分析方法
酶抑制率按下式计算,并进行方差分析和Duncan新复极差分析。
酶抑制率(%)=[(对照组酶活力-处理组酶活力)/对照组酶活力]×100
2 结果与分析
2.1 Spinosyn A对家蝇生长发育的影响

表1 Spinosyn A对家蝇卵的孵化、化蛹、蛹重、羽化和成虫重的影响Table 1 Effect of Spinosyn A on the hatching rate,pupatation rate, pupa weight,emergence rate and adult dry weight of Musca domestica L.
(1) Spinosyn A浸液法处理对家蝇生长发育的影响 由表1可知,Spinosyn A对家蝇卵采用浸泡法处理后,随着Spinosyn A 浓度的增加,家蝇卵孵化率有明显下降的趋势,方差分析显示,各处理组与对照组之间有显著差异,而且各处理浓度之间也有显著差异。而且对随后的化蛹率和蛹重的检测表明在高浓度时其化蛹率有所下降,在20 mg/L时其化蛹率最低,100 mg/L时又有升高,但是其蛹重并无差异,其羽化率与化蛹率相似,成虫重与蛹重有一定的关系,都是在5和100 mg/L时比较低。
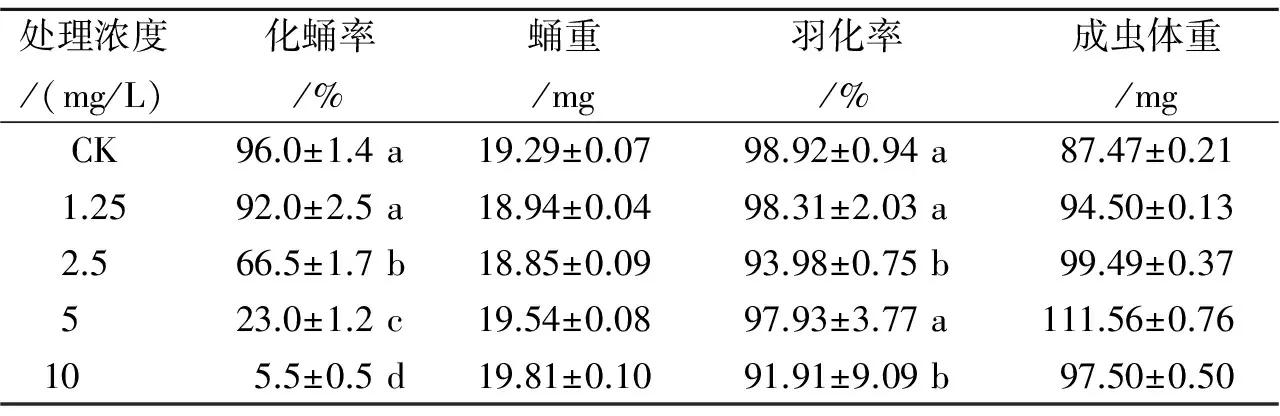
表2 Spinosyn A对家蝇幼虫化蛹率的影响、蛹重羽化率和成虫体重的影响Table 2 Effect of Spinosyn A on pupatation rate,pupa weight, emergence rate and adult dry weight of Musca domestica L.
(2)Spinosyn A含药饲料法处理对家蝇生长发育的影响 由表2可知, 含Spinosyn A饲料饲养幼虫后,家蝇化蛹率明显降低,全部与对照组有显著差异;幼虫化蛹后,各处理组之间并无太大差异,这表明Spinosyn A的处理对家蝇蛹重、羽化率和成虫体重影响不大,且与浓度并无相关性。
(3)Spinosyn A对家蝇离体、活体Na+,K+-ATPase的作用 由表3可知,在离体条件下,低浓度(10-5,10-4mol/L)的Spinosyn A能抑制Na+,K+-ATPase的活性,而高浓度(10-3mol/L)激活Na+,K+-ATPase的活性,浓度为10-5、10-4mol/L和10-3mol/L的Spinosyn A以及阿维菌素之间都有显著差异。总的来说,表现出随着浓度的增大而逐渐激活的趋势,而对照药剂锐劲特与Spinosyn A的抑制能力相近,阿维菌素表现出很强的抑制能力。
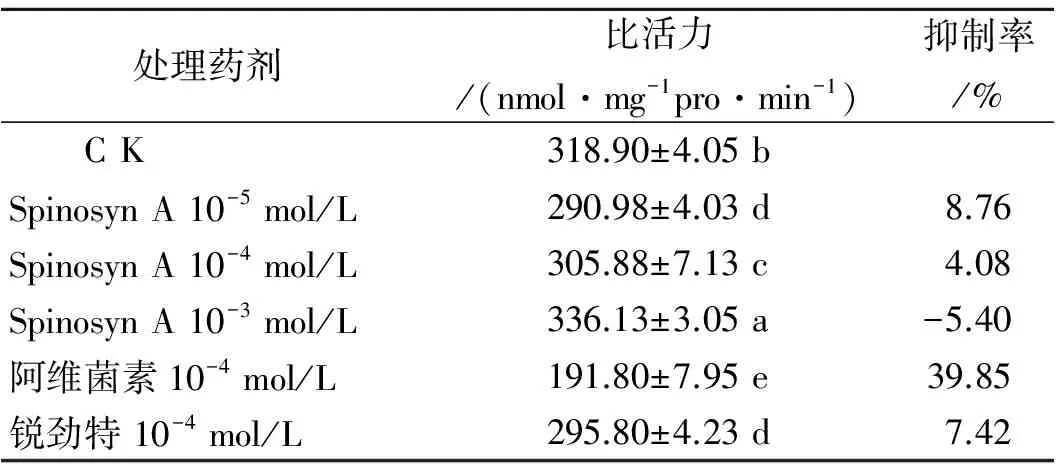
表3 Spinosyn A对家蝇离体Na+,K+-ATPase的抑制Table 3 Inhibition of Spinosyn A on Na+, K+-ATPase in vitro in Musca domestica L.
由表4可知,在活体条件下,经Spinosyn A处理24 h后,各处理浓度与对照组之间有显著差异,而且处理的浓度越高,对家蝇Na+,K+-ATPase的抑制率越高。而阿维菌素与锐劲特的抑制能力相当,但表现出比Spinosyn A强的抑制能力。而药剂处理48 h后,Na+,K+-ATPase的活性同样被抑制,10-7、10-6mol/L的Spinosyn A的抑制率相对于24 h有一定的升高,而10-5mol/L的抑制率有所回落,表明在48h内家蝇的Na+,K+-ATPase持续被10-7~10-5mol/L的Spinosyn A抑制而不能恢复正常的水平。

表4 Spinosyn A对家蝇(24 h和48 h)活体Na+,K+-ATPase的抑制Table 4 Inhibition of Spinosyn A on Na+,K+-ATPase in vivo in Musca domestica L.

表5 Spinosyn A对家蝇离体Ca2+,Mg2+-ATPase的影响Table 5 Effect of Spinosyn A on Ca2+, Mg2+-ATPase in vitro in Musca domestica L.

表6 Spinosyn A对家蝇活体Ca2+,Mg2+-ATPase的影响Table 6 Effect of Spinosyn A on Ca2+, Mg2+-ATPase in vivo in Musca domestica L.
(4)Spinosyn A对家蝇离体、活体Ca2+,Mg2+-ATPase的作用 由表5可知,离体条件下,在Spinosyn A浓度较低(10-5mol/L)时,对Ca2+,Mg2+-ATPase表现出一定的抑制作用,而在高浓度(10-4、10-3mol/L)时表现出激活作用而且随着浓度的升高而激活率越大,而且各处理药剂之间差异显著。
由表6可知,Spinosyn A处理24 h后明显激活家蝇Ca2+,Mg2+-ATPase,激活率都超过41.8%,但是不同浓度之间并不存在浓度效应,而对照药剂阿维菌素和锐劲特都显得比Spinosyn A的激活率更高一些。
2.3 Spinosyn A对家蝇AChE的影响
由表7可知即使在1.67×10-4mol/L这样高的浓度下,Spinosyn A对离体的AChE的抑制率也才5.2%,而且,3个浓度之间并没有显著差异,这显然与有机磷类农药不同有关,有机磷类农药对AChE的抑制都存在浓度效应。对照药剂甲基对硫磷1.67×10-5mol/L与对照组和各个浓度的Spinosyn A都有显著差异。

表7 Spinosyn A对家蝇离体AChE的影响Table 7 Effect of Spinosyn A on AChE in vitro in Musca domestica L.
从表8可知,Spinosyn A处理24 h后,能激活家蝇活体AChE的活性,而且各浓度之间也有显著差异,并且表现出Spinosyn A对AChE的激活能力随其浓度的增大而提高的趋势。处理48 h后,浓度在10-7~10-5mol/L范围内的Spinosyn A都能对家蝇的AChE有激活作用。但是10-6mol/L的Spinosyn A激活能力最低,所以处理48 h后Spinosyn A对AChE的激活能力并没有随其浓度的增大而提高的趋势。与24 h相比,10-7mol/L和10-5mol/L Spinosyn A的激活能力有所增强,而10-6mol/L的激活能力却在下降。

表8 Spinosyn A对家蝇活体(24 h和48 h)AChE的影响Table 8 Effect of Spinosyn A on AChE in vivo(24 h and 48 h) in Musca domestica L.
3 讨论
用浸液法处理家蝇卵之后观察到Spinosyn A对家蝇卵的孵化有明显的抑制作用,而且这种抑制能力随着浓度的增加而增强,这表明Spinosyn A对家蝇有杀卵活性,这应该是Spinosyn A控制家蝇的一个机制。用含药饲料饲养家蝇发现家蝇的化蛹受到明显的抑制,由于采用24 h内初孵幼虫进行的试验,故此结果可能是幼虫取食含药饲料之后死亡也可能使抑制幼虫化蛹,但是不管是哪种原因都可以降低家蝇的数量。同样的处理观察到的家蝇的蛹重和羽化率与对照组相比没有差异,表明Spinosyn A并不影响这两个指标,而家蝇成虫体重反而有所增加,说明幼虫克服了Spinosyn A的毒害恢复继续发育的能力。
Leng等[11]证实溴氰菊酯在10-7~10-3mol/L时抑制家蝇脑触突Na+,K+-ATPase的活性,并认为溴氰菊酯抑制家蝇脑触突蛋白磷酸化是神经毒性的一个重要机理。一般的竞争性抑制剂都表现出低浓度激活,高浓度抑制的特性,比如烟碱对nAChR的作用[12]。但是Spinosyn A却表现出离体条件下在低浓度时抑制在高浓度时激活的现象,显然表明Spinosyn A对家蝇Na+,K+-ATPase离体的影响不是对酶的竞争性抑制作用,而产生这样的结果可能是间接作用。在活体时,24 h和48 h都表现出明显的抑制作用,而且其抑制率都随着浓度的增大而上升的趋势。笔者认为这是杀虫剂对家蝇靶标位点(nAChR和GABA受体)作用之后的效应,对这2个位点的作用都导致神经系统的超活化而长时间处于兴奋状态。Na+通道长时间被激活使正常的神经冲动无法实现,Na+通道长期开放的结果必然加快了膜内ATP的消耗,使ATP浓度降低,同时也可能使Na+,K+-泵钝化,这两个原因都是导致Na+,K+-ATPase的整体活力下降而使Na+,K+-ATPase酶活力在亚致死浓度下降低的原因。所以Na+,K+-ATPase不是Spinosad的作用靶标,Spinosad对Na+,K+-ATPase的影响只是Spinosad作用于靶标之后的效应。
在离体条件下,Spinosyn A对家蝇成虫Ca2+,Mg2+-ATPase的作用结果与对Na+,K+-ATPase的作用结果相似,都是在低浓度的时候抑制在高浓度的时候激活。笔者同样认为Spinosyn A对Ca2+,Mg2+-ATPase并无直接作用,可能是间接作用的结果。在活体时,处理24 h后表现出明显的激活作用,激活率与处理浓度之间并无相关性。昆虫经Spinosyn A处理之后,由于其对家蝇nAChR和GABA受体的作用使膜内外的电位差有所降低,难以维持正常的水平。再加上Na+,K+-ATPase受到抑制,使膜内的电位更高,这将产生一种向膜外泵出正电荷的力,而Ca2+,Mg2+-ATPase正是向外转移正电荷的酶,所以就促进了Ca2+,Mg2+-ATPase活性的增强。同时,膜外游离的Ca2+的增加会使膜的阈值升高而使膜趋向于稳定,这将部分抵消杀虫剂的作用,昆虫的神经系统可能就是这样来抵御杀虫剂对昆虫生理的瞬间毒害的。
AChE是有机磷和氨基甲酸酯类杀虫剂的作用位点,一般来说,AChE有3个重要区域包括结合部位,催化部位和变构部位。杀虫剂能抑制AChE一般需要一个带正电荷原子与结合部位结合,形成酶-杀虫剂的复合物。Spinosyn A是一个十二元环的大环内酯,并不存在明显的正电荷中心,所以可以解释它并不抑制AChE的活性,这个结果也与报道符合[13]。然而在活体条件下,被Spinosyn A处理24 h和48 h后处理的AChE都被明显激活,这是一个新的现象。一般来说,酶的活性增强主要原因是酶数量的增加,酶数量的增加不外乎2个原因:控制AChE基因的Copy数量的增加(即基因扩增)或者对控制AChE基因的调控能力的增强。Fournier[14]的实验证实有机磷的抗性与果蝇中枢神经系统中AChE的量密切相关。但是现在并不知道Spinosyn A能否引起AChE的基因扩增和增加AChE的表达。然而AChE的活性增强之后,家蝇必然产生一系列的生理生化反应,比如加快对ACh的水解,导致突触之间ACh含量的降低,那么要保证足够ACh到达突触后膜与ACh受体结合使正常的神经冲动向下传递,则突触前膜必须释放更多的ACh。这样会提高产生神经冲动的阈值,势必影响正常神经活动的进行。
[1]宁黔冀,尚稚珍.昆虫ATPase活性的测定与应用[A].张芝利,朴永范,吴钜文.中国有害生物综合治理文集[C].北京:中国农业科技出版社,1996.11~12.
[2]何运转,李 梅,冯国蕾,等.拟除虫菊酯对家蝇Na-K-ATPase抑制作用的研究[J],1999,42(1):19~24
[3]蒋志胜,尚稚珍,王晓博,等,美洲大蠊Na+,K+-ATPase作为靶标的初步研究[J].农药学学报,2000,2(4):28~32.
[4]冷欣夫,唐振华,王荫长.杀虫药剂分子毒理学及昆虫抗药性[M].北京:中国农业出版社,1996.7~8.
[5]Matsumura F,Ghiasuddin S M. Characteristics of DDT-sensitive Ca-ATPase in the axonic membrane[A].Toshio Ned. Neurotoxicology of insecticides and pheromones[C].New York: Plenum press,1979.245~257.
[6]陈年春.农药生物测定技术[M].北京:北京农业大学出版社,1991.21~56.
[7]Braford M M.A rapid and sensitive method for the quantitattion of migrogram quantitives of protein utilizing the principle of protein-dye binding[J]. Analyt Biochem,1976,72: 248~254.
[8]徐友涵. 一种简便、灵敏的ATPase活性测定法[J].生物化学与生物物理进展,1986,13(4):64~66.
[9]Gorun V,Proinov L,Baltescu V. Modified Ellman procedure for assay of cholinesterase in crude enzymatic preparaions[J].Analytical biochemistry,1978,86:324~326.
[10]Ellman G L,Courtney K D,Andres V,etal. A new and rapid colorimetric determination of acetylcholinesterase activity[J].Biochemical pharmacology,1961,7,88~95.
[11]Leng X F,Xiao D Q.Effect of deltamethrin r protein phosphorylation of housefly brain synaptosome[J]. Pestcide Sciecce,1995,44:88~89.
[12]吴青君,张文吉,张友军.烟碱样乙酰胆碱受体及其有关杀虫药剂[J].植物保护,2000,26(4):39~41.
[13]Salgado V L.The mode of action of spinosad and other insect control products[J].Down to Earth,1997,52: 35~44.
[14]Fournier D,Bride F M,Hoffmann F,etal.Acetylcholinesterase: Two types of modifications cofer resistant to insecticides[J].J Biol Chem,1975,267:14270~14274.
2009-08-30
徐志红(1978-),男,湖北汉川人,农学硕士,讲师,主要从事农药学研究.
10.3969/j.issn.1673-1409(S).2009.04.003
S482.3
A
1673-1409(2009)04-S0007-06
