外源性IGF-Ⅰ对急性坏死性胰腺炎大鼠胰腺病理损伤的影响
2009-11-28郭豫学王映珍王世文李自力孙志江牛天平唐艳
郭豫学 王映珍 王世文 李自力 孙志江 牛天平 唐艳
外源性IGF-Ⅰ对急性坏死性胰腺炎大鼠胰腺病理损伤的影响
郭豫学 王映珍 王世文 李自力 孙志江 牛天平 唐艳
重症急性胰腺炎(severe acute pancreatitis,SAP)的发病机制是一个复杂的、多因素参与的病理生理过程。参与SAP发生发展过程中的炎症性细胞因子包括TNF-α 、IL-1β、IL-6、IL-8、血小板活化因子等[1],抗炎症细胞因子包括TGF-β和IL-l0等。本实验应用外源性生长调节素(insulin-like growth factor Ⅰ,IGF-Ⅰ)干预治疗急性坏死性胰腺炎(ANP)大鼠,以观察其对ANP大鼠血浆TNF-α、IL-10水平及胰腺病理损伤的影响。
一、材料与方法
1.动物模型与分组:健康雄性Wistar大鼠72只,体重(200±20)g,购自兰州大学医学实验动物中心。按照随机数字法分为假手术组(SO组)、ANP组、IGF-Ⅰ组,每组又分术后6、12、24 h 3个时间点。ANP组和IGF-Ⅰ组采用胰胆管逆行推注5%牛磺胆酸钠溶液0.1 ml/100 g体重的方法制备ANP模型,SO组推注等量生理盐水。IGF-Ⅰ组于术前0.5 h和术后3 h经后肢内侧皮下注射IGF-Ⅰ溶液(浓度20 μg/ml)2.5 ml/kg体重,而SO组和ANP组则于相同时间点注射等量生理盐水。术后禁食,自由饮水。
2.标本采集:每组动物分别于术后6、12、24 h各取8只,麻醉后无菌条件下取右心室血5 ml,加入灭热源的肝素抗凝管,分离血浆后保存于-70℃待检。开腹取胰头部胰腺组织,置10%甲醛溶液固定。
3.血淀粉酶、IL-10和TNF-α测定:全自动生化分析仪测定血淀粉酶。用BIO-rad 550型酶标仪(美国 BIO-rad公司),采用ELISA法测定血浆IL-10和TNF-α。
4.胰腺组织病理形态学观察:固定的胰腺组织常规脱水、包埋、切片、HE染色。由两名病理科医师采用Kusske组织学评估标准[2]评估胰腺损伤程度。
二、结果
1.血淀粉酶、TNF-α和IL-10水平的变化:ANP组各时间点的血淀粉酶、TNF-α和IL-10水平均较SO组显著升高(Plt;0.05或lt;0.01)。IGF-Ⅰ组12、24 h的血淀粉酶较ANP组同时点显著降低(Plt;0.05),与SO组无显著差异;而血浆IL-10水平则较ANP组显著升高(Plt;0.05或lt;0.01)。IGF-Ⅰ组各时间点血浆TNF-α均较ANP组显著下降(Plt;0.05),但仍显著高于SO组(Plt;0.05,表1)。
2.胰腺组织病理学改变:光镜下,ANP 6 h组可见胰腺组织结构轻度紊乱,间质水肿明显,少量炎性细胞浸润,腺泡细胞坏死,但小叶结构尚清晰,部分大鼠胰腺可见出血;24 h组胰腺组织结构紊乱,小叶结构模糊,腺泡细胞大部分坏死,可见孤岛状腺泡结构,坏死胰腺组织周围可见炎性细胞浸润,间质充血、出血。IGF-Ⅰ24 h组与ANP组比较,胰腺小叶间水肿、出血、脂肪变性、坏死及炎症细胞浸润均有所减轻(图1)。
ANP组各时点胰腺的病理分值较SO组明显增高(Plt;0.05),而IGF-Ⅰ组较ANP组下降,其中12 h和24 h点具有统计学意义(Plt;0.05,图2)。
讨论近年的各种研究数据表明,白细胞浸润和众多细胞因子尤其是前致炎因子的释放在胰腺炎时的胰腺局部损害与全身炎症反应综合征(SIRS)以至多器官功能衰竭(MOF)的发生发展中起主要作用。
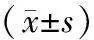
表1 各组大鼠血清淀粉酶、IL-10和TNF-α的变化
注:与SO组相应时间点比较,*Plt;0.05,**Plt;0.01;与ANP组相应时间点比较,ΔPlt;0.05,ΔΔPlt; 0.01

A、B、C:SO组6、12、24 h;D、E、F:ANP组6、12、24 h;G、H、I:IGF-Ⅰ组6、12、24 h
图1各组胰腺组织病理学改变(HE ×400)
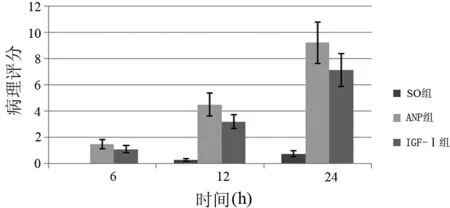
图2 各组大鼠的胰腺病理评分
TNF-α是联系特异性免疫和炎症反应的重要因子,TNF-α在急性胰腺炎(AP)由局部病变发展到全身性病损过程中起着重要作用,其水平与AP预后呈正相关[3]。IL-10是免疫系统的惟一具有免疫下调作用的细胞因子,具有免疫抑制和抗炎症作用, Van Laethem等[4]报道,在诱导胰腺炎之前和其间给予IL-10可以减轻胰腺炎的严重程度。Warzecha等[5]的实验发现,给予蛙皮素诱导的动物外源性IL-10可以减轻胰腺的损害,降低血浆脂肪酶的活性和血浆IL-1b的浓度,还可以增加胰腺的血流量和胰腺DNA的合成。
IGF-Ⅰ又称生长调节素,是由70个氨基酸组成的具有内分泌、自分泌及旁分泌特性的单链多肽,主要由肝细胞合成和分泌,对机体生长发育起着重要调节作用[6]。IGF-Ⅰ可以诱导胰腺腺泡细胞和β细胞的增殖,在胰腺部分切除和AP时都有IGF-ⅠmRNA的过度表达,提示IGF-Ⅰ参与了胰腺的再生过程。IGF-Ⅰ对SAP时胰腺的保护作用主要有以下几个方面:(1)减轻白细胞的浸润和减少IL-1β的产生,从而可以减轻胰腺的损害[6];(2)改善胰腺炎时胰腺的微循环;(3)保护肠黏膜屏障,抑制肠道细菌易位。王映珍等[7]报道外源性IGF-Ⅰ可明显降低ANP大鼠血浆内毒素、二胺氧化酶水平,减轻ANP时小肠组织的损伤,对肠黏膜屏障具有一定的保护作用。
本实验结果显示,IL-10水平在造模后6 h虽然明显增高,但此后逐渐降低,说明这种应激的抗炎反应还不足以对抗强大的促炎反应,使病情进一步发展。而TNF-α水平在ANP明显增高,且与胰腺病理评分呈正相关。给予外源性IGF-Ⅰ治疗后血浆淀粉酶活性、TNF-α浓度明显降低,而IL-10浓度较ANP组增高,胰腺组织病理改变减轻,病理评分明显下降,表明IGF-Ⅰ通过下调TNF-α和上调IL-10从而减轻ANP时的胰腺损害。
[1] Kazbay K,Tarnasky PR,Hawes RH,et al.Increased transforming growth factor beta in pure pancreatic juice in pancreatitis.Pancreas,2001,22:193-195.
[2] Kusske AM,Rongione AJ,Ashley SW,et al.Interleukin-10 prevents death in lethal necrotizing pancreatitis in mice.Surgery,1996,120:284 - 289.
[3] Mews P,Philips P,Fahmy R,et al.Pancreatic stellate cells respond to inflammatory cytokines:Potential role in chronic Pancreatitis.Gut,2002,50:535-541.
[4] Van Laethem JL,Marchant A,Delvaux A,et al.Interleukin 10 prevents necrosis in murine experimental acute pancreatitis.Gastroenterology,1995,108:1917-1922.
[5] Warzecha Z,Dembinski A,Ceranowicz P,et al.IGF-Ⅰ stimulates production of interleukin-10 and inhibits development of caerulein-induced pancreatitis.J Physiol Pharmacol,2003,54:575-590.
[6] Rosen CJ,Pollak M.Circulating IGF-Ⅰ:New perspectives for a new century.Trends Endocrinol Metab,1999,10:136-141.
[7] 王映珍,王世文,李培杰,等.胰岛素样生长因子-Ⅰ对重症急性胰腺炎大鼠小肠黏膜上皮细胞bax和bcl-2 mRNA表达的影响.世界华人消化杂志,2008,16:1396-1401.
2008-08-11)
(本文编辑:屠振兴)
10.3760/cma.j.issn.1674-1935.2009.02.019
730030 兰州,甘肃省紧急医疗救援中心(郭豫学、王映珍、王世文、李自力、牛天平);兰州石化总医院(孙志江);兰州市第二人民医院急诊科(唐艳)
王世文,Email: wshw120@163.com
