人骨髓来源内皮祖细胞的分离培养及生物学特性的鉴定
2009-04-25唐欲博陈孝黄保丁冯鑫彭龙云彭新生邹学农
唐欲博 陈孝 黄保丁 冯鑫 彭龙云 彭新生 邹学农
基础研究
人骨髓来源内皮祖细胞的分离培养及生物学特性的鉴定
唐欲博 陈孝 黄保丁 冯鑫 彭龙云 彭新生 邹学农
目的建立人骨髓来源的内皮祖细胞(EPCs)分离、培养、诱导分化与鉴定的方法,并探讨其生物学特性。方法收集腰椎间盘退变性疾病患者的髂骨骨髓24例,密度梯度离心法分离的单个核细胞接种于纤维连接蛋白包被的培养瓶,贴壁培养,EGM-2培养基诱导扩增EPCs。Dil-ac-LDL、FITC-UEA-I荧光双标、流式细胞术鉴定EPCs,计算纯度。透射电镜和管腔形成实验鉴定EPCs向血管内皮细胞(ECs)分化的能力。结果培养72 h换液时可见贴壁细胞形成明显细胞克隆集落,第5天集落数增加,1周后细胞融合达80%,至第14天细胞呈铺路石样排列。培养至第7天细胞Dil-ac-LDL、FITC-UEA-I双荧光染色阳性率为(95.1±4.0)%,CD133、CD34、KDR、VE-Cadherin标记阳性率分别为(18.5±4.4)%、(45.4±7.8)%、(66.7±7.2)%、(20.5±5.3)%。培养第10天细胞透射电镜显示成熟血管ECs特有的Weibel-Palade小体。管腔形成实验表明,体外ECMatrix上培养7至12d的EPCs具有较强的管腔形成能力。结论采用密度梯度离心与贴壁培养法分离、培养的人髂骨骨髓来源的单个核细胞在特定诱导条件下可分化为EPCs,纯度较高,稳定性和重复性好。EPCs培养7至12d,具有良好的管腔形成能力。
内皮细胞;骨髓细胞;细胞,培养的;细胞分离
内皮祖细胞(endothelial progenitor cells,EPCs)是血管内皮细胞(endothelial cells,ECs)的前体细胞,是一群介于血液-血管细胞与成熟内皮细胞之间的具有较强增殖分化能力、可向血管新生部位趋化并促进血管新生的幼稚细胞[1,2]。成人EPCs存在于骨髓之中,在机体出现缺血、组织损伤或受到细胞因子、药物等刺激的情况下,可从骨髓向靶部位动员、归巢、分化,形成新生血管,因此其在临床各种缺血性疾病和血管损伤方面有着广泛的应用前景[3,4]。研究发现,EPCs不仅参与胚胎血管生成,还在胎儿出生后的血管新生和血管内皮损伤修复过程中起着重要作用[5-7]。腰椎间盘退变性疾病因其高发病率和高致残率,严重危害人体健康,造成了沉重的社会负担。椎间盘内无血管组织,其营养来源于经软骨终板和纤维环的渗透作用。终板血供异常可影响椎间盘基质代谢,促使椎间盘退变。本研究采集腰椎退变性疾病患者骨髓进行EPCs的分离、培养、扩增和鉴定,为研究EPCs在椎间盘退变性疾病的发病机理及其预防治疗奠定基础。
1 材料与方法
1.1材料
淋巴细胞分离液(Ficoll-PaquePLUS,GE Healthcare公司),小鼠抗人CD34流式抗体、E-selectin流式抗体(BD公司),CD133流式抗体(Miltenyi公司),VEGFR-2流式抗体(R&D公司),VE-Cadherin、vWF流式抗体(eBioscience公司),Dil-ac-LDL(Molecular Probes公司),FITC-UEA-I(Vector公司),人纤维连接蛋白(FN,Invitrogen公司),内皮细胞基础培养基及生长因子套装(EGM-2 BulletKit)(Lonza公司);体外血管生成试剂盒(In Vitro Angiogenesis Assay Kit,Milipore公司);细胞活力和细胞毒性检测试剂盒(CCK-8,日本同仁化学研究所);倒置相差显微镜(OLYMPUS);荧光显微镜(LEICA);流式细胞仪(COULTER)。
1.2方法
1.2.1单个核细胞的分离与培养 本研究计划取得中山大学附属第一医院医学伦理委员会批准。在患者知情同意的前提下,24例成人骨髓均取自中山大学附属第一医院骨科退变性腰椎滑脱、椎管狭窄伴腰椎不稳、腰椎间盘突出伴退变性腰椎滑脱手术患者髂骨取骨区(2008年11月~2009年 5月,年龄38~73岁,平均61.3岁),排除血液系统疾病、恶性肿瘤及乙肝表面抗原阳性患者,2 mmol/L EDTA-PBS溶液抗凝。PBS等倍稀释骨髓后,将骨髓按4:3比例加至于淋巴细胞分离液上,20℃2 000 r/min离心30 min。离心后,用吸管吸出中间单个核细胞层,用2倍体积PBS洗涤,1 000 r/min室温离心7 min。以3×106/cm2接种于25 μg/ml人FN包被的培养瓶中。37℃、5%CO2培养箱培养,72 h后换液,洗去非贴壁细胞,每3天换液。倒置显微镜下观察贴壁细胞生长情况。
1.2.2细胞增殖情况观测 分离的原代细胞接种3d后进行第一次换液,从第4天起,用CCK-8试剂盒检测细胞增殖情况,将贴壁细胞重新接种于96孔板中,加入WST-8,37℃、5%CO2培养箱孵育4 h,酶标仪检测OD值。每24小时检测1次,连续10 d,观察细胞增殖情况并绘制生长曲线。
1.2.3 细 胞的 染 色与 鉴 定 Dil-ac-LDL和FITC-UEA-I双荧光染色:EPCs与 10 μ g/ml Dil-ac-LDL避光孵育4 h,4%多聚甲醛固定10 min,PBS漂洗,加入FITC-UEA-I(15μg/ml)避光孵育1 h,PBS漂洗,晾干,荧光显微镜下观察。随机计数10个非重叠视野,计算双阳性细胞比例。
1.2.4细胞表型检测 流式细胞术:0.25%胰酶消化EPCs,计数,分别与CD133、CD34、VEGFR-2、VE-cadherin、E-selectin、vWF单克隆抗体在4℃孵育30 min,用PBS漂洗,300 μl PBS悬浮细胞后上机检测。
1.2.5透射电镜分析 将EPCs轻轻刮下,2 000 r/ min室温离心10 min,戊二醛固定30 min,离心,送透射电镜室进行脱水、包埋、切片、染色。
1.2.6管腔形成实验 将试剂盒中的胶液与缓冲液预混,铺于板,37℃、5%CO2培养箱孵育1 h,1× 104个细胞/孔接种于体外血管生成试剂盒的ECMatrix上,培养箱孵育过夜,12 h后倒置显微镜下观察管腔形成情况。
1.3统计学分析
2 结果
2.1内皮祖细胞的形态观察和增殖情况
细胞接种时呈小圆形,24 h后可见细胞贴壁生长,并逐渐变为梭形,不贴壁细胞仍呈圆形,体积较小;4天左右细胞明显增殖,细胞体积增大,5天左右见类似血岛结构的细胞集落形成,集落边缘细胞呈纺锤形和不规则梭形,呈放射状单层生长,集落中心细胞密集呈多层生长,5~6天时梭性细胞首尾相连接形成线样结构,少量细胞连接,呈明显的管壁管腔,管壁由单层细胞组成;至第7天,细胞集落逐渐增大,细胞体积变大(图1A);约至第10天,细胞可达到80%~90%融合,细胞集落结构消失,细胞伸展呈纺锤形(图1B);至第14天,细胞基本铺满瓶底,呈铺路石样密集排列(图1C)。原代细胞在接种后第3天进行首次换液,第4~13天的细胞生长曲线显示(图2),从细胞原代分离时算起,第4~7天为EPCs增殖潜伏期,此期细胞缓慢增殖,生长曲线平缓,EPCs生长至第8~11天达到增殖高峰。
2.2内皮祖细胞的荧光双染实验
采用Dil-ac-LDL和FITC-UEA-I染色,于荧光显微镜下观察,结合FITC-UEA-I的贴壁细胞呈绿色(图1D),摄取Dil-ac-LDL的贴壁细胞呈红色(图1E),双阳性标记细胞呈黄色(图1F),阳性率为(95.1±4.0)%,表明其具有EPCs的特征。
2.3内皮祖细胞的表型检测
流式细胞仪分析培养7 d和14 d的细胞表达CD133、CD34、KDR、VE-Cadherin、E-selectin、vWF的阳性率结果见表1及图3,经一定时间的诱导,CD133表达率下降,而相应成熟ECs抗原KDR、E-selectin、vWF表达则增加(P<0.05)。
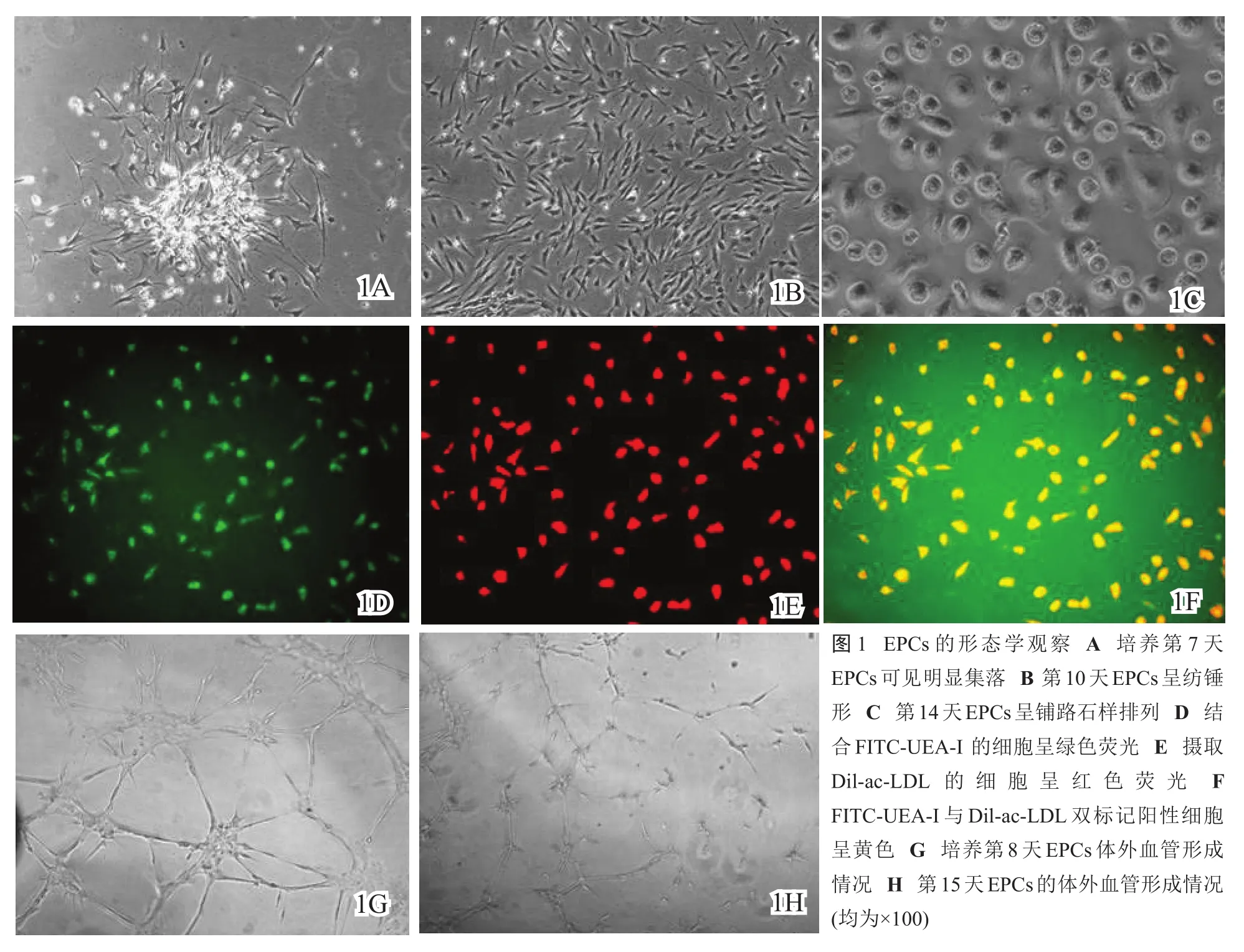
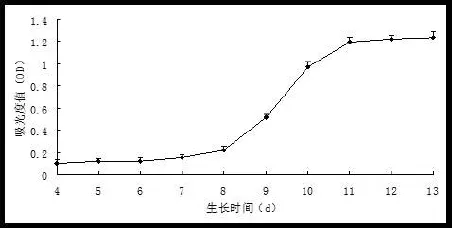
图2 EPCs生长曲线
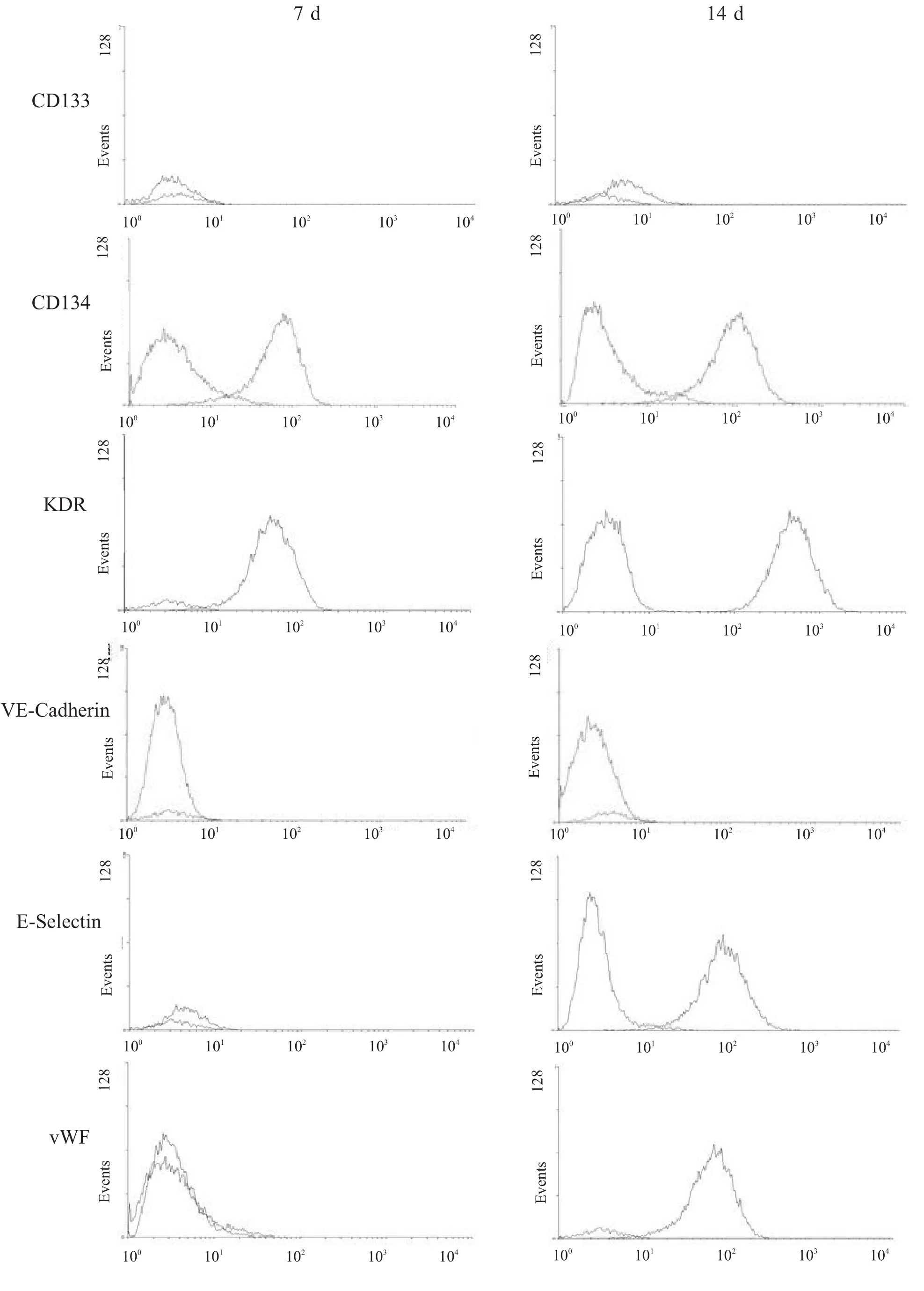
图3 培养7 d、14 d的细胞流式细胞仪分析结果:细胞表达CD133、CD34、KDR、VE-Cadherin、E-selectin、vWF的阳性率
2.4 透射电镜分析
透射电镜结果显示培养第10天的EPCs在细胞质内含一种短棒状小体,含平行管状内部结构,即血管ECs所特有的Weibel-Palade小体(图4)。
2.5体外血管生成实验
培养第8天和第15天的原代细胞消化后种植于体外血管生成试剂盒的ECMatrix上,前者12 h可见细胞相互连接形成管腔样结构(图1G),18 h可见原管腔增大,旁边有新管腔形成,而后者12 h的管腔形成能力明显弱于前者(图1H)。
3 讨论
1997年,Asahara等[2]等首次从外周血中分离出EPCs,随后大量研究证实,这些细胞来源于骨髓,具有旺盛的增殖能力,能够直接分化为血管ECs,在缺血等因素的刺激下,能够动员人血,在受损血管的修复和缺血组织的再血管化中扮演着重要角色。
椎间盘是体内最大的无血供组织,对退变腰椎间盘的病理学及MRI影像学研究发现,腰椎间盘退变过程中软骨终板下骨血运改变是诱发退变的早期机制,而对退变腰椎间盘动物模型的软骨终板形态学研究证明,软骨终板血供减少、钙化导致的腰椎间盘营养障碍,可能是启动腰椎间盘退变的关键因素[8]。体外扩增的EPCs可整合至血管壁,促进缺血组织的血管新生及损伤血管内膜的再内皮化过程[7,9]。通过移植自体EPCs或动员骨髓中EPCs,可快速恢复血管内皮的结构和功能[10]。骨髓来源的EPCs可能对腰椎间盘退变病人终板下骨微循环的重建具有重要作用,为椎间盘退变性疾病的防治提供了新的思路。
细胞的诱导分化是多种细胞、细胞因子以及微环境相互调控作用的结果,在一个更接近人体内环境的培养条件下,更有利于EPCs的诱导分化。Murohara等[6]在体外培养脐血源性EPCs时发现,CD34-与CD34+细胞共同培养较CD34+细胞单独培养贴壁细胞数量增加3倍,细胞集落数增加6倍,提示EPCs的发育可能需要CD34+细胞与CD34-细胞之间的相互作用。因此,本实验24例骨髓标本均采用密度梯度离心结合贴壁培养法培养细胞,有利于EPCs和其他细胞的相互作用,促进EPCs生长。
在本研究的细胞培养过程中,弃去培养72h后的未贴壁细胞,可以避免骨髓中巨噬细胞、成纤维细胞等对实验的干扰。培养至第7天,细胞集落逐渐增大,细胞体积变大,此时的培养细胞表达EPCs特异性抗原标志,可特异性摄取FITC-UEA-I并内吞Dil-ac-LDL;最后细胞分化成典型成熟ECs的铺路石样形态,数量也明显增加,这说明人骨髓单个核细胞在体外一定条件下可以分化为EPCs,且较成熟ECs有明显的增殖优势。
本实验应用流式细胞仪,分析单个核细胞经诱导分化前后细胞表面表达内皮系抗原的变化,在定向诱导分化早期,EPCs表面高表达CD133,随时间推移表达比例逐渐下降,与此同时,相应成熟的ECs抗原VE-cadherin、KDR、vWF的表达则显著增加,表明EPCs在特定细胞因子的诱导下,逐渐失去幼稚细胞的特有标记物CD133,开始向成熟ECs分化。另一方面也体现出EPCs的不稳定性。在老年及一些病理情况下,由于端粒酶活性降低,EPCs在体外培养时往往因为迅速老化而难以保持祖细胞性状,表现为再生能力下降,倍增次数减少,凋亡加速等。
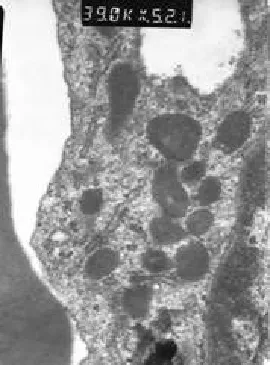
图4 电镜下观察胞浆内W-P小体(×39 000)
表1 EPCs不同时间点CD133、CD34、KDR、VE-Cadherin、E-selectin、vWF表达结果(±s)
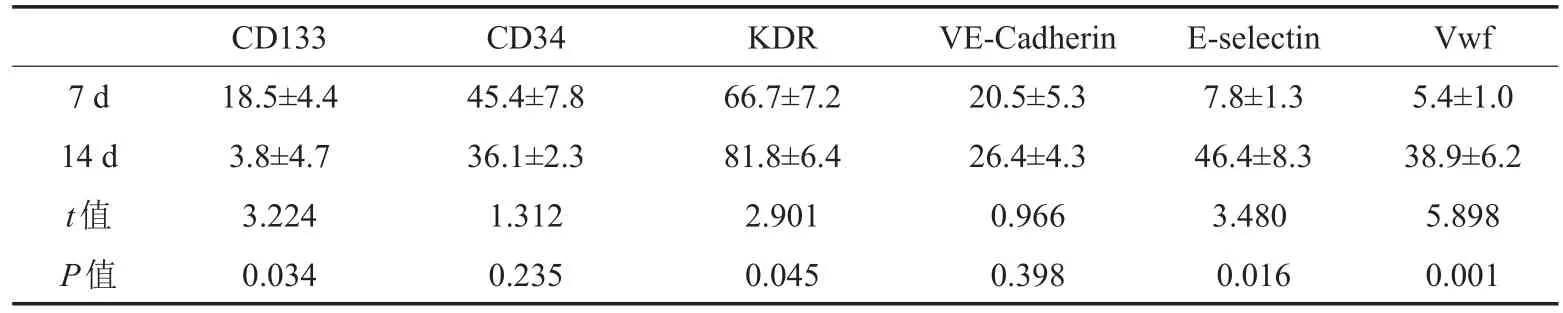
表1 EPCs不同时间点CD133、CD34、KDR、VE-Cadherin、E-selectin、vWF表达结果(±s)
7 d 14 d t值P值CD133 18.5±4.4 3.8±4.7 3.224 0.034 CD34 45.4±7.8 36.1±2.3 1.312 0.235 KDR 66.7±7.2 81.8±6.4 2.901 0.045 VE-Cadherin 20.5±5.3 26.4±4.3 0.966 0.398 E-selectin 7.8±1.3 46.4±8.3 3.480 0.016 Vwf 5.4±1.0 38.9±6.2 5.898 0.001
实验中,透射电镜观察到培养10 d的细胞胞浆中已出现典型的Weibel-Palade小体,表明EPCs已开始向成熟ECs分化。而通过对比不同时期EPCs的管腔形成能力,可以看出成熟ECs的成血管能力要远远弱于分化早期的EPCs。
总之,我们通过系统的检测,确定了采用密度梯度离心与贴壁培养法分离培养的人髂骨骨髓来源的单个核细胞,通过特定诱导条件下可分化为EPCs,EPCs纯度较高。该方法稳定性和重复性好,为研究EPCs在椎间盘退变性疾病的发病机理奠定了基础。
1 Isner JM,Asahara T.Angiogenesis and vasculogenesis as therapeutic strategies for postnatal neovascularization [J]. J Clin Invest,1999,103(9):1231-1236.
2 Asahara T,Murohara T,Sullivan A,et al.Isolation of putative progenitor endothelial cells for angiogenesis[J].Science,1997, 275(5302):964-967.
3 Maeda M,Fukui A,Nakamura T,et al.Progenitor endothelial progenitor cells on vascular grafts:An ultrastructural study[J]. J Bio Mater Res,2000,51(1):55-60.
4 Gill M,Dias S,Hattori K,et al.Vascular trauma induces rapid but transient mobilization of VEGFR2+AC133+endothelial precursor cells[J].Circ Res,2001,88(2):167-174.
5 Rafii S,Oz MC,Seldomridge JA,et al.Characterization of hematopoietic cells arising on the textured surface of left ventricular assist devices[J].Ann Thorac Surg,1995,60(6): 1627-1632.
6 Murohara T,Ikeda H,Duan J,et al.Transplanted cord blood-derived endothelial precursor cells augment postnatal neovascularization[J].J Clin Invest,2000,105(11):1527-1536.
7 Kawamoto A,Tkebuchava T,Yamaguchi JI,et al.Intramyocardial transplantation of autologous endothelial progenitor cells for therapeautic neovascularization of myocardial ischemia[J]. Circulation,2003,107(3):461-468.
8 Jünger S,Gantenbein-Ritter B,Lezuo P,et al.Effect of limited nutrition on in situ intervertebral disc cells under simulatedphysiological loading.Spine,2009,34(12):1264-1271.
9 Murayama T,Tepper OM,Silver M,et al.Determination of bone marrow-derived endothelial progenitor cell significance in angiogenic growth factor-induced neovascularization in vivo [J].Exp Hematol,2002,30(8):967-972.
10 Rafii S,Meeus S,Dias S,et al.Contribution of marrowderived progenitors to vascular and cardiac regeneration[J]. Semin Cell Dev Biol,2002,13(1):61-67.
(本文编辑 白朝晖)
Cultivation and identification of endothelial progenitor cells from human bone marrow
TANG Yu-bo*,CHEN Xiao,HUANG Bao-ding,FENG Xin,PENG Long-yun,PENG Xin-sheng,ZOU Xue-nong.*Department of Pharmacy,the First Hospital Affiliated of SUN Yat-sen University,Guangzhou,Guangdong 510080,China Corresponding author:ZOU Xue-nong,E-mail:zxnong@hotmail.com
Objective To establish methods of isolation,cultivation,induction and identification for endothelial progenitor cells(EPCs)from human bone marrow in vitro.Methods Mononuclear cells were collected by density gradient centrifugation from the bone marrow of 24 patients with intervertebral disc degeneration.The isolated cells were cultivated in dishes coated with fibronectin and induced by angiogenic growth factors. Immuno-fluorescence staining and flow cytometry were used to indentify EPCs.The differentiation of EPCs to endothelial cells(ECs)was determined by transmission electron microscope(TEM)and in vitro angiogenesis. Results Cell colony-forming units appeared 72 hours after seeding and increased obviously after 5 days.One week later the cells confluenced to 80%.Attached cells formed cobblestone like structure by 14 days.The uptake rate of Dil-ac-LDL and FITC-UEA-I was(95.1±4.0)%.Flow cytometric analysis showed that positive rate of CD133,CD34,KDR,and VE-Cadherin was(18.5±4.4)%,(45.4±7.8)%,(66.7±7.2)%,and(20.5±5.3)%, respectively.Weibel-Palade body was observed in endochylema under TEM.The cells cultivated for 7 days to 12 days formed tube-like structure on ECMatrix.Conclusions EPCs could be efficiently isolated by density gradient centrifugation combined with induction by EGM-2 medium from human bone marrow.EPCs had angiogenic potential between 7 days to 12 days.
Endothelial cells;Bone marrow cells;Cells,cultured;Cell separation
R329.2
A
1674-666X(2009)01-0056-06
“中-德生物技术青年科学家小组”计划(国科生便子[2009]004号);NSFC-广东联合基金(u0732001)
510080广州,中山大学附属第一医院药学部(唐欲博、李孝),脊柱外科(黄保丁、彭新生、邹学农),心血管内科(彭龙云);中山大学药学院(冯鑫)
邹学农,E-mail:zxnong@hotmail.com
