黄瓜老化种子基因组DNA的损伤与修复的RAPD研究
2009-04-05伍春莲乔爱民孙敏
伍春莲 乔爱民 孙敏
(1.西华师范大学生命科学学院,四川南充,637002;2.仲恺农业技术学院园艺系;3.西南大学生命科学学院)
黄瓜老化种子基因组DNA的损伤与修复的RAPD研究
伍春莲1乔爱民2孙敏3
(1.西华师范大学生命科学学院,四川南充,637002;2.仲恺农业技术学院园艺系;3.西南大学生命科学学院)
应用RAPD技术对人工老化和PEG处理的黄瓜种子进行扩增多态性DNA分析,建立了黄瓜种子基因组DNA的损伤及其修复的RAPD指纹图谱。在92条引物中有22条可应用于老化种子的研究,16条可应用于PEG处理种子的研究,并从中找出了6条引物S190、S300、S359、S475、S1140、S2144用来比较黄瓜老化种子及其修复的RAPD扩增带型的变化。结果发现,人工老化处理的黄瓜种子的DNA带减少甚至消失,而PEG渗调修复后的黄瓜老化种子DNA带重新出现或者与对照基本相同,从而建立了黄瓜老化种子基因组DNA的损伤与修复的RAPD指纹图谱。
黄瓜种子 人工老化 DNA损伤与修复 PEG渗调 RAPD
黄瓜(Cucumis ativus)又名胡瓜、刺瓜、王瓜,属葫芦科黄瓜属植物,具有清热利水,解毒消肿,生津止渴的作用,具有很高的经济利用价值。黄瓜种子在贮藏过程中容易发生老化,导致种子质量、活力和抗逆性降低,给农业生产造成巨大的经济损失。种子质量是目前的研究热点之一,但大多集中在生理生化方面,分子研究则主要集中在蛋白质和RNA上,从DNA分子水平方面的研究却少见报道[1]。
随机扩增多态性DNA(RAPD)是一种利用一系列10碱基的随机引物对所研究的基因组DNA进行扩增的分子标记[2~3]。RAPD能从DNA分子水平上直接反映整个基因组的特征,能快速、准确地反映基因组DNA因发生DNA片段的插入、缺失,或发生碱基突变而产生的多态性信息[4]。RAPD技术自Williams于1990年创立以来,已经在遗传多样性分析、品种鉴定、药材的道地性以及栽培植物品种的分类研究等方面得到了广泛应用[5~10]。本文利用RAPD技术研究了人工老化过程中种子基因组DNA的损伤积累以及利用PEG(聚乙二醇)对损伤的DNA进行渗透修复,这在国内外是一种新的尝试,同时将蔬菜种子在人工老化处理过程中基因组DNA的损伤积累以及损伤DNA的PEG渗调修复对种子质量的影响联系起来,具有创新意义。
1 材料与方法
1.1 试验材料
供试材料为黄瓜(Cucumis sativusL.)品种津研四号(Jin Yan No.4 cucumber)的种子。随机引物均购自上海生物工程有限公司。
1.2 试验方法
①种子的人工老化 将黄瓜种子于40℃,RH 100%条件下进行老化处理。具体步骤如下:在干燥器底部盛一定量的蒸馏水,放在40℃的生化培养箱中,平衡水分2 d,再用小纱袋装50粒大小均匀、种皮完好的种子,敞口放入干燥器中,再将干燥器密封,放入40℃的生化培养箱中。每天放入一批种子,共放入15批种子。然后将所有种子从干燥器中取出,于室内条件下平衡水分。这样就得到了不同老化天数的黄瓜种子(即不同活力的黄瓜种子)。
②老化种子的PEG渗调引发 在9 cm的培养皿中,加入适量的25%的PEG溶液,取老化的黄瓜种子50粒置于其内,于15℃的光照培养箱中处理24 h。然后将种子取出,用蒸馏水冲洗5次,再用吸水纸将种子表面的水吸干,并用电风扇将种子吹干至一定程度,最后于室内平衡水分。
③种子基因组DNA的提取和RAPD方法 种子基因组DNA的提取采用SDS法[11]。
RAPD方法为:20 μL的反应体系中含有60 ng模板,1.2 U Taq DNA聚合酶,3.0 mmol/L MgCl2,0.20 mmol/L dNTP,1.40 μmol/L引物,1×buffer,其余用双蒸水补齐。DNA预变性94℃进行4 min,94℃变性30 s,37℃退火30 s,72℃延伸1 min,循环30次后,72℃再延伸10 min。RAPD扩增产物的检测:配制1.5%(w/v)的琼脂糖凝胶,于1×TBE缓冲液中电泳检测基因组DNA的扩增产物。电泳电压为5 V/cm,1.5 h,溴化乙锭 (EB)直接加在琼脂糖凝胶中,使其终浓度为0.5 μg/mL。待溴酚蓝迁移至琼脂糖凝胶的2/3处,取出胶在300 nm紫外透射光下观察并拍照记录。
④引物筛选 取 10粒没有老化的种子提取DNA,作为筛选随机引物的模板。
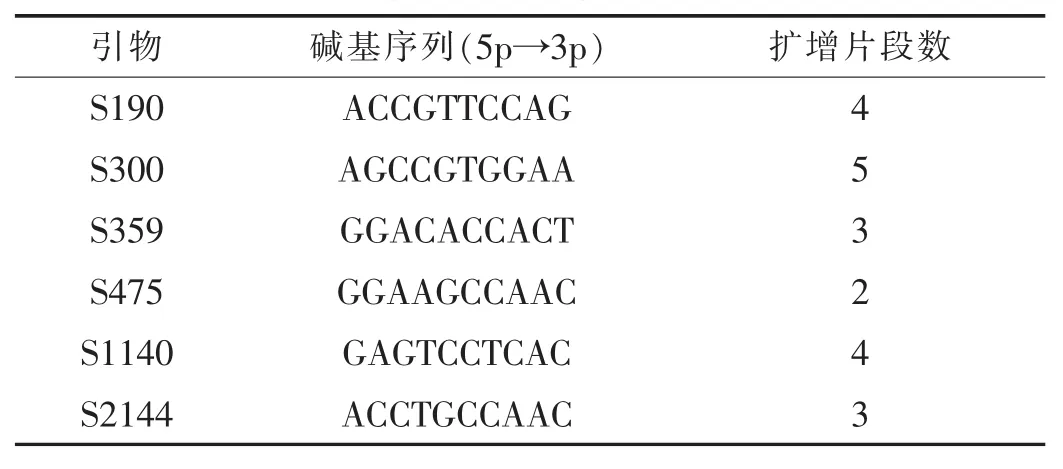
表1 多态性随机引物的序列及扩增结果
2 结果与分析
2.1 引物的筛选
在103条10 bp的单引物中总共有92条引物扩增出稳定而清晰的产物,占总引物的89.3%,一般为2~10条片段,介于200~2000 bp。选用扩增产物稳定而清晰的引物(表1),作为黄瓜老化种子基因组DNA损伤及其修复的RAPD的研究。
2.2 黄瓜老化种子及其PEG渗调修复的RAPD研究
试验对经40℃,RH 100%人工老化1~15 d的黄瓜种子进行RAPD扩增和用25%PEG 6000对人工老化不同天数的黄瓜种子进行渗调后的RAPD扩增。利用引物 S359,S475,S300,S190,S1140及 S2144进行DNA老化和修复的对照分析。由图1可知,利用引物S359分析时发现,利用人工老化的黄瓜种子进行RAPD扩增,老化3,7,8,13,14 d的种子与对照相比,均无扩增条带出现,而老化1,4,5,6,9,10,11 d的种子在约500 bp处均只有1~2条条带,其余均丢失,说明经过人工老化的黄瓜种子可能使基因组DNA受到了损伤,老化的天数不同,DNA损伤的程度也不同,表现为某一引物在DNA上的结合位点受到了破坏,从而使多态性DNA带完全消失;同时对人工老化的黄瓜种子进行PEG渗调(图2),RAPD扩增后发现,老化3,7,8,14 d的种子扩增出与对照基本相同的带型,原来只有1~2条条带的地方也出现了与对照基本相同的带型,只有老化13 d的经PEG渗调后仍无扩增条带,可能是种子内因和受损程度过大的外因同时作用的结果。
由图3可知,利用引物S190分析时发现,利用人工老化的黄瓜种子进行RAPD扩增,老化4,7,8,9,12,13,14,15 d的种子与对照相比,均无扩增条带出现,1 d和3 d的种子条带减少;当用PEG渗调处理以后,所有批次的扩增条带都出现 (图4),只是老化1,8,13 d的种子约1400 bp处缺失1条条带,其余与对照基本相同。以上表明,人工老化处理对黄瓜种子的基因组DNA会造成损伤,表现为DNA带的减少甚至完全消失,而PEG渗调后,老化程度较轻的黄瓜种子DNA得到了修复,表现为DNA带的重新出现,甚至与对照基本相同。利用引物 S475,S300,S1140,S2144扩增也出现了与上述基本相同的情况 (数据未显示)。
3 小结与讨论
已有大量研究资料表明,利用人工加速老化法可以模拟种子的自然老化或劣变过程[12]。人工加速老化处理种子只是加速了种子内部的代谢过程,与自然老化相比,并无老化机理上的差异。种子老化会引起其基因组DNA不同程度的损伤。DNA的损伤有以下几种类型:①碱基的损伤与丢失;②错误碱基;③甲基化碱基;④嘧啶二聚体;⑤DNA链的断裂;⑥DNA链的交联[13]。种子内损伤的DNA只要在适宜的条件下(如适宜的水分和温度)就会被种子细胞内的修复系统所校正和修复。已有研究资料表明,在引发处理时对种子的吸水加以适当控制,DNA的修复机制就会被激活[14~15]。其中,渗调引发可以使DNA的修复机制被激活,改善种子的成苗[16],并使引发种子在水中的萌发初期有更合理的代谢平衡[17]。
数年前,已有人开始从种子中提取DNA用于RAPD分析[1,18]。Robert等认为,模板DNA的完整性会影响RAPD带型。他们以为,质量最差的种子会产生最丰富的DNA多态性,然而,他们的研究结果却表明,DNA多态性出现最多的是室内贮藏的种子,而非质量最差的人工加速老化的种子[19]。
本试验中,对人工老化以及渗调引发的黄瓜种子基因组DNA进行RAPD分析发现,黄瓜种子经过不同时间的人工老化处理后,92条引物中共有22条的扩增产物表现出多态性,22条引物的多态性RAPD带型大多数都是DNA带的减少甚至消失,少数是DNA带量的减少,亮度减弱。同时利用25%的PEG 6000溶液对老化1~15 d的黄瓜种子进行渗调引发24 h,对其基因组DNA进行RAPD扩增,共获得了16条引物的基因组DNA指纹图谱。从指纹图谱来看,经PEG渗调引发的黄瓜老化种子,RAPD扩增产物基本可以恢复到老化前的状态,但是老化程度过重(如13~14 d),RAPD扩增的产物减少甚至没有,也就是说,引物在该结合位点的扩增产物减少或者没有。老化程度较轻的黄瓜种子(老化1~6 d)经PEG渗调引发后一般都有相同的带型,而老化程度较重的黄瓜种子(老化7~15 d)则基本没有扩增条带。由此说明,人工老化处理对黄瓜种子的基因组DNA造成了损伤,使某些引物在其基因组DNA上的结合位点遭到了破坏,从而使DNA带减弱甚至消失。而PEG渗调引发可以在一定程度上激活DNA的修复机制,使损伤的DNA得到修复。但是由于DNA的损伤是随机发生的,引物在基因组DNA上的结合位点也是随机的,也就是说,有的引物的结合位点被破坏,而有的引物的结合位点没有被破坏。但总体来说,老化程度较轻的黄瓜种子PEG渗调引发后,引物的结合位点基本没有影响,说明结合位点本来就没有受损伤,或者即使受了损伤也在渗调引发过程中得到了修复。而老化程度较重的黄瓜种子的损伤DNA即使经渗调引发也得不到修复,说明DNA损伤过于严重,或者是核内的修复体系也被破坏了。

图1 引物S359在人工老化黄瓜种子上的RAPD指纹图谱

图2 引物S359在PEG处理黄瓜种子上的RAPD指纹图谱

图3 引物S190在人工老化黄瓜种子上的RAPD指纹图谱

图4 引物S190在PEG处理黄瓜种子上的RAPD指纹图谱
总之,黄瓜种子在人工老化过程中其基因组DNA的损伤是随机发生的。随着老化程度的加重,随机引物在基因组DNA上的特定结合位点被破坏,表现为RAPD扩增的DNA带的减少甚至消失。而PEG渗调引发对黄瓜种子中损伤的DNA具有一定的修复作用,表现为DNA带重新出现或者与对照基本相同,从而建立了黄瓜老化种子基因组DNA的损伤与修复的RAPD指纹图谱。但是,DNA损伤和PEG渗调引发的机制还需要进一步研究。
[1]McDonald M B,Elliot L J,Sweeney P A.DNA extraction Rom dry seeds for RAPD analyses in varietal identification studies[J].Seed Sci Technol,1994,22:171-176.
[2]Williams J G K,Kubelik A R,Lvak K J,et al.DNA polymorphism amplified by arbitrary primers[J].Nucleic Acids Res,1990,18(22):6531-6535.
[3]乔爱民,傅家瑞,刘佩瑛.分子标记在植物上的应用[J].长江蔬菜,1999(4):1-4.
[4]惠东威,陈受宜.RAPD技术及其应用[J].生物工程进展,1992,12(6):1-5.
[5]王刚刚,谭仲明,张义正.RAPD分析在诸葛菜与太白诸葛菜种间正反交杂种中的应用[J].四川大学学报:自然科学版,1999,36(2):343-346.
[6]乔代蓉,曹毅,徐柯,等.不同生态型麦冬特异分子标记的选择与鉴定[J].四川大学学报:自然科学版,2002,39(2):361-364.
[7]李俊丽,向长萍,张宏荣.南瓜种质资源遗传多样性的RAPD分析[J].园艺学报,2005,32(5):834.
[8]谢伟,乐超银,林直,等.兰属品种RAPD鉴定和亲缘关系分析[J].江苏农业学报,2005,21(4):369.
[9]雷高鹏,乔代蓉,熊焰,等.麦冬道地性的RAPD分析[J].四川大学学报:自然科学版,2006,39(2):1374-1378.
[10]马虹,左开井,唐克轩,等.东方百合杂交系部分栽培品种的遗传多样性分析[J].四川大学学报:自然科学版,2007,44(1):181-185.
[11]Dellaporta S L,Woods J,Hicks J B.A plant DNA minipreparation[J].Plant Mol Bio Rep,1983,1:19-21.
[12]乔爱民,傅家瑞.PEG渗调引发处理对菜薹老化种子DNA损伤的修复作用[J].园艺学报,2000,27(1):62-64.
[13]罗进贤.分子生物学引论[M].广州:中山大学出版社,1987:144-170.
[14]Ashraf M,Bray C M.DNA synthsis in osmoprimed leek (Allium porrumL.)seeds and evidence for repair and replication[J].Seed Science Research,1993,3:15-23.
[15]Burgass R W,Powell A A.Evidence for repair processes in the invigoration of seeds by hydration[J].Annals of Botany,1984,53:753-757.
[16]Osborne D J.Biochemical control systems operating in the early hours of germination[J].Canadan Journal of Botany, 1983,61:3568-3577.
[17]Dell'Aquila A.Water uptake and protein synthesis in germinating wheat embryos under the osmotic stress of polyethylene glycol[J].Annals of Botany,1992,69:167-171.
[18]Chunwongse J,Martin G B,Tanksley S D.Pregerination genotypic screening using PCR amplification of half-seeds [J].Theoretical and Applid Genetics,1993,86:694-698.
[19]Shatters R G,Schweder M E,West S H,et al.Environmentally induced polymorphisms detected by RAPD analysis of soybean seed DNA [J].Seed Science Research, 1995,5:109-116.
RAPD Studies on Genomic DNA Damages During Artificial Aging and Its Osmoprimed Repair with PEG in Cucumber Seeds
WU Chunlian1,QIAO Aimin2,SUN Min3
(1.School of Life Sciences,China West Normal University,Nanchong,Sichuan 637002; 2.Departure of Horticulture,Zhongkai Agrotechnical College;3.School of Life Sciences,Southwest University)
RAPD was applied to DNA polymorphism analysis of artificial aged and PEG osmoprimed seeds in Cucumber, and the fingerprints of RAPD were established among genomic DNA damages of cucumber seeds.Twenty-two priemrs from 92 were suitable for cucumber seeds of artificial aging and 16 primers from 92 were suitable for cucumber seeds of PEG treatment.A comparative study was made on DNA bands of cucumber seeds of artificial aging and PEG osmoprimed repairment with six primers S190,S300,S359,S475,S1140 and S2144.The results showed that DNA bands of artificial aging seeds were weaker till they disappeared completely,but when they were repaired with PEG,the amplified DNA profile was the same as control or almost the same as the control.Therefore,the fingerprint of RAPD was established among genomic DNA damages of cucumber seeds during artificial aging and its osmoprimed repairment with PEG.
Cucumber seed;Artificial accelerated aging;DNA damage and repair;PEG osmopriming;RAPD
10.3865/j.issn.1001-3547.2009.14.005
广东省自然科学基金资助(NO.001424)
伍春莲(1976-),女,博士,讲师,主要从事细胞与分子生物学研究,电话:13281952429。E-mail:wcl_xj@163.com
2009-04-09
