铜与稀硝酸反应及一氧化氮性质实验的联合设计
2009-01-20尚广斗
尚广斗
1问题的提出
铜与稀硝酸反应的实验是中学化学的重要演示实验之一,如图1所示为人教版高中第二册第16页[实验1-7]图1-18所示的实验装置,演示过程中发现该实验存在以下缺点。
①反应一旦进行,就难以及时终止;②便于收集产生的气体,但无法进一步进行气体产物的性质实验;③反应生成的NO气体因接触空气生成红棕色的NO2气体影响观察NO气体的颜色:④反应生成的NO气体不能够被NaOH溶液吸收。
现将铜与稀硝酸反应的实验加以改进。
2实验用品
2.1仪器
青霉素瓶、10ml一次性医用塑料注射器等。
2.2药品
粗铜丝、大约4mol/L的稀硝酸、NaOH溶液、蒸馏水等。
3实验装置
如图2所示。
4实验操作
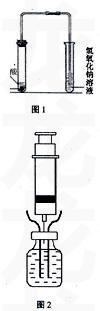
4.1铜与稀硝酸反应的实验
4.1.1先用注射器向封口、洁净的青霉素瓶注入大约10ml稀硝酸,然后将两根粗铜丝的其中一端都打磨成针状再插入青霉素瓶内。使铜丝下端位于液面以上。
4.1.2用10ml注射器将青霉素瓶内的剩余空气尽量抽尽(抽2—3次),再将内无空气的该注射器的针头插入青霉素瓶内,注意应使针头下端位于液面以上。
4.1.3给青霉素瓶热水浴加热一会儿,按下两根铜丝,观察发生的实验现象,可以看到:铜丝表面有无色气泡产生,溶液变成蓝色。由于产生大量无色气体,瓶内气压增加到一定程度时,注射器的活塞被迫向外移动,从而用注射器收集到无色的NO气体。
4.1.4当注射器收集到大约5mlNO气体时。上移铜丝使其下端脱离液面,反应随即停止。将注射器从青霉素瓶上取下备用。再用另外一支干燥的注射器使用上述装置用同样的方法制取并收集约5ml NO气体。
4.2一氧化氮的性质实验
4.2.1溶解性。将盛有5ml NO气体注射器的针头插入盛有水的烧杯中,吸入适量水振荡,观察现象。可看到气体的体积无明显变化,说明NO难溶于水且不与水反应。
4.2.2与氧气反应。向盛有5ml NO的于燥注射器内吸入适量空气。观察注射器内发生的实验现象,可以看到:无色气体变成红棕色。说明NO易跟O2反应生成红棕色的NO2气体。
将该注射器的针头插入水中并向该注射器内抽入少量蒸馏水,保持注射器内的活塞位置不变,观察发生的实验现象,可以看到:红棕色气体变成无色,注射器内液面上升,说明NO2易溶于水且与水反应。
4.2.3实验完成后,用NaOH溶液等对废气、废液进行处理。
5改进意义
该实验方法用青霉素瓶作为反应器使铜与稀硝酸反应在几乎隔绝空气的条件下进行。避免了气体产物与空气的直接接触,便于及时观察到NO气体颜色的“本来面目”。并可用注射器收集到较纯的NO气体,从而可进行NO的性质实验。
由于实验在封闭体系中进行,无有毒气体排放,避免了空气污染。
实验中可随时通过上下移动铜丝,可以控制反应的发生、快慢和停止。
组装一套该装置器材简单,材料易得,操作方便,可进行多次演示。
该装置也适合于演示铜与浓硝酸反应并制取NO2等实验。
