电解饱和氯化钠溶液的一个微型实验设计
2009-01-20何性刚蔡发泉
何性刚 蔡发泉
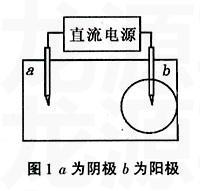
1实验装置图
见图1。
2实验仪器和药品
直流电源,PH试纸,滤纸,饱和的氯化钠溶液,带导线的碳棒两根,胶头滴管,玻璃片。
3实验操作
先在玻璃片上放一张直径为11cm的滤纸。然后在滤纸中部依次平铺3-5张PH试纸。再用胶头滴管取饱和氯化钠溶液润湿PH试纸。接通电源。将两碳棒竖立置于PH试纸的两个点上,两电极相距约3cm。
4实验记录及现象分析
4.1电压的选择
该实验在多大电压下反应现象明显,效果好,探究如下。
根据上表数据分析。在电压16V时两碳棒处出现的现象最快,但由于此时产生的CI2量较多,嗅觉感觉明显,对学生和老师的身心危害较大。从环保的角度和绿色化学的理念考虑,采用12V或14V反应电压即可较快的观察到现象,又减小了对环境的污染。

4,2现象
①a电极(阴极)与试纸接触处PH试纸变蓝,出现一个蓝色圆圈;②b电极(阳极)与试纸接触处出现一个双色同心圆,内圆为白色,外圆为浅红色;③两碳棒间的圆圈宽度大于外侧宽度。
4.3原理
a电极作为阴极,其电极处的水电离的H+得到电子生成H2,而留在溶液里的OH-使a电极处的PH试纸变蓝。
6电阴作为阳极,其电极处发生了氧化反应产生Cl2,2Cl-2e=Cl2,氯气溶于溶液中Cl2+2H2O=HCI+HClO,产生次氯酸,次氯酸的漂白作用使电极与试纸接触出的PH试纸变白产生一个白色圆。产生的次氯酸和盐酸电离出的H+向阴极迁移时,则在外部产生一个浅红色的外圆。
阳极处的H+向阴极迁移,阴极处的OH-向阳极迁移,从而造成两碳棒间的圆圈宽度大于外侧。
5实验优点
实验微型化,设计科学。所需仪器较少,操作更简单,现象明显。生成的氯气是微量的,对空气的污染很小,符合绿色化学理念。若该微型实验作为演示实验,结合多媒体现代教学仪器投影仪使用。能使学生更清楚的观察到实验过程及现象,会给学生留下深刻的印象,收到很好的教学效果。