耐力训练及限制饮食对单纯性肥胖大鼠脂肪合成的影响
2008-10-29王立靖衣雪洁
王立靖 衣雪洁
摘要:为探讨运动及限制饮食对单纯性肥胖大鼠脂合成的影响,将大鼠随机分为四组:正常饮食对照组(ND),高脂饮食非运动组(HN),高脂饮食运动组(HE)和限制高脂饮食运动组(LE)。造肥胖模型后对HE和LE组实行游泳耐力训练,期间LE组进行限制性高脂饮食。10周后,测定其体重、体长、脂肪垫重量,并测定其肝组织乙酰CoA羧化酶(ACC)基因表达、甘油三酯、血胰岛素及极低密度脂蛋白水平。游泳训练后,HE和LE组ACC基因表达比HN组分别下降19.6%和36.3%,大鼠体重及体脂百分比也显著下降;LE组甘油三酯、血胰岛素和极低密度脂蛋白水平显著降低。且LE组甘油三酯含量比HE组显著下降。耐力训练降低了大鼠脂类的合成,结合限制饮食使这种趋势更明显,减肥效果更好。
关键词:单纯性肥胖;运动;饮食;乙酰CoA羧化酶
中图分类号:G804.5文献标识码:A文章编号:1007-3612(2008)09-1215-04
Influence of Endurance Training and Food-Restriction on Fat Synthesis in Rats with Simple Obesity
WANG Li-jing1, YI Xue-jie2
(1. Southeast University, Nanjing 210096, Jiangsu China; 2. Shenyang Sport University, Shenyang 110032, Liaoning China)
Abstract:To explore the effects of endurance training and food-restriction on fat synthesis, we divide rats into four groups randomly: Normal diet contrast group (ND), high fat diet non-exercise group (HN), high fat diet exercise group (HE) and high-fat diet-limiting exercise group (LE). After making fat rats model, rats of HE and LE groups are trained to swim, and rats of LE group go on the restricted-high fat diet during this time. we measure their weight, the length of bodies, fat cushion weight, and also determine the level of acetyl CoA carboxyl enzyme ( ACC ) gene expression, triglyceride in rats liver, and the level of blood insulin, very low-density lipoprotein. 10 weeks later, ACC gene expression is 19.6% and 36.3% in HE and LE groups lower than that in HN group, and the rats weight and body fat content decreases remarkably too. The level of liver triglyceride, blood insulin, and very low-density lipoprotein in LE group decrease remarkably. Moreover, the liver triglyceride level of LE group decreases remarkably compared with HE group. Endurance training reduces fat synthesis, and it is has a more effective function if combined with food-restriction.
Key words: simple obesity; exercise; diet; Acetyl CoA carboxyl enzyme
肥胖是近年来一种常见的能量代谢性疾病,随着人们生活方式的改变及生活水平的提高,肥胖在人群中占有越来越高的比例,肥胖与高血压、糖尿病、脑血管意外、癌症等多种疾病密切相关。临床上,肥胖按其发生机制可分为病理性肥胖和单纯性肥胖两类,单纯性肥胖占肥胖总数的90%以上,其病因尚不十分明确,目前认为其发病与饮食及生活方式有关。
运动及运动加限制饮食是一种很好的减肥方式,它既能改善身体机能状态,同时对机体又几乎无副作用,被肥胖人群广泛采用。以往研究重点主要放在了运动后脂肪分解供能方面上,而对脂肪合成因素的变化研究较少。脂肪的合成大部分在肝组织中进行,乙酰CoA羧化酶(ACC) 是肝组织中脂肪酸合成限速酶,对肝中甘油三酯的合成起到重要的促进作用,甘油三酯释放入血后主要以极低密度脂蛋白的形式运输。
Jang报道,饮食易感性肥胖大鼠肝组织中ACC基因表达明显高于正常对照组[1],耐力训练及限制饮食对单纯性肥胖大鼠肝组织ACC基因表达的影响还未见报道。本次试验通过测定大鼠肝组织中ACC基因表达、甘油三酯及血中极低密度脂蛋白的水平探讨耐力训练和耐力训练加限制饮食对肥胖的影响。
1实验材料及方法
1.1实验动物及分组┆雄性4周龄(Sprague-Dawley)SD大鼠40只,体重约50 g/只,购自沈阳医学院动物饲养部。所有动物适应性饲养一周后,随机分为四组:正常对照组(ND)、高脂饮食不运动组(HN)、高脂饮食运动组(HE)和限制高脂饮食运动组(LE)。分组后组间体重无统计学差别。饲料配方:正常对照组采用国家标准饲料,其余三组采用高脂高营养饲料[2]。室温(23±3)℃,相对湿度为45%±10%,通风良好,每天定时人工照明(12 h),造肥胖模型期间大鼠自由摄取食物,自由饮水。
1.2运动方案┒苑逝肿榇笫蠼行高脂饲料喂养10周后,其体重超过对照组大鼠平均体重25%[3](P<0.001),HE和LE组大鼠开始3 d试游泳,前3 d试游泳时间分别为每天15min,30 min,45 min,以后开始保持60 min/d,6 d/周,持续10周,水温(34±2)℃,水池长100 cm,宽60 cm,高80 cm。其间LE组每天给与饮食量为HE组的85%,其余三组饮食不变。
1.3取样和测定大鼠在末次游泳训练后禁食过夜,次日取材,随机去除多余大鼠使每组均为8只,测定其体重及体长,计算 lees指数(3体重(g)×103/体长(cm)),然后眼球取血处死大鼠。采集的血样在室温下3 000 rpm离心10 min,分离血清,密封,—20℃保存,待测。剥离大鼠肾周和附睾周围脂肪组织并称重。
1.3.1肝组织ACC基因表达的测定用氯仿/异丙醇/酒精一步法抽提肝组织总RNA,总RNA抽提试剂盒(上海生工生物工程技术服务有限公司)。 按上海生工生物工程公司逆转录试剂盒说明书,合成反应液总量为20 μL的反应体系(表1)。

ACC引物根据参考文献[4]与基因文库(J03808)设计,由北京华美生物工程公司设计合成。上游为序列:5'CAGGCCGGATGCAGGAGAAG3',下游序列:5'GAGATGTGC TGGGTCATGTGGAC3'。内对照β-actin基因的上游引物序列:5'AGCCTTCCTTCCTG GGTATG3',下游引物序列:5'AGCGTACTCCTGCTTGCTCA3'。ACC扩增片断为380bp,内对照扩增长度为700bp
PCR反应按试剂盒说明书(上海生工生物工程技术服务有限公司)按以下条件进行(表3)。

1.3.2肝甘油三脂的测定取肝右叶0.2 g加入1.8 mL生理盐水中,匀浆,3 000 rpm离心15 min,取上清液,严格按试剂盒说明(宁波慈城试剂公司)用分光光度法测定。
1.3.3血中极低密度脂蛋白水平的测定取血清并严格按试剂盒说明宁波慈城试剂公司)用分光光度法测定。
1.3.4血中胰岛素水平的测定取血清用放免法(解放军总医院科技开发中心放射免疫研究所)严格按照试剂盒说明测定。
1.4统计学处理实验数据应用SPSS12.0软件包进行处理,均数间比较采用单因素方差分析Turckeys'检验。
2结果
2.110周肥胖造模后各组大鼠体重、Lees指数及肥胖组体重肥胖度┆见表4
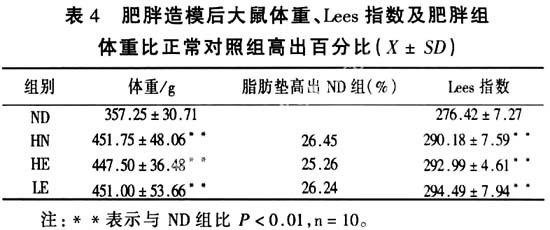
表4显示 ,10周肥胖造模后HN、HE及LE组大鼠体重及Lees指数均显著高于ND组(玃<0.01),这三组间体重及Lees指数无统计学差别,且HN、HE及LE组大鼠体重均比ND组高出25%以上,造肥胖模型成功。
2.2游泳训练和游泳训练加限制饮食后大鼠体重、lees指数及体脂百分比┆见表5。
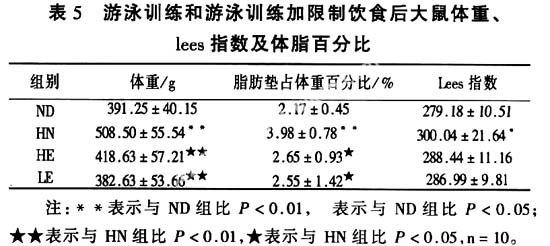
表5显示,游泳训练后HN组大鼠体重及体脂百分比比ND组显著升高(玃<0.01),Lees指数明显升高(玃<0.05);HE和LE组大鼠体重比HN组显著下降(玃<0.01),体脂百分比明显下降(玃<0.05);其余各组间Lees指数无统计学差异;LE组大鼠体重、体脂百分比比HE组均有下降趋势,但无统计学差异。
2.3游泳训练后各组大鼠肝组织ACC基因表达结果┆见下图1。
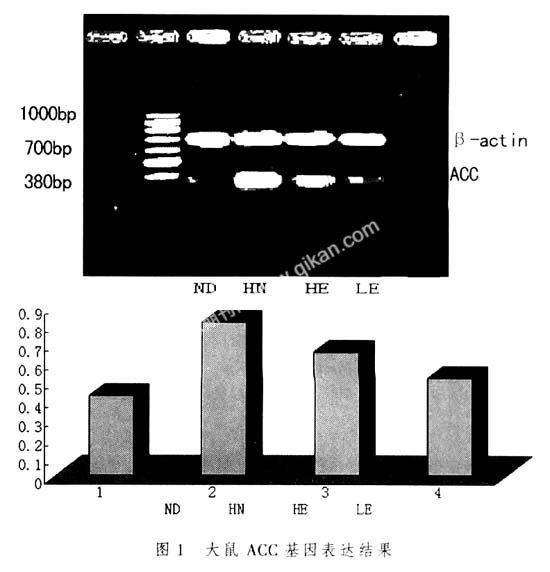
图1大鼠ACC基因表达结果图1显示,肝组织中ACC基因表达在HN组最高,比ND组升高93.1%,HE及LE组比HN组分别下降19.6%和36.3%,经游泳耐力训练及耐力训练加限制饮食后出现了明显的下降。
2.4游泳训练和游泳训练加限制饮食对大鼠肝组织中甘油三酯含量及血中极低密度脂蛋白和胰岛素的影响

表6显示,HN组大鼠血胰岛素水平、肝中甘油三酯含量及血中极低密度脂蛋白水平均显著高于ND组;HE组与HN组相比这三个指标均未发生显著变化,LE组胰岛素和极低密度脂蛋白和甘油三酯水平均显著下降;与HE组相比,LE组甘油三酯含量也显著下降,其余两个指标并未发生显著变化。
3讨论
肥胖已成为21世纪人类健康的杀手,对肥胖病的防治刻不容缓。人们一直在探索治疗肥胖的有效的途径,但目前尚未见明显的突破,本试验通过给与SD大鼠高脂高营养饮食10周后,成功造肥胖模型。经游泳耐力训练,显著降低了肥胖大鼠体重及体脂百分比,以此证明耐力游泳训练可起到减肥效果。限制饮食在动物试验中较容易实施,但对于广大肥胖患者若限制饮食量较大会导致饥饿感觉强烈,不容易坚持。国外有文献报道[5]单纯性限制饮食一般饮食限制量为肥胖对照组的80%左右,而本次实验要把耐力训练与限制饮食联合作用,因此我们把耐力训练加限制饮食组的饮食量定为单纯性运动组平均饮食量的85%,经8周游泳耐力训练加限制饮食作用后,比单纯性运动组有放大减肥效果的作用,提示耐力训练加限制饮食联合作用比单纯耐力训练有更好的治疗肥胖效果。下面将对耐力训练和耐力训练加限制饮食减肥部分作用机制进行讨论:
3.1游泳耐力训练和耐力训练加限制饮食对单纯性肥胖大鼠肝组织中甘油三酯合成的影响脂肪的合成在肝组织最为旺盛,ACC是肝组织中脂肪酸合成限速酶,它主要存在细胞液中[6],催化脂肪酸合成的第一步反应, 即乙酰CoA合成丙二酰CoA, 后者可进一步生成脂肪酸,并能阻止肉碱脂酰转移酶Ι将长链脂肪酸转移至线粒体内膜, 从而可减少长链脂肪酸的氧化并促进脂肪酸和甘油三酯的生成[7]。
Malewia报道肥胖大鼠肝组织匀浆中乙酰CoA羧化酶(acetyl-CoA carboxyl enzyme,ACC)含量高于正常大鼠肝组织中ACC含量[8]。McCarty认为降低肝脏中ACC的活性可降低其甘油三酯的生成。ACC基因表达或活性变化可以直接影响FFA水平,因而影响了组织中甘油三酯的合成。本试验中单纯性肥胖组大鼠肝组织中ACC基因表达比正常对照组组高93.1%,肝组织中TG含量也比正常对照组极显著升高,两者变化趋势相一致。提示高脂膳食引起大鼠肥胖,肝组织中ACC基因表达升高促进脂肪酸和甘油三酯的合成增加是诱导大鼠肥胖的重要原因之一。
运动可以降低肥胖者脂肪含量,肝组织中ACC基因表达的变化可能在其中起着重要的作用。耐力训练使遗传性肥胖大鼠肝组织中ACC基因表达下降,脂肪酸生成减少[9]。但在所查文献中并未见到有关于耐力训练对单纯性肥胖大鼠肝中ACC基因表达的影响。本次实验通过施加耐力训练降低了单纯运动组大鼠肝组织中ACC的基因表达,其肝脏中甘油三脂含量也发生极显著下降。可以认为,耐力训练无论是对遗传性肥胖还是对单纯性肥胖,都可以通过降低肝组织中ACC基因表达来降低肝组织中甘油三酯的合成,进而使VLDL入血量减少。
限制饮食同样可以影响ACC基因表达。Winder报道,限制饮食可以降低肝组织中ACC基因表达,使ACC基因表达下降[10]。本次实验也发现,限制饮食组大鼠肝组织中ACC基因表达低于单纯运动组,同时肝组织中甘油三酯含量也出现显著下降。如果单纯限制饮食,ACC基因表达下降幅度较小。限制饮食组大鼠在单纯性耐力训练基础上进一步限制了能量的摄入,加强能量代谢负平衡,使肝组织中脂肪酸合成底物减少,ACC基因表达同时降低,甘油三酯合成量降低,更有效地促进减肥作用。
3.2游泳耐力训练及耐力训练加限制饮食对单纯性肥胖大鼠血液中极低密度脂蛋白水平的影响肝组织中甘油三酯与Apo B等载脂蛋白结合后生成VLDL微粒释放入血,血液中甘油三酯主要存在于极低密度脂蛋白中。本研究结果显示,肥胖组大鼠血中极低密度脂蛋白水平显著高于正常对照组。赵源源报道,肥胖者血中VLDL水平显著高于正常[11]。这可能是由于肥胖者肝组织中ACC基因表达的增高,促使肝中甘油三酯合成增加,进而造成了血液中极低密度脂蛋白升高,单纯性肥胖大鼠体内存在着明显的脂合成紊乱。
耐力训练可以明显改善肥胖者脂代谢紊乱,降低血液中极低密度脂蛋白水平[12]。本实验结果显示,单纯运动组大鼠血中极低密度脂蛋白水平有下降趋势,但并无统计学差别,这可能与本试验选择的训练强度大小及训练时间长短有关。
有关限制饮食对肥胖者肝组织中甘油三酯的合成及极低密度脂蛋白在血中转运的影响报道并不多见。本试验限制饮食组大鼠血中极低密度脂蛋白水平与单纯运动组相比有下降趋势,但并无统计学差异,说明单纯限制饮食对脂代谢紊乱的改善无明显意义。但限制饮食与游泳耐力训练联合作用后,血极低密度脂蛋白水平与单纯性运动组相比,发生了更显著的降低,使脂代谢紊乱得以更好的改善。限制饮食是在机体运动能量消耗增加的基础之上使能量代谢进一步达到负平衡,增加了极低密度脂蛋白的供能作用,达到更好的减肥效果。
3.3耐力训练和耐力训练加限制饮食对胰岛素在脂肪合成及血脂转运过程中作用的影响
3.3.1肥胖状态下胰岛素对肝组织中脂肪合成及血脂转运的调节本试验中肥胖组大鼠血胰岛素水平显著高于正常对照组。胰岛素对肝脏中甘油三酯的合成及极低密度脂蛋白在血中的转运等均有重要影响。实验证明,少活动且肥胖大鼠体内每一个β细胞分泌胰岛素的能力降低,且肌细胞膜上葡萄糖载体对胰岛素的敏感性降低,影响了肌细胞对葡萄糖的摄取,这就需要更多的胰岛细胞来维持葡萄糖的动力学平衡,使胰岛素不正常的升高,而且有可能发生肌组织胰岛素抵抗[13],使肌肉利用脂肪减少,导致肥胖加重。
胰岛素是影响ACC基因表达的重要因素之一,Rumberger报道,胰岛素的升高能促进ACC基因表达的增高[14],并且ACC活性与胰岛素水平呈线性正相关[15]。胰岛素一方面可以通过作用于蛋白磷酸酶促使磷酸化的ACC恢复活性,另一方面,还可以在基因水平上直接提高其表达。另外,胰岛素还能直接促进周围组织摄取FFA[16],促进甘油三酯的合成,进而影响极低密度脂蛋白的合成。
高胰岛素水平引起肝脏中ACC基因表达增加,使肝组织中脂肪酸及甘油三酯生成增加。肥胖大鼠肝组织中ACC基因表达的增高能够促进甘油三酯的合成及VLDL向血液中的释放,可能是单纯性肥胖发生发展过程中的一个重要原因。
在胰岛素增高状态下,肥胖大鼠肝脏中VLDL微粒合成增加而分解减少。体内研究显示,高浓度胰岛素抑制甘油三酯的酯解,刺激甘油三酯的酰化[17]。Sparks认为,血中富含甘油三酯的脂蛋白受胰岛素的正向调节[15]。本试验结果也显示,胰岛素水平的的增高可能是肥胖大鼠脂代谢紊乱的一个重要原因[18]。
3.3.2游泳耐力训练及游泳耐力训练加限制饮食后胰岛素对脂代谢的影响游泳耐力训练后,单纯运动组大鼠血胰岛素水平比肥胖组显著下降,对ACC基因表达的促进作用减少,ACC基因表达下降,肝组织中TG合成减少,进而使极低密度脂蛋白释放入血减少。
胰岛素抵抗现象在耐力训练后得到改善,引起血极低密度脂蛋白的分解。本实验中,运动组大鼠血胰岛素水平发生了显著下降,各项脂代谢指标也趋近正常,游泳耐力训练改善了单纯性肥胖大鼠的高胰岛素血症及脂代谢紊乱。
Pesonen认为,限制饮食可以降低肥胖者血胰岛素水平[19],从而改善脂代谢紊乱。经施加限制饮食后,耐力训练加限制饮食组除肝脏中甘油三酯含量比单纯运动组下降显著外,血胰岛素和极低密度脂蛋白水平与单纯运动运动组相比并无统计学差异,但有向良好方向发展的趋势。限制饮食使机体能量摄入减少,促进能量代谢达到负平衡,但与单纯运动组相比,单纯限制饮食在本次试验中意义并不明显,分析可能是与限制饮食的程度较小或时间短有关。但耐力训练加限制饮食组与肥胖组相比,其血胰岛素水平、肝中ACC基因表达下降显著,肝组织甘油三酯含量和血极低密度脂蛋白水平均显著下降。耐力训练联合限制饮食作用对脂代谢紊乱的改善有更好的促进作用,减肥效果更加明显。
4结论
耐力训练通过改善肥胖大鼠胰岛素抵抗,下调大鼠肝脏中ACC基因表达,降低了肝组织中甘油三酯的合成,同时降低了血液中极低密度脂蛋白的转运,进而肥胖者之代谢紊乱及减轻体重的目的。结合限制饮食使血胰岛素水平、脂肪在肝组织中合成及血脂转运有向更好的方向发展的趋势,具有更好的减肥效果。
参考文献:
[1] Jang I, Hwang D, Lee J, et al. Physiological Difference between Dietary Obesity-Susceptible and Obesity-Resistant Sprague Dawley Rats in Response to Moderate High Fat Diet[J]. Exp Anim 2003, 52(2): 99-107.
[2] 施新猷.现代医学实验动物学[M].北京:人民军医出版社,2000,(9):483.
[3] 孙志,张中成,刘志诚.营养性肥胖动物模型的实验研究[J].中国药理学通报,2002,18(4):466-7.
[4] Young L, May W,Tetsuya K,et al.Liporegulation in Diet-induced Obesity[J].J Biol Chem,2001,276(8):5629-5635.
[5] Luscombe ND, Clifton PM, Noakes M,et al. Effect of a high-protein, energy-restricted diet on weight loss and energy expenditure after weight stabilization in hyperinsulinemic subjects[J].Int J Obes Relat Metab Disord,2003,27(5):582-90.
[6] Demetrios V, Alexios A, Asish K. et al. Contraction-induced Changes in Acetyl-CoA Carboxylase and 5-AMP-activated Kinase in Skeletal Muscle [J]. J Biol Chem,1997,272(20):13255-13261.
[7] Jeukendrup AE.Regulation of fat metabolism in skeletal muscle [J]. Ann N Y Acad Sci 2002,967: 217-35.
[8] Malewiak MI, Griglio S, Le Liepvre X. Relationship between lipogendsis, ketogeNDsis, and malonyl-CoA content in isolated hepatocytes from the obese Zucker rat adapted to a high-fat diet [J]. Metabolism,1985,34(7):604-11.
[9] Atkinson LL, Kelly SE, Russell JC,et al. MEDICA 16 inhibits hepatic acetyl-CoA carboxylase and reduces plasma triacylglycerol levels in insulin-resistant JCR: LA-cp rats [J]. Diabetes,2002,51(5):1548-55.
[10] Winder WW, MacLean PS, Lucas JC, et al. Effect of fasting and refeeding on acetyl-CoA carboxylase in rat hindlimb muscle [J]. J Appl Physiol, 1995, 78: 578-582.
[11] 赵源源,马贵明,赵静,等.92例单纯性肥胖儿童血脂检测结果分析[J].南京医科大学学报,2001,24(1): 65.
[12] Aellea. Effect of aerobic and an aerobic training on plasma lipoprotein [J].Int J Sports Med 1993,14:396-400.
[13] Sparks JD, Sparks CE. Insulin regulation of triacylglycerol-rich lipoprotein synthesis and secretion [J]. Biochim Biophys Acta, 1994,1215:9-32.
[14] Rumberger JM, Wu T, Hering MA, et al. Role of hexosamiND biosynthesis in glucose-mediated up-regulation of lipogenic enzyme mRNA levels: Effects of glucose, glutamiND and glucosamiND on glycerophosphate dehydrogenase, fatty acid synthase, and acetyl-CoA carboxylase mRNA levels [J]. J Biol Chem, 2003, 278(31):28547-52.
[15] Girard J, Perdereau D, Foufelle F, et al. Regulation of lipogenic enzyme expression by nutrients and hormons[J]. FASEB J, 1994, 8(1): 36-42.
[16] Kim SP, Ellmerer M, Van Citters GW, et al. Primacy of hepatic insulin resistance in the development of the metabolic syndrome induced by an isocaloric moderate-fat diet in the dog[J].Diabetes,2003,52(10):2453-60.
[17] Coppack SW,Jensen MD, Miles JM. In vivo regulation of lipolysis in humans [J].J Lipid Res, 1994,35:177-193.
[18] Blaak EE. Fatty acid metabolism in obesity and type 2 diabetes mellitus [J]. Proc Nutr Soc, 2003,62(3):753-60.
[19] Pesonen U, Huupponen R, Rouru J. Hypothalamic neuropeptide expression after food restriction in Zucker rats: evidence of persistent neuropeptide Y gene activation [J]. Brain Res Mol Brain Res, 1992, 16(3-4):255-60.
