从肝治心组方对心肌缺血再灌注损伤大鼠心肌Nrf2、HO-1和铁转运相关蛋白的影响
2025-02-28汪辛强何飘朴美虹谢丽华曾阳王瑾茜张程程胡国恒陈亚


〔摘要〕 目的 研究从肝治心组方对心肌缺血再灌注损伤(MIRI)大鼠心肌保护作用及核转录因子红系2相关因子2(Nrf2)、血红素加氧酶-1(HO-1)、二价金属转运蛋白1(DMT1)和膜铁转运辅助蛋白(Heph)表达的影响。方法 将60只SPF级雄性SD大鼠随机分为正常组、假手术组、模型组、从肝治心组方组[5.32 g/(kg·d)]、麝香保心丸组[10.27 mg/(kg·d)]、地尔硫[艹][卓]组[6.86 mg/(kg·d)],每组10只。通过结扎左前降支冠状动脉30 min后再灌注120 min,构建MIRI大鼠模型,术后连续灌胃给药14 d后取材。采用HE染色观察心肌组织形态学变化,普鲁士蓝染色观察心肌组织铁沉积情况,透射电子显微镜检测心肌组织超微结构,RT-PCR、Western blot检测Nrf2、HO-1、DMT1、Heph mRNA和蛋白表达情况。结果 与正常组和假手术组比较,模型组大鼠心肌纤维排列紊乱,纤维瘢痕组织增生,铁沉积水平高,线粒体结构异常,线粒体内脊模糊,Nrf2、HO-1、Heph mRNA和蛋白表达下调(Plt;0.05),DMT1 mRNA和蛋白表达上调(Plt;0.05)。与模型组比较,各给药组大鼠心肌组织病理损伤改善,铁沉积水平降低,线粒体和内脊结构较完整,Nrf2、HO-1、Heph mRNA和蛋白表达上调(Plt;0.05),DMT1 mRNA和蛋白表达下调(Plt;0.05)。结论 从肝治心组方可能是通过激活Nrf2/HO-1信号通路,上调Heph的表达,下调DMT1的表达,减轻心肌组织铁沉积,发挥改善MIRI的作用。
〔关键词〕 心肌缺血再灌注损伤;从肝治心组方;核因子E2相关因子2;血红素加氧酶-1;膜铁转运辅助蛋白;二价金属转运蛋白1;铁代谢失衡
〔中图分类号〕R256.2" " " " "〔文献标志码〕A" " " " " 〔文章编号〕doi:10.3969/j.issn.1674-070X.2025.01.004
Effects of Conggan Zhixin Formula on Nrf2, HO-1, and iron transport-related proteins in myocardial ischemia-reperfusion injury in rats
WANG Xinqiang1, HE Piao1, PIAO Meihong2, XIE Lihua1,2, ZENG Yang1,2, WANG Jinxi1,
ZHANG Chengcheng2, HU Guoheng1, CHEN Ya1*
1. The First Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410007, China; 2. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China
〔Abstract〕 Objective To study the myocardial protective effects of Conggan Zhixin Formula on myocardial ischemia-reperfusion injury (MIRI) in rats and its influence on the expressions of nuclear factor-erythroid 2-related factor 2 (Nrf2), heme oxygenase-1 (HO-1), divalent metal transporter 1 (DMT1), and hephaestin (Heph). Methods Sixty male SPF-grade SD rats were randomly divided into normal group, sham-operated group, model group, Conggan Zhixin Formula group [5.32 g/(kg·d)], Shexiang Baoxin Pill group [10.27 mg/(kg·d)], and diltiazem group [6.86 mg/(kg·d)], with ten rats in each group. A MIRI rat model was established by ligating the left anterior descending coronary artery for 30 minutes followed by 120 minutes of reperfusion. Samples were collected after 14 consecutive days of gavage administration post-surgery. HE staining was used to observe the morphological changes in myocardial tissue, Prussian blue staining was employed to assess iron deposition in the myocardial tissue, and transmission electron microscopy was utilized to examine the ultrastructure of myocardial tissue. RT-PCR and Western blot were performed to examine the mRNA and protein expressions of Nrf2, HO-1, DMT1, and Heph. Results Compared with the normal group and sham-operated group, the model group exhibited disordered arrangement of myocardial fibers, fibrous scar tissue hyperplasia, high levels of iron deposition, abnormal mitochondrial structure with blurred cristae, and downregulated mRNA and protein expressions of Nrf2, HO-1, and Heph (Plt;0.05), as well as upregulated mRNA and protein expression of DMT1 (Plt;0.05). Compared with the model group, the rats in each drug-administered group showed reduced morphological damage in the myocardial tissue, reduced levels of iron deposition, more intact mitochondrial and cristae structures, more intact mitochondrial and cristae structures, upregulated mRNA and protein expressions of Nrf2, HO-1, and Heph (Plt;0.05), and downregulated mRNA and protein expression of DMT1 (Plt;0.05). Conclusion Conggan Zhixin Formula may exert its effects on reducing MIRI by activating the Nrf2/HO-1 signaling pathway, upregulating Heph expression, downregulating DMT1 expression, and reducing iron deposition in myoc⁃ardial tissue.
〔Keywords〕 myocardial ischemia-reperfusion injury; Conggan Zhixin Formula; nuclear factor-erythroid 2-related factor 2; heme oxygenase-1; membrane iron transporter accessory protein; divalent metal transporter 1; iron metabolism imbalance
随着人口老龄化发展和现代生活压力的增大,我国心肌梗死发病率不断上升,加重了社会经济负担。心肌缺血再灌注损伤(myocardial ischemic reperfusion injury, MIRI)是指心肌梗死后缺血区域心肌组织恢复血流后可能出现比之前更严重的损伤,其发病机制尚不明确,可能与细胞凋亡、坏死、铁死亡、氧化应激损伤、线粒体功能障碍、细胞内钙超载等有关,目前缺乏有效的治疗手段[1]。
近年来,铁死亡作为MIRI机制受到广泛关注。铁死亡是二价铁超载导致的超氧化应激反应,特点是铁代谢失衡和脂质过氧化产物增多,活性氧(reactive oxygen species,ROS)大量堆积在细胞内,导致细胞膜崩溃、细胞死亡[2]。铁死亡的发生与氧化系统和抗氧化系统之间的平衡失调密切相关,细胞内的铁沉积可以导致氧化应激损伤,核转录因子红系2相关因子2(nuclear factor-erythroid 2-related factor 2, Nrf2)是抗氧化系统中重要的转录因子,血红素加氧酶-1(heme oxygenase-1, HO-1)是其下游因子,具有抗炎、抗凋亡作用[3]。研究发现,Nrf2/HO-1信号通路不仅能抗氧化应激损伤,还对铁代谢失衡有调节作用,成为研究抗铁代谢失衡药物的热点[4]。
课题组前期研究发现,在缺氧/复氧损伤的H9c2心肌细胞中,Nrf2/HO-1信号通路被抑制,线粒体膜电位水平下降,ROS水平升高,与铁死亡有着密切关系,从肝治心组方可以抑制缺氧/复氧损伤H9c2心肌细胞铁死亡[5]。本研究以铁代谢失衡可能是MIRI发生机制为切入点,探讨MIRI模型大鼠心肌组织Nrf2、HO-1、膜铁转运辅助蛋白(hephaestin, Heph)和二价金属转运蛋白1(divalent metal-ion transporter 1,DMT1)的表达变化,以及从肝治心组方发挥MIRI保护作用的具体机制。
1 材料
1.1" 动物
雄性SPF级SD大鼠60只,体质量250~280 g,购自湖南斯莱克景达实验动物有限公司[许可证号:SCXK(湘)2019-0004]。饲养于湖南中医药大学SPF级实验动物中心[实验单位使用许可证编号:SYXK(湘)2019-0009],环境温度保持在(24±2) ℃,湿度保持在60%±10%,明/暗光线12 h交替,自由摄食和饮水,适应性喂养7 d。本实验经湖南中医药大学实验动物伦理委员会批准,伦理审查批号:LL2021101201。
1.2" 药物
从肝治心组方组成:红参10 g,当归10 g,丹参10 g,柴胡10 g,姜黄10 g,郁金10 g,白芥子5 g,九香虫5 g。水煎剂,滤液蒸发浓缩至含生药1.5 g/mL,由湖南中医药大学第一附属医院提供。麝香保心丸(国药准字:Z31020068,批号:210109,规格:22.5 mg/丸,上海和黄药业有限公司);盐酸地尔硫[艹][卓]缓释胶囊(Ⅱ)(国药准字:H12020126,批号:2101155,规格:90 mg/粒,天津田边制药有限公司)。
1.3" 主要试剂
HE染色试剂盒、普鲁士蓝染色试剂盒(北京索莱宝科技有限公司,批号:G1120、G1428);超纯总RNA提取试剂盒(杭州Simgen生物技术有限公司,批号:5003050);RT-PCR反应专用反转录试剂、扩增试剂(日本TaKaRa公司,批号:RR047A、RR820A);Nrf2抗体、HO-1抗体、DMT1抗体(武汉Proteintech生物技术有限公司,批号:16396-1-AP、27282-1-AP、20507-1-AP);Heph抗体、β-Tubulin(美国Affinity Bio⁃sciences生物科技有限公司,批号:DF13057、AF7011);彩色预染蛋白Marker、ECL化学发光底物试剂盒(合肥Biosharp生物科技有限公司,批号:BL712A、BL523B);Western快速转膜液、Western快速封闭液(上海Beyotime生物技术股份有限公司,批号:P0575-1 L、P0252-100 mL)。
1.4" 主要仪器
旋转蒸发仪(型号:RE-2000B,巩义中天科技仪器有限公司);数字心电图机(型号:ECG-2303B,广州三锐电子科技有限公司);小型动物呼吸机(型号:RWD407,深圳瑞沃德生命科技有限公司);病理切片机(型号:RM2016,德国Leica仪器有限公司);光学显微镜(型号:TS100,日本Nikon公司);透射电子显微镜(型号:FEI TECNAI G2 20 TWIN,美国FEI公司);核酸蛋白浓度测定仪(型号:BioDrop Ulite,英国Biochrom公司);多功能酶标仪(型号:Enspire,美国Perkinelmer公司);荧光定量PCR仪(型号:Roche LightCycler480 Ⅱ,瑞士Roche公司);蛋白印迹系统、化学发光系统(型号:Bio-Rad、CheemiDoc XRS+Imager,美国Bio-Rad公司)。
2 方法
2.1" MIRI模型的制备
大鼠术前禁食12 h、禁饮1 h,2%戊巴比妥钠0.3 mL/100 g体质量腹腔注射麻醉。气管插管,呼吸机辅助呼吸,连接数字心电图机,记录Ⅱ导联心电图,开胸暴露心脏,找到左心耳与肺动脉圆锥之间的左前降支冠状动脉(left anterior descending coronary artery, LAD),在左心耳下离根部2~3 mm,以6-0号带线缝合针结扎。术中监测心肌缺血成功标志:局部心肌颜色变紫色或灰色,Ⅱ导联心电图持续ST段抬高或倒置呈弓背向上抬高。持续30 min后打开结扎线再灌注120 min,再灌注成功标志:左前降支结扎以下缺血心肌颜色由紫色、灰色变鲜红色,抬高的ST段下降gt;50%,或高尖的T波下降。迅速复位心脏,关闭胸腔,腹腔注射青霉素10万U预防感染。脱离呼吸机后,待大鼠恢复自主呼吸后拔管,放回鼠笼,整个实验过程严格遵循无菌操作的要求。正常组不作处理,假手术组仅开胸而不结扎,其余手术过程与造模相同。
2.2" 分组及给药方法
60只大鼠随机分为正常组、假手术组、模型组、从肝治心组方组、麝香保心丸组、地尔硫[艹][卓]组,每组10只。正常组不作处理,假手术组只开胸不结扎LAD,其余各组制备MIRI模型大鼠。术后第1天各组开始干预,正常组、假手术组、模型组给予等体积蒸馏水灌胃;正常人一天服用从肝治心组方剂量为70 g,依据体型系数法[6]进行人与大鼠药物剂量换算,大鼠用药剂量为5.32 g/(kg·d);麝香保心丸正常人一天服用剂量为135 mg,换算得大鼠给药剂量为10.27 mg/(kg·d);盐酸地尔硫[艹][卓]缓释胶囊(Ⅱ)正常人一天服用剂量为90 mg,换算得大鼠给药剂量为6.86 mg/(kg·d)。灌胃14 d后处死各组大鼠,留取心肌组织行指标检测。
2.3" HE染色观察心肌组织形态学变化
将大鼠心肌组织用4%多聚甲醛固定24 h以上,梯度脱水,石蜡包埋后固定位置切片(厚度约为3~5 μm),脱蜡水化后HE染色,梯度脱水透明,封片后在光镜下观察心肌组织形态学变化。
2.4" 普鲁士蓝染色观察心肌组织铁沉积情况
将大鼠心肌组织制备成石蜡切片,脱蜡水化后普鲁士蓝染色工作液染色,孵育、复染、梯度乙醇脱水、二甲苯透明,封片后行显微镜观察心肌组织铁沉积情况。
2.5" 透射电子显微镜检测心肌组织超微结构
将新鲜的大鼠心肌组织用电镜固定液4 ℃固定2~4 h,冲洗后用1%四氧化锇固定2 h,再冲洗后用丙酮梯度脱水,100%环氧树脂中60 ℃包埋过夜。用Leica UC7切片(厚度为70 nm)后3%乙酸铀和柠檬酸铅37 ℃下各染色15 min。冲洗晾干后,用透射电子显微镜观察心肌组织超微结构。
2.6" RT-PCR检测Nrf2、HO-1、DMT1、Heph mRNA表达
取适量大鼠缺血再灌注区域心肌组织研磨匀浆,超纯总RNA提取试剂盒提取总RNA,测定RNA浓度,合成cDNA后使用RT-PCR扩增检测。参照www.ncbi.nlm.nih.gov/genbank设计引物,北京擎科生物科技有限公司合成引物,引物序列信息详见表1,使用2-ΔΔct的算法定量分析。
2.7" Western blot检测Nrf2、HO-1、DMT1、Heph蛋白表达
取适量大鼠缺血再灌注区域心肌组织研磨匀浆,RIPA裂解液4 ℃裂解30 min,4 ℃低温离心(12 000 r/min,10 min,离心半径6 cm)后收集上清液。检测各样本蛋白浓度,SDS变性后-20 ℃保存。制胶上样,电泳,转膜,封闭,一抗Nrf2(1∶2 000)、HO-1(1∶3 000)、DMT1(1∶1 000)、Heph(1:2 000)、β-Tubulin(1∶5 000)4 ℃孵育过夜。次日PBST洗膜4次,二抗IgG HRP(1∶5 000)常温孵育1 h,PBST清洗4次,避光配制ECL显色液,孵育盒用锡纸包裹好,将PVDF膜正面朝下置于ECL显色液中避光孵育3 min后,正面朝上置于仪器中显色,导出图片并用Image J软件分析灰度值。
2.8" 统计学方法
采用SPSS 22.0软件进行统计学分析。多样本计量资料以“x±s”表示,符合正态分布和方差齐性者,进行单因素方差分析,两组之间比较用独立样本t检验;方差不齐者,两组之间比较用Dunnett's T3法。均以Plt;0.05为差异有统计学意义。
3 结果
3.1" 各组大鼠心肌组织形态学变化
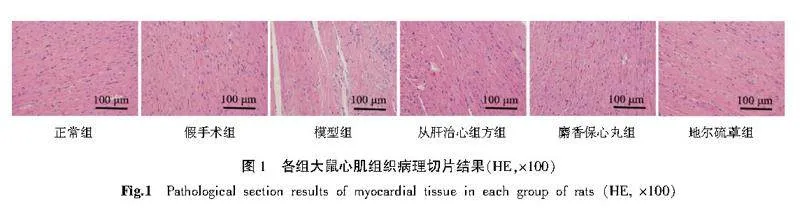
正常组大鼠心肌纤维规律排列,结构完整,细胞核清晰,细胞间质正常;假手术组心肌细胞之间少量炎性细胞浸润,细胞核大致正常;模型组可见心肌纤维排列紊乱稀疏,肌纤维断裂,偶可见心肌细胞发生斑片状坏死,细胞核皱缩甚或消失,细胞间质可见大量炎性细胞浸润,纤维瘢痕组织增生;与模型组比较,各给药组心肌组织形态学明显改善,肌纤维排列相对有序,炎症细胞浸润减少。详见图1。
3.2" 各组大鼠心肌组织铁沉积情况
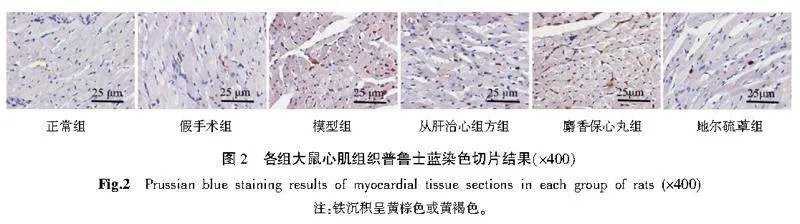
正常组和假手术组心肌组织铁沉积不显著;模型组铁沉积增多;各给药组相较于模型组,铁沉积减少。详见图2。
3.3" 各组大鼠心肌细胞超微结构观察结果
正常组和假手术组大鼠心肌细胞形态正常,心肌纤维排列规则,线粒体丰富,内脊结构完整;模型组心肌细胞形态上有差异,可见坏死心肌细胞,心肌纤维断裂,排列紊乱,线粒体分布不均,线粒体内脊模糊,自噬体形成;相比模型组,各给药组病理形态改善,心肌细胞形态差异小,心肌纤维排列相对规则,线粒体内脊排列规则、结构较清晰。详见图3。
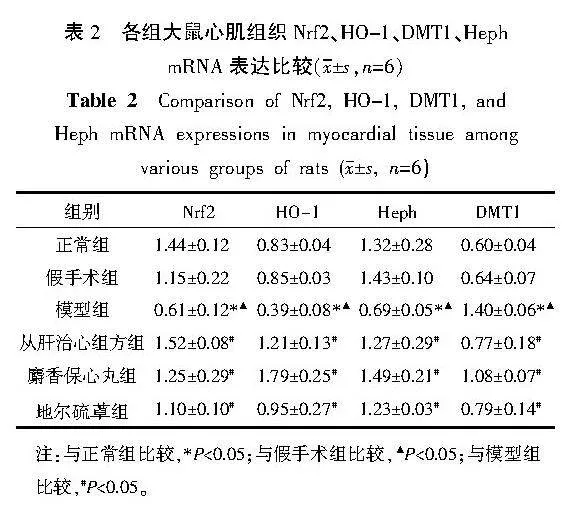
3.4" 各组大鼠心肌组织Nrf2、HO-1、DMT1、Heph mRNA的表达情况
与正常组比较,假手术组Nrf2、HO-1、DMT1、Heph mRNA表达差异无统计学意义(Pgt;0.05);与正常组和假手术组比较,模型组Nrf2、HO-1、Heph mRNA表达减少(Plt;0.05),DMT1 mRNA表达增加(Plt;0.05);与模型组比较,各给药组Nrf2、HO-1、HephmRNA表达增加(Plt;0.05),DMT1 mRNA表达减少(Plt;0.05)。详见表2。
3.5" 各组大鼠心肌组织Nrf2、HO-1、DMT1、Heph蛋白的表达情况
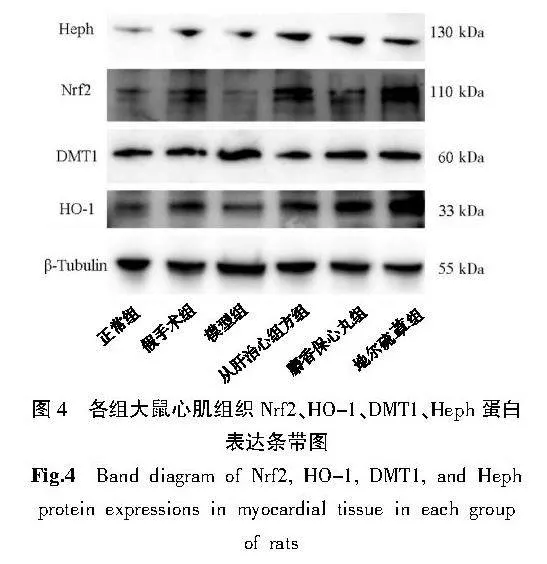
与正常组比较,假手术组Nrf2、HO-1、DMT1、Heph蛋白表达差异无统计学意义(Pgt;0.05);与正常组和假手术组比较,模型组Nrf2、HO-1、Heph蛋白表达减少(Plt;0.05),DMT1蛋白表达增加(Plt;0.05);与模型组比较,各给药组Nrf2、HO-1、Heph蛋白表达增加(Plt;0.05),DMT1蛋白表达减少(Plt;0.05)。详见图4、表3。
4 讨论
随着人口老龄化发展,我国心血管疾病的发病率和死亡率逐年上升,并且呈年轻化的趋势。其中,急性心肌梗死(acute myocardial infarction, AMI)是心血管死亡事件发生的主要原因,AMI是指因冠状动脉粥样硬化斑块急性破裂,继发冠状动脉血流中断或闭塞导致心肌急性坏死,同时具备心肌损伤和至少一项心肌缺血的临床证据[7]。快速恢复梗死部位血液灌注是治疗AMI的关键,急诊溶栓和经皮冠状动脉介入治疗是目前常用的再灌注治疗方法,但是心肌组织恢复灌注后可能出现比之前更为严重的损伤,即MIRI,主要表现为致死性心肌再灌注损伤、心肌顿抑、微血管阻塞以及心律失常,目前缺乏有效的治疗手段[8]。故MIRI的预防和改善逐渐成为心血管疾病研究领域的热点。
MIRI根据其症状表现,归属于中医学“胸痹心痛”范畴。追溯中医经典,《黄帝内经》中记载“气郁”为心病的重要病因病机。《石室秘录·双治法》提出“心病调肝”之说:“如人病心痛,不可只治心痛,必须兼治肝……盖心气之伤,由于肝木之不足,补其肝而心君安其位矣。”《石室秘录·偏治法》云:“人病心痛,不治心而偏治肝。”追溯方药记载,最早体现“心病调肝”之说的是《金匮要略》中的橘枳姜汤[9]。全国名中医王行宽认为,“肝心同治法”的理论基石主要有两方面:一是心、肝共主血脉,两者协调则肝有所藏,心血充盈;二是神、魂共主七情,心、肝各司神魂,共主七情,以行情志。从肝治心组方为心痛灵基础上增加疏肝解郁之品而成,是王行宽“心病治肝,肝心同治”学术思想的体现。该方中当归补血活血,红参大补元气、通血脉,二者共奏补养气血、活血化瘀之功,共为君药;丹参行气活血、益气养血,又入心、肝二经,攻补兼备,柴胡疏通肝木、宣畅气血,姜黄、郁金行气破瘀、宣降气机,四者共为臣药;白芥子豁痰开胸利气,为佐药;九香虫理胸膈之凝滞,为诸药先锋使者。此外,柴胡、郁金疏肝气,当归、红参养肝血,能解郁和肝。诸药合用,共奏补气活血、疏肝解郁之功。
铁从食物中摄取,由肠道吸收,通过血液遍布全身,主要储存在红细胞内[10]。铁对人体至关重要,作为血红蛋白和肌红蛋白的组成元素,参与氧气运输,也是机体中很多酶类的组成部分,参与机体能量代谢和过氧化氢生产过程,而心脏作为泵血器官,易发生铁超载类疾病[11]。生理情况下,铁的摄取和流失是平衡的,当MIRI时血流瘀滞,血红蛋白结构损伤,释放大量游离铁,心肌细胞内铁超载,铁离子进入线粒体,导致线粒体内铁沉积,铁离子蓄积后在H2O2的催化下发生芬顿反应和Haber-Weiss反应,形成过量ROS和脂质过氧化物,引起细胞膜和线粒体膜崩溃,导致心肌细胞铁死亡[12]。
心肌细胞线粒体铁含量比其他细胞高50%,心肌梗死区域红细胞大量溶解,细胞膜损伤,血红蛋白中铁释放并沉积,导致心肌细胞铁死亡,引发MIRI的病理事件[13]。本研究构建MIRI大鼠模型,结果显示,MIRI大鼠心肌纤维排列紊乱,纤维瘢痕组织增生,铁沉积水平高,线粒体结构异常,线粒体内脊模糊。从肝治心组方能够改善大鼠心肌组织病理形态学改变,减少心肌细胞核皱缩、坏死,减少细胞间质炎症细胞浸润,改善纤维瘢痕组织增生,减少心肌组织中铁沉积,降低线粒体损伤程度。多项研究表明,铁死亡与MIRI的发生密切相关,抑制铁死亡的发生可以减轻MIRI[10,14-16]。Nrf2是参与脂质过氧化过程中控制细胞内氧化稳态的关键调节因子[17]。在正常条件下,Nrf2和Kelch样Ech相关蛋白1(Kelch like Ech associated protein 1, Keap1)结合存在于细胞质中,在氧化应激下,分布在细胞质中的Nrf2从Keap1解聚,然后转移到细胞核中,与抗氧化反应原件结合,上调几种抗氧化的下游靶基因表达,包括HO-1、谷胱甘肽S-转移酶等,从而发挥细胞保护作用。其中,HO-1启动子包含核心抗氧化反应原件碱基序列,而Nrf2可以优先结合这些序列来诱导HO-1表达。Nrf2/HO-1信号通路参与铁死亡、细胞自噬、程序性细胞坏死和细胞凋亡的预防,可作为动脉硬化、心律失常和心肌梗死的潜在治疗靶点[18]。Nrf2已被证明可以通过对抗铁代谢失衡诱导的氧化应激来抑制铁死亡,也可以预防铁死亡激活剂引起的铁死亡[19]。Nrf2也能调控铁调素表达,以控制细胞内铁稳态和抗氧化系统[20]。HO-1参与铁代谢,可以将血红素降解为Fe2+、CO及胆绿素,当MIRI时,HO-1过表达促进铁沉积[21]。DMT1广泛表达,负责机体的铁吸收,铁超载时介导Fe2+进入细胞[22]。Heph是含铜的亚铁氧化酶,通过将Fe2+氧化成Fe3+来减轻铁过载诱发的氧化应激损伤[23]。本研究发现,MIRI大鼠心肌组织Nrf2、HO-1、Heph mRNA和蛋白表达减少,DMT1 mRNA和蛋白表达增加,而从肝治心组方使MIRI大鼠心肌组织Nrf2、HO-1、Heph mRNA和蛋白表达增加,DMT1 mRNA和蛋白表达减少,改善了MIRI大鼠心肌细胞铁死亡。
综上所述,从肝治心组方可能通过促进Nrf2/HO-1通路表达、上调Heph的表达以减轻铁过载诱发的氧化损伤,抑制DMT1的表达以减少具有氧化还原活性的Fe2+的吸收,维持铁代谢稳定,进而抑制了因铁离子价态不稳定导致芬顿反应和Haber-Weiss反应产生的ROS及脂质过氧化产物引起的心肌细胞铁死亡,从而对MIRI的心肌组织发挥保护作用。
参考文献
[1] TANG D L, CHEN X, KANG R, et al. Ferroptosis: Molecular mechanisms and health implications[J]. Cell Research, 2021, 31: 107-125.
[2] DIXON S J, LEMBERG K M, LAMPRECHT M R, et al. Ferroptosis: An iron-dependent form of nonapoptotic cell death[J]. Cell, 2012, 149(5): 1060-1072.
[3] GE M, YAO W F, YUAN D D, et al. Brg1-mediated Nrf2/HO-1 pathway activation alleviates hepatic ischemia-reperfusion injury[J]. Cell Death amp; Disease, 2017, 8(6): e2841.
[4] YANG J W, MO J J, DAI J J, et al. Cetuximab promotes RSL3-induced ferroptosis by suppressing the Nrf2/HO-1 signalling pathway in KRAS mutant colorectal cancer[J]. Cell Death amp; Disease, 2021, 12(11): 1079.
[5] 何" 飘, 朴美虹, 谢丽华, 等. 从肝治心组方通过Nrf2/HO-1通路对缺氧/复氧损伤H9c2心肌细胞铁死亡的影响[J]. 中药药理与临床, 2024, 40(1): 16-23.
[6] 魏" 伟, 吴希美, 李元建. 药理实验方法学[M]. 4版. 北京: 人民卫生出版社, 2010: 70-71.
[7] CHEN L, YAN S, HE Y, et al. Prediction of acute myocardial infarction in asian patients with acute ischemic stroke: The CTRAN score[J]. Journal of the American College of Cardiology, 2022, 2(7): 845-852.
[8] HAUSENLOY D J, YELLON D M. Myocardial ischemia-reperfusion injury: A neglected therapeutic target[J]. The Journal of Clinical Investigation, 2013, 123(1): 92-100.
[9] 王子焱, 范金茹, 张" 超, 等. 基于数据挖掘探讨全国名中医王行宽诊疗胸痹心痛遣方用药规律及学术经验[J].中国实验方剂学杂志, 2023, 29(5): 204-215.
[10] LI J Y, LIU S Q, YAO R Q, et al. A novel insight into the fate of cardiomyocytes in ischemia-reperfusion injury: From iron metabolism to ferroptosis[J]. Frontiers in Cell and Developmental Biology, 2021, 9: 799499.
[11] FANG X X, ARDEHALI H, MIN J X, et al. The molecular and metabolic landscape of iron and ferroptosis in cardiovascular disease[J]. Nature Reviews Cardiology, 2023, 20(1): 7-23.
[12] MANCARDI D, MEZZANOTTE M, ARRIGO E, et al. Iron overload, oxidative stress, and ferroptosis in the failing heart and liver[J]. Antioxidants, 2021, 10(12): 1864.
[13] WOFFORD J D, CHAKRABARTI M, LINDAHL P A. Mössbauer spectra of mouse hearts reveal age-dependent changes in mitochondrial and ferritin iron levels[J]. The Journal of Biological Chemistry, 2017, 292(13): 5546-5554.
[14] HUANG F Z, YANG R H, XIAO Z Z, et al. Targeting ferroptosis to treat cardiovascular diseases: A new continent to be explored[J]. Frontiers in Cell and Developmental Biology, 2021, 9: 737971.
[15] FAN Z Y, CAI L L, WANG S N, et al. Baicalin prevents myocardial ischemia/reperfusion injury through inhibiting ACSL4 mediated ferroptosis[J]. Frontiers in Pharmacology, 2021, 12: 628988.
[16] WU X G, LI Y, ZHANG S C, et al. Ferroptosis as a novel therapeutic target for cardiovascular disease[J]. Theranostics, 2021, 11(7): 3052-3059.
[17] WARPSINSKI G, SMITH M J, SRIVASTAVA S, et al. Nrf2-regulated redox signaling in brain endothelial cells adapted to physiological oxygen levels: Consequences for sulforaphane mediated protection against hypoxia-reoxygenation[J]. Redox Biology, 2020, 37: 101708.
[18] ZHANG X Y, YU Y H, LEI H Y, et al. The Nrf-2/HO-1 signaling axis: A ray of hope in cardiovascular diseases[J]. Cardiology Research and Practice, 2020, 2020: 5695723.
[19] ABDALKADER M, LAMPINEN R, KANNINEN K M, et al. Targeting Nrf2 to suppress ferroptosis and mitochondrial dysfunction in neurodegeneration[J]. Frontiers in Neuroscience, 2018, 12: 466.
[20] LIM P J, DUARTE T L, AREZES J, et al. Nrf2 controls iron homeostasis in haemochromatosis and thalassaemia via Bmp6 and hepcidin[J]. Nature Metabolism, 2019, 1(5): 519-531.
[21] MARRO S, CHIABRANDO D, MESSANA E, et al. Heme controls ferroportin1 (FPN1) transcription involving Bach1, Nrf2 and a MARE/ARE sequence motif at position-7007 of the FPN1 promoter[J]. Haematologica, 2010, 95(8): 1261-1268.
[22] YANATORI I, KISHI F. DMT1 and iron transport[J]. Free Radical Biology amp; Medicine, 2019, 133: 55-63.
[23] PETRAK J, VYORAL D. Hephaestin: A ferroxidase of cellular iron export[J]. The International Journal of Biochemistry amp; Cell Biology, 2005, 37(6): 1173-1178.
〔收稿日期〕2023-05-01
〔基金项目〕全国名老中医药专家传承工作室建设项目(国中医药函人教函〔2022〕75号);湖南省自然科学基金项目(2021JJ40418);湖南省卫生健康委员会科研计划项目(202203074417);湖南中医药大学第一附属医院中医药传承创新专项(2024XYLH363);湖南中医药大学校级科研项目(Z2023XJYB25);湖南中医药大学中医学世界一流培育学科(2023)。
〔通信作者〕*陈" 亚,女,硕士,副主任医师,E-mail:310532@hnucm.edu.cn。
