索拉非尼和多纳非尼对大鼠体内艾托格列净药代动力学的影响
2025-02-27邓艳茹曹格溪闫彬李颖董占军



摘要: 目的 探究索拉非尼、多纳非尼对艾托格列净在大鼠体内药代动力学的影响,为临床联合用药提供参考。方法 24只雄性SD大鼠随机分为4组,每组6只。A、B组大鼠分别连续7天灌胃索拉非尼对照溶剂和索拉非尼(100 mg/kg),第7天均灌胃艾托格列净(1. 5 mg/kg);C、D组大鼠分别连续7天灌胃多纳非尼对照溶剂和多纳非尼(40 mg/kg),第7天均灌胃艾托格列净(1. 5 mg/kg)。于不同时间点从大鼠眼内眦静脉丛取血,采用超高效液相色谱-串联质谱法测定艾托格列净质量浓度并绘制药-时曲线,应用DAS 2. 1. 1软件非房室模型计算药代动力学参数。符合正态分布的计量资料两组间比较采用成组t检验,非正态分布的计量资料两组间比较采用Mann-Whitney U秩和检验。结果 与A组比较,B组艾托格列净药-时曲线下面积(AUC 0-t )和AUC 0-∞ 均明显增加(P值均lt;0. 05),半衰期(t 1/2 )、平均滞留时间(MRT 0-t )、MRT 0-∞ 均显著延长(P值均lt;0. 05),清除率(CL Z/F )显著降低(Plt;0. 05);与C组比较,D组艾托格列净的AUC 0-t 、AUC 0-∞ 均显著增加(P值均lt;0. 01),达峰时间(T max )、t 1/2 、MRT 0-t 、MRT 0-∞ 均显著延长(P值均lt;0. 01),表观分布容积(V Z/F )和CL Z/F 均显著降低(P值均lt;0. 05)。结论 索拉非尼和多纳非尼均能影响艾托格列净在大鼠体内的药代动力学过程,明显增加艾托格列净的体内暴露量,临床联合用药时应密切监测疗效及药物不良反应,必要时给予剂量调整,避免潜在的药物相互作用风险。
关键词: 索拉非尼; 多纳非尼; 艾托格列净; 大鼠, Sprague-Dawley; 药代动力学; 药物相互作用
基金项目: 河北省自然科学基金(H2022307063)
Effect of sorafenib and donafenib on the pharmacokinetics of ertugliflozin in ratsDENG Yanru 1,2,3 , CAO Gexi 1,2,3 , YAN Bin 1,2,3 , LI Ying 2,3 , DONG Zhanjun 1,2,3
1. Graduate School of Hebei Medical University, Shijiazhuang 050017, China; 2. Department of Pharmacy, Hebei General Hospital,Shijiazhuang 050057, China; 3. Hebei Key Laboratory of Clinical Pharmacy, Shijiazhuang 050057, ChinaCorresponding author: DONG Zhanjun, 13313213656@126.com (ORCID: 0000-0001-5349-4907)
Abstract: Objective To investigate the effect of sorafenib and donafenib on the pharmacokinetics of ertugliflozin in rats, and toprovide a theoretical basis for drug combination in clinical practice. Methods A total of 24 male Sprague-Dawley rats wererandomly divided into groups A, B, C, and D, with 6 rats in each group. The rats in groups A and B were given sorafenib controlsolvent and sorafenib (100 mg/kg), respectively, by gavage for 7 consecutive days, followed by ertugliflozin (1.5 mg/kg) bygavage on day 7. Blood samples were collected from the angular vein plexus at different time points, and ultra-performance liquidchromatography-tandem mass spectrometry was used to determine the mass concentration of ertugliflozin and plot the plasmaconcentration-time curves, while the non-compartment model in DAS 2.1.1 software was used to calculate related pharmacokineticparameters. The independent-samples t test was used for comparison of normally distributed continuous data between two groups, and theMann-Whitney U test was used for comparison of non-normally distributed continuous data between two groups. Results Compared withgroup A, group B had significant increases in the AUC 0-t and AUC 0-∞ of the plasma concentration-time curve of ertugliflozin (both Plt;0.05), significant prolongation of t 1/2 , MRT 0-t , and MRT 0-∞ (all Plt;0.05), and a significant reduction in CL Z/F (Plt;0.05). Compared with group C, group D had significant increases in the AUC 0-t and AUC 0-∞ of ertugliflozin (both Plt;0.05), significant prolongation ofT max , t 1/2 , MRT 0-t , and MRT 0-∞ (all Plt;0.01), and significant reductions in V Z/F and CL Z/F (both Plt;0.05). Conclusion Bothsorafenib and donafenib can affect the pharmacokinetics of ertugliflozin in rats and significantly increase the plasma exposure ofertugliflozin. The efficacy and adverse drug reactions of ertugliflozin should be closely monitored during combined use in clinicalpractice and the dose should be adjusted when necessary to avoid the potential risk of drug interaction.
Key words: Sorafenib; Donafenib; Ertugliflozin; Rats, Sprague-Dawley; Pharmacokinetics; Drug Interactions
Research funding: Natural Science Foundation of Hebei Province (H2022307063)
原发性肝癌发病居恶性肿瘤第4位,死亡率仅次于肺癌,居第2位,疾病负担沉重[1-2] 。原发性肝癌中以肝细胞癌(HCC)最常见,占比 75%~85%[3] 。2 型糖尿病(type 2 diabetes,T2DM)是肝脏恶性肿瘤的独立危险因素,T2DM 通过多种机制加速肝癌进展、影响治疗结局[4-5]。同时,T2DM是肝癌患者常见的合并症。
索拉非尼是一种口服多靶点、多激酶抑制剂,可使晚期HCC患者生存获益,是最早用于肝癌系统抗肿瘤治疗的分子靶向药物[6-7]。多纳非尼是通过氘修饰技术,将索拉非尼的吡啶酰甲胺结构改为吡啶酰三氘代甲胺,该位点涉及酰胺水解、氧化、去甲基和葡糖醛酸化等多个代谢过程,不仅影响药物活性,药代动力学特征也发生改变[8-9]。研究显示,索拉非尼和多纳非尼均可抑制尿苷二磷酸葡萄糖醛酸转移酶 1A9(UDP-glucuronosyltransferase1A9,UGT1A9)Ⅱ相代谢酶[10-11] ,且体外研究证明索拉非尼是P-糖蛋白(P-glycoprotein,P-gp)的抑制剂[12] 。艾托格列净是钠-葡萄糖共转运蛋白2(sodium-glucose co-transporter 2,SGLT2)抑制剂类口服降糖药,其降糖疗效不依赖于β细胞功能,不易引发低血糖,且该类药物具有心血管保护及肾脏获益的优势[13-15] ,在临床应用广泛。艾托格列净主要经UGT1A9和UGT2B4/2B7介导的O-葡糖醛酸化代谢,少量经细胞色素P450(CYP450)酶氧化代谢,且艾托格列净是P-gp和乳腺癌耐药蛋白转运体底物[16-17] 。临床上索拉非尼或多纳非尼与艾托格列净可能联合用于治疗肝癌合并T2DM患者,但合用是否会发生基于药物代谢酶或转运体的药物相互作用,目前未见报道。因此,本研究拟在大鼠体内进行索拉非尼和多纳非尼对艾托格列净的药代动力学影响探究,旨在为临床合理用药提供参考。
1 材料与方法
1. 1 仪器与试剂
1. 1. 1 主要仪器 岛津 LC-30A型超高效液相色谱仪(日本岛津公司);AB Sciex Triple Quad 5500型串联三重四级杆质谱仪(包含Turbo VTM型电喷雾离子化源,美国 AB 公司);AB204-S 标准型分析天平(瑞士 MettlerToledo公司);KQ5200E超声波清洗器(江苏昆山市超声仪器有限公司);VM-03U 型涡旋混匀器(美国精骐公司);Sorvall ST 16高速低温离心机(美国 Thermo Fisher公司)。
1.1.2 药品与试剂 艾托格列净对照品(批号C15501208,纯度 99%)、索拉非尼原料药(批号 C15090388,纯度98%)购自上海麦克林生化科技股份有限公司;达格列净对照品(内标,批号F2209347,纯度≥99%)购自上海阿拉丁生化科技股份有限公司;甲苯磺酸多纳非尼片(批号01221105)购自苏州泽璟生物制药股份有限公司;肝素钠注射液(批号F201231104)购自河北常山生化药业股份有限公司;二甲基亚砜(DMSO)购自北京索来宝科技有限公司;色谱级乙腈、甲酸、乙酸铵、甲基叔丁基醚购自赛默飞世尔科技有限公司;娃哈哈纯净水购自杭州娃哈哈集团有限公司。
1. 2 实验动物 SPF级雄性SD大鼠24只,体质量230~250 g,购自北京华阜康生物科技股份有限公司,实验动物质量合格证号:110322231103572586,生产许可证号:SCXK(京)2019-0008,动物使用许可证号:SYXK(冀)2020-005。所有大鼠在标准环境中饲养,实验前12 h禁食,可自由饮水。
1. 3 血浆样品测定方法
1. 3. 1 对照品溶液的配制 精密称取艾托格列净对照品适量,用DMSO溶液溶解,制成终质量浓度1 mg/mL的对照品储备液。用 50% 乙腈-水逐级稀释,配制成 50、100、500、1 000、2 000、5 000、10 000、20 000 ng/mL的混合标准曲线工作溶液。同法制得低、中、高质控工作溶液,终浓度分别为150、8 000、15 000 ng/mL。
1. 3. 2 内标溶液的配制 精密称取达格列净1 mg溶解于 1 mL DMSO 中,配制成 1 mg/mL 的内标储备液,用50% 乙腈-水稀释得到 2 000 ng/mL 的混合内标工作溶液。
1. 3. 3 色谱条件 以Boltimate ® EXT-C18(2. 1×100 mm,2. 7 μm)为色谱柱;以含0. 1%甲酸的5 mmol/L乙酸铵溶液(A)-乙腈(B)为流动相进行梯度洗脱(0~0. 5 min,50%B;0. 5~1 min,50%~90%B;1~2. 5 min,90%B;2. 5~3 min,90%~50%B;3~3. 1 min,50%B);流速为0. 3 mL/min;进样量为6 μL。
1. 3. 4 质谱条件 离子化源为电喷雾离子源,采用正离子,多反应监测扫描;艾托格列净和内标达格列净定量分析离子对分别为m/z 437. 4→207. 0(去簇电压:130 V,碰撞能量:47 V)、m/z 426. 2→167. 1(去簇电压:80 V,碰撞能量:30 V),质谱图见图1。气帘气压力为20. 0 psi、碰撞气体压力为8 kPa,源喷射电压为5 500 V;离子源温度为500 ℃;Gas1为50. 0 psi,Gas为60 psi。
1. 3. 5 血浆样品的处理 取大鼠血浆样品50 μL,加入“1. 3. 2”项中的内标溶液5 μL和甲基叔丁基醚250 μL,涡旋混匀3 min,4 ℃条件下12 000 r/min离心10 min,取上清液200 μL,室温下氮气吹干,用100 μL 50%乙腈-水复溶,涡旋混合,待进样分析。
1. 4 方法学验证
1. 4. 1 专属性 按照“1. 3. 5”项方法分别处理大鼠空白血浆、艾托格列净质量浓度为5 ng/mL的模拟血浆样品、大鼠灌胃艾托格列净(1. 5 mg/kg)1 h的血浆样品,进样分析后记录色谱图,考察方法的专属性。
1. 4. 2 标准曲线和定量下限 精密量取8份45 μL大鼠空白血浆,分别加入“1. 3. 1”项系列对照品工作溶液5 μL,涡旋混匀,配制成艾托格列净质量浓度分别为5、10、50、100、200、500、1 000、2 000 ng/mL的校正标样,按“1. 3. 5”项方法操作后进样分析,记录峰面积。以艾托格列净的质量浓度为横坐标,艾托格列净与内标的峰面积比值为纵坐标,采用加权最小二乘法拟合回归曲线,定量下限为标准曲线的最低点。
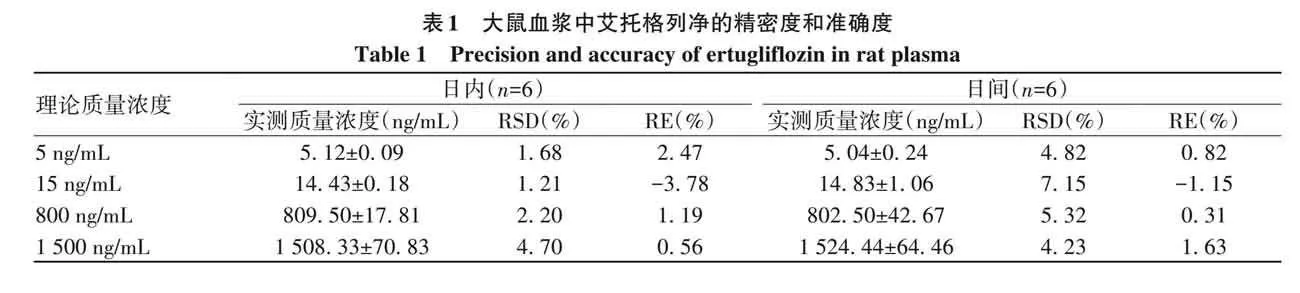
1. 4. 3 精密度与准确度 按照“1. 3. 5”项要求配制艾托格列净的定量下限、低、中、高质控4个质量浓度分别为5、15、800、1 500 ng/mL的血浆样品,每个浓度平行6份。
连续3天测定,分别用3条随行标准曲线回归方程计算艾托格列净实际质量浓度,考察日内、日间精密度采用相对标准偏差(relative standard deviation, RSD),准确度采用相对误差(relative error, RE)。质控样品和定量下限样品的RSD应分别lt;15%和lt;20%,RE应分别在±15%和±20%范围内。
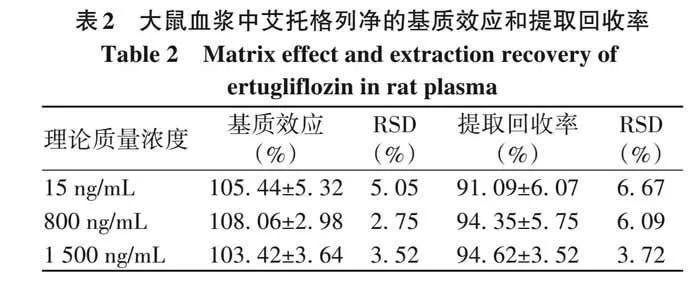
1. 4. 4 基质效应与提取回收率 取6份不同来源的空白血浆配制15、800、1 500 ng/mL的低、中、高质控样品,按“1. 3. 5”项方法处理,每个质量浓度平行6份,进样分析记录分析物与内标的峰面积比值为A。另取空白血浆,不加内标,同法处理取上清液得到空白基质溶液后,加入内标溶液和低、中、高3个质控工作溶液,使其与质控样品质量浓度一致,进样分析后测得分析物与内标峰面积比值为B,艾托格列净质控纯溶液和内标峰面积比值为 C。提取回收率(%)=A/B×100%,基质效应(%)=B/C×100%。
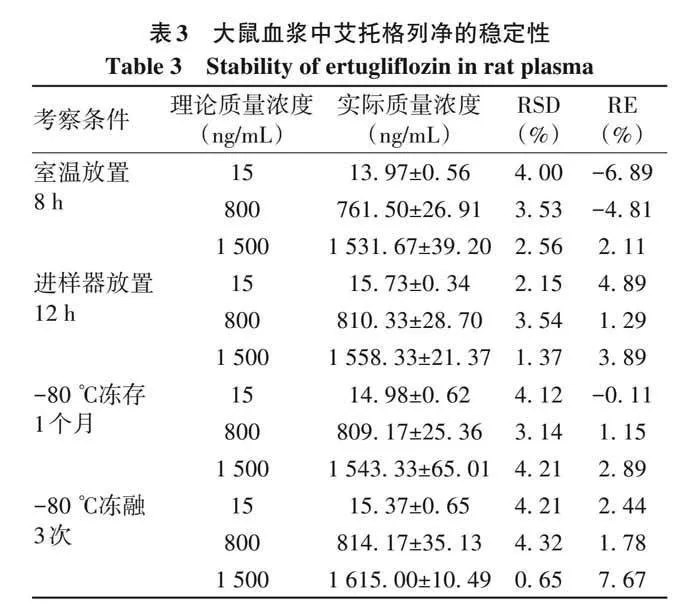
1. 4. 5 稳定性 按照“1. 3. 5”项下要求配制艾托格列净低、中、高3个质量浓度的质控样品,每个浓度平行6份,分别考察室温放置8 h、处理后样品在进样器放置12 h,−80 ℃冻存1个月、−80 ℃至室温冻融3次的稳定性。质控样品的RE在±15%之间,RSDlt;15%,表明分析物在上述条件下稳定。
1. 5 大鼠体内药代动力学研究
1. 5. 1 索拉非尼对艾托格列净药动学影响实验 12只健康雄性SD大鼠,随机分为A、B两组,每组6只。索拉非尼以含5% DMSO的0. 5%羧甲基纤维素钠(CMC-Na)溶液混悬,艾托格列净用0. 5% CMC-Na溶液配制。A组和B组大鼠连续7天分别灌胃索拉非尼对照溶剂和索拉非尼(100 mg/kg),在第7天常规给药1 min后均予艾托格列净(1. 5 mg/kg)灌胃。分别在给药前及给药后5、10、20、30、45 min和1、1. 5、2、3、5、7、10、12、24、48 h于大鼠眼内眦静脉丛取血约100 μL,置于肝素化离心管后3 500 r/min离心10 min,取上清液保存至−80 ℃冰箱中待测。
1. 5. 2 多纳非尼对艾托格列净药动学影响实验 12只健康雄性 SD 大鼠,随机分为 C、D 两组,每组 6 只。多纳非尼片用 0. 5% 羟丙基甲基纤维素(HPMC)和纯净水以4∶1比例溶解配制。C组和D组大鼠连续7天分别灌胃多纳非尼对照溶剂和多纳非尼(40 mg/kg),第7天给药后 1 min 灌胃艾托格列净(1. 5 mg/kg),其余处理同“1. 5. 1”。
1. 6 统计学方法 应用DAS 2. 1. 1软件非房室模型计算药代动力学参数,采用GraphPad Prism 8. 0软件绘制药-时曲线。采用SPSS 25. 0软件进行统计分析,符合正态分布的计量资料以 x ˉ ±s表示,两组间比较采用成组t检验;非正态分布的计量资料以M(P 25 ~P 75 )表示,两组间比较采用Mann-Whitney U秩和检验。Plt;0. 05为差异有统计学意义。
2 结果
2. 1 方法学验证2. 1. 1 专属性 大鼠空白血浆、艾托格列净质量浓度为5 ng/mL的模拟血浆样品、大鼠灌胃艾托格列净(1. 5 mg/kg)1 h的血浆样品的典型色谱图见图2。结果显示,艾托格列净及内标的保留时间分别为 1. 06、1. 02 min,空白血浆中内源性物质不干扰艾托格列净及内标的测定,方法专属性良好。
2.1.2 标准曲线与定量下限 艾托格列净在5~2 000 ng/mL范围内线性关系良好,典型回归方程为 Y=0. 003 21X+0. 005 4(r=0. 998 6),定量下限为5 ng/mL。标准曲线上所有浓度点的精密度均小于15%,准确度在85%~115%。
2. 1. 3 精密度与准确度 艾托格列净日内、日间RSD均不超过7. 15%,RE为−3. 78%~2. 47%,详见表1。RSD与RE均满足生物样品定量分析要求,表明本方法重现性良好。
2. 1. 4 基质效应与提取回收率 艾托格列净3个质控浓度样品的基质效应为103. 42%~108. 06%,RSD不超过5. 05%,表明基质不干扰艾托格列净的测定。提取回收率为91. 09%~94. 62%,符合定量分析方法要求,结果见表2。
2. 1. 5 稳定性 大鼠血浆中艾托格列净在不同处理和储存条件下的稳定性结果见表3。结果显示,各样品在室温下放置8 h,在自动进样器中放置12 h,在−80 ℃保存1个月以及反复冻融3次(−80 ℃至室温)的稳定性均未受到影响,RSD不超过4. 32%,稳定性良好。
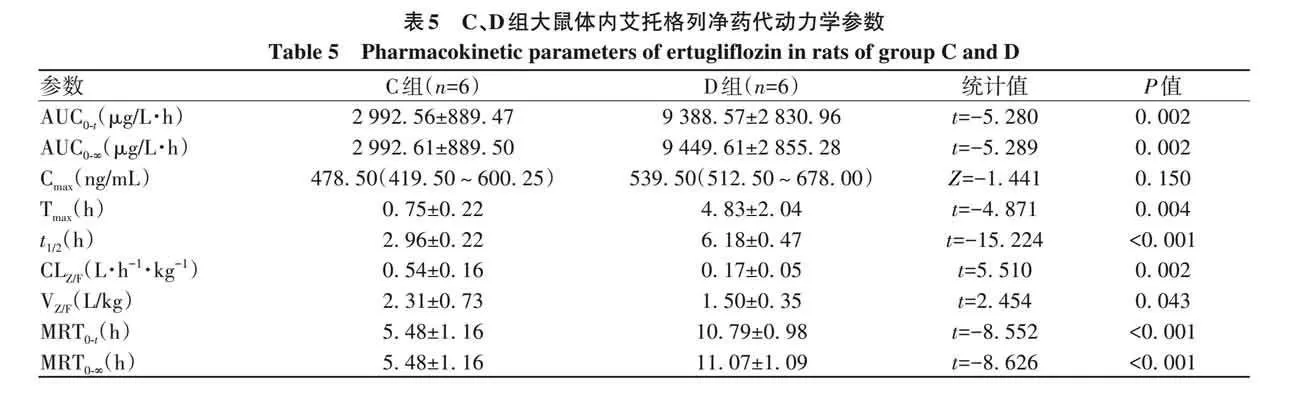
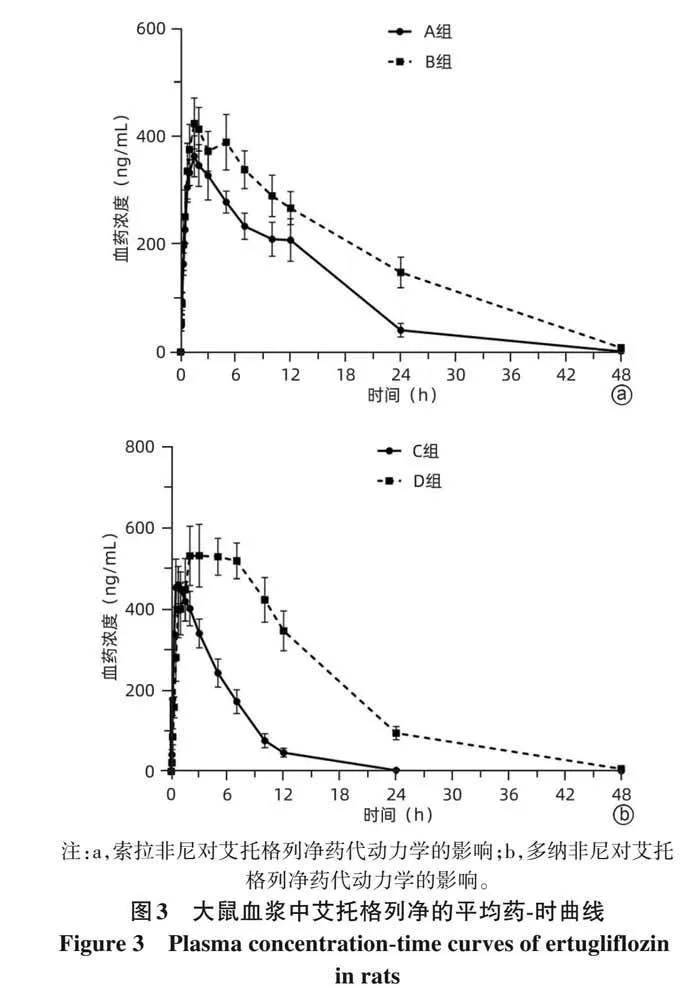
2. 2 大鼠体内药动学结果 大鼠血浆中艾托格列净的平均血药浓度-时间曲线见图3,A、B组大鼠体内艾托格列净的主要药动学参数见表4,C、D组大鼠体内艾托格列净的主要药动学参数见表5。结果显示,与A组相比,B 组艾托格列净的 AUC 0-t 、AUC 0-∞ 均显著增加(P 值均lt;0. 05),t 1/2 、MRT 0-t 、MRT 0-∞ 均显著延长(P 值均lt;0. 05),CL Z/F 显著降低(Plt;0. 05)。与C组相比,D组艾托格列净的 AUC 0-t 、AUC 0-∞ 均显著增加(P 值均lt;0. 01),T max 、t 1/2 、MRT 0-t 、MRT 0-∞ 均显著延长(P 值均lt;0. 01),CL Z/F 、V Z/F 均显著降低(P值均lt;0. 05)。
3 讨论
艾托格列净具有生物利用度高(100%)、对 SGLT2选择性高、半衰期长(约16. 6 h)等特点,同时能够独立于降糖作用外使心血管获益和减重,因此在T2DM合并心血管疾病、T2DM伴肥胖患者中有较大优势[17-18] 。因T2DM患者常存在共病,艾托格列净与其他药物联用现象十分普遍,如合用药物影响其代谢酶及转运体,药物发生相互作用的风险也会增加。老年T2DM患者中,分别有14%和6%患者罹患晚期肝纤维化和肝硬化,T2DM是肝癌的显著危险因素之一[5] 。临床上索拉非尼、多纳非尼均为晚期肝癌患者的一线治疗药物选择,其与艾托格列净联合使用的情况也十分常见。本研究在大鼠体内,分别考察了多次给予索拉非尼和多次给予多纳非尼对单次给予艾托格列净的药代动力学相互作用,结果发现索拉非尼使艾托格列净的 AUC 0-t 和 AUC 0-∞ 分别增加64. 7% 和 67. 2%,多纳非尼使艾托格列净的 AUC 0-t 和AUC 0-∞ 分别增加 213. 7% 和 215. 8%。此外 B、D 两实验组中,艾托格列净的t 1/2 较对照组均显著延长,而CL Z/F 显著下降,提示联合索拉非尼或多纳非尼均显著抑制大鼠体内艾托格列净的代谢过程,从而增加其暴露量。艾托格列净的降糖疗效与体内暴露量呈正相关,尿糖排泄量具有剂量依赖性[19],同时艾托格列净暴露的增加可能导致泌尿系感染、酮症酸中毒、低血糖等药物不良反应风险增加。因此,临床上索拉非尼或多纳非尼与艾托格列净联用时,需给予高度重视,及时评估疗效及不良反应,必要时减少艾托格列净给药剂量甚至更换降糖药物,避免影响药物治疗结局。
本研究以大鼠为实验对象开展研究,尽管人与啮齿动物的 UGT酶活性及表达水平存在差异,但两种属间UGT代谢酶家族具有较高的同源性和相似性[20] 。大鼠体内UGT1A9为非功能性表达代谢酶,由UGT1A7代偿发挥UGT1A9的作用[21-22] 。有研究显示,索拉非尼能够显著抑制大鼠体内UGT1A7(对应人类UGT1A9)的表达,从而抑制底物他喷他多、达格列净等药物的葡萄糖醛酸化,增加底物体内暴露量[10,23]。艾托格列净主要经肝脏UGT1A9和UGT2B7代谢为无药理活性的葡糖苷酸,研究报道,UGT1A9诱导剂利福平和UGT1A9抑制剂酮康唑均能显著影响艾托格列净的体内药代动力学过程[24-25]。同样,本研究推测索拉非尼主要抑制了大鼠体内艾托格列净经UGT1A7(对应人类UGT1A9)的葡萄糖醛酸化代谢途径,导致其清除率降低。此外,索拉非尼被证实是P-gp的体外抑制剂[12],其也可能参与了艾托格列净经P-gp的转运过程,从而影响其暴露量。本研究显示,多纳非尼对艾托格列净的影响较索拉非尼更为显著,这可能是由于氘代策略使多纳非尼对UGT1A9的抑制强度发生改变,另外多纳非尼和艾托格列净竞争性结合UGT1A9的能力与索拉非尼也存在差异,具体机制尚需进一步研究。
综上,本研究表明索拉非尼和多纳非尼均能影响艾托格列净在大鼠体内的药代动力学过程,增加其体内暴露量,临床联合用药时应密切监测疗效及不良反应,对临床用药有一定参考价值。本研究不足之处在于以健康大鼠为实验对象,未纳入肝癌和T2DM动物模型,没有考虑疾病状态对体内药代动力学过程的影响,上述问题可在今后更深入的研究中进一步探讨。
伦理学声明: 本研究方案于2023年4月25日经由河北省人民医院实验动物伦理委员会审批,批号:202322,符合实验室动物管理与使用准则。
利益冲突声明: 本文不存在任何利益冲突。
作者贡献声明: 邓艳茹负责查阅文献,设计论文框架,撰写论文;邓艳茹、曹格溪、闫彬负责实验操作,研究过程的实施;邓艳茹、曹格溪负责数据分析,绘制图表;李颖、董占军指导撰写文章并最后定稿。
参考文献:
[1] National Health Commission of the People’s Republic of China.Standard for diagnosis and treatment of primary liver cancer (2024 edition)[J]. J Clin Hepatol, 2024, 40(5): 893-918. DOI: 10.12449/JCH240508.中华人民共和国国家卫生健康委员会. 原发性肝癌诊疗指南(2024年版)
[J]. 临床肝胆病杂志, 2024, 40(5): 893-918. DOI: 10.12449/JCH240508.
[2] ZHENG RS, CHEN R, HAN BF, et al. Cancer incidence and mortalityin China, 2022[J]. Chin J Oncol, 2024, 46(3): 221-231. DOI: 10.3760/cma.j.cn112152-20240119-00035.郑荣寿, 陈茹, 韩冰峰, 等. 2022年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2024, 46(3): 221-231. DOI: 10.3760/cma.j.cn112152-20240119-00035.
[3] BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statis⁃tics 2018: GLOBOCAN estimates of incidence and mortality world⁃wide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI: 10.3322/caac.21492.
[4] TILG H, MOSCHEN AR, RODEN M. NAFLD and diabetes mellitus
[J]. Nat Rev Gastroenterol Hepatol, 2017, 14(1): 32-42. DOI: 10.1038/nrgastro.2016.147.
[5] AJMERA V, CEPIN S, TESFAI K, et al. A prospective study on theprevalence of NAFLD, advanced fibrosis, cirrhosis and hepatocellu⁃lar carcinoma in people with type 2 diabetes[J]. J Hepatol, 2023,78(3): 471-478. DOI: 10.1016/j.jhep.2022.11.010.
[6] RAOUL JL, KUDO M, FINN RS, et al. Systemic therapy for intermedi⁃ate and advanced hepatocellular carcinoma: Sorafenib and beyond
[J]. Cancer Treat Rev, 2018, 68: 16-24. DOI: 10.1016/j.ctrv.2018.05.006.
[7] DENG N, LI XM, DING XY, et al. Current status and progress of sec⁃ond-line treatment for hepatocellular carcinoma[J/CD]. Chin J LiverDis (Electronic Edition), 2024, 16(1): 1-6. DOI: 10.3969/j. issn.1674-7380.2024.01.001.邓娜, 栗晓咪, 丁晓燕, 等. 肝细胞癌二线治疗的现状和进展[J/CD]. 中国肝脏病杂志(电子版), 2024, 16(1): 1-6. DOI: 10.3969/j.issn.1674-7380.2024.01.001.
[8] KEAM SJ, DUGGAN S. Donafenib: First approval[J]. Drugs, 2021,81(16): 1915-1920. DOI: 10.1007/s40265-021-01603-0.
[9] Expert Committee on Liver Cancer, Chinese Society of Clinical On⁃cology; Expert Committee on Safety Management of Antitumor Drugsof Chinese Society of Clinical Oncology. Consensus of experts onthe clinical application of donafenib in the treatment of hepatocellu⁃lar carcinoma[J]. Chin Clin Oncol, 2022, 27(8): 749-757. DOI: 10.3969/j.issn.1009-0460.2022.08.013.中国临床肿瘤学会肝癌专家委员会, 中国临床肿瘤学会抗肿瘤药物安全管理专家委员会. 多纳非尼治疗肝细胞癌临床应用专家共识[J]. 临床肿瘤学杂志, 2022, 27(8): 749-757. DOI: 10.3969/j.issn.1009-0460.2022.08.013.
[10] HE XR, LI Y, MA YL, et al. Development of UPLC-MS/MS method tostudy the pharmacokinetic interaction between sorafenib and dapa⁃gliflozin in rats[J]. Molecules, 2022, 27(19): 6190. DOI: 10.3390/molecules27196190.
[11] HE XR, LI Y, LI YJ, et al. In vivo assessment of the pharmacokineticinteractions between donafenib and dapagliflozin, donafenib andcanagliflozin in rats[J]. Biomed Pharmacother, 2023, 162: 114663.DOI: 10.1016/j.biopha.2023.114663.
[12] GONG L, GIACOMINI MM, GIACOMINI C, et al. PharmGKB sum⁃mary: Sorafenib pathways[J]. Pharmacogenet Genomics, 2017, 27(6): 240-246. DOI: 10.1097/FPC.0000000000000279.
[13] WOJCIK C, WARDEN BA. Mechanisms and evidence for heart fail⁃ure benefits from SGLT2 inhibitors[J]. Curr Cardiol Rep, 2019, 21(10): 130. DOI: 10.1007/s11886-019-1219-4.
[14] VALLON V. The mechanisms and therapeutic potential of SGLT2 in⁃hibitors in diabetes mellitus[J]. Annu Rev Med, 2015, 66: 255-270.DOI: 10.1146/annurev-med-051013-110046.
[15] Chinese Diabetes Society. Guidelines for the prevention and treat⁃ment of type 2 diabetes mellitus in China (2020 edition) [J]. Chin JDiabetes Mellitus, 2021, 13(4): 315-409. DOI: 10.3760/cma.j.cn115791-20210221-00095.中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2020年版)[J].中华糖尿病杂志, 2021, 13(4): 315-409. DOI: 10.3760/cma.j.cn115791-20210221-00095.
[16] COSENTINO F, CANNON CP, CHERNEY DZI, et al. Efficacy of er⁃tugliflozin on heart failure-related events in patients with type 2 dia⁃betes mellitus and established atherosclerotic cardiovascular dis⁃ease: Results of the VERTIS CV trial[J]. Circulation, 2020, 142(23):2205-2215. DOI: 10.1161/CIRCULATIONAHA.120.050255.
[17] CHENG Q, ZOU SP, SUN MH. Clinical therapeutic value of a newgeneration of sodium-glucose cotransporter-2 inhibitor ertugliflozinin patients with diabetes and special populations[J]. Chin J New Drugs,2023, 32(11): 1099-1107. DOI: 10.3969/j.issn.1003-3734.2023.11.004.程钱, 邹舒鹏, 孙明辉. 新一代钠-葡萄糖共转运体-2抑制剂艾托格列净在糖尿病及特殊人群中的治疗价值[J]. 中国新药杂志, 2023, 32(11):1099-1107. DOI: 10.3969/j.issn.1003-3734.2023.11.004.
[18] MARKHAM A. Ertugliflozin: First global approval[J]. Drugs, 2018,78(4): 513-519. DOI: 10.1007/s40265-018-0878-6.
[19] FEDIUK DJ, NUCCI G, DAWRA VK, et al. Overview of the clinicalpharmacology of ertugliflozin, a novel sodium-glucose cotransporter2 (SGLT2) inhibitor[J]. Clin Pharmacokinet, 2020, 59(8): 949-965.DOI: 10.1007/s40262-020-00875-1.
[20] ZHOU N, LI TT, CHEN XJ. Research progress of regulation of UDP-glucuronosyltransferases and herb-drug interaction[J]. J Pharm Res,2022, 41(6): 394-399. DOI: 10.13506/j.cnki.jpr.2022.06.010.周楠, 李婷婷, 陈西敬. 尿苷二磷酸葡萄糖醛酸转移酶的调控及其介导的中药-药物相互作用研究进展[J]. 药学研究, 2022, 41(6): 394-399.DOI: 10.13506/j.cnki.jpr.2022.06.010.
[21] EMI Y, IKUSHIRO S, IYANAGI T. Drug-responsive and tissue-specific alternative expression of multiple first exons in rat UDP-glucuronosyltransferase family 1 (UGT1) gene complex[J]. J Bio⁃chem, 1995, 117(2): 392-399. DOI: 10.1093/jb/117.2.392.
[22] WEBB LJ, MILES KK, AUYEUNG DJ, et al. Analysis of substratespecificities and tissue expression of rat UDP-glucuronosyltransferasesUGT1A7 and UGT1A8[J]. Drug Metab Dispos, 2005, 33(1): 77-82.DOI: 10.1124/dmd.104.001321.
[23] KARBOWNIK A, MIEDZIASZCZYK M, GRABOWSKI T, et al. In vivoassessment of potential for UGT-inhibition-based drug-drug interac⁃tion between sorafenib and tapentadol[J]. Biomed Pharmacother,2020, 130: 110530. DOI: 10.1016/j.biopha.2020.110530.
[24] DAWRA VK, SAHASRABUDHE V, LIANG YL, et al. Effect of rifampinon the pharmacokinetics of ertugliflozin in healthy subjects[J]. ClinTher, 2018, 40(9): 1538-1547. DOI: 10.1016/j.clinthera.2018.07.014.
[25] HAN DG, YUN H, YOON IS. A novel high-performance liquid chro⁃matographic method combined with fluorescence detection for de⁃termination of ertugliflozin in rat plasma: Assessment of pharmacoki⁃netic drug interaction potential of ertugliflozin with mefenamic acidand ketoconazole[J]. J Chromatogr B Analyt Technol Biomed LifeSci, 2019, 1122-1123: 49-57. DOI: 10.1016/j.jchromb.2019.05.023.
收稿日期:2024-05-23;录用日期:2024-07-05
本文编辑:刘晓红
