基于APLN/PI3K/Akt信号通路探讨柴胡疏肝散加减对三阴性乳腺癌细胞增殖、迁移与侵袭的影响
2025-02-27朱思洵姚昶杨静苏彬赵倩馨蒋立新

〔摘要〕 目的 基于转录组学测序探究柴胡疏肝散加减含药血清通过爱帕琳肽(APLN)/磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)信号通路对三阴性乳腺癌MDA-MB-231细胞增殖、迁移与侵袭的影响。方法 采用SD大鼠制备柴胡疏肝散加减含药血清和对照血清。不同比例对照血清和含药血清干预MDA-MB-231细胞24 h,通过CCK-8法检测细胞增殖活力,筛选最佳比例;采用转录组测序分析对照血清组和含药血清组细胞中差异表达基因和信号通路。将APLN siRNA或过表达质粒转染细胞,以敲低或过表达APLN;采用CCK-8法、划痕与Transwell侵袭实验分别检测含药血清联合APLN敲低或过表达干预后细胞的增殖、迁移与侵袭能力;采用RT-PCR以及Western blot法分别检测APLN、PI3K、Akt基因与蛋白的表达情况。结果 与对照血清组比较,含药血清组中细胞的增殖活力、迁移与侵袭能力降低(Plt;0.05)。转录组结果显示,相对于对照血清组,含药血清组中上调116个基因,下调66个基因;这些差异基因主要富集于PI3K/Akt、丝裂原活化蛋白激酶(MAPK)等肿瘤相关的信号通路。在Top30差异基因中,含药血清降低APLN基因和蛋白的表达(Plt;0.05),并抑制APLN下游PI3K/Akt信号通路的激活(Plt;0.05);APLN敲低进一步增强含药血清对细胞增殖、迁移、侵袭以及PI3K/Akt通路激活的抑制作用(Plt;0.05),而APLN过表达则削弱了含药血清的上述作用(Plt;0.05)。结论 柴胡疏肝散加减含药血清可通过负调控APLN的表达拮抗PI3K/Akt信号通路的激活来抑制三阴性乳腺癌细胞增殖、迁移与侵袭,以达到抗癌的疗效。
〔关键词〕 柴胡疏肝散加减;三阴性乳腺癌;APLN/PI3K/Akt信号通路;增殖;迁移;侵袭
〔中图分类号〕R285.5"""""""" 〔文献标志码〕A""""""""" 〔文章编号〕doi:10.3969/j.issn.1674-070X.2025.02.006
〔收稿日期〕2024-09-19
〔基金项目〕无锡市卫生健康委员会重点项目(Z202203)。
〔通信作者〕*蒋立新,男,教授,主任中医师,E-mail:15961665000@163.com。
Effects of modified Chaihu Shugan Powder on proliferation, migration, and invasion of triple-negative breast cancer cells based on APLN/PI3K/Akt signaling pathway
ZHU Sixun1, YAO Chang2, YANG Jing1, SU Bin1, ZHAO Qianxin1, JIANG Lixin1*
1. Department of Breast Surgery, Jiangyin Hospital of Chinese Medicine, Wuxi, Jiangsu 214400, China; 2. Department of Breast Surgery, Jiangsu Province Hospital of Chinese Medicine, Nanjing, Jiangsu 210000, China
〔Abstract〕 Objective To explore the effects of modified Chaihu Shugan Powder medicated serum on proliferation, migration, and invasion of triple-negative breast cancer MDA-MB-231 cells through the APLN/PI3K/Akt signaling pathway based on transcriptome sequencing. Methods SD rats were used to prepare modified Chaihu Shugan Powder medicated serum and control serum. MDA-MB-231 cells were treated with different proportions of control and medicated serums for 24 h. Cellular proliferation activity was assessed using the CCK-8 assay to determine the optimal proportion. Transcriptome sequencing was employed to analyze differentially expressed genes and signaling pathways in cells from the control serum group and the medicated serum group. Cells were transfected with APLN siRNA or overexpression plasmid to knock down or overexpress APLN. The CCK-8 assay, wound healing assay, and Transwell invasion assay were used to check cellular proliferation, migration, and invasion abilities, respectively, after intervention with the medicated serum combined with APLN knockdown or overexpression. RT-PCR and Western blot were utilized to determine the expressions of APLN, PI3K, and Akt genes and proteins. Results Compared with the control serum group, the cellular proliferation activity, migration, and invasion abilities in the medicated serum group decreased (Plt;0.05). Transcriptomic results showed that, compared with the control serum group, 116 genes were significantly upregulated and 66 genes were downregulated in the medicated serum group. These differential genes were primarily enriched in tumor-related signaling pathways such as PI3K/Akt and mitogen-activated protein kinase (MAPK). Among the top 30 differential genes, the medicated serum reduced the expressions of APLN gene and protein (Plt;0.05) and inhibited the activation of the APLN downstream PI3K/Akt signaling pathway (Plt;0.05). APLN knockdown further enhanced the inhibitory effects of the medicated serum on cell proliferation, migration, invasion, and PI3K/Akt pathway activation (Plt;0.05), whereas APLN overexpression attenuated these effects of the medicated serum (Plt;0.05). Conclusion The modified Chaihu Shugan Powder medicated serum can inhibit the proliferation, migration, and invasion of triple-negative breast cancer cells by negatively regulating APLN expression, thereby antagonizing the activation of PI3K/Akt signaling pathway and exerting anti-cancer effects.
〔Keywords〕 modified Chaihu Shugan Powder medicated serum; triple-negative breast cancer; APLN/PI3K/Akt signaling pathway; proliferation; migration; invasion
本文引用: 朱思洵, 姚" 昶, 杨" 静, 苏" 彬, 赵倩馨, 蒋立新. 基于APLN/PI3K/Akt信号通路探讨柴胡疏肝散加减对三阴性乳腺癌细胞增殖、迁移与侵袭的影响[J]. 湖南中医药大学学报, 2025, 45(2): 228-238.
乳腺癌是妇科最常见的癌症,也是全球癌症死亡的主要原因之一[1]。三阴性乳腺癌(triple-negative
breast cancer,TNBC)作为一种特殊的乳腺癌亚型,占乳腺癌的15%~20%[2]。由于TNBC分化差,侵袭性强,预后易复发或转移。TNBC缺乏相关受体标记物,致使患者很难进行靶向治疗。接受化学治疗的患者,只有不到30%的有治疗效果,但复发率和死亡率仍高于非TNBC亚型[3]。因此,开发新的治疗药物,探寻其作用机制,对TNBC治疗具有重要意义。
中药复方因其具有改善肿瘤症状、缓解放化学治疗不适、提高患者生存质量等优势,成为肿瘤辅助治疗的有效方法[4-5]。中医学认为,TNBC主要分为肝郁气滞、痰瘀互结、气血两虚等类型,其治疗应从疏肝理气、活血化瘀、补气养血着手[6]。柴胡疏肝散源于《景岳全书》,具有疏肝理气、活血止痛等功效,符合TNBC治疗之策。最近一项临床研究发现,柴胡疏肝散加减联合阿霉素-环磷酰胺(adriamycin-cyclophosphamide,AC)方案和紫杉醇治疗晚期乳腺癌患者可提高客观缓解率,降低中医证候积分,比单纯AC方案和紫杉醇治疗更佳[7]。此外,网络药理学研究发现,柴胡疏肝散可能通过磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、转化生长因子β(transforming growth factor-β,TGF-β)/Smad等信号通路调控细胞增殖、凋亡、周期等细胞功能治疗乳腺癌[8],但具体机制有待进一步研究。
本课题组在柴胡疏肝散原方上加入黄芪、浙贝母、半边莲、鬼针草、夏枯草,形成柴胡疏肝散加减方剂(命名回春方)。黄芪具有益气扶正之效,鬼针草具有清热散瘀之效,浙贝母、半边莲、夏枯草具有散结、除瘤、排毒之效,柴胡疏肝散加减有望在TNBC上起到更好的治疗效果,但其内在机制需要初步探究。因此,本研究基于转录组测序探究柴胡疏肝散加减含药血清通过爱帕琳肽(apelin,APLN)/PI3K/Akt信号通路对MDA-MB-231细胞增殖、迁移与侵袭的影响,揭示其治疗乳腺癌的作用机制,为柴胡疏肝散加减治疗TNBC提供实验依据。
1 材料
1.1" 实验动物与细胞
SPF级雄SD大鼠10只,8周龄,体质量200~220 g,由斯贝福(苏州)生物技术股份有限公司提供,实验动物生产许可证:SCXK(苏)2022-0006,饲养于实验动物中心。动物饲养条件为温度(23±3) ℃,相对湿度50%~70%,12 h/12 h昼夜循环,常规饮食。MDA-MB-231细胞购自江苏凯基生物技术股份有限公司(以下简称凯基生物),批号:KGG3220-1。
1.2" 主要药物及试剂
柴胡疏肝散加减中北柴胡(批号:2301764101)、醋香附(批号:2205018101)、川芎(批号:2208323101)、枳壳(批号:2207120101)、芍药(批号:2112177101)、橘络(批号:21030781)、甘草(批号:2301226101)、黄芪(批号:2301088101)、浙贝母(批号:2301526101)、半边莲(批号:2201429101)、鬼针草(批号:230116015)、夏枯草(批号:2203008101)均购自苏州市天灵中药饮片有限公司。
Leibovitz's L-15培养基(含双抗)(批号:KGL1801-500)、胰酶消化液(批号:KGL2102-100)、CCK-8细胞增殖检测试剂盒(批号:KGA9306-1000)、DEPC水(批号:KGF2201-100)、GAPDH抗体(批号:KGC6102-1)、羊抗兔IgG-HRP(批号:KGC6202-0.1)、羊抗小鼠IgG-HRP(批号:KGC6203-0.1)、基质胶(批号:KGL5101-1)、结晶紫染色液(批号:KGE1202-100)、KeygenMAX 3000转染试剂(批号:KGA9705-1.5)、全蛋白提取试剂盒(批号:KGB5303-100)、BCA蛋白含量检测试剂盒(批号:KGB2101-250)均购自凯基生物;胎牛血清(批号:10099-141,美国Gibco公司);异丙醇(批号:67-63-0)、氯仿(批号:67-66-3)、无水乙醇(批号:64-17-5)均购自南京化学试剂有限公司;cDNA第一链合成试剂盒(批号:RR036B)、TB Green Premix Ex Taq II(批号:RR820A),均购自日本TaKaRa公司;TRIzol(批号:15596-026,美国Invitrogen公司);APLN(批号:sc-293441,美国Santa Cruz Biotechnology公司);PI3K抗体(批号:ab191606)、Akt抗体(批号:ab179463)、p-Akt抗体(批号:ab81283)均购自英国Abcam公司;p-PI3K抗体(批号:AF3241,江苏亲科生物研究中心有限公司)。
1.3" 主要仪器
超净工作台(型号:SW-CJ-1FD,苏州净化设备有限公司);紫外光度仪(型号:UV-2450,日本Shimadzu公司);荧光定量PCR循环仪(型号:7500,美国ABI公司);高速冷冻离心机(型号:SorvallTM ST16R,美国Thermo Fisher Scientific公司);生物倒置显微镜(型号:IX51,日本OLYMPUS公司);酶标仪(型号:ELx800,美国BioTek公司);PCR仪(型号:Veriti 96 well Thermal cycler,美国ABI公司)。
2 方法
2.1" 柴胡疏肝散加减含药血清的制备
柴胡疏肝散加减由北柴胡6 g、醋香附10 g、川芎3 g、枳壳6 g、芍药15 g、橘络10 g、甘草3 g、黄芪20 g、浙贝母10 g、半边莲30 g、鬼针草10 g、夏枯草15 g组成,统一煎煮3次,每次45 min。筛网滤掉残渣,收集3次药液合并,经浓缩为0.75 g/mL柴胡疏肝散加减浓缩液。过滤除菌后,分装,-20 ℃保存,避免反复冻融。10只大鼠适应1周后,随机分为含药血清组和对照血清组,每组5只。根据人与大鼠药物剂量换算系数[9],含药血清组大鼠给予12 g/kg灌胃,对照血清组大鼠给予等体积生理盐水灌胃。连续灌胃7 d,末次灌胃2 h后CO2麻醉,股动脉取血。全血低温静置2~4 h后,3 000 g、4 ℃离心30 min。取上清液,56 ℃灭活30 min,0.22 μm过滤除菌,超低温保存备用。
2.2" 细胞培养、转染与分组
MDA-MB-231细胞用含有10%胎牛血清的完全培养基培养,每2~3 d换液一次。首先用不同比例(0、0.5%、1%、2%、4%、8%、16%、32%)的对照血清和柴胡疏肝散加减含药血清分别干预MDA-MB-231细胞24 h,筛选最佳干预比例。APLN siRNA(si-APLN,正向:5'-GCCCAGAGGGUCAAGGAAUTT-3';反义链:5'-AUUCCUUGACCCUCUGGGCTT-3')、siRNA阴性对照(si-NC,正义链:5'-UUCUCCGAACG⁃UGUCACGUTT-3';反向:5'-ACGUGACACGUUCGGAGAATT-3')、APLN过表达质粒(oe-APLN)以及过表达空质粒pcDNA3.1(+)(oe-NC)由凯基生物构建。APLN过表达质粒构建主要步骤如下:通过National Center for Biotechnology Information (NCBI)(https://www.ncbi.nlm.nih.gov)网站获得APLN编码区序列(coding sequence,CDS),PCR扩增目的片段,利用EcoRI和BamHI双酶切pcDNA3.1(+)质粒和目的片段,T4连接酶连接,经转化、单克隆菌落筛选与鉴定、质粒抽提等步骤获得pcDNA3.1(+)-APLN融合质粒,即oe-APLN。
为验证APLN基因敲低和过表达效率,将对数生长期的MDA-MB-231细胞随机分为五组:对照组、si-NC组、si-APLN组、oe-NC组、oe-APLN组。si-NC、si-APLN、oe-NC或oe-APLN通过KeygenMAX 3000转染试剂转染至MDA-MB-231细胞。48 h后,进行RT-PCR检测。
另将对数生长期的MDA-MB-231细胞随机分成6组:对照血清组、柴胡疏肝散加减含药血清组(含药血清组)、柴胡疏肝散加减含药血清联合siRNA阴性对照组(含药血清+si-NC组)、柴胡疏肝散加减含药血清联合APLN敲低组(含药血清+si-APLN)、柴胡疏肝散加减含药血清联合过表达阴性对照组(含药血清+oe-NC组)以及柴胡疏肝散加减含药血清联合APLN过表达组(含药血清+oe-APLN组)。采用KeygenMAX 3000转染试剂分别将si-NC、si-APLN、oe-NC、oe-APLN转染MDA-MB-231细胞,于37 ℃、5% CO2条件下培养24 h,用10%柴胡疏肝散加减含药血清继续干预24 h。收集细胞,用于后续检测。
2.3" CCK-8检测细胞的增殖活力
将对数生长期的MDA-MB-231细胞消化、收集细胞,不完全培养基重悬。96孔细胞培养板中每孔加入100 μL细胞悬液(5×104个/mL)。根据分组干预后,每孔加入10 μL的CCK-8反应液,37 ℃孵育2 h,摇床上轻轻混匀,酶标仪检测450 nm波长处各孔吸光度值。根据吸光度值计算各组细胞抑制率。
2.4" 转录组测序检测细胞中基因表达情况
转录组测序于南京派森诺基因科技有限公司进行。主要步骤如下:对照血清组(control)和10%柴胡疏肝散加减含药血清组(CSS)中MDA-MB-231细胞经RNA提取、Oligo(dT)磁珠富集总RNA、mRNA片段化、反转录cDNA、cDNA文库构建等步骤后,通过Agilent 2100 Bioanalyzer对文库进行质检。质检合格后,采用基于Illumina测序平台的第二代测序技术(next-generation sequencing,NGS)对文库进行测序。原始下机数据过滤后,比对到人的参考基因组上。根据比对结果,计算每个基因的表达量。在此基础上,进一步对样品进行基因表达差异分析、聚类分析以及GO和KEGG富集分析。
2.5" 划痕实验检测细胞的迁移能力
将对数生长期的MDA-MB-231细胞接种到6孔板中。待细胞融合度达80%左右,用200 μL无菌枪头在6孔板中划2条平行直线。PBS洗去悬浮细胞,按照分组进行干预。分别于培养0 h和24 h置于倒置显微镜下(放大100倍)拍照,测量0 h和24 h细胞划痕宽度,统计细胞相对迁移距离。
2.6" Transwell检测细胞的侵袭能力
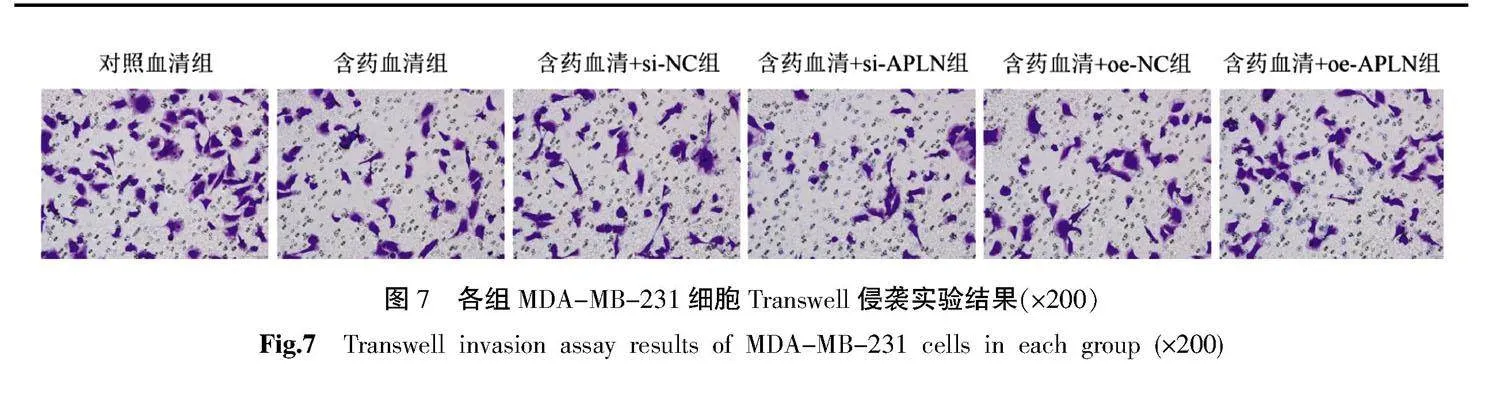
将对数生长期的MDA-MB-231细胞消化接种到6孔板中,按分组处理细胞。细胞消化离心,于无血清培养中重悬。将4 ℃预冷的基质胶用无血清培养基稀释6倍,加入Transwell上室,铺满小室底部。37 ℃培养箱中孵育1~3 h。将重悬的细胞计数,调整密度为5×104个/mL。取100 μL细胞悬液加入Transwell小室,下室加入500 μL含20% FBS的培养基,于37 ℃、5% CO2培养箱中孵育24 h。取出Transwell小室,用棉签将上室中未侵袭的细胞去除,晾干。下室加入500 μL结晶紫(4%多聚甲醛配制),放入小室染色30 min。PBS清洗,随机选择视野拍照(放大200倍)、计数。
2.7" RT-PCR检测细胞中APLN、PIK3C3与Akt mRNA表达情况
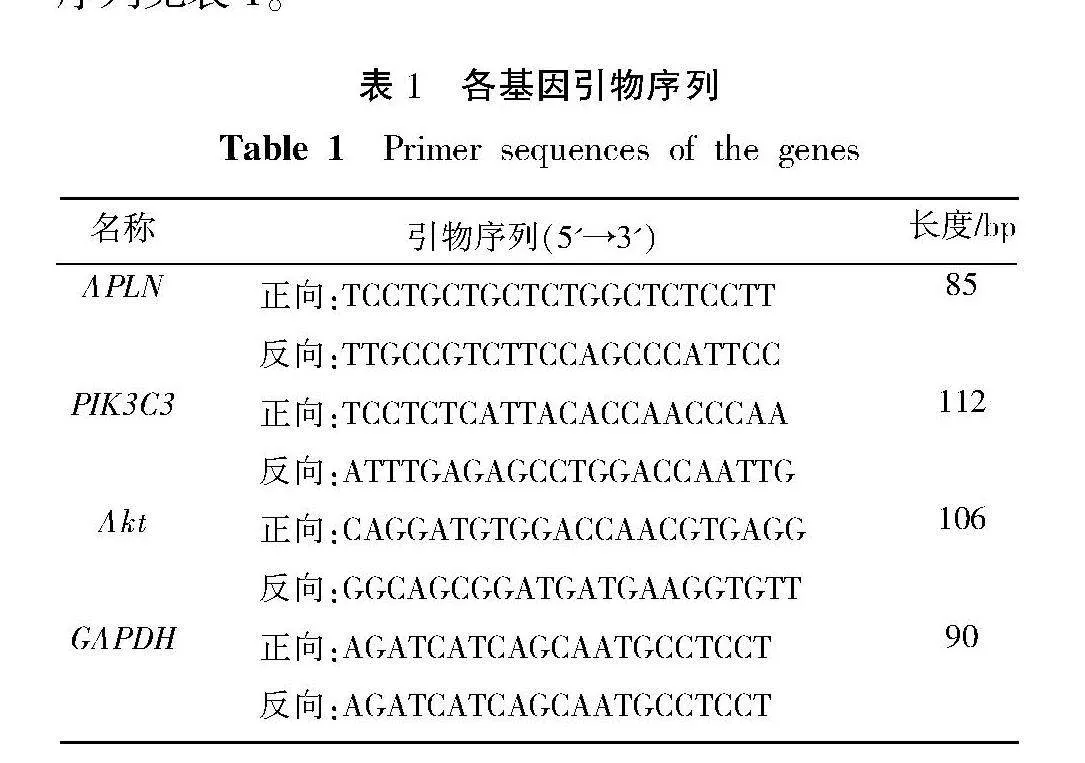
根据产品说明书,使用TRIzol试剂提取细胞总RNA。采用琼脂糖凝胶电泳检测总RNA的完整性,并用紫外光度仪测定总RNA的浓度和纯度。使用cDNA第一链合成试剂盒将总RNA逆转录为cDNA。通过NCBI设计基因特异性引物,并由凯基生物合成。以GAPDH作为内参基因。采用TB Green Premix Ex Taq Ⅱ和荧光定量PCR循环仪进行定量分析。PCR反应程序为95 ℃,5 min;95 ℃,15 s;60 ℃,20 s;72 ℃,40 s;共40个循环。采用2-ΔΔCt法计算基因的相对表达量。APLN、PIK3C3与Akt引物序列见表1。
2.8" Western blot检测细胞中APLN、磷酸化PI3K、磷酸化Akt蛋白表达情况
使用全蛋白提取试剂盒提取各组细胞中总蛋白,并采用BCA蛋白含量检测试剂盒检测总蛋白含量。蛋白变性后于十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)中分离目的蛋白,并通过转膜将分离的蛋白转移到聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上。5%牛血清白蛋白溶液封闭1~2 h,1×TBST中漂洗2~3次。加入一抗过夜孵育,二抗37 ℃孵育1~2 h,ECL显色。使用ChemiDoc MP Imaging System成像。使用ImageJ软件对结果进行灰度分析。
2.9" 统计学分析
采用SPSS 21.0软件对数据进行统计学分析。采用t检验进行两组间比较,采用单因素方差分析(One-way ANOVA)进行多组比较,并通过LSD方法进行事后比较。数据以“x±s”表示,Plt;0.05表示差异有统计学意义。采用GraphPad Prism 9.0软件作图。
3 结果
3.1" 柴胡疏肝散加减含药血清对MDA-MB-231细胞增殖活力的影响
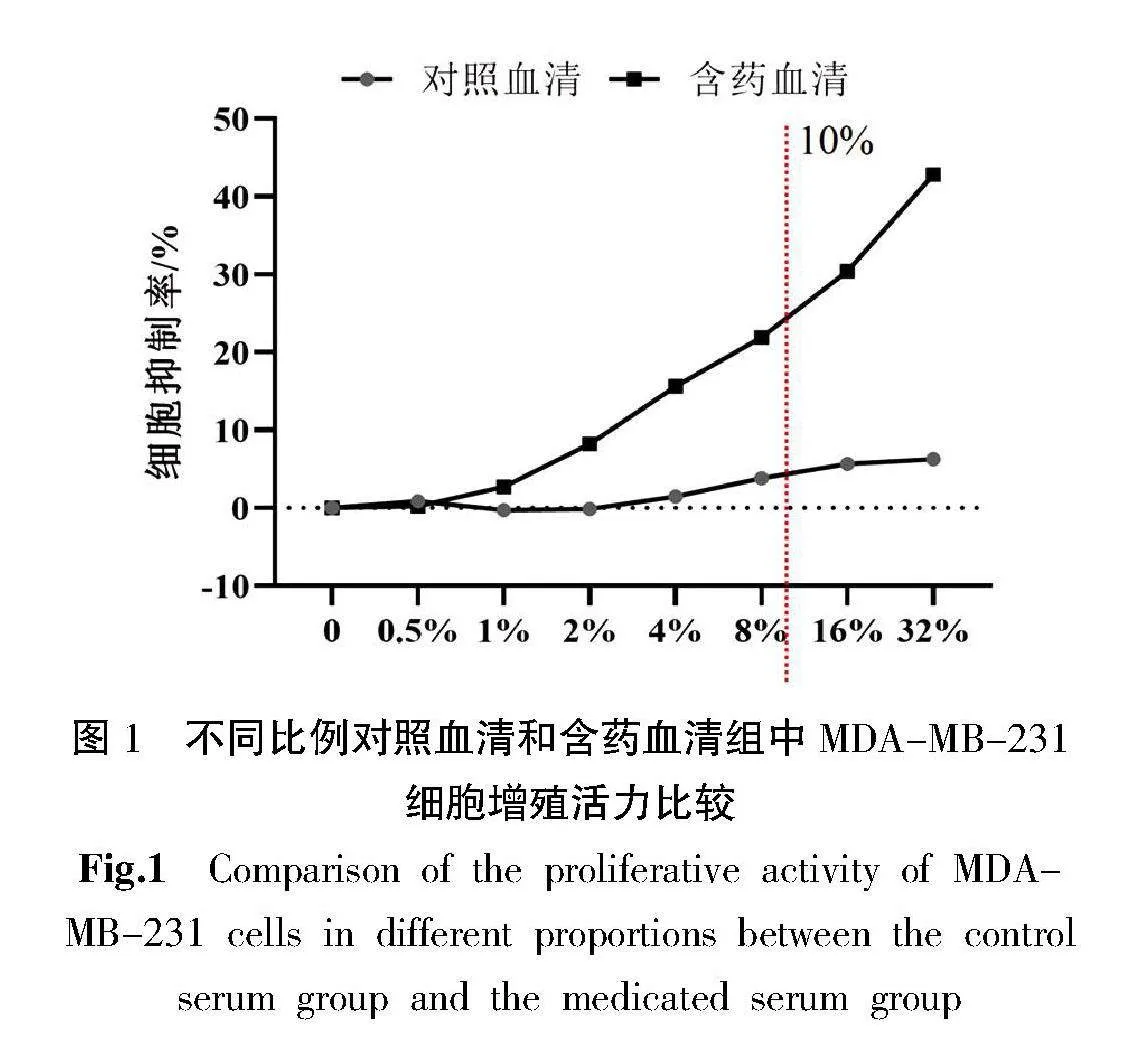
与对照血清组比较,MDA-MB-231细胞的增殖活力呈柴胡疏肝散加减含药血清浓度依赖性递减,其中10%柴胡疏肝散加减含药血清对MDA-MB-231细胞增殖活力的抑制率达20%,具有显著抑制效果。因此,选择10%含药血清干预MDA-MB-231细胞。详见图1。
3.2" 转录组学分析
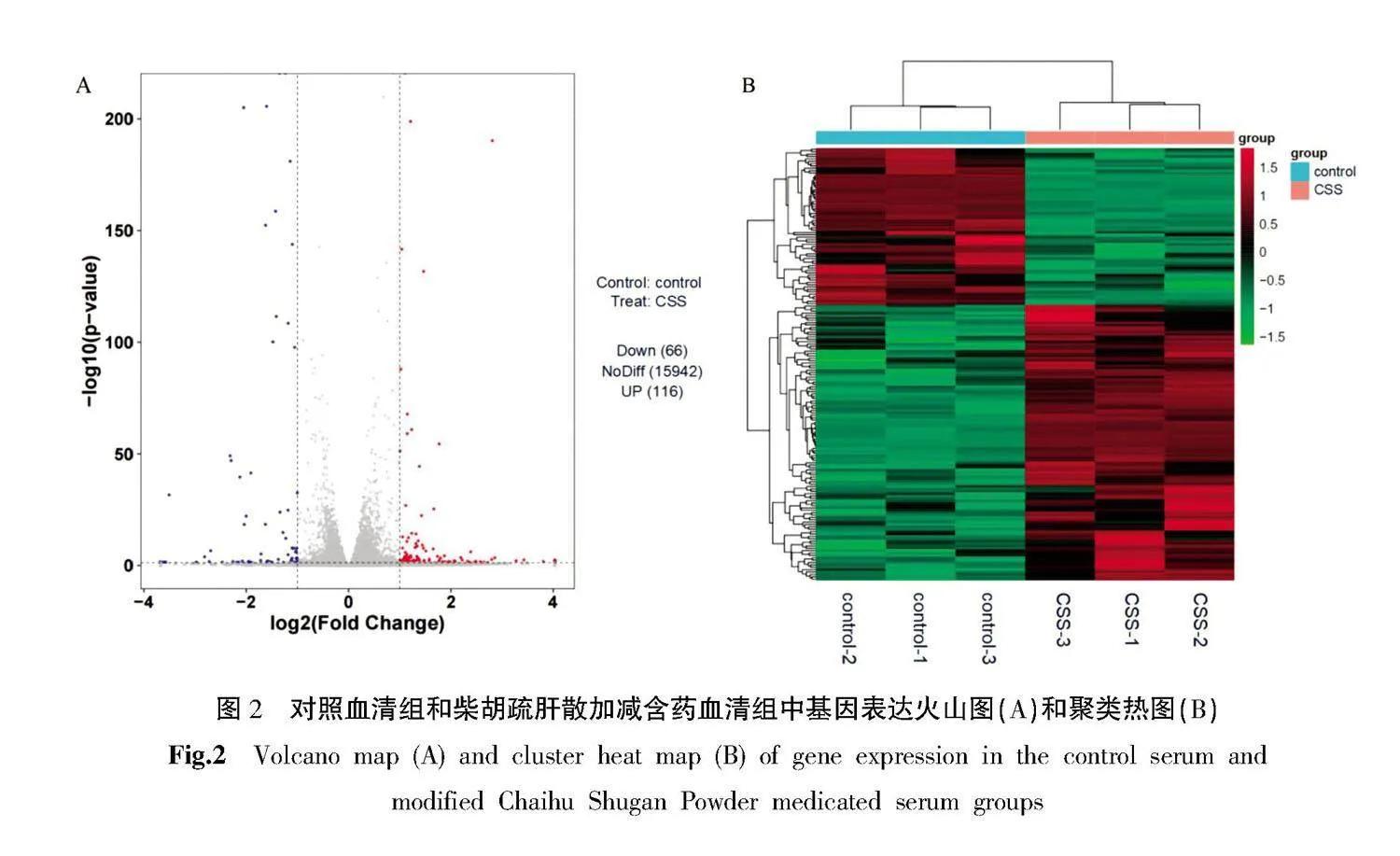
3.2.1nbsp; 火山图和聚类热图" 采用DESeq对对照血清组和柴胡疏肝散加减含药血清组细胞中基因表达进行差异分析,筛选条件为:|log2(Fold change)|gt;1,显著性Plt;0.05。火山图显示,与对照血清组比较,柴胡疏肝散加减含药血清组细胞中有116个基因显著上调,66个基因显著下调(图2A)。聚类热图显示,差异基因表达量在组内重复性较好,组间差异显著(图2B)。
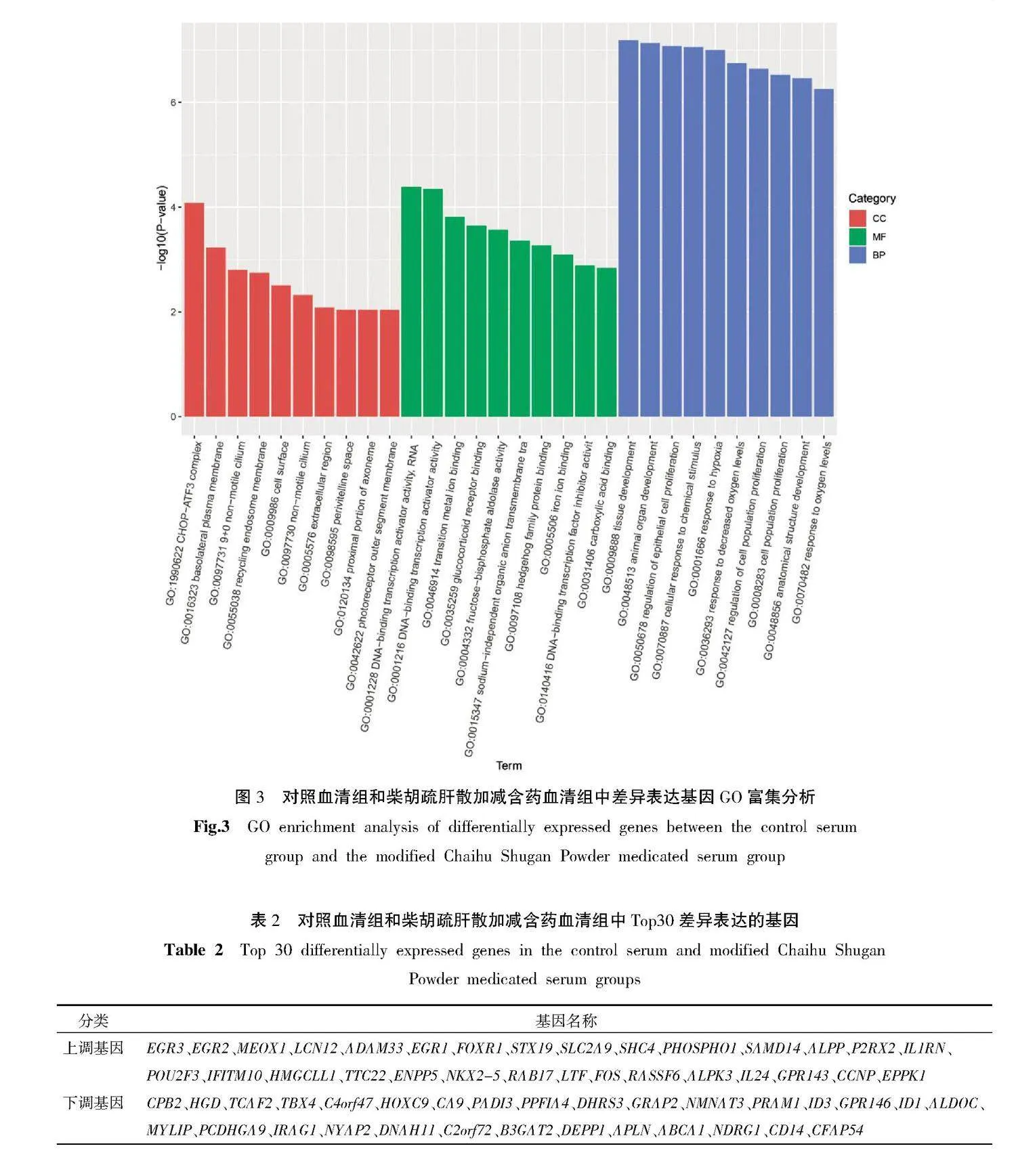
3.2.2" 差异表达基因的GO富集分析" 为了探究柴胡疏肝散加减含药血清对MDA-MB-231细胞中差异表达基因主要生物学功能的影响,采用GO富集分析揭示其生物学功能。GO富集分析按功能分成3个部分:细胞组分(cell component,CC)、分子功能(molecular function,MF)和生物过程(biological process,BP)。在CC中,差异基因主要富集于CCAAT增强子结合蛋白同源蛋白(CCAAT enhance-binding protein homologous protein,CHOP)-激活转录因子3(activated transcriptional factor 3,ATF3)复合物、基底外质膜等;在MF中,差异基因主要富集于DNA结合转录激活因子活性、过渡金属离子结合等;在BP中,差异基因主要富集于组织发育、动物器官发育、上皮细胞增殖调控、细胞对化学应激的反应等。详见图3。
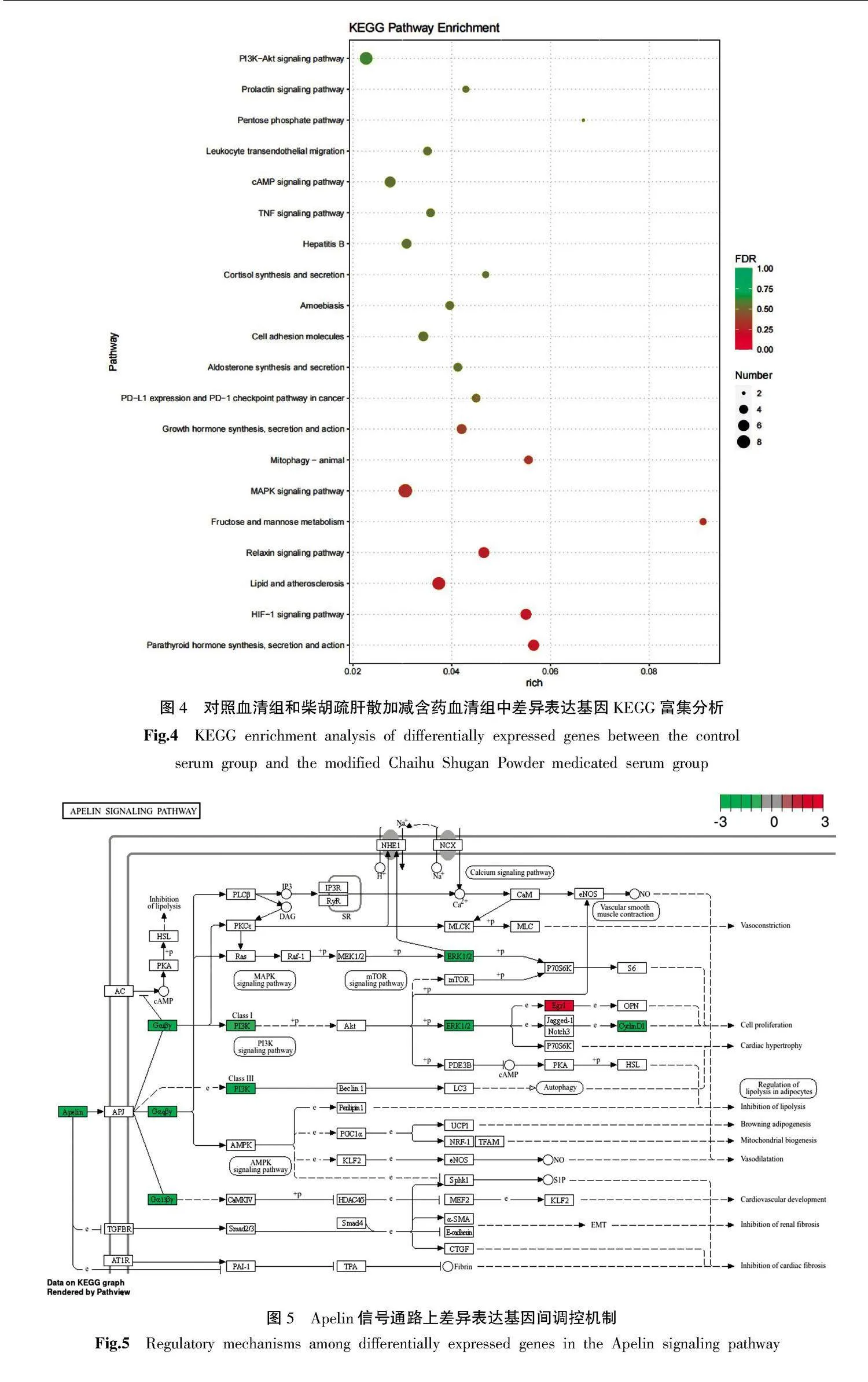
3.2.3" 差异表达基因的KEGG富集分析" KEGG富集分析显示两组间差异基因主要富集于PI3K/Akt信号通路、MAPK信号通路、脂质与动脉粥样硬化、环磷酸腺苷信号通路等。PI3K/Akt、MAPK是经典的肿瘤信号通路,提示柴胡疏肝散加减含药血清可能通过PI3K/Akt与MAPK信号通路抑制MDA-MB-231细胞的增殖活力。详见图4。
3.2.4" 柴胡疏肝散加减含药血清调控的关键靶点筛选" 柴胡疏肝散加减含药血清处理后MDA-MB-231细胞中显著上调和下调的Top30基因见表2。在这些差异基因中,柴胡疏肝散加减含药血清显著抑制调控PI3K/Akt信号通路的APLN基因的表达。详见表2和图5。
3.3" 各组MDA-MB-231细胞中APLN基因敲低和过表达验证
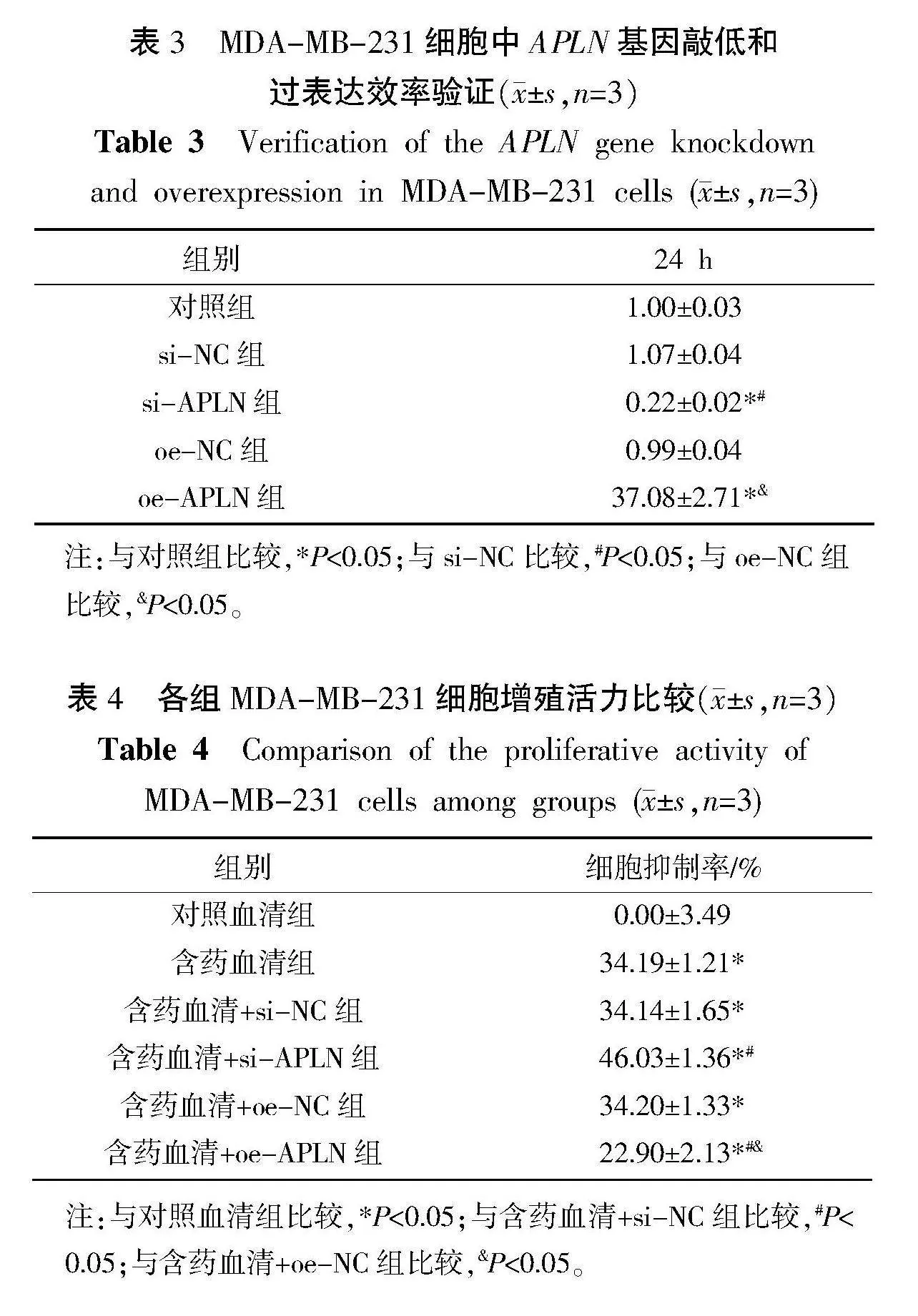
与对照组相比,si-NC组中APLN mRNA相对表达量差异无统计学意义(Pgt;0.05),而si-APLN组中APLN mRNA相对表达量降低(敲低效率约80%)(Plt;0.05)。与oe-NC组相比,oe-APLN组中APLN mRNA相对表达量增加了37.45倍(37.08/0.99)(Plt;0.05)。详见表3。
3.4" 各组MDA-MB-231细胞增殖活力比较
含药血清组中细胞增殖活力低于对照血清组(Plt;0.05)。含药血清+si-APLN组中细胞增殖活力低于含药含药血清+si-NC组(Plt;0.05);含药血清+oe-APLN组中细胞增殖活力高于含药含药血清+oe-NC组(Plt;0.05),但仍低于对照血清组(Plt;0.05)。与含药血清组比较,含药血清+si-NC组和含药血清+oe-NC组中细胞增殖活力差异均无统计学意义(Pgt;0.05)。详见表4。
3.5" 各组MDA-MB-231细胞迁移能力
与对照血清组比较,含药血清组、含药血清+si-APLN组及含药血清+oe-NC组中细胞的迁移距离均减少(Plt;0.05);与含药血清+si-NC组比较,含药血清+si-APLN组中细胞的迁移距离减少(Plt;0.05);与含药血清+oe-NC组比较,含药血清+oe-APLN组中细胞的迁移距离增加(Plt;0.05);与含药血清组比较,含药血清+si-NC组和含药血清+oe-NC组中细胞的迁移距离差异均无统计学意义(Pgt;0.05)。详见图6及表5。
3.6" 各组MDA-MB-231细胞侵袭能力
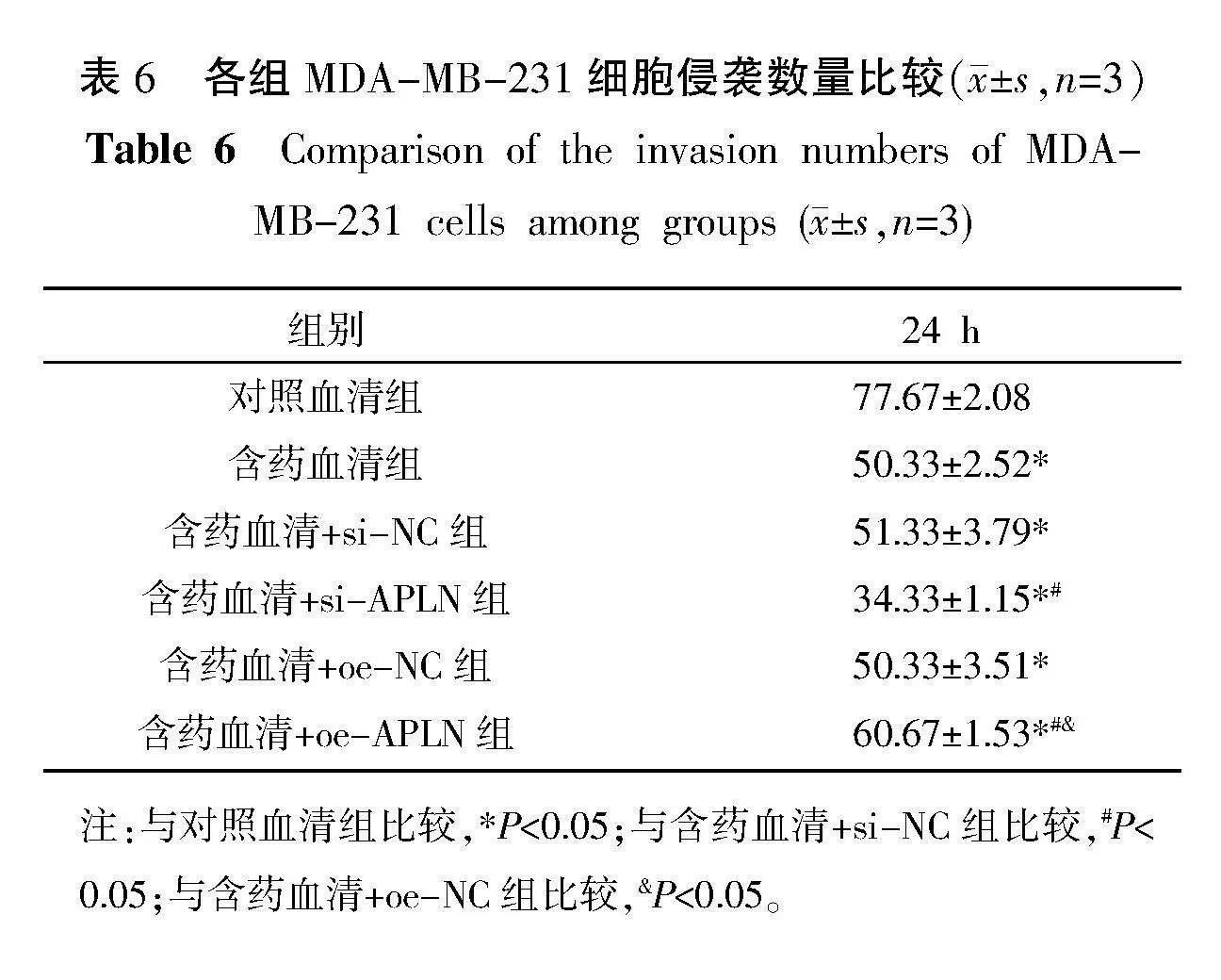
与对照血清组比较,含药血清组、含药血清+si-APLN组及含药血清+oe-APLN组中细胞的侵袭数量均减少(Plt;0.05);与含药血清+si-NC组比较,含药血清+si-APLN组中细胞的侵袭数量减少(Plt;0.05);与含药血清+oe-NC组比较,含药血清+oe-APLN组中细胞的侵袭数量增加(Plt;0.05);与含药血清组比较,含药血清+si-NC组和含药血清+oe-NC组中细胞的侵袭数量差异均无统计学意义(Pgt;0.05)。详见图7及表6。
3.7" 各组MDA-MB-231细胞中APLN、PIK3C3、Akt mRNA表达情况
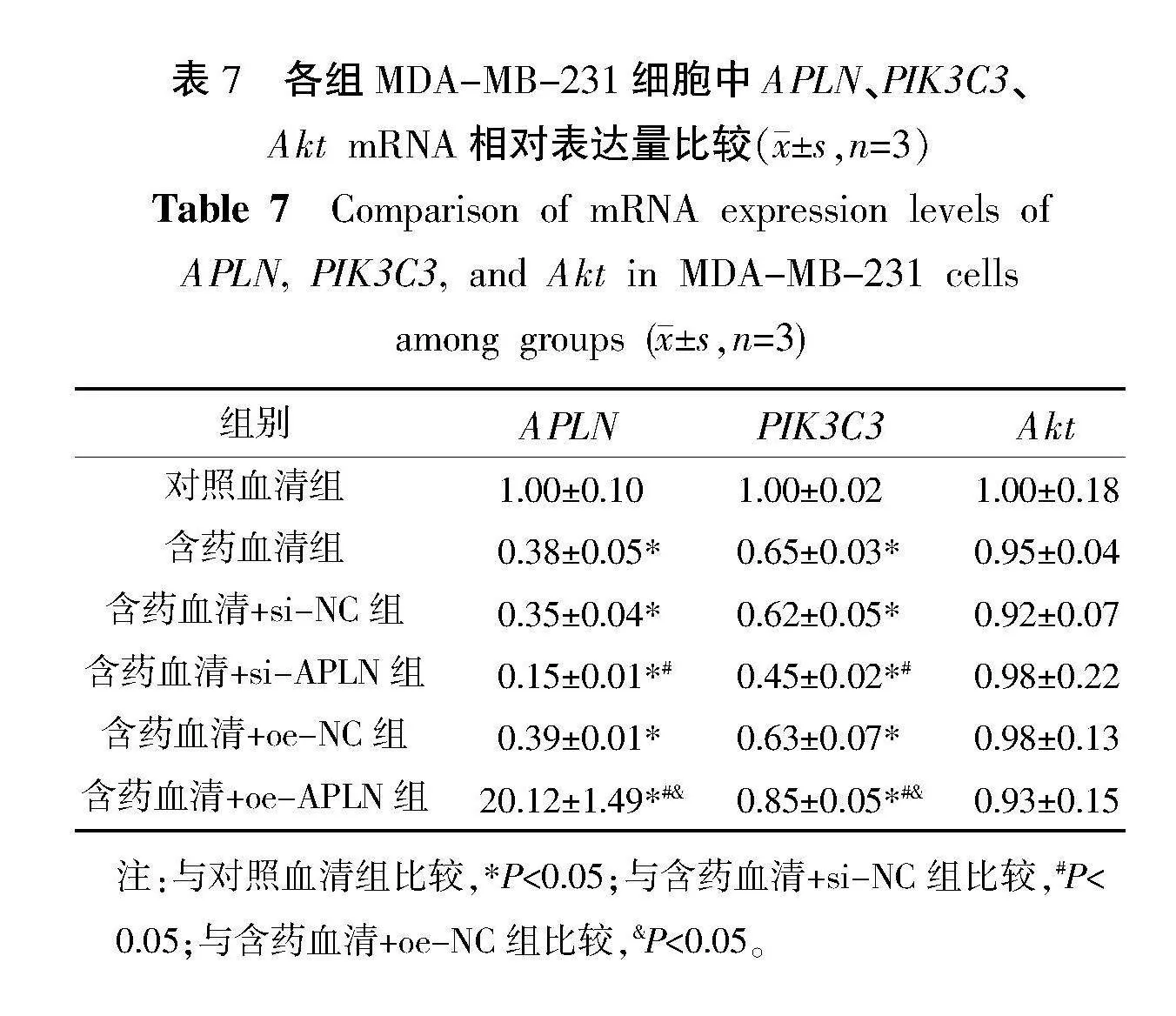
与对照血清组比较,含药血清组和含药血清+si-APLN组细胞中APLN和PIK3C3 mRNA相对表达量均减少(Plt;0.05);与含药血清+si-NC组比较,含药血清+si-APLN组细胞中APLN和PIK3C3 mRNA相对表达量减少(Plt;0.05);与含药血清+oe-NC组比较,含药血清+oe-APLN组中APLN和PIK3C3 mRNA相对表达量增加(Plt;0.05)。细胞中Akt mRNA相对表达量在各组中差异均无统计学意义(Pgt;0.05)。详见表7。
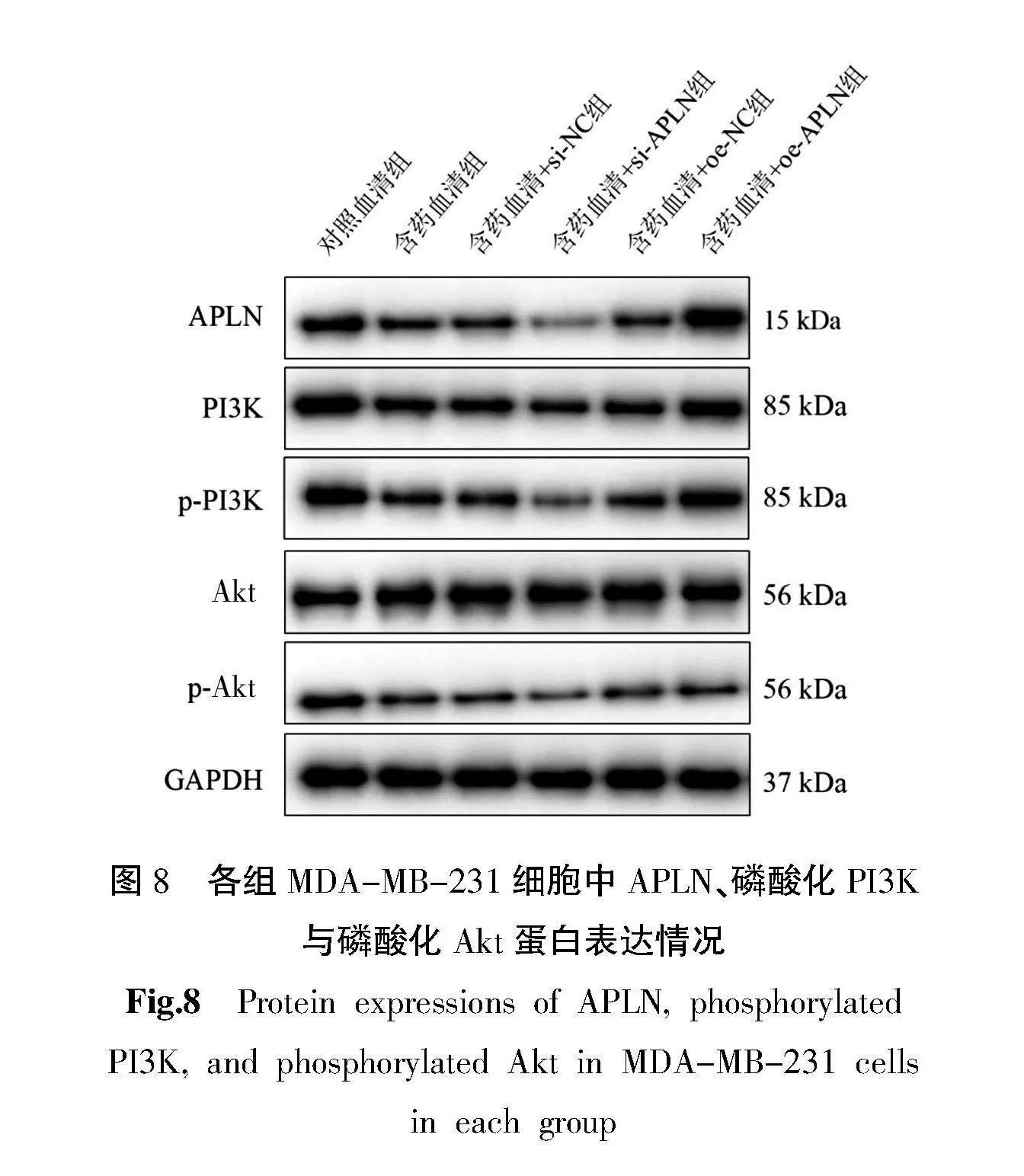
3.8" 各组MDA-MB-231细胞中APLN、磷酸化PI3K与磷酸化Akt蛋白表达情况
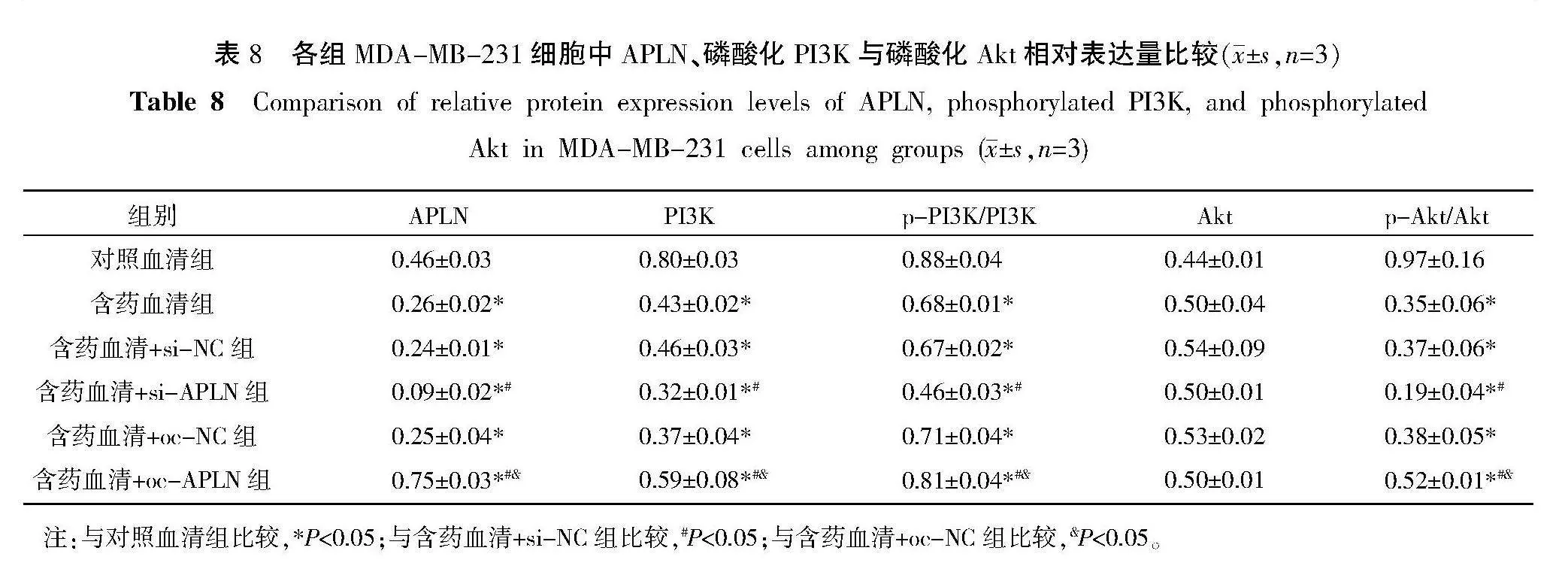
含药血清组和含药血清+si-APLN组细胞中APLN、PI3K、磷酸化PI3K与磷酸化Akt蛋白相对表达量低于对照血清组(Plt;0.05)。含药血清+si-APLN组细胞中APLN、PI3K、磷酸化PI3K与磷酸化Akt蛋白相对表达量低于含药血清+si-NC组(Plt;0.05),而含药血清+oe-APLN组细胞中APLN、PI3K、磷酸化PI3K与磷酸化Akt蛋白相对表达量高于含药血清+oe-NC组(Plt;0.05)。含药血清+si-NC组和含药血清+oe-NC组细胞中APLN、PI3K、磷酸化PI3K与磷酸化Akt蛋白相对表达量与含药血清组比较无统计学意义(Pgt;0.05)。Akt蛋白相对表达量在各组间均无统计学意义(Pgt;0.05)。详见图8和表8。
4 讨论
TNBC是一种高度侵袭性和异质性的乳腺癌亚型,目前尚缺乏有效的治疗方案[10],深入研究其发病及治疗机制具有重要的临床意义[11]。我国最早对乳腺癌的描述见于晋朝的《肘后备急方》,因乳腺癌局部坚硬如石,遂称为“乳疳”“乳岩”等。治疗乳之实证,以“通”为法,应以疏肝理气、养血柔肝为治则;若肝气郁滞,血脉失和,则发为乳岩[12-13]。因此,对于TNBC,应从肝论治,疏肝理气,活血化瘀是治疗TNBC的基本方针[14]。
中药因其具有显著的抗癌性与低毒性,常用于癌症的综合治疗[15]。柴胡疏肝散作为中医基础方,主治肝气郁滞之证,具有疏肝理气之效,多年来广泛应用于临床[7,16],可有效治疗肝郁气滞型乳腺癌[7,14]。柴胡疏肝散中北柴胡疏肝理气,为君药;枳壳理气宽中,香附理血中之滞、川芎疏肝开郁,芍药柔肝止痛、养血调经,芍药配甘草,酸甘化阴,共养肝体,为臣药。诸药合用,共奏疏肝解郁之效[14]。据报道,柴胡疏肝散及其加减可对乳腺癌(包括TNBC)化学治疗起到增敏作用[7,17],其活性成分槲皮素和木犀草素可抑制TNBC细胞增殖并促进PTX化学治疗敏感[17]。在本文中,柴胡疏肝散加减含药血清抑制MDA-MB-231细胞增殖、迁移与侵袭,通过转录组测序揭示了对照血清组和含药血清组细胞中差异表达基因主要富集于PI3K/Akt、MAPK等信号通路,与XIAO等[8]通过网络药理学揭示柴胡疏肝散治疗乳腺癌的分子机制基本一致。
PI3K/Akt和MAPK信号通路的异常激活是导致TNBC复发、转移与预后不良的重要因素。许多研究探讨了中药复方通过PI3K/Akt、MAPK信号通路抑制TNBC进展。例如,乳积方作为一种传统中药复方,通过抑制PI3K/Akt通路将TNBC细胞周期阻滞于S期,进而发挥抗肿瘤作用[18];白蒲黄颗粒通过抑制MAPK信号通路诱导TNBC细胞DNA损伤,进而抑制其增殖[19]。在本实验中,柴胡疏肝散加减含药血清干预后差异表达基因显著富集于PI3K/Akt、MAPK信号通路,提示柴胡疏肝散加减含药血清可能通过PI3K/Akt、MAPK信号通路来干预MDA-MB-231细胞增殖、迁移与侵袭。
APLN作为一种脂肪因子家族成员,调节多种代谢功能,如胰岛素分泌、血压、体液平衡等[20]。近年来,许多研究报道APLN参与细胞增殖、淋巴管与新血管生成等生理过程[20],被认为是多种癌症治疗的靶点[21-23]。在乳腺癌中,多项临床研究显示APLN与乳腺癌淋巴结转移和TNM分期强相关,其高表达与预后不良有关[24],提示APLN可作为乳腺癌治疗的潜在靶点。此外,APLN诱导乳腺癌MCF-7细胞增殖与侵袭[25],而抑制APLN信号通路可能增加乳腺癌细胞放疗敏感性[26]。APLN作为Apelin信号通路上核心成员,许多研究证实APLN激活PI3K/Akt信号通路,促进癌症进展,如肝癌[27]、宫颈癌[28]、胰腺癌[29]等。然而,APLN对TNBC细胞增殖、迁移与侵袭的影响尚未有研究报道。在本研究中,柴胡疏肝散加减含药血清干预后降低MDA-MB-231细胞中APLN mRNA的表达,并抑制PI3K/Akt信号通路激活;APLN敲低进一步增强柴胡疏肝散加减含药血清对MDA-MB-231细胞增殖、迁移、侵袭以及PI3K/Akt信号通路激活的抑制作用,而APLN过表达则起到相反作用,提示柴胡疏肝散加减含药血清可通过调控APLN/PI3K/Akt信号通路抑制MDA-MB-231细胞的增殖、迁移与侵袭,为柴胡疏肝散加减干预TNBC提供了理论基础和治疗靶点,也为后续针对患者中APLN表达的高低开展精准治疗提供了可能。
综上,柴胡疏肝散加减含药血清对MDA-MB-231细胞增殖、迁移与侵袭的抑制作用可通过负调控APLN/PI3K/Akt信号通路的激活来实现。TNBC增殖与转移与细胞周期调控异常相关,接下来将探究柴胡疏肝散加减是否通过调控APLN/PI3K/Akt信号通路影响细胞周期和凋亡来抑制TNBC细胞增殖、迁移与侵袭。此外,本研究缺乏PI3K/Akt信号通路激动剂或抑制剂干预实验,动物水平上也缺少柴胡疏肝散加减调控该信号通路抑制肿瘤生长与转移的证据,有待于进一步研究。同时,柴胡疏肝散加减对TNBC患者的治疗效果尚未系统性研究,后续将完善临床资料收集,包括柴胡疏肝散加减单独和联合化学治疗药物对TNBC治疗效果的相关数据,明确柴胡疏肝散加减对TNBC患者的治疗和增敏作用。
参考文献
[1] BRAY F, LAVERSANNE M, SUNG H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA, 2024, 74(3): 229-263.
[2] GARRIDO-CASTRO A C, LIN N U, POLYAK K. Insights into molecular classifications of triple-negative breast cancer: Improving patient selection for treatment[J]. Cancer Discovery, 2019, 9(2): 176-198.
[3] 北京乳腺病防治学会中西医结合专业委员会. 三阴性乳腺癌中西医结合辅助强化治疗专家共识(2022版)[J]. 中国医学前沿杂志(电子版), 2023, 15(9): 21-29.
[4] 林丽丽, 周" 怡, 刘红涛, 等. 中药双向调控肿瘤免疫治疗癌症的机制研究[J]. 中医学报, 2024, 39(4): 743-750.
[5] 李萍萍. 中医药治疗乳腺癌述评[J]. 北京中医药大学学报, 2023, 46(11): 1616-1622.
[6] 朱梦鸽, 鲁" 凯. 中医治疗三阴性乳腺癌的研究进展[J]. 上海医药, 2024, 45(7): 59-62.
[7] 赵" 玲, 高伟艳, 顾爱丽, 等. 柴胡疏肝散加减联合AC方案和紫杉醇治疗晚期乳腺癌患者的效果[J]. 中国民康医学, 2023, 35(12): 82-84, 88.
[8] XIAO K M, LI K X, LONG S D, et al. Potential molecular mechanisms of Chaihu-Shugan-San in treatment of breast cancer based on network pharmacology[J]. Evidence-Based Complementary and Alternative Medicine, 2020, 2020: 3670309.
[9] NAIR A, MORSY M A, JACOB S. Dose translation between laboratory animals and human in preclinical and clinical phases of drug development[J]. Drug Development Research, 2018, 79(8): 373-382.
[10] WEI S J, ZHANG Y B, MA X R, et al. MAT as a promising therapeutic strategy against triple-negative breast cancer via inhibiting PI3K/AKT pathway[J]. Scientific Reports, 2023, 13(1): 12351.
[11] MAO M S, JIA Y L, CHEN Y X, et al. HJURP regulates cell proliferation and chemo-resistance via YAP1/NDRG1 transcriptional axis in triple-negative breast cancer[J]. Cell Death amp; Disease, 2022, 13(4): 396.
[12] 王雨青, 孙霃平, 刘" 胜. 从“乳为肝窍”论治乳房疾病[J]. 陕西中医, 2022, 43(7): 929-931, 949.
[13] 廖" 丽, 李定祥. 论乳为肝窍[J]. 中国中医基础医学杂志, 2017, 23(3): 315-317.
[14] 李立兵, 王" 珍, 王小璞. 柴胡舒肝散含药血清对乳腺癌MCF-7细胞的体外抑制作用及Bcl-2与VEGF的影响[J]. 中国中医药现代远程教育, 2021, 19(1): 157-159.
[15] YANG Z M, ZHANG Q H, YU L H, et al. The signaling pathways and targets of traditional Chinese medicine and natural medicine in triple-negative breast cancer[J]. Journal of Ethnopharmacology, 2021, 264: 113249.
[16] 张" 娟, 饶" 娟, 张丽霞. 柴胡疏肝散合针刺治疗脾虚肝郁气滞型咽喉反流性疾病临床观察[J]. 光明中医, 2024, 39(4): 699-701.
[17] WEI W, LI X F, LI Z Y. Exploration of the sensitization effect of Chaihu Shugan powder on chemotherapy for triple-negative breast cancer and its active ingredients[J]. Biopolymers, 2024, 115(5): e23605.
[18] JIA W Y, LIN X, CHEN X Z, et al. Rujifang inhibits triple-negative breast cancer growth via the PI3K/AKT pathway[J]. Journal of Ethnopharmacology, 2024, 327: 118011.
[19] MI S, LIU X, ZHANG L, et al. Chinese medicine formula 'Baipuhuang Keli' inhibits triple-negative breast cancer by hindering DNA damage repair via MAPK/ERK pathway[J]. Journal of Ethnopharmacology, 2023, 304: 116077.
[20] CHRISTODOULATOS G S, SPYROU N, KADILLARI J, et al. The role of adipokines in breast cancer: Current evidence and perspectives[J]. Current Obesity Reports, 2019, 8(4): 413-433.
[21] 朱东来, 王" 婷, 陆" 静, 等. APLN及其受体在肝细胞癌中的表达及其临床意义[J]. 现代医药卫生, 2023, 39(14): 2400-2406.
[22] LV S, AN Y, DONG H, et al. High APLN expression predicts poor prognosis for glioma patients[J]. Oxidative Medicine and Cellular Longevity, 2022, 2022: 8393336.
[23] CHEN J, LI Z, ZHAO Q, et al. Roles of apelin/APJ system in cancer: Biomarker, predictor, and emerging therapeutic target[J]. Journal of Cellular Physiology, 2022, 237(10): 3734-3751.
[24] HU D, CUI Z, PENG W, et al. Apelin is associated with clinicopathological parameters and prognosis in breast cancer patients[J]. Archives of Gynecology and Obstetrics, 2022, 306(4): 1185-1195.
[25] PENG X, LI F, WANG P, et al. Apelin-13 induces MCF-7 cell proliferation and invasion via phosphorylation of ERK1/2[J]. International Journal of Molecular Medicine, 2015, 36(3): 733-738.
[26] 李馨如, 罗" 成, 荀" 欣, 等. HER-3基因表达对乳腺癌细胞放射抵抗及Apelin/APJ信号通路的作用机制[J]. 中国临床研究, 2023, 36(1): 12-17.
[27] CHEN H R, WONG C C, LIU D B, et al. APLN promotes hepatocellular carcinoma through activating PI3K/Akt pathway and is a druggable target[J]. Theranostics, 2019, 9(18): 5246-5260.
[28] WANG Q, WANG B Y, ZHANG W J, et al. APLN promotes the proliferation, migration, and glycolysis of cervical cancer through the PI3K/AKT/mTOR pathway[J]. Archives of Biochemistry and Biophysics, 2024, 755: 109983.
[29] CHAVES-ALMAGRO C, AURIAU J, DORTIGNAC A, et al. Upregulated apelin signaling in pancreatic cancer activates oncogenic signaling pathways to promote tumor development[J]. International Journal of Molecular Sciences, 2022, 23(18): 10600.
(本文编辑" 苏" 维)
