绿针假单胞菌桔黄亚种在香蕉枯萎病防治中的应用
2025-02-16宋秀丽赵崇钊卓愉林马伟纯马健维张品淼陈碧珊




摘要:绿针假单胞菌被认为是环境友好型的植物生防与促生菌,但关于绿针假单胞菌对香蕉枯萎病的防治效果尚不清楚。本研究利用绿针假单胞菌防治香蕉枯萎病,通过抗病相关代谢酶检测、代谢液的抑菌效果和盆栽试验明确绿针假单胞菌对香蕉枯萎病的生防效果及对土壤微生物群落的影响。结果表明:绿针假单胞菌桔黄亚种P1能够显著抑制香蕉枯萎病病原菌,抑菌率为89.92%。P1的菌悬液和代谢液均能有效抑制香蕉枯萎病病原菌菌丝生长和孢子萌发;生防菌P1能够分泌与生防作用相关的嗜铁素、蛋白酶、纤维素酶和淀粉酶;P1能够稳定定殖于植物根际土壤,显著抑制土壤中镰孢菌拷贝数的增加,对香蕉根系枯萎病防效达88.43%,对香蕉株高、茎围和植株干质量具有显著的促进作用。同时土壤中绿针假单胞菌P1 的丰度与真菌群落多样性(Fungus Shannon)和镰孢菌(Fusarium)的相对丰度呈显著负相关,与细菌群落多样性(Bacterial Shannon)、群落丰度(BacterialChao1)和真菌群落丰度(Fungus Chao1)呈极显著负相关。研究表明,绿针假单胞菌桔黄亚种P1是一株良好的广谱抑菌性生防菌,能够显著防控香蕉枯萎病,并对香蕉具有促生作用。
关键词:香蕉枯萎病;尖孢镰孢菌;绿针假单胞菌;抑菌机制;生防效果
中图分类号:S436.68 文献标志码:A 文章编号:2095-6819(2025)01-0206-12 doi: 10.13254/j.jare.2023.0339
香蕉(Musa spp.)是世界上重要的热带和亚热带水果,我国是仅次于印度的香蕉第二大生产国,是世界香蕉消费第一大国[1]。香蕉枯萎病是我国香蕉产区发生最为严重、最难防治的一种毁灭性土传病害,被老百姓称为“香蕉癌症”。香蕉枯萎病(Fusariumwilt disease of banana),又称巴拿马病或黄叶病,是由尖孢镰孢菌古巴专化型(Fusarium oxysporium f. sp.cubense 4,Foc 4)引起的一种土传维管束病害,几乎能侵染所有的香蕉品种,难以防控[2-5]。尤其在全球变暖以及集约化农业快速发展的背景下,风险将进一步增大[6]。
土传病害控制包括化学药剂、抗性品种、轮作种植、生物防治等方式[7-11]。生物防治因具有绿色、长效、生态友好等特点,被认为是未来预防土传病害的重要措施之一[12-13]。研究证明,贝莱斯芽孢杆菌B18对Foc TR4具有显著抑制作用,盆栽防效为67.9%[14]。勇智[12]研究发现放线菌对Foc TR4具有良好的抑制作用,Yang 等[15]发现木霉菌有消除Foc TR4 传播的潜力,孙杰等[16]发现由绿色木霉和解淀粉芽孢杆菌制成复合生防菌剂能有效抑制Foc 4的增殖。绿针假单胞菌(Pseudomonas chlororaphis)是国内外研究最早、报道最多的一类生防菌,受到各国研究者的关注。绿针假单胞菌广泛分布于植物根际土壤中,可产生多种具有抑菌作用的次生代谢产物,包括吩嗪类物质、藤黄绿脓菌素(Pyoluteorin,Plt)、硝吡咯菌素(Pyrrolntrin,Prn)、2,4-DAPG(2,4-diacetylphloroglueinol,Phl)、脂多肽类及其衍生物等,在防治病害中发挥着重要作用[17]。此外,绿针假单胞菌还可以产生植物激素IAA、嗜铁素等物质,促进植物的生长[18-19]。研究报道,绿针假单胞菌(P. chlororaphis)对植物抵抗病原菌、线虫等侵染具有显著的促进作用[20]。但目前关于绿针假单胞菌防治香蕉枯萎病的研究还鲜有报道。鉴于此, 本研究拟探究绿针假单胞菌对香蕉枯萎病的生防作用机理与生防效果,明确绿针假单胞菌对香蕉枯萎病的生防作用机理与生防效果,初步探究绿针假单胞菌对土壤微生物群落丰度与多样性的影响,为绿针假单胞菌的应用及其土壤生物作用研究提供理论基础。
1 材料与方法
1.1 菌株P1的鉴定
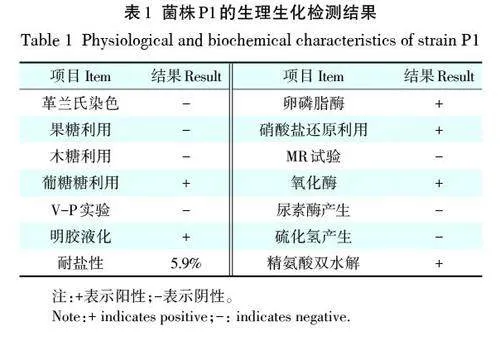
1.1.1 菌株形态特征及生理生化指标测定
将菌株P1单菌落接种于KB固体培养基上,28 ℃培养24 h后,参照《常见细菌系统鉴定书册》[21]和《伯杰氏细菌鉴定手册》[22]对菌株进行形态特征观察与生理生化指标测定。
1.1.2 P1菌株16S rDNA鉴定
采用TIANGEN 细菌基因组DNA 提取试剂盒提取菌株P1基因组DNA为模板,选择16S rDNA保守基因(引物为27F-1492R)进行PCR 扩增并测序[23]。所得PCR产物由生工生物工程(上海)股份有限公司进行测序,使用MEGA 7.0软件对测序结果进行分析并分类。
1.2 拮抗菌P1对香蕉枯萎病的抑菌效果
香蕉枯萎病病原菌尖孢镰孢菌(F. oxysporum)JB9 由岭南师范学院热带作物绿色防控课题组分离,经过形态学观察、分子生物学鉴定确定为尖孢镰孢菌。
生防细菌P1为岭南师范学院热带作物绿色防控课题组前期分离,菌种P1保藏于中国普通微生物菌种保藏管理中心,保藏编号为CGMCC No:19577,菌株16S rDNA 序列上传至NCBI 数据库的登录号为OR_143372。
采用平板对峙法检测P1对JB9的抑制效果。在PDA培养基平板中心接种一个直径5 mm的香蕉枯萎病病原菌菌饼,采用十字交叉法将5 μL OD600 为1.0的待测菌株菌悬液滴加距皿中心2.5 cm处。以无菌培养基为对照,5个重复,密封后放于28 ℃恒温箱培养5~7 d,待空白菌株长至平板边缘,拍照后利用Image-Pro Plus 6.0 识别计算抑菌率。
抑菌率(%)=(对照菌落面积-处理菌落面积)/对照菌落面积×100
分别挑取对照组与处理组病原菌菌落边缘菌丝放置显微镜下观察形态[14]。
1.3 生防菌生长曲线
用接种针挑取活化培养24 h后的生防菌,接种于100 mL PDB培养液中,置于28 ℃、170 r·min-1的摇床中振荡培养24 h作为种子液。无菌条件下抽取1 mL生防菌种子培养液接种到装有99 mL PDB培养基的250 mL 锥形瓶中,设3 个重复,置于预先设置好28 ℃、170 r·min-1的摇床中振荡培养,分别在培养12、24、48、72、96、120 h和144 h取样,用紫外分光光度计测定生防菌培养液的OD600值。
1.4 生防菌代谢酶测定
1.4.1 蛋白酶检测
A:称取脱脂奶粉(DSM)6.4 g溶于240 mL蒸馏水中,放于高压灭菌锅121 ℃灭菌1 min。B:称取琼脂(Agar)6.4 g,加水定容至240 mL,放于高压灭菌锅121 ℃灭菌20 min,待冷却后备用。当A灭菌后,取出冷却,同时用微波炉融化B,冷却至50~60 ℃将两者混合后倒平板。接种生防菌后置于30 ℃培养箱中培养3 d,观察是否出现透明圈,拍照记录[24]。
1.4.2 纤维素酶检测
称取蛋白胨(Peptone)10 g、羧甲基纤维素钠(CMC-Na)10 g、酵母粉(Yeast Extract)10 g、氯化钠(NaCl)5 g、琼脂(Agar)18 g、磷酸二氢钾(KH2PO4)1g,用水定容至1 000 mL,调节pH 为7.0,置于高压灭菌锅灭菌,待冷却后倒平板。将生防菌接种后放于30 ℃培养箱中培养2 d,取出,用预先配好的浓度为1mg·mL-1的刚果红溶液染色,静置1 h,将染液倒掉,再倒入1 mol·L-1的NaCI溶液,浸泡静置1 h,拍照观察记录有无透明圈[24]。
1.4.3 淀粉酶检测
配制淀粉酶鉴定培养基,称取可溶性淀粉2 g、FeSO4 ·7H2O 0.05 g、KNO3 3.1 g、NaCl 0.05 g、K3PO4 ·3H2O 0.05 g、MgSO4·7H2O 0.05 g、琼脂2 g、蒸馏水100mL,高压蒸气(121 ℃、20 min)灭菌。将滤纸片在菌株发酵液中浸泡润湿后放入淀粉酶培养基内,在37 ℃下培养2~3 d,然后加稀碘液将整个培养基平板上覆盖,15 min后再观察透明圈的存在情况[24]。
1.4.4 嗜铁素检测
A :称取60.5 mg 的铬天青(Chrome AzurolSulphonate,CAS)溶于50 mL 去离子水中;B:10 mL的三价铁溶液(配制1 mmol FeCl3·6H2O,溶液中相当于含有10 mmol·L-1盐酸);C:称取72.9 mg溴化十六烷基三甲基铵(Hexadecy -ltrimethyl-ammoniumBromide,HDTMA)溶于40 mL 去离子水)。将A 和B混合,玻璃棒揽拌混匀;然后加入C 溶液调节pH 至中性,加入琼脂20.0 g,蒸馏水定容至1 000 mL;放于高压蒸气(121 ℃、20 min)灭菌器中灭菌后待冷却至50~60 ℃,混匀后倒平皿;将生防菌接菌平板中心,置于30 ℃培养箱中培养5 d,拍照记录观察有无透明圈[25]。
1.5 P1生防菌发酵液的抑菌效果
将菌株种子液1 mL 加入99 mL PDB培养液中培养,28 ℃、170 r·min-1下培养2 d,稀释至OD600=1.0作为生防菌发酵液,经4 ℃离心机6 000 r·min-1离心15min后的上清液用0.22 μm微膜过滤,即得到生防菌发酵上清液,取其上清液与PDA培养基混合配成0、3%、5%、10%、20%浓度的PDA培养基,然后倒平板,冷凝后于平板中心接种病原菌(直径9 mm),观察记录病原菌菌落直径。每个处理重复3次,置于28 ℃黑暗培养箱中培养7 d后测病原菌菌落直径。
将镰孢菌在PDA培养基中进行产孢培养。采用24孔细胞培养板,将浓度分别为3%、5%、10%的生防菌发酵上清液加入到病原菌孢子悬浮液中,菌悬液最终体积为2 mL,以未接种生防菌的灭菌培养液为对照,研究发酵上清液对病原孢子萌发的影响。将尖镰孢LD在PDA培养基上扩繁5 d,然后用打孔器打成7mm菌蝶,无菌环境下转移至PDA培养基上培养,当菌落直径达4 cm时,切掉没有生长病原菌的部分培养基。分别取浓度为3%、5%、10%的15 mL生防菌无菌溶液加到培养皿中,刮掉菌丝,静置20 min,倒掉溶液,26 ℃恒温培养48 h,以无菌水为对照用血球计数板检测孢子悬浮液的浓度[14]。
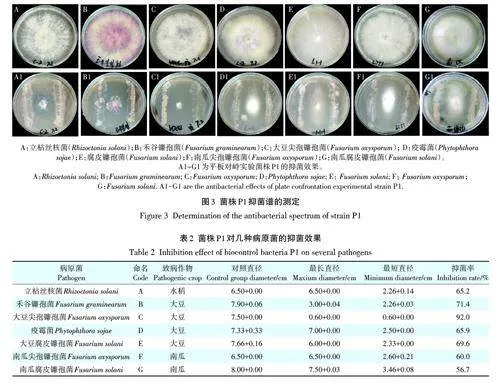
1.6 抑菌谱的测定
采用平板对峙法对植物病原菌进行抑菌效果测定。在距离PDA平板中心3 cm处用菌钩将活化的拮抗细菌划线接种。用打孔器打取直径为0.7 cm的经扩繁的植物病原菌接种在平板的中央,膜密封培养,一种植物病原菌重复3个平板,置于28 ℃恒温箱培养6 d,测量最长半径和最短半径。
病原菌:供试病原菌为水稻立枯丝核(Rhizoctoniasolani);大豆根腐病病原菌禾谷镰孢菌(F.graminearum)、尖孢镰孢菌(F. oxysporum)、疫霉菌(Phytophthora sojae)、腐皮镰孢菌(F. solani);2株南瓜根腐病病原菌尖孢镰孢菌(F. oxysporum)、腐皮镰孢菌(F. solani),均由东北农业大学植物保护学院提供。
1.7 P1生防菌的生防效果试验设计
(1)香蕉枯萎病病原菌孢子液制备。刮取PDA培养基上的菌丝至PDB培养基中,28 ℃下170 r·min-1恒温箱培养5 d,经过2层纱布过滤获得病原菌孢子液,用血球计数板调节孢子浓度为1×106 CFU·mL-1,4 ℃冰箱保存待用。
(2)生防菌发酵液制备。将生防菌种子液按1%的接菌量转接到新鲜的PDB培养基中,170 r·min-1下28 ℃培养2 d,用无菌水稀释OD600=1.0,用血球计数板调节菌悬液浓度分别为1×106、1×107、1×108 CFU·mL-1的三种发酵液,4 ℃冰箱保存待用。
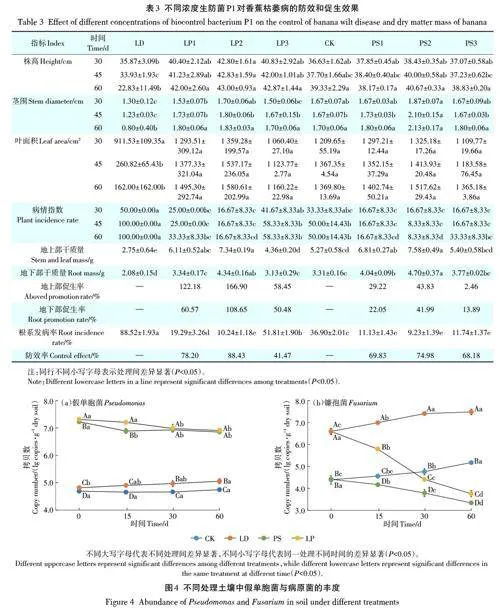
试验设置8个处理:①CK处理:采集田间香蕉种植土壤浇灌200 mL 蒸馏水;②LD处理:CK土壤浇灌100 mL 1×106 CFU·mL-1 的病原菌孢子悬浮液和100mL 蒸馏水;③LP1 处理:LD 土壤浇灌100 mL 1×106CFU·mL-1 P1 菌悬液;④LP2 处理:LD 土壤浇灌100mL 1×107 CFU·mL-1 P1菌悬液;⑤LP3处理:LD土壤浇灌100 mL 1×108 CFU·mL-1 P1菌悬液;⑥PS1处理:CK 土壤浇灌100 mL 1×106 CFU·mL-1 P1 菌悬液和100 mL蒸馏水;⑦PS2处理:CK 土壤浇灌100 mL 1×107 CFU·mL-1 P1 菌悬液和100 mL 蒸馏水;⑧PS3 处理:CK土壤浇灌100 mL 1×108 CFU·mL-1 P1菌悬液和100 mL蒸馏水。盆栽试验采用直径为20 cm、高18.8cm的花盆,每盆装入2 kg土壤,每盆土壤按照试验处理将处理液与土壤混匀后静置7 d,采用伤根处理移栽种植4片叶龄长势一致的“巴西”香蕉组织培养苗。每个处理6盆,设置3次重复。
所有盆栽放于人工气候室随机区组排列培养,每隔3 d淋1次无菌水,保持土壤持水量为60%。在香蕉移栽后30、45、60 d观察记录香蕉枯萎病病级。香蕉枯萎病病级特征如下:0级:植株无枯黄症状;1级:植株下部叶片出现轻微的枯黄症状,嫩叶完好,少部分根系轻微褐变,茎部出现水渍状褐变;2级:植株下部叶片出现明显的枯黄症状,但嫩叶完好,根系出现褐变,茎部和假茎部出现水渍状褐变;3级:整个植株出现枯黄症状,根系褐变腐烂,茎部和假茎部褐变连片,少数叶柄出现红褐;4 级:植株出现枯萎死亡症状,根系严重褐变腐烂。
病情指数(%)=Σ(各级病株数×相对级数值)/(调查总株数×最高病级数值)×100
用量尺测量香蕉株高、茎粗,用叶面积测量仪测定植株叶面积。在种植60 d时移出香蕉,观察记录香蕉根系发病率,调查香蕉根系数量,香蕉根系褐变腐烂则记为根系发病,计算发病率。取香蕉植株从球茎上方切断,105 ℃杀青30 min,45 ℃烘干至恒质量后,称量记录地上部、地下部干质量。
防效率(%)=(CK/LD 组发病率-处理组发病率)(/ CK/LD发病率)×100
促生率(%)=(CK/LD 组干质量-处理组干质量)(/ CK/LD组干质量)×100[26]
1.8 根际土壤微生物测定与分析
采集CK、LD、PS2(PS)、LP2(LP)处理0 d以及处理后香蕉移栽15、45、60 d时采集香蕉根际土壤进行假单胞菌和镰孢菌属qPCR 检测。土壤中荧光假单胞菌数量的测定参照杜娟等[27]的研究方法,即:以荧光假单胞菌的蛋白编码基因gyrB(gyrB-F:TGTTC⁃GAGGTGGTCGACAACT;gyrB - R:TGGAGGACGGT⁃CATGATGA)作为靶标基因,利用特异性引物建立实时荧光定量PCR的方法。土壤尖孢镰孢菌数量的测定参照Tao 等[28] 的研究方法,所用引物为FOF1 和FOR1(FOF1:5′ -ACATACCACTTGTTGCCTCG-3′ ;FOR1:5′-CGCCAATCAATTTGAGGAACG-3′)[29],所有样品均设定3个平行测试,以ddH2O代替DNA模板为阴性对照。根据各样品CT值计算每克干土所含尖孢镰孢菌的拷贝数,取对数值,以l g(copies·g-1 drysoil)表示。对盆栽处理60 d 采集CK、LD、PS2(PS)、LP2(LP)的香蕉根际土壤样品微生物总DNA 进行提取,由上海天昊生物科技有限公司进行后续分析。土壤总DNA 的提取使用E.Z.N.A.® soil DNA Kit(OmegaBio-tek,Norcross,GA,美国)试剂盒。使用16S的V4-V5区特异性引物F515(5′-GTGCCAGC⁃MGCCGCGG-3 ′)和R907(5 ′ - CCGTCAATTC⁃MTTTRAGTTT-3′)[30]进行PCR扩增。使用ITS1区域引物ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2(5′-GCTGCGTTCTTCATCGATGC-3′)[31]进行真菌PCR扩增。在QIIME 软件中对下机后的原始序列进行拼接和过滤,得到有效数据。将所有样品的有效数据采用USEARCH按照标准流程分析,按97%的序列相似度聚类成操作分类单元(OTU)[32]。使用RDPclassifier/UNITE(version7.2)数据库对获得的OTU 进行分类注释,获取每个OTU的细菌分类学信息。样本有效序列≥10万条,所有样本按最小样本序列数抽平,细菌最小样品序列数为73 347,真菌最小样品序列数为148 831。使用Mothur或R等软件进行生物信息学分析。
1.9 统计分析
采用Excel 2016 软件对数据进行统计分析和绘图,使用SPSS 17.0对数据进行统计分析,采用方差分析(ANOVA)和Duncan的多重比较进行处理之间差异的显着性水平(Plt;0.05)分析,采用Excel 2007和R软件制图。
2 结果与分析
2.1 菌株P1的鉴定
菌株P1在平板中正面呈现乳白色,背面为棕黄色。生理生化指标的测定结果表明,菌株P1革兰氏染色为阴性,葡萄糖利用、明胶液化、耐盐性、卵磷脂酶、硝酸盐还原利用、氧化酶和精氨酸双水解检测结果为阳性(表1)。菌株P1经过16S rDNA基因序列构建系统发育树,该菌株与Pseudomonas chlororaphissubsp. aurantiaca strain ATCC 33663 聚在一个分支(图1)。结合形态和生理生化特征,鉴定菌株P1属于绿针假单胞菌桔黄亚种(Pseudomonas chlororaphissubsp. aurantiaca strain)。
2.2 菌株P1对香蕉枯萎病病原菌的抑菌活性
平板对峙实验证明拮抗菌P1对香蕉枯萎病病原菌具有显著的抑菌作用(图2a、图2b),在第7天抑菌率达89.92%(图2B),显微镜观察发现P1抑制的镰孢菌菌丝发生不同程度的畸变,变得粗大、弯曲,有的发生断裂、溶解现象(图2c、图2d))。生防菌相关代谢酶的检测结果,证明P1能分泌蛋白酶、淀粉酶、纤维素酶和嗜铁素。发酵培养液的OD600值随着接种培养时间的增加,生防菌菌悬液的OD600值在12~48 h内增长迅速,48~96 h进入衰退期,96 h后处于平缓期(图2c)。生防菌P1的代谢液对尖孢镰孢菌具有显著的抑菌作用,10%浓度的P1代谢液对生防菌菌丝生长的抑菌率达89.92%,10%浓度代谢液浸泡48 h后孢子悬浮液浓度与对照相比显著降低86.44%,10%浓度代谢液浸泡孢子24 h后,孢子萌发的抑制率为93%,浸泡48 h孢子萌发的抑制率为96%(图2D~图2F)。
2.3 菌株P1抑菌谱的测定
生防菌P1对7种植物病原镰孢菌菌丝生长均有很好的抑制效果(图3),其中对6株病原真菌的抑菌效果较好,抑菌率均大于60%。大豆尖孢镰孢菌(F.oxysporum)、禾谷镰孢菌(F. graminearum)、腐皮镰孢(F. solani),抑菌率分别为92.0%、71.4%、69.6%(表2)。
2.4 菌株P1对香蕉枯萎病的防病与促生效果
盆栽30 d 后LD 处理香蕉枯萎病病情指数为50.00%,CK 处理香蕉枯萎病病情指数为33.33%,PS1、PS2、PS3、LP2病情指数均为16.67%。盆栽60 dCK处理病情指数为50.00%,LD处理香蕉枯萎病病情指数为100.00%,LP2、PS2中香蕉枯萎病病情指数显著降低,分别为16.67%、8.33%(表3)。与LD和CK相比,PS1、PS2、LP2 均能显著降低香蕉枯萎病的病情指数,其中PS2 的防病效果最显著。与CK 相比,PS2 在45 d 时香蕉茎围显著增加。与LD 相比,LP1、LP2、LP3 处理显著增加了香蕉株高、茎围,其中LP2 处理香蕉在30、45、60 d 株高最高。盆栽60d 后,与CK、LD 相比,LP、PS 不同处理显著增加了香蕉地上部、地下部干质量,并且显著降低了香蕉根系的发病率,其中LP2、PS2 效果最显著,地上部促生率分别为166.90%、43.83%,地下部促生率分别为108.65%、41.99%,根系发病防效率为88.43% 和74.98%(表3)。
2.5 菌株P1的定殖与生物作用
CK土壤中假单胞菌丰度在0~60 d差异不显著,LD处理假单胞菌丰度在0~60 d出现逐渐增加的趋势(图4a)。PS假单胞菌丰度在15 d显著下降,而后保持稳定。LP假单胞菌丰度则在30 d显著下降,而后保持稳定。在0~60 d时,PS和LP土壤中假单胞菌丰度均显著高于CK和LD处理。在0 d和15 d时,LP处理假单胞菌丰度显著高于PS处理,在30 d和60 d时,PS 和LP 处理假单胞菌丰度差异不显著。在0~60 dLD处理假单胞菌显著高于CK处理。
由图4b可知,0~60 d,CK和LD处理镰孢菌丰度呈增加的趋势,PS和LP处理镰孢菌丰度呈不断下降的趋势。在15、30、60 d时PS中镰孢菌丰度显著低于CK,LP处理镰孢菌丰度显著低于LD,在30 d和60 d时LP处理镰孢菌丰度显著低于CK。
皮尔逊相关性分析结果(图5)表明香蕉枯萎病病情指数与根系发病率呈极显著正相关,与株高、叶面积、茎粗、植株干质量呈极显著负相关,其中与叶面积和地上部干质量相关性最强,并且地下部干质量与茎粗、叶面积和地上部干质量呈极显著正相关(图5)。Pseudomonas 与真菌多样性(Fungus Shannon)和Fusarium 的相对丰度呈显著负相关,与细菌群落丰度(Bacterial Chao1)、细菌群落多样性(BacterialShannon)和真菌群落丰度(Fungus Chao1)呈极显著负相关。Fusarium 的相对丰度与Fungus Shannon、Fungus Chao1 和Bacterial Shannon 呈极显著正相关。Pseudomonas 与香蕉枯萎病病情指数和与根系发病率呈显著负相关,与茎粗、叶面积和植株干质量呈显著正相关(图5)。通过RDA 分析(图6),发现LP、PS 处理与CK、LD 处理的土壤微生物群落具有显著差异。Fusarium 与香蕉枯萎病病情指数和根系发病率呈显著正相关,与叶面积、茎粗、植株干质量呈显著负相关。
3 讨论
绿针假单胞菌(Pseudomonas chlororaphis)是目前研究较多的生防菌种之一[20],是公认的环境友好型植物生防及促生菌[33-35]。典型的绿针假单胞菌菌株具有定殖植物的能力,并抑制植物病原菌的活性[32]。本研究中绿针假单胞菌菌株P1对香蕉枯萎病病原菌及多种病原菌具有较强的抑制作用。其中对香蕉枯萎病病原菌的抑菌率可达89.92%。同时本研究中生防菌P1发酵上清液对尖镰孢菌丝、孢子萌发和孢子产生均有较好的抑制作用。随着发酵液浓度的增加抑菌率提升,发酵液浓度为10% 时对菌丝生长的抑制率达到89.92%。10%浓度代谢液浸泡香蕉枯萎病病原菌孢子24 h后,孢子萌发的抑制率为93%。绿针假单胞菌可以合成多种拮抗病原菌的抗生素吩嗪衍生物、HCN、铁载体等,这些代谢产物的特性决定了绿针假单胞菌的生防潜质及应用前景[20]。据报道Pseudomonas chlororaphis subsp. aurantiaca 和Pseudomonas chlororaphis subsp. aureofaciens 产生的抗生素种类主要有吩嗪-1-羧酸、2-羟基-吩嗪-1-羧酸(2-hydroxy phenazine 1-carboxylic acid,2-OH PCA)、硝吡咯菌素(pyrrolnitrin,Prn)、2-hexyl、5 -propylresorcinol[36]。这类化合物对植物细胞的生长发育无显著影响,但本身具有广谱抗菌性,可用于防治植物真菌性病害[37-38]。绿针假单胞菌株PCL1319、GP72 和HT66 等,均可高效合成吩嗪类化合物。吩嗪类化合物作为高效的抗菌剂,对环境友好,具有良好的农业应用与开发前景[39-41]。菌株G05 产生的吡咯硝酸盐是抑制赤霉病菌的主要代谢产物[42]。绿针假单胞菌株O6 产生的氰化氢可导致线虫[43]和蚜虫细胞死亡[44]。
绿针假单胞菌可以合成多种抗生素,具有抵抗病原微生物的作用,绿针假单胞菌还具有较强的植物根际促生能力,使其在农业和园艺领域得以广泛应用[45]。例如,防治烟草疫霉病[46]、番茄枯萎病[47]、番茄病原菌尖孢镰孢菌[48]、辣椒疫霉病[49]、小麦全蚀病[50]、豆类炭疽病[51]。本研究中绿针假单胞菌P1可以防治香蕉枯萎病,其显著降低了香蕉枯萎病病情指数与根系发病率。绿针假单胞菌对多种植物具有防病促生作用[52-53],且无生物致病性,对环境友好[54]。据报道菌株O6 能合成吩嗪-1-羧酸、藤黄绿菌素、2-羟基-吩嗪-1-羧酸等物质抑制病原菌[55]。菌株O6可以通过合成吲哚乙酸,从而促进植物生长[56]。本研究中菌株P1显著增加了株高、茎粗、叶面积和植株干质量,这与前人研究具有一致性。因此,绿针假单胞菌P1对香蕉具有较好的防病促生作用,在生物防治领域具有较好的开发前景。
本研究结果表明香蕉园种植香蕉后土壤中镰孢菌数量呈增加的趋势,添加绿针假单胞菌P1后土壤中镰孢菌数量呈不断下降的趋势,并且P1在土壤中能够稳定定殖,同时也改变了土壤微生物群落的区系组成。
本研究表明Pseudomonas 与真菌多样性(FungusShannon)和Fusarium 的相对丰度呈显著负相关,与细菌群落丰度(Bacterial Chao1)、细菌群落多样性(Bacterial Shannon)和真菌群落丰度(Fungus Chao1)呈极显著负相关。这说明P1及其产生的抑病代谢物具有广谱抑菌性,抑制了土壤中Fusarium 丰度的增加,同时也抑制了土壤中其他细菌和真菌群落丰度和多样性。因此,绿针假单胞类生防菌及其代谢物可以显著影响土壤微生物群落丰度和多样性,但关于微生物区系的研究还尚不明确。因此未来将从土壤生态学角度进一步研究绿针假单胞类生防菌及其代谢物对土壤微生物群落结构、多样性及其群落功能的作用,明确绿针假单胞菌在农业土壤生态系统中的生物学作用机制,为绿针假单胞菌成为真正的绿色农药,应用到农业生产中提供科学依据与技术指导。
4 结论
(1)绿针假单胞菌P1菌株及其发酵液对香蕉枯萎病病原菌尖孢镰孢菌生长具有显著的抑制作用,同时对大豆病原菌尖孢镰孢菌(F. oxysporum)、禾谷镰孢菌(F. graminearum)、腐皮镰孢(F. solani)的抑菌效果较好,抑菌率分别为92.0%、71.4%、69.6%。
(2)生防菌P1 在土壤中定殖效果较好,能够显著降低Fusarium 的相对丰度,显著抑制香蕉枯萎病的发病率,并能显著增加香蕉株高、茎粗、叶面积和植株干质量。
(3)生防菌P1显著降低了土壤中真菌群落多样性(Fungus Shannon)、真菌群落丰度(Fungus Chao1)、细菌群落多样性(Bacterial Shannon)和群落丰度(Bacterial Chao1)。
参考文献:
[1] 李华平, 李云锋, 聂燕芳. 香蕉枯萎病的发生及防控研究现状[J]. 华南
农业大学学报, 2019, 40(5):128-136. LI H P, LI Y F, NIE Y F.
Reseearch status of occurrence and control of Fusarium wilt of banana
[J]. Journal of South China Agricultural University, 2019, 40(5):128-
136.
[2] LIU S W, LI J, ZHANG Y, et al. Fusaric acid instigates the invasion of
banana by Fusarium oxysporum f. sp. cubense TR4[J]. The New
Phytologist, 2020, 225(2):913-929.
[3] DELGADO-BAQUERIZO M, GUERRA C A, CANO-DÍAZ C, et al.
The proportion of soil-borne pathogens increases with warming at the
global scale[J]. Nature Climate Change, 2020, 10:550-554.
[4] SHEN Z Z, PENTON C R, LV N N, et al. Banana Fusarium wilt
disease incidence is influenced by shifts of soil microbial communities
under different monoculture spans[J]. Microbial Ecology, 2018, 75(3):
739-750.
[5] 李恒, 畅文军, 陈汉清, 等. 香蕉枯萎镰刀菌4号生理小种mon1 基
因敲除转化子的表型分析及致病力测定[J]. 热带生物学报, 2019,
10(2):127-134. LI H, CHANG W J, CHEN H Q, et al. Functional
analysis of the mon1 gene in Fusarium oxysporun f. sp. cubense race 4
[J]. Journal of Tropical Biology, 2019, 10(2):127-134.
[6] 朱永官, 彭静静, 韦中, 等. 土壤微生物组与土壤健康[J]. 中国科学:
生命科学, 2021, 51(1):1-11. ZHU Y G, PENG J J, WEI Z, et al.
Linking the soil microbiome to soil health[J]. Scientia Sinica(Vitae),
2021, 51(1):1-11
[7] JIANG Y J, LIU M Q, ZHANG J B, et al. Nematode grazing promotes
bacterial community dynamics in soil at the aggregate level[J]. The
ISME Journal, 2017, 11(12):2705-2717.
[8] SHI R Y, HONG Z H, LI J Y, et al. Mechanisms for increasing the pH
buffering capacity of an acidic ultisol by crop residue-derived biochars
[J]. Journal of Agricultural and Food Chemistry, 2017, 65(37):8111-
8119.
[9] ABDALLAH D B, TOUNSI S, FRIKHA-GARGOURI O. Inoculum
type affect the efficacy of the endophytic Bacillus amyloliquefaciens
subsp. plantarum strain 32a against the plant pathogen Agrobacterium
tumefaciens[J]. Applied Soil Ecology, 2019, 134:25-30.
[10] SHEN Z Z, XUE C, PENTON C R, et al. Suppression of banana
Panama disease induced by soil microbiome reconstruction through
an integrated agricultural strategy[J]. Soil Biology and Biochemistry,
2019, 128:164-174.
[11] 桂莎, 刘芳, 张立丹, 等. 复合菌剂防控香蕉枯萎病的效果及其微
生物学机制[J]. 土壤学报, 2020, 57(4):995-1007. GUI S, LIU F,
ZHANG L D, et al. Effects of complex anti - fungal agents
biocontrolling Fusarium wilt on banana and its microbiological
mechanism[J]. Acta Pedologica Sinica, 2020, 57(4):995-1007.
[12] 勇智. 抗尖孢镰刀菌(古巴专化型)放线菌筛选及生物防治[D].
南宁:广西民族大学, 2020:3 - 28. YONG Z. Screening of
actinomycetes resistant to Fusarium oxysporum(Specialized type in
Cuba) and biological control[D]. Nanning:Guangxi University for
Nationalities, 2020:3-28.
[13] RAMAKRISHNAN S, SREENIVAS S S. Biological control of soilborne
fungal and root-knot nematode disease complex in FCV
tobacco nursery[J]. Journal of Biological Control, 2016, 29(4):203.
[14] 万青, 包晓东, 李文彬, 等. 一株贝莱斯芽孢杆菌B18 的分离纯化
与鉴定及其对香蕉枯萎病的防效[J]. 基因组学与应用生物学,
2021, 40(9):3209 -3215. WAN Q, BAO X D, LI W B, et al.
Solation, purification and identification of a Bacillusvelezensis B18
and its control effect on banana wilt[J]. Genomics and Applied Biology,
2021, 40(9):3209-3215.
[15] YANG J, LI B, LIU S W, et al. Fermentation of Foc TR4-infected
bananas and Trichoderma spp[J]. Genetics and Molecular Research,
2016, 15(4):15048494.
[16] 孙杰, 马凤娟, 解开治, 等. 复合生防菌剂防控香蕉枯萎病发生的
效果探讨[J]. 中国农学通报, 2020, 36(16):135-142. SUN J, MA
F J, XIE K Z, et al. Effect of compound biocontrol agents on the
occurrence of banana Fusarium wilt[J]. Chinese Agricultural Science
Bulletin, 2020, 36(16):135-142.
[17] 章茂林. 拮抗细菌SU8抑菌活性与抑菌物质提取及其理化性质初
步研究[D]. 长沙:湖南农业大学, 2014:20-38. ZHANG M L. A
study on inhibition of antibacterial SU8 preliminary study physical
and chemical properties[D]. Changsha: Hunan Agricultural
University, 2014:20-38.
[18] 张伟琼, 聂明, 肖明. 荧光假单胞菌生防机理的研究进展[J]. 生物
学杂志, 2007, 24(3):9-11. ZHANG W Q, NIE M, XIAO M.
Advances in biocontrol mechanism of Pseudomonas fluorescens[J].
Journal of Biology, 2007, 24(3):9-11.
[19] ILHAN K, KARABULUT O A. Efficacy and population monitoring of
bacterial antagonists for gray mold(Botrytis cinerea Pers. ex. Fr. )
infecting strawberries[J]. BioControl, 2013, 58(4):457-470.
[20] 张春媚, 徐明洁, 李雪威, 等. 绿针假单胞菌的研究进展及农业应
用潜力[J]. 微生物学报, 2022, 62(2):391-402. ZHANG C M, XU
M J, LI X W, et al. Recent research advances and application
potential in agriculture of Pseudomonas chlororaphis[J]. Acta
Microbiologica Sinica, 2022, 62(2):391-402.
[21] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社,
2001:189-255. DONG X Z, CAI M Y. Handbook for identification of
common bacterial systems[M]. Beijing:Science Press, 2001:189-255.
[22] BUCHANAN R, BERGEY N. Bergey′ s manual of determinative
bacteriology[M]. 9th Edition. Baltimore:Williams and Wilkins
Company, 1994:205-315.
[23] LALUCAT J, MULET M, GOMILA M, et al. Genomics in bacterial
taxonomy:impact on the genus Pseudomonas[J]. Genes, 2020, 11(2):
139.
[24] 胡美忠, 邬小兰, 郁建生. 一株产抗菌脂肽芽孢杆菌筛选鉴定、产
酶特性及其脂肽初步鉴定[J]. 中国饲料, 2018(19):55-59. HU
M Z, WU X L, YU J S. Screening antimicrobial lipopeptide of
Bacillus, enzyme-producing properties and lipopeptide identification
[J]. China Feed, 2018(19):55-59.
[25] 沈佳慧, 左杨, 乔俊卿, 等. 贝莱斯芽胞杆菌Bacillus velezensis
YL2021嗜铁素合成基因dhbC 的功能研究[J]. 中国生物防治学报,
2022, 38(3):602 - 612. SHEN J H, ZUO Y, QIAO J Q, et al.
Functional analysis of dhbC gene from the siderophore producing
bacterium Bacillus velezensis YL2021[J]. Chinese Journal of
Biological Control, 2022, 38(3):602-612.
[26] 李枢妍, 阳黎恒, 肖雪婷, 等. 一株香蕉枯萎病拮抗菌的筛选、鉴定
及生防效果研究[J]. 南方农业学报, 2021, 52(7):1826-1834. LI
S Y, YANG L H, XIAO X T, et al. Screening, identification and
biocontrol effect of antagonistic bacteria against banana Fusarium wilt
[J]. Journal of Southern Agriculture, 2021, 52(7):1826-1834.
[27] 杜娟, 吴季荣, 俞明正, 等. 转基因小麦根际土壤中荧光假单胞菌
数量的变化[J]. 麦类作物学报, 2014, 34(3):345-350. DU J, WU
J R, YU M Z, et al. Analysis of quantity change of P. fluorescens in
rhizospheric soil of tansgenic wheat[J]. Journal of Triticeae Crops,
2014, 34(3):345-350.
[28] TAO C Y, LI R, XIONG W, et al. Bio-organic fertilizers stimulate
indigenous soil Pseudomonas populations to enhance plant disease
suppression[J]. Microbiome, 2020, 8(1):137.
[29] JIMÉNEZ-FERÁANDEZ D, MONTES-BORREGO M, NAVASCORTÉS
J A, et al. Identification and quantification of Fusarium
oxysporum in planta and soil by means of an improved specific and
quantitative PCR assay[J]. Applied Soil Ecology, 2010, 46(3):372-
382.
[30] 钟书堂. 土壤熏蒸联合生物有机肥施用对香蕉枯萎病的防控效应
研究[D]. 南京:南京农业大学, 2015:16-48. ZHONG S T. Effects
of soil fumigation combined with bio-organic fertilizer application on
banana Fusarium wilt disease suppression[D]. Nanjing:Nanjing
Agricultural University, 2015:16-48.
[31] ZHU C, LING N, GUO J J, et al. Impacts of fertilization regimes on
arbuscular mycorrhizal fungal(AMF) community composition were
correlated with organic matter composition in maize rhizosphere soil
[J]. Frontiers Microbiology, 2016, 7:1840.
[32] TIAN W, WANG L, LI Y, et al. Responses of microbial activity,
abundance, and community in wheat soil after three years of heavy
fertilization with manure:based compost and inorganic nitrogen[J].
Agriculture Ecosystems and Environment, 2015, 213:219-227.
[33] BIESSY A, NOVINSCAK A, BLOM J, et al. Diversity of
phytobeneficial traits revealed by whole-genome analysis of
worldwide-isolated phenazine-producing Pseudomonas spp[J].
Environmental Microbiology, 2019, 21(1):437-455.
[34] ANDERSON A J, KIM Y C. Insights into plant-beneficial traits of
probiotic Pseudomonas chlororaphis isolates[J]. Journal of Medical
Microbiology, 2020, 69(3):361-371.
[35] ARREBOLA E, TIENDA S, VIDA C, et al. Fitness features involved
in the biocontrol interaction of Pseudomonas chlororaphis with host
plants:the case study of PcPCL1606[J]. Frontiers in Microbiology,
2019, 10:719.
[36] 沈雪梅. 根际促生假单胞菌的比较基因组学研究与绿针假单胞菌
优势小基因组菌株的构建[D]. 上海:上海交通大学, 2016:13-30.
SHEN X M. Comparative cenomic analysis of plant growth-promoting
rhizobiacteria in Pseudomonas and construction of dominant genomereduced
P. chlororaphis strains[D]. Shanghai:Shanghai Jiao Tong
University, 2016:13-30.
[37] MAVRODI D V, PAREJKO J A, MAVRODI O V, et al. Recent
insights into the diversity, frequency and ecological roles of
phenazines in fluorescent Pseudomonas spp[J]. Environmental
Microbiology, 2013, 15(3):675-686.
[38] PIERSON L, PIERSON E A. Metabolism and function of phenazines
in bacteria:impacts on the behavior of bacteria in the environment
and biotechnological processes[J]. Applied Microbiology and
Biotechnology, 2010, 86(6):1659-1670.
[39] BIESSY A, FILION M. Phenazines in plant-beneficial Pseudomonas
spp. : biosynthesis, regulation, function and genomics[J].
Environmental Microbiology, 2018, 20(11):3905-3917.
[40] SCHIESSL K T, HU F, JO J, et al. Phenazine production promotes
antibiotic tolerance and metabolic heterogeneity in Pseudomonas
aeruginosa biofilms[J]. Nature Communications, 2019, 10(1):762.
[41] SHEN X M, HU H B, PENG H S, et al. Comparative genomic analysis
of four representative plant growth-promoting rhizobacteria in
Pseudomonas[J]. BMC Genomics, 2013, 14:271.
[42] HUANG R, FENG Z B, CHI X Y, et al. Pyrrolnitrin is more essential
than phenazines for Pseudomonas chlororaphis G05 in its suppression
of Fusarium graminearum[J]. Microbiological Research, 2018, 215:
55-64.
[43] KANG B R, ANDERSON A J, KIM Y C. Hydrogen cyanide produced by
Pseudomonas chlororaphis O6 exhibits nematicidal activity against
Meloidogyne hapla[J].The Plant Pathology Journal,2018,34(1):35-43.
[44] KANG B R, ANDERSON A J, KIM Y C. Hydrogen cyanide produced
by Pseudomonas chlororaphis O6 is a key aphicidal metabolite[J].
Canadian Journal of Microbiology, 2019, 65(3):185-190.
[45] PAULITZ T C, BÉLANGER R. Biological control in greenhouse
systems[J]. Annual Review of Phytopathology, 2001, 39(1):103-133.
[46] 王远山, 王平, 胡正嘉. 绿针假单胞菌PL9 菌株对烟草疫霉的拮抗
作用研究[J]. 华中农业大学学报, 2002, 21(3):248-251. WANG
Y S, WANG P, HU Z J. Screening of rhizobacteria antagonistic to
Phytophthora parasitica var. Nicotianae, pathogen of disease of
tobacco black shank[J]. Journal of Huazhong Agricultural University,
2002, 21(3):248-251.
[47] PUOPOLO G, RAIO A, PIERSON L, et al. Selection of a new
Pseudomonas chlororaphis strain for the biological control of
Fusarium oxysporum f. sp. radicis-lycopersici[J]. Phytopathologia
Mediterranea,2011, 50:228-235.
[48] TAMBONG J T, HÖFTE M. Phenazines are involved in biocontrol of
Pythium myriotylum on cocoyam by Pseudomonas aeruginosa PNA1
[J]. European Journal of Plant Pathology, 2001, 107(5):511-521.
[49] 何延静, 刘海明, 胡洪波, 等. 一株拮抗辣椒疫霉的假单胞菌的分
离与鉴定[J]. 微生物学报, 2006, 46(4):516-521. HE Y J, LIU H
M, HU H B, et al. Isolation and characterization of a new
Pseudomonas strain against Phytophthora capsici[J]. Acta
Microbiologica Sinica, 2006, 46(4):516-521.
[50] PIERSON L, THOMASHOW L. Cloning and heterologous expression
of the phenazine biosynthetic[J]. Molecular Plant-microbe
Interactions, 1992, 5(4):330-339.
[51] BARDAS G A, LAGOPODI A L, KADOGLIDOU K, et al. Biological
control of three Colletotrichum lindemuthianum races using
Pseudomonas chlororaphis PCL1391 and Pseudomonas Fluorescens
WCS365[J]. Biological Control, 2009, 49(2):139-145.
[52] RAIO A, PUOPOLO G, CIMMINO A, et al. Biocontrol of cypress
canker by the phenazine producer Pseudomonas chlororaphis subsp.
aureofaciens strain M71[J]. Biological Control, 2011, 58(2):133-138.
[53] EGAMBERDIEVA D. Pseudomonas chlororaphis:a salt-tolerant
bacterial inoculant for plant growth stimulation under saline soil
conditions[J]. Acta Physiologiae Plantarum, 2012, 34(2):751-756.
[54] ANDERSON J A, STALEY J, CHALLENDER M, et al. Safety of
Pseudomonas chlororaphis as a gene source for genetically modified
crops[J]. Transgenic Research, 2018, 27(1):103-113.
[55] PARK J Y, OH S A, ANDERSON A J, et al. Production of the
antifungal compounds phenazine and pyrrolnitrin from Pseudomonas
chlororaphis O6 is differentially regulated by glucose[J]. Letters in
Applied Microbiology, 2011, 52(5):532-537.
[56] CHEN Y W, SHEN X M, PENG H S, et al. Comparative genomic
analysis and phenazine production of Pseudomonas chlororaphis, a
plant growth-promoting rhizobacterium[J]. Genomics Data, 2015, 4:
33-42.
