热损伤在牙种植体拔除中的应用研究
2025-02-16王淼徐博雅朱秀峰常晓峰贺龙龙

[摘要]目的:通过加热种植体有控制地破坏牙种植体的骨结合状态,使已经形成骨结合但无保留意义的种植体能够以较小的扭矩旋出,从而微创拔除种植体。方法:在离体组织中,使用加热器在新鲜牛肋骨-种植体模型上寻找理想的加热温度和加热时间。在动物实验中,观察加热种植体后种植体旋出扭矩、种植体稳定性和种植体周围骨组织学变化。根据离体组织结果将动物实验分为四组。包括:空白对照组;C1组(低温组),100℃持续30 s;C2组(高温组1),200℃持续20 s;C3组(高温组2),300℃持续20 s。结果:动物实验结果表明低温组C1加热后1周ISQ值和旋出扭矩均有所增加,拔除1个月后骨表面可见。高温组C2、C3加热后1周ISQ值和旋出扭矩均下降,且拔除种植体后1个月C2组在骨表面可观察到少量新生骨线的形成,但是C3组未见新生骨线。实验结果提示C2组的温度设置在加热种植体后可以降低种植体旋出扭矩且不影响周围骨的再生。结论:热处理是微创拔除种植体的可行方法之一,但应注意加热温度及加热时间。
[关键词]牙种植体;热损伤;骨结合;拔除;微创
[中图分类号]R782.11" " [文献标志码]A" " [文章编号]1008-6455(2025)02-0019-05
Application of Thermal Damage in Osseointegrated Implant Extraction
WANG Miao1,2,3, XU Boya1,2,4, ZHU Xiufeng1,2,3, CHANG Xiaofeng1,2,3, HE Longlong1,2,3
( 1.Key Laboratory of Shaanxi Province for Craniofacial Precision Medicine Research, College of Stomatology, Xi'an Jiaotong University, Xi'an 710004, Shaanxi, China; 2.Clinical Research Center of Shaanxi Province for Dental and Maxillofacial Diseases, College of Stomatology, Xi'an Jiaotong University, Xi'an 710004, Shaanxi, China; 3.Department of Implant Dentistry, College of Stomatology, Xi'an 710004, Shaanxi, China; 4.Department of Digital Implant Restoration, College of Stomatology, Xi'an Jiaotong, Xi'an 710004, Shaanxi, China )
Abstract: Objective" To use heating to disrupt the bone-implant interface of dental implants, allowing for the minimally invasive removal of implants that are no longer needed but have formed stable osseointegration. Methods" In vitro experiments were conducted using a fresh bovine rib-implant model to determine the ideal heating temperature and duration using a heating device. In vivo experiments were then carried out to observe the effects of implant heating on implant stability, removal torque, and histological changes in the surrounding bone tissue. The in vivo experiments were divided into four groups based on the results of the in vitro experiments: a blank control group, C1 (low-temperature group): 100℃ for 30 s, C2 (high-temperature group 1): 200℃ for 20 s, and C3 (high-temperature group 2): 300℃ for 20 s. Results" The in vivo experiments showed that the low-temperature group (C1) had an increase in implant stability and removal torque one week after heating, and bone growth was observed on the implant surface one month after removal. The high-temperature groups (C2 and C3) had a decrease in implant stability and removal torque one week after heating, and while bone growth was observed on the implant surface of the C2 group one month after removal, no bone growth was observed in the C3 group. The results suggest that C2 group can reduce implant removal torque without affecting bone regeneration. Conclusion" Thermal treatment can be used as a minimally invasive method for removing dental implants, but the temperature and duration of heating should be carefully considered.
Key words: dental implant; thermal damage; osseointegration; extraction; minimally invasive
种植体与骨组织界面之间骨结合是种植体成功的关键。随着牙种植技术及牙种植体材料表面处理水平不断提高,种植体的骨结合已经有很高的远期成功率。但种植修复后仍存在一定概率的并发症风险,当种植位点不准确、出现种植体机械并发症以及无法治愈的种植体周围炎等情况时,仍需将种植体拔除。目前,种植体的拔除方式简单粗暴,骨损伤较大,与微创医学的发展趋势不相符合[1-2]。
从Eriksson和Albrektsson经典研究可得出结论,骨组织在47℃时对热最敏感。后来进一步的实验表明,更大的骨损伤发生在53℃持续1 min,在56℃时碱性磷酸酶开始失活,当加热至60℃时会造成更明显的骨坏死[3-4]。Gungormus M和Erbasar GNH[5]模拟了使用不同设备功率加热种植体-骨结合界面的温度分布,结果显示种植体周围的温度上升得非常快,仅需1 s就可到达47℃。因此加热器,加热时间和种植体大小是热损伤破坏骨结合必须考虑的因素。Cunliffe J等[6]使用超高频单极电刀拔除一枚失败的种植体,给予15 s脉冲式加热至钛种植体,以造成种植体-骨结合界面的热损伤。1周后复诊,局麻下使用棘轮扳手反向扭出,扭矩小于30 N·cm。在另一病例报道中,Worni A等[7]使用CO2激光在种植体骨结合界面诱导热坏死,并以大约35 N·cm的扭矩取出。Massei GSM等[8]给予种植体3 s高频率电刺激,2周之后,种植体可用较小扭矩旋出(15~50 N·cm),并且组织学观察显示热坏死范围仅限于50 µm。
从文献综述中可以看出,热损伤种植体骨结合界面似乎是一种有前景的微创取出种植体的方法。但此类研究多局限于病例报道和三维有限元模拟,有待进一步的研究支持[9]。因此本研究设计了离体组织实验和动物实验,在离体组织实验中寻找最佳的加热器和加热时间,在动物实验中检验此方法的可行性及热损伤导致的骨坏死范围。
1" 材料和方法
1.1 实验动物及材料:4只纯种雄性比格犬,15~16个月龄,实验动物由西安迪乐普生物医学有限公司提供[许可证号:SCXX(陕)2016-012],重量13~16 kg,平均重量14.5 kg。无缺失牙,恒牙完全萌出,口内牙齿数目完整,无牙周、牙体等口腔疾病,营养健康状况良好,动作敏捷。实验动物质量检测单位:陕西省实验动物质量监督检测中心。实验动物质量合格证编号:61001600000108。动物实验在第四军医大学口腔医院动物实验中心进行,实验单位实用许可证编号:SYXK(陕)2016-013,动物随机编号,术前分笼圈养2周,定时定量喂养。所有实验操作均严格遵守动物伦理学相关规定。种植体由常州百康特(Bioconcept)医疗器械有限公司提供,专为动物实验设计。种植体的直径为3.3 mm,长度为10 mm,表面经过大颗粒喷砂加酸蚀处理(SLA),符合实验设计要求。此外,所有其他实验设备及器械均为动物实验常规器械,确保实验过程的标准化和一致性。
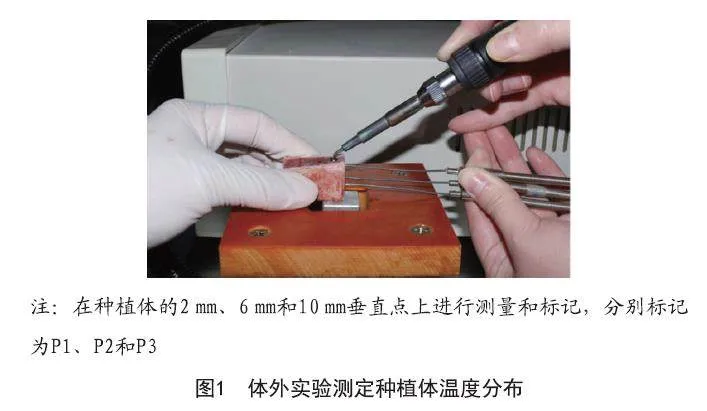
1.2 体外实验:体外实验选取新鲜的牛肋骨植入种植体。种植体选用BKT种植体(常州百康特医疗器械有限公司,3.3 mm×10 mm)。离体组织选用20 mm×20 mm的新鲜牛肋骨骨块。在实验前半小时将骨块置于水浴箱中水浴至37℃。将种植体植入骨块中,植入扭矩保持在35 N·cm左右。使用校准后的电加热装置(DBS,德国)加热种植体内部连接部位,并使用热电偶丝在3个位置(P1、P2和P3)测量种植体表面温度(见图1)。测温软件自动记录温度变化,记录间隔为1 s。电加热装置的温度设置范围为50℃~400℃(50℃、100℃、150℃、200℃、250℃、300℃、350℃、400℃),并且每个设置可以保持在恒定温度。
1.3 动物实验
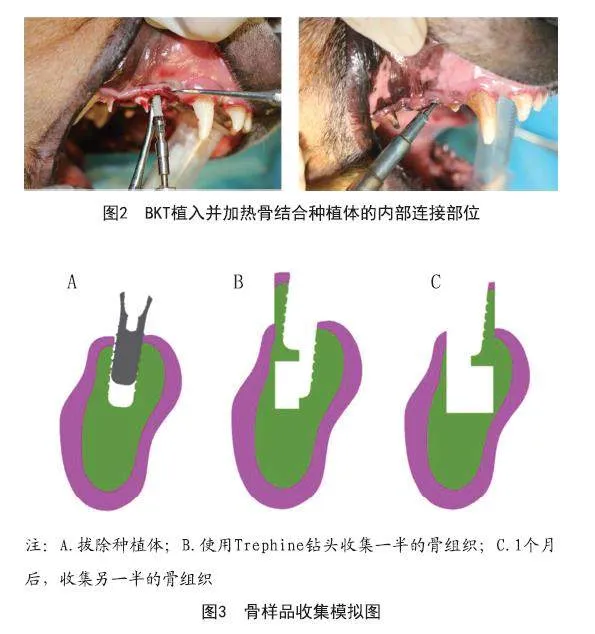
1.3.1 种植体植入:对4只雄性比格犬(平均年龄15个月,平均体重14.5 kg)进行CBCT检查,获取颌骨三维图像信息。选择第二、第三前磨牙近中根作为种植位点,4只比格犬共计32位点。比格犬术前8 h禁食,腹腔注射3%戊巴比妥(MERCK,德国)麻醉,术中监测呼吸和心跳。用高速手机分离上下颌第二、三前磨牙,微创法拔除近中牙根,生理盐水冲洗拔牙窝。拔牙窝逐级备孔,即刻植入BKT种植体3.3 mm×10 mm,植入扭矩均大于35 N·cm(见图2)。种植体动度仪(OSSTELL,瑞典)测量植入后初始ISQ值,连接覆盖螺丝,缝合伤口。
1.3.2 加热实验及样本取材:种植术后4个月,麻醉后行X线检查,观察种植体周围无透射影像,同时使用种植体动度仪测量ISQ值,共同评估骨结合情况[10-11]。使用加热器探头给予种植体中央螺丝底面进行加热,温度组分为三组,具体如下。C1(低温组):100℃持续30 s ;C2(高温组1):200℃持续20 s;C3(高温组2):300℃持续20 s(此分组设置来源于离体组织实验结果)。
加热实验后将16枚种植体立即旋出,另外16枚种植体1个月后旋出。选用计数扭矩扳手(Neobiotech,韩国),旋出时记录旋出扭矩。在旋出种植体的同时,用Trephine钻头取出一半的骨,观察周围骨组织的损伤情况。1个月后取另一半骨,观察骨组织愈合情况(见图3)。对取出骨组织进行切片和HE染色。
1.4 统计学分析:使用SPSS 13.0软件进行数据处理和分析。平均值±标准差用于描述数据。数据符合正态分布和方差齐性的标准。采用单因素方差分析和t检验描述组别和时间点之间的差异。显著性水平设定为0.05。
2" 结果
2.1 体外实验:根据多通道温度计的读数选择了三个代表性温度进行讨论(见图4)。当热源温度为100℃时,P1、P2、P3三点温度在32 s、43 s、50 s到达热损伤临界温度47℃。因此在动物实验中,保持低温组(C1)设置为100℃加热30 s,此时种植体没有达到47℃,且未引起种植体-骨结合界面的热损伤。当热源温度为200℃时,P1、P2、P3三点温度在9 s、14 s、18 s到达热损伤临界温度47℃。在第20秒时,三点温度分别为,59.3℃,50.8℃,48℃。因此高温组(C2)中将热源温度设为200℃,加热时间设为20 s,能够观察瞬时超过47℃是否会造成种植体周围骨的热损伤。当热源温度为300℃时,P1、P2、P3三点温度在4 s、6 s、8 s到达热损伤临界温度47℃。在第20秒时,P1、P2、P3三点温度分别为,95℃,65℃,60℃。因此,另外一组高温组(C3)加热时间设为20 s,以观察持续超过热损伤温度10 s,能否很好地达到去骨结合的目的,且观察骨损伤范围大小是否符合微创目的。
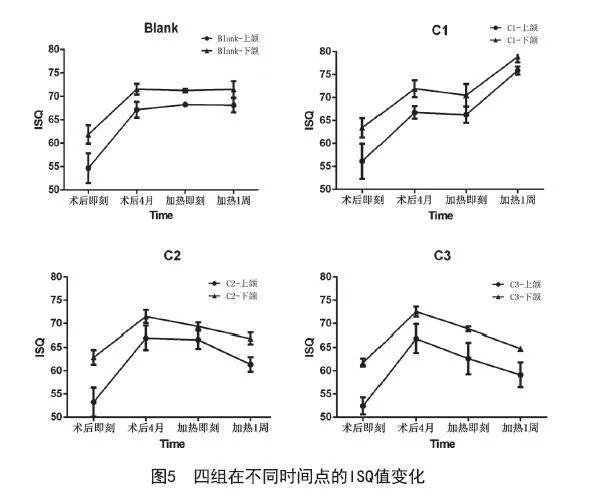
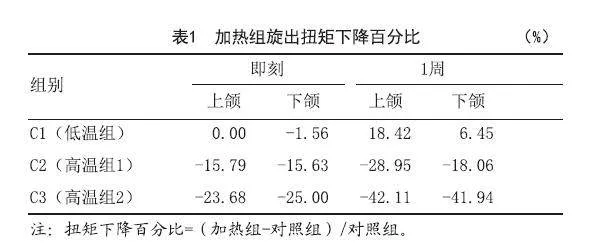
2.2 动物实验:根据X线和ISQ评估,在种植体植入4个月后所有种植体均形成良好的骨结合。C3组中有一个下颌种植体在加热后1周松动,因此在ISQ和旋出扭矩计算中剔除此数据。由于上颌和下颌之间的基线差异,将加热前后的ISQ和旋出扭矩变化作为新的变量进行统计分析。四组的ISQ值在4个月内均有增加,4个月时组间比较差异无统计学意义(P>0.05)。加热处理后,C1组的ISQ值没有显著下降(P=0.203),而C2组和C3组的ISQ值低于对照组,C2组平均下降2.50%(P=0.002),C3组平均下降5.78%(P<0.001)。加热后1周,三组的ISQ与对照组相比有显著变化:C1组增加10.85%(P=0.003),C2组减少8.19%(P=0.001),C3组减少11.33%(P<0.001)。见图5。对于C1组,加热后旋出扭矩没有明显下降(P=0.469)。1周后,C1组的扭矩增加(P=0.015),而上颌的扭矩增加幅度大于下颌(见表1),可能是由于上颌和下颌骨结构的差异;在C2组和C3组中,与对照组相比,加热后的扭矩呈连续下降趋势(加热后:PC2=0.003,PC3=0.008;1周后:PC2=0.003,PC3=0.036)。
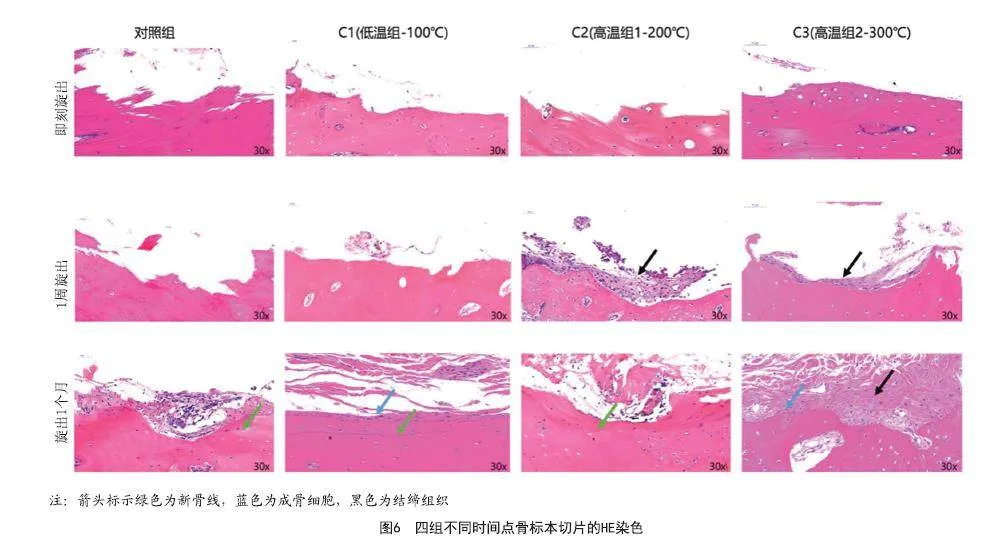
组织学结果显示,对照组的种植体骨结合表面边缘不规则。C1、C2和C3组的骨表面也不规则,并且加热后未发现结缔组织。加热后1周,在C2组和C3组中观察到少量纤维结缔组织。加热后1个月,在空白组、C1组和C2组的切片中观察到新骨的形成和成骨细胞的积聚。但在C3组中没有观察到明显的新骨或骨愈合。见图6。
3" 讨论
本课题组旨在寻找一种微创方法解除牢固的骨结合,使得稳定的骨结合状态发生可控的损伤,从而可以用较小的力量旋出种植体。回顾文献发现热处理可能是一个很好的方法,但相关研究十分有限。通过动物实验,本研究发现经过热处理后,骨结合的种植体的旋转扭矩和ISQ值显著降低,这与Cunliffe J和Massei GSM的报告相一致[6-8]。通过应用高温加热种植体,能够降低种植体与牙槽骨之间的附着力,并减少反向旋转拔除种植体所需的力量。在C2组的体外实验中,确定了种植体在相对较短的时间内达到了略高于47℃,但旋出扭矩在加热后1周显著降低。在C3组中,当加热20 s时,种植体颈部附近的温度接近于90℃。当温度超过90℃时,骨的断裂负荷、刚度和线性变形会降低[12-13],即高温处理会改变骨的机械性能。经过加热处理后1周,C3组所需的扭矩比对照组降低了约60%。因此,降低种植体旋出扭力须在种植体-骨结合界面处发生热损伤或坏死。
尽管高温组的旋出扭矩和ISQ值均有所降低,但C2组和C3组之间的组织学分析存在差异。加热后1周,C2组和C3组的骨表面上出现了少量结缔组织,可能是由于高温导致种植体周围的骨细胞凝固和坏死,形成无菌炎症。经过1个月的愈合期后,与C1组和对照组类似,C2组出现了成骨细胞聚集和新骨形成。这提供了有力的证据,表明C2组的温度设置并未影响骨愈合能力。虽然C3组中有成骨细胞,但未观察到明显的新骨形成,表明热损伤后该组的愈合能力严重受到影响。C1组结果所示,低温似乎能够增强骨结合。加热后,C1组的ISQ值和旋出扭矩略微降低,但差异无统计学意义。在C1组较低的温度设置下,种植体周围未达到47℃,因此没有发生种植体-骨结合界面的热损伤。然而,在加热后1周,C1组的ISQ值和扭矩都增加了。Rittel D[14]的研究发现,更高的旋出扭矩可以表明骨的质量更好、有了更高的强度。这种现象得到了理论和实践的支持,例如,轻微的温度升高可以刺激骨重塑并增加皮质骨密度[15-17],也与高温刺激骨折愈合的事实相一致[18]。这种有趣的现象也为未来利用热刺激加速骨结合过程提供了思路[19]。
根据最新的系统综述,目前有五种方法用于拔除骨结合的种植体[20-21]。使用高速车针、环切钻、超声骨刀和激光辅助方法的成功率较高,但它们具有破坏性并可能引起后续问题。反向扭矩拔除作为最保守的方法,被推荐作为拔除骨结合种植体的首选方法。然而,反向扭矩的成功率为87.7%,失败的原因是扭矩过大导致颌骨骨折或种植体折断。本实验热处理的探索可以作为反向扭矩的补充方法。第一步先使用热处理损伤种植体-骨结合界面来降低扭矩,这在本研究中已经得到确认,然后使用扭矩扳手将热处理后的种植体拔除,这将增加反向扭矩拔除的成功率并减少骨损失。尽管在拔除种植体时必须尽量保持微创,但在考虑拔除方法时,可预测的骨愈合能力也很重要[22]。本研究表明短时加热处理种植体后,周围骨组织仍具有愈合能力。
本研究仍存在一些局限性。首先,无法从组织学结果中观察到预期的种植体-骨结合表面的热损伤范围。在对照组中,大扭力旋除带有骨结合的种植体会带走部分骨组织,因此对照组即刻旋出和1周旋出组织学切片均表现为不整齐的骨创面。加热后,C2组和C3组的表面同样粗糙,热损伤范围无法测量。最可能的原因是C2组和C3组的温度设置未引起即刻明显的坏死,并且在处理标本时,热损伤的表面脱落或被冲刷掉。这可能是因为本研究首先在体外研究中找到了最佳的温度和时间的设置,此温度可在种植体-骨结合界面上可以产生有限且可控的热损伤。同时观察到每组的骨愈合能力也表明了损伤的程度。本实验的另一个局限性是种植体只实现了骨结合,没有经历咬合负荷。文献回顾发现,种植体在长期负重后,种植体周围的骨会发生持续的改建,特别是骨松质部分会改建为致密的骨结构[23]。因此本实验动物模型无法模拟负重后发生骨改建后的种植体-骨结合状态。
根据体外和体内实验的结果,最佳和受控条件下对种植体进行加热会降低种植体与骨组织的骨结合,使失败种植体拔除过程变得简单和微创。本实验中使用了相同型号的种植体,需要进一步研究来明确适合不同类型种植体的温度时间设置。本实验的结果表明,热处理是一种可行的、微创的去除骨结合种植体的方法。然而,在该技术的临床应用之前,仍需要进行大量的进一步研究。
[参考文献]
[1]Fäh R, Schätzle M. Complications and adverse patient reactions associated with the surgical insertion and removal of palatal implants: a retrospective study[J]. Clin Oral Implants Res, 2014,25(6):653-638.
[2]Stajčić Z, Stojčev Stajčić L J, Kalanović M, et al. Removal of dental implants: review of five different techniques[J]. Int J Oral Maxillofac Surg, 2016,45(5):641-648.
[3]Eriksson A R, Albrektsson T. Temperature threshold levels for heat-induced bone tissue injury: a vital-microscopic study in the rabbit [J]. J Prosthet Dent, 1983,50(1):101-107.
[4]Oyster D K, Parker W B, Gher M E. CO2 lasers and temperature changes of titanium implants [J]. J Periodontol, 1995, 66(12):1017-1024.
[5]Gungormus M, Erbasar g N H. Transient heat transfer in dental implants for thermal necrosis-aided implant removal: A 3D finite element analysis [J]. J Oral Implantol, 2019,45(3):196-201.
[6]Cunliffe J, Barclay C. Removal of a dental implant: An unusual case report [J]. Int J Implant Dent, 2011,1(1):22.
[7]Worni A, Marchand L, Sailer I, et al. Explantation of an osseointegrated titanium implant using laser-induced thermo-necrosis: a case report [J]. Int J Oral Maxillofac Implants, 2018,33(6):e151-e155.
[8]Massei G S-M, S. Thermo-explantation. A novel approach to remove osseointegrated implants [J]. Eur Cell Mater, 2004,7(2):48.
[9]贺龙龙,王淼,王婉蓉,等.去除折断种植体部件时种植体的三维有限元热力学分析[J].中国美容医学,2017,26(12):4.
[10]Meredith N, Shagaldi F, Alleyne D, et al. The application of resonance frequency measurements to study the stability of titanium implants during healing in the rabbit tibia [J]. Clin Oral Implants Res, 1997,8(3):234-243.
[11]Quesada-García M P, Prados-Sánchez E, Olmedo-Gaya M V, et al. Measurement of dental implant stability by resonance frequency analysis: a review of the literature[J]. Med Oral Patol Oral Cir Bucal, 2009,14(10):e538-546.
[12]米坤龙,张永忠,刘奇,等.骨组织热损伤研究进展[J].生物骨科材料与临床研究,2013,10(1):27-30.
[13]Borchers R E, Gibson L J, Burchardt H, et al. Effects of selected thermal variables on the mechanical properties of trabecular bone [J]. Biomaterials, 1995, 16(7): 545-551.
[14]Rittel D, Dorogoy A, Shemtov-Yona K. Modelling dental implant extraction by pullout and torque procedures [J]. J Mech Behav Biomed Mater, 2017, 71: 416-427.
[15]Shui C, Scutt A. Mild heat shock induces proliferation, alkaline phosphatase activity, and mineralization in human bone marrow stromal cells and Mg-63 cells in vitro [J]. J Bone Miner Res, 2001,16(4):731-741.
[16]Ye C P, Heng B C, Liu H, et al. Culture media conditioned by heat-shocked osteoblasts enhances the osteogenesis of bone marrow-derived mesenchymal stromal cells [J]. Cell Biochem Funct, 2007,25(3):267-276.
[17]Norgaard R, Kassem M, Rattan S I. Heat shock-induced enhancement of osteoblastic differentiation of hTERT-immortalized mesenchymal stem cells [J]. Ann N Y Acad Sci, 2006,1067:443-447.
[18]Leon S A, Asbell S O, Arastu H H, et al. Effects of hyperthermia on bone. Ⅱ. Heating of bone in vivo and stimulation of bone growth [J]. Int J Hyperthermia, 1993, 9(1): 77-87.
[19]Blay A, Blay C C, Tunchel S, et al. Effects of a low-intensity laser on dental implant osseointegration: removal torque and resonance frequency analysis in rabbits [J]. J Oral Implantol, 2016,42(4):316-320.
[20]Roy M, Loutan L, Garavaglia G, et al. Removal of osseointegrated dental implants: a systematic review of explantation techniques [J]. Clin Oral Investig, 2020,24(1):47-60.
[21]王婉蓉,常晓峰,贺龙龙.失败种植体的拔除方法[J].华西口腔医学杂志,2018,36(2):3.
[22]Solderer A, Al-Jazrawi A, Sahrmann P, et al. Removal of failed dental implants revisited: Questions and answers [J]. Clin Exp Dent Res, 2019,5(6):712-724.
[23]Bosshardt D D, Chappuis V, Buser D. Osseointegration of titanium, titanium alloy and zirconia dental implants: current knowledge and open questions [J]. Periodontol 2000, 2017,73(1):22-40.
[收稿日期]2024-04-22
本文引用格式:王淼,徐博雅,朱秀峰,等.热损伤在牙种植体拔除中的应用研究[J].中国美容医学,2025,34(2):19-23.
