红阳猕猴桃SnRK1的克隆及其在果实中的表达分析
2025-02-09蒋开秀刘林娅何斌宋姝熠龚小见黄亚成






摘""要:红阳猕猴桃属于我国自主培育的优良品种,具有独特的红色性状和高糖低酸特性,因其香气浓郁,味道独特而备受欢迎。其果实的生长发育受到多种因素的影响,其中植物的蔗糖非发酵-1-相关蛋白激酶1(SnRK1)在调控碳水化合物代谢以及应对生物和非生物胁迫方面起重要的开关作用。因此,本研究以红阳猕猴桃为材料,克隆得到红阳猕猴桃SnRK1家族2个基因的全长cDNA,分别命名为AcSnRK1.1和AcSnRK1.2,利用生物信息学方法分析AcSnRK1.1和AcSnRK1.2的理化性质、基因结构、保守基序、蛋白保守结构域及顺式作用元件等,并采用实时荧光定量检测AcSnRK1.1和AcSnRK1.2基因在不同组织和果实不同处理下的表达特性。结果表明:AcSnRK1.1和AcSnRK1.2基因分别含有1548、1545"bp的开放阅读框,编码515、514个氨基酸。生物信息学分析发现AcSnRK1.1和AcSnRK1.2的氨基酸序列与其他植物SnRK1蛋白具有较高同源性;氨基酸序列显示,AcSnRK1.1和AcSnRK1.2包含了SnRK1家族特有的结构STKc_AMPK_alpha、AMPK_C、UBA_SnRK1_plant;进化树分析表明AcSnRK1.1和AcSnRK1.2基因属于SnRK1家族;组织特异性分析显示,AcSnRK1.1和AcSnRK1.2在红阳猕猴桃各个组织中均有表达,在果实中表达丰度最高;在果实发育过程中,AcSnRK1.1和AcSnRK1.2的表达量均呈先下降后上升的趋势;qRT-PCR分析表明AcSnRK1.1和AcSnRK1.2的表达受ABA、GA3、ET、CPPU的调控。随着贮藏时间的增加,AcSnRK1.1和AcSnRK1.2的表达量呈先下降后上升的趋势,推测AcSnRK1基因可能调控蔗糖合酶的表达。本研究结果表明AcSnRK1.1和AcSnRK1.2基因在红阳猕猴桃果实发育和贮藏过程中发挥重要作用,为进一步阐述AcSnRK1.1和AcSnRK1.2基因的功能奠定基础。
关键词:红阳猕猴桃;SnRK1;基因克隆;生物信息学分析;表达分析中图分类号:S663.4""""""文献标志码:A
Cloning"and"Expression"Analysis"of"SnRK1"in"Actinidia"chinensis"var."Hongyang
JIANG"Kaixiu1,2,"LIU"Linya2,"HE"Bin2,"SONG"Shuyi2,"GONG"Xiaojian1*,"HUANG"Yacheng2*
1."Key"Laboratory"for"Information"System"of"Mountainous"Areas"and"Protection"of"Ecological"Environment,"Guizhou"Normal"University,"Guiyang,"Guizhou"550001,"China;"2."School"of"Biological"Science"and"Technology,"Liupanshui"Normal"University,"Liupanshui,"Guizhou"553004,"China
Abstract:"Hongyang"kiwifruit"is"a"distinguished"variety"independently"developed"in"China."It"features"a"distinctive"red"coloration,"possesses"high"sugar"content"and"low"acidity,"and"is"favored"for"its"rich"aroma"and"unique"flavor"profile."The"growth"and"development"of"fruits"are"influenced"by"a"multitude"of"factors,"among"which"sucrose"non-fermenta tion-1-associated"protein"kinase"1"(SnRK1)"plays"a"pivotal"role"in"the"regulation"of"carbohydrate"metabolism"and"the"response"to"both"biotic"and"abiotic"stresses."Therefore,"in"this"study,"we"cloned"the"full-length"cDNA"of"2"genes"in"the"SnRK1"family"of"Hongyang"kiwifruit,"named"AcSnRK1.1"and"AcSnRK1.2."The"physical"and"chemical"properties,"gene"structure,"conserved"motifs,"protein"conserved"domains,"and"cis-acting"elements"of"AcSnRK1.1"and"AcSnRK1.2"were"systematically"analyzed"using"bioinformatics"approaches."The"expression"characteristics"of"AcSnRK1.1"and"AcSnRK1.2"genes"in"different"tissues"and"fruits"were"quantitatively"detected"by"real-time"fluorescence."AcSnRK1.1"and"AcSnRK1.2"genes"contained"an"open"reading"frame"of"1548"bp"and"1545"bp,"respectively,"encoding"proteins"containing"515"and"514"amino"acids"with"highly"consistent"sequences"(96.31%)"respectively."Both"genes"contained"10"exons"and"2"introns."Bioinformatics"analysis"showed"that"AcSnRK1.1"and"AcSnRK1.2"had"high"homology"with"other"plant"SnRK1"proteins."The"amino"acid"sequence"showed"that"STKc_AMPK_alpha,"AMPK_C"and"UBA_SnRK1_plant"were"unique"to"the"SnRK1"family."Evolutionary"tree"analysis"showed"that"AcSnRK1.1"and"AcSnRK1.2"belonged"to"the"SnRK1"family."Tissue"specific"analysis"showed"that"AcSnRK1.1"and"AcSnRK1.2"were"expressed"in"all"tissues"of"Hongyang"Kiwifruit,"but"the"expression"abundance"was"the"highest"in"fruit."During"fruit"development,"the"expression"levels"of"AcSnRK1.1"and"AcSnRK1.2"decreased"first"and"then"increased."qRT-PCR"analysis"showed"that"the"expression"of"AcSnRK1.1"and"AcSnRK1.2"was"responsive"to"ABA,"GA3,"ET"and"CPPU."With"the"increase"of"storage"time,"the"expression"levels"of"AcSnRK1.1"and"AcSnRK1.2"showed"a"downward"trend"first"and"then"an"upward"trend,"suggesting"that"AcSnRK1"gene"might"regulate"the"expression"of"sucrose"synthase."The"results"of"this"study"indicate"that"AcSnRK1.1"and"AcSnRK1.2"genes"play"an"important"role"in"the"development"and"storage"of"Hongyang"kiwifruit,"which"would"lay"a"foundation"for"further"elucidation"of"the"functions"of"AcSnRK1.1"and"AcSnRK1.2"genes.
Keywords:"Actinidia"chinensis"var."Hongyang;"SnRK1;"gene"cloning;"bioinformatics"analysis;"expression"analysis
DOI:"10.3969/j.issn.1000-2561.2025.02.006
蔗糖非发酵-1相关蛋白激酶1(sucrose"non-"fermenting"1-related"protein"kinase,"SnRK1)蛋白是一类广泛存在于植物中的丝氨酸/苏氨酸蛋白激酶,是酵母中SNF1和动物中AMPK的同源蛋白,是一个能量感受器,可被能量缺乏所激活[1]。SnRK1基因是由3个亚基组成的异三聚体,包括催化α亚基、支架β亚基和腺嘌呤核苷酸AMP或ADP缔合γ亚基[2-3]。SnRK1是SnRK超家族中的一个重要分支,在植物中高度保守且广泛参与了调控多种生理过程,主要参与了植物的生长发育[4]。在草莓中的研究表明,FaSnRK1a基因可以上调FaSUS1和FaSUS3基因表达提高蔗糖合酶(SUS)活性,促进果实中蔗糖的积累,从而影响果实的发育[5]。马铃薯中的反义表达SnRK1基因可使其蔗糖合成酶基因表达急剧下调,并且导致蔗糖合成酶的活性降低了30%,说明SnRK1在转录水平上能对蔗糖合成酶基因进行调节,影响蔗糖合成酶的活性,从而降低块茎中淀粉含量[6]。将大麦中SnRK1进行沉默表达,导致其花粉发育受阻,花粉中只含有少量或不含有淀粉,这可能与不能利用输入的蔗糖有关,即沉默表达后的SnRK1无法激活蔗糖合成酶的活性[7]。番茄中过表达mhSnRK1基因可增加番茄叶片和成熟果实中淀粉含量[8]。以上结果表明,SnRK1通过调控蔗糖合酶的表达,在源和库组织之间对蔗糖分配发挥着至关重要的作用。此外,SnRK1还参与激素信号传导、生物胁迫和非生物胁迫等过程,如在小麦萌发和幼苗早期生长过程中,SnRK1受到ABA的负调控[5];在拟南芥中,SnRK1通过调控胁迫应答基因的表达和ABA信号通路参与糖和黑暗的响应[9]。
猕猴桃也称奇异果,含有丰富的维生素C、微量元素、氨基酸和膳食纤维,此外,还具有重要的保健功能,有“水果之王”的美称[10-12],深受消费者喜爱,具有极高的经济效益[13-14]。现有研究在猕猴桃果实中鉴定到较多与果实发育和品质形成有关的基因,这些基因的调控机制为果实品质和产量的改善提供了一定的基础。本课题组前期研究已经证实蔗糖合酶与果实发育密切相关[15],且已有的研究也表明,SnRK1能够调控蔗糖合酶的活性,影响果实的产量和品质。本研究以红阳猕猴桃为材料,克隆得到了2个SnRK1成员,对其进行生物信息学分析,并分析其在红阳猕猴桃不同组织、果实发育时期和后熟软化阶段的表达特性,以期为深入研究红阳猕猴桃SnRK1蛋白激酶的生理功能奠定基础。
1""材料与方法
1.1""材料
1.1.1""植物材料""供试品种为种植在贵州省六盘水市米箩乡的8年生的红阳猕猴桃。激素处理材料的采集参照刘林娅等[16]的方法。不同组织和果实不同发育时期材料的采集参照任东立等[15]的方法。后熟软化时期的果实于花后138"d采集,分别在采集后2、4、6、8、15、17、19"d取样。每个实验均设置3个生物学重复,样品采集后立即用锡箔纸包裹置于液氮中速冻,置于–80"℃冰箱保存,用于后续RNA的提取。
1.1.2""菌株与试剂""逆转录试剂盒、普通琼脂糖凝胶DNA回收试剂盒、大肠杆菌(Escherichia"coli)"DH5α均购自天根生化科技(北京)有限公司;Trans"Taq®"HiFi"DNA"Polymerase"High"Fidelity(HiFi)购自北京全式金生物技术有限公司;Phanta"Max"Super-Fidelity"DNA"Polymerase"(P505)购自南京诺唯赞生物科技股份有限公司;SYBR试剂盒购自生工生物工程(上海)股份有限公司;其他生化试剂为进口或国产分析纯试剂。
DNA序列测序由生工生物工程(上海)股份有限公司完成。
1.2""方法
1.2.1""AcSnRK1基因全长cDNA克隆""红阳猕猴桃总RNA提取参照实验室改良的CTAB法,浓度和质量检测符合实验要求,可用于下一步实验[17]。按照逆转录试剂盒操作说明书合成cDNA第一链。基于红阳猕猴桃转录组测序信息,设计SnRK1基因序列的特异引物(表1),以逆转录的产物为模板,利用PCR法对SnRK1基因进行cDNA全长扩增。反应条件:95"℃预变性5"min;95"℃变性30"s,55"℃退火30"s,72"℃延伸1.5"min,28次循环;72"℃延伸10"min。PCR产物用1%琼脂糖凝胶进行电泳检测目的条带,并按照TIANGEN公司凝胶回收试剂盒说明书进行凝胶回收,回收产物连接到PEASY-T1载体送公司测序。
1.2.2""AcSnRK1基因的生物信息学分析""在NCBI网站相关程序中对SnRK1蛋白序列进行BLAST比对和保守结构域预测,利用其他在线网站和软件预测SnRK1蛋白的理化性质、亚细胞定位预测、跨膜结构域以及进行氨基酸同源比对和构建进化树。
(1)AcSnRK1基因的理化性质、亚细胞定位和染色体定位。利用ExPASY(https://www.expasy."org/tools)在线软件预测SnRK1氨基酸数量、相对分子质量(MW)、理论等电点(pI),不稳定系数(instability"index)、脂溶性系数(aliphatic"index)和疏水性(grand"average"of"hydropathicity)。使用WOLF"PSORT"(https://wolfpsort.hgc.jp/)在线软件预测SnRK1编码蛋白的亚细胞定位。将红阳猕猴桃基因结构注释信息和基因ID上传至TBtools软件的Gene"Location"Visualize"from"GTF/GFF工具中,分析染色体定位。
(2)SnRK1系统发育树构建。使用MEGA11软件的Clustal"W算法的默认参数进行序列比对,利用Neighbor-Joining法,设置1000次bootstrap检验重复,其他参数默认,将得到的建树信息导入EvolView"2(https://evolgenius.info//evolview-"v2/#login)在线软件中对进化树进行美化。
(3)AcSnRK1结构域序列分析。将在Pfam(http://pfam-legacy.xfam.org/)数据库下载TCP转录因子的隐马尔可夫模型(HMM)和NCBI的CDD(https://www.ncbi.nlm.nih.gov/cdd)结果利用TBtools软件进行保守结构域可视化,进一步确定目的序列均含有SnRK1蛋白结构域。将在Clustal"X序列比对后的结果导入DNAMAN软件中进行编辑,仅保留保守结构域序列,导出图片,使用PowerPoint软件进行标注,并使用WebLogo(http://weblogo.berkeley.edu/)在线软件生成一致的序列标识。
(4)AcSnRK1基因结构及保守基序分析。在MEME(https://meme-suite.org/meme/tools/meme)网站中上传AcSnRK1和AcSnRK2氨基酸序列,分析红阳猕猴桃基因家族转录因子的蛋白质保守基序,motif最大检索数设置为6个,其他参数为默认值。将保守基序结果、Clustal"X序列比对后的结果、红阳猕猴桃基因结构注释信息和蛋白信息导入TBtools软件的Gene"Structure"View(Advanced)工具中,将目标基因的基因结构及保守基序进行可视化分析。
(5)AcSnRK1基因的顺式作用元件分析。将红阳猕猴桃基因组全序列提交到TBtools软件中,截取起始密码子上游2000"bp序列作为基因的启动子区,使用PlantCare(http://bioinformatics.psb."ugent.be/webtools/plantcare/html/)在线软件进行顺式作用元件预测,再利用TBtools软件进行可视化分析。
1.2.3""实时荧光定量PCR分析""采用伯乐公司的CFX96"Touch实时荧光定量PCR仪分析不同处理对AcSnRK1基因表达的影响,具体的操作步骤参照仪器使用说明书。取不同处理样品的RNA为材料,逆转录合成cDNA第一链后用于实时荧光定量分析。选用18S和GAPDH作为内参基因,基因的荧光定量引物见表1,按照生工生物工程(上海)股份有限公司的TBgreenII说明书设计反应程序。
1.3""数据处理
所有试验数据均由3次重复试验获得,并与18s和GADPH的表达数据进行了归一化处理,以3个生物重复和3个技术重复的平均值±标准误差表示。实验结果采用E–ΔΔCt算法进行分析,使用GraphPad"Prism"9.5软件进行单因素方差分析。
2""结果与分析
2.1""AcSnRK1基因的克隆与序列分析
通过其他物种的SnRK1基因序列,在猕猴桃基因组网站(http://kiwifruitgenome.org/)上进行Blast检索,获得该基因的基因组序列。根据已知序列设计引物,通过反转录PCR扩增得到目的基因,命名为AcSnRK1.1(PSS35124)和AcSnRK1.2(PSS33671),其全长分别为2189、2056"bp(图1),开放阅读框分别为1548、1545"bp,分别编码515、514个氨基酸。氨基酸序列比对表明2个基因的氨基酸序列相似性为96.31%(图2)。
绿色水平横线表示STKc_AMPK_alpha保守结构域,紫色水平横线表示UBA_SnRK1_plant保守结构域,红色水平横线表示AMPK_C保守结构域。
2.2""AcSnRK1基因的生物信息学分析
2.2.1""AcSnRK1的理化性质、亚细胞定位及染色体定位""使用ExPASy软件对SnRK1家族成员进行蛋白质理化性质分析发现,AcSnRK1.1和AcSnRK1.2基因分别编码515、514个氨基酸,相对分子质量为58.68、58.75"kDa,等电点为8.22、
8.56,呈碱性,不稳定系数为45.61、45.92。Wolf亚细胞定位预测结果显示,AcSnRK1.1和AcSnRK1.2均定位在细胞质中。AcSnRK1.1和AcSnRK1.2在染色体定位结果显示,2个基因随机分布在2条染色体上,AcSnRK1.1和AcSnRK1.2分别分布在2号和3号染色体上。
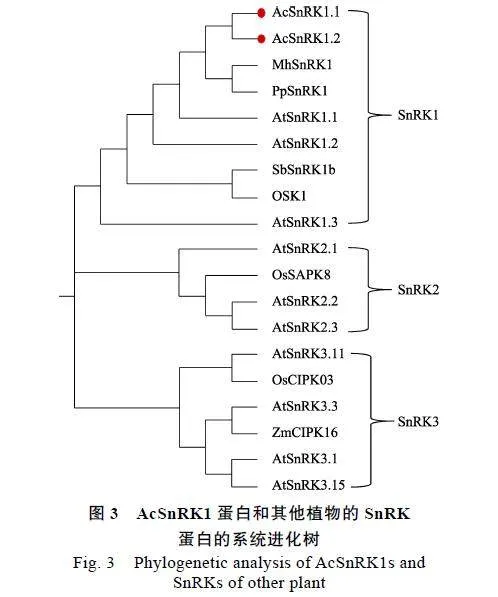
2.2.2""SnRK1的系统发育分析""利用MEGA"11软件,采用NJ法构建AcSnRK1.1、AcSnRK1.2与其他物种SnRK氨基酸序列的系统进化树。系统进化分析表明,AcSnRK1.1、AcSnRK1.2与同一分支的平邑甜茶(Malus"hupehensis)、桃(Prunus"persica"L.)的亲源关系较近,且19个SnRK蛋白明显聚为3个不同的组,分别对应于SnRK蛋白家族的3个亚家族。而AcSnRK1.1和AcSnRK1.2均聚在SnRK1亚家族中(图3),由此推断AcSnRK1.1和AcSnRK1.2均属于红阳猕猴桃SnRK1亚家族成员。
2.2.3""AcSnRK1.1和AcSnRK1.2的基因结构、蛋白保守结构域及保守序列分析""利用TBtools软件对AcSnRK1.1和AcSnRK1.2基因的外显子-内含子结构进行分析,结果表明,AcSnRK1.1和AcSnRK1.2基因均含有2个内含子和10个外显子(图4)。此外,对AcSnRK1.1和AcSnRK1.2基因的蛋白保守结构域进行分析发现,AcSnRK1.1和AcSnRK1.2蛋白均含有SnRK1家族特有的保守结构域:STKc_AMPK_alpha、AMPK_C、UBA_"SnRK1_plant结构域(图4)。对AcSnRK1.1和AcSnRK1.2基因的保守基序进行分析,结果显示AcSnRK1.1和AcSnRK1.2蛋白均含有6个motif元件(图4)。综上可知同一个亚族中的成员具有高度相似的基因结构与保守基序列,该结果与系统发育进化树分类结果一致。
2.2.4""AcSnRK1.1和AcSnRK1.2基因的启动子顺式作用元件分析""为更好地了解红阳猕猴桃的AcSnRK1.1和AcSnRK1.2基因的转录调控及潜在功能,利用PlantCARE软件分析AcSnRK1.1和AcSnRK1.2的启动子区域(起始密码子上游2000"bp)的顺式调控元件。结果显示,所有启动子序列中共有36个顺式作用元件,从中筛选出17个与激素信号通路及生长发育相关顺式元件[主要包含脱落酸响应元件、赤霉素响应元件、水杨酸响应元件、茉莉酸甲酯(MeJA)响应元件、生长素响应元件、光响应元件、生长调节、干旱、低温应答元件]分析发现,AcSnRK1基因中的顺式作用元件大多与生长调节(生长素、糖代谢)、激素响应(脱落酸、赤霉素等)、胁迫应答(脱水胁迫、创伤)和光响应(光信号)等相关(图5)。表明AcSnRK1.1和AcSnRK1.2基因的功能相对保守,每个亚族成员的表达模式比较相近。
2.3""AcSnRK1.1和AcSnRK1.2基因表达模式分析
2.3.1""AcSnRK1.1和AcSnRK1.2基因在不同组织中的表达分析""为了分析AcSnRK1.1和AcSnRK1.2基因在红阳猕猴桃不同组织中的表达模式,利用qRT-PCR技术检测其在红阳猕猴桃的雌花、雄花、芽、树皮、叶和果实中的表达量。结果表明:AcSnRK1.1和AcSnRK1.2基因在红阳猕猴桃的6个组织或器官中均有表达,但表达量存在差异,2个基因在果实中的表达量显著高于其他组织(图6),说明AcSnRK1.1和AcSnRK1.2基因可能在果实的生长发育过程中发挥重要作用。
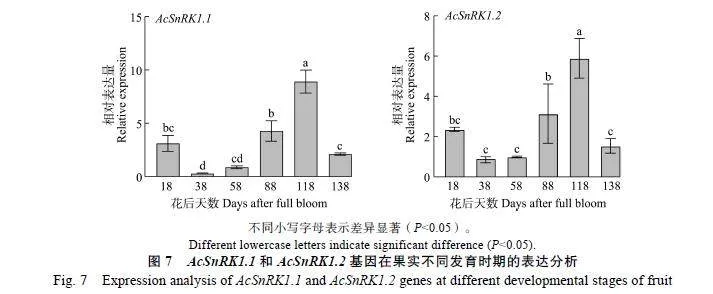
2.3.2""AcSnRK1.1和AcSnRK1.2基因在果实发育时期的表达分析""AcSnRK1.1和AcSnRK1.2基因在红阳猕猴桃果实不同发育时期的表达模式如图7所示,随着果实的发育,AcSnRK1.1和AcSnRK1.2的表达量均呈先下降后上升的趋势,在花后38~118"d的果实中的表达量明显上升,差异显著,表明AcSnRK1.1和AcSnRK1.2基因的表达和果实生长发育可能存在相关性。
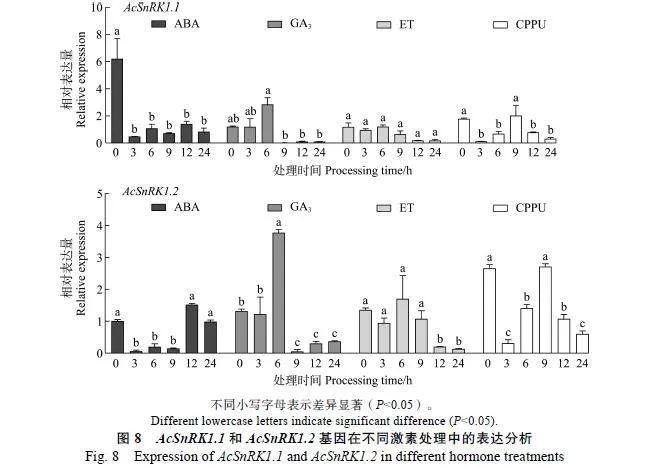
2.3.3""AcSnRK1.1和AcSnRK1.2基因在不同激素中的表达分析""红阳猕猴桃果实经不同激素(ABA、GA3、ET、CPPU)处理后,AcSnRK1.1和AcSnRK1.2基因的表达模式如图8所示,AcSnRK1.1和AcSnRK1.2基因在GA3处理0~6"h时,表达量明显上调,6"h时表达量最高,6"h之后表达量开始下调;AcSnRK1.1在ET处理前期,表达量无明显变化,9"h时表达量开始下调;AcSnRK1.2在ET处理3~6"h时,表达量呈上升趋势,6"h后表达量开始下调;AcSnRK1.1和AcSnRK1.2基因在CPPU处理3~9"h时表达量明显上升,9"h后表达量开始下降;ABA处理后,AcSnRK1.1和AcSnRK1.2在ABA处理前期下调表达,其中,AcSnRK1.1持续下调表达,AcSnRK1.2后期上调表达但总体呈现下降趋势。
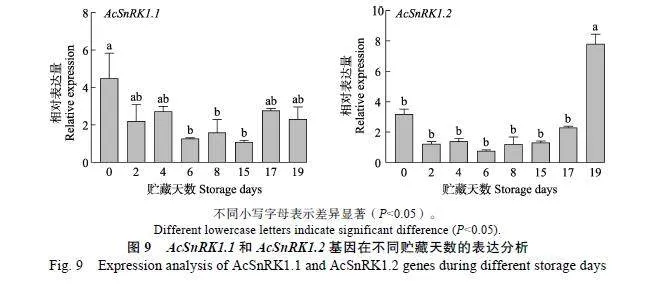
2.3.4""AcSnRK1.1和AcSnRK1.2基因在果实后熟软化阶段的表达分析""AcSnRK1.1和AcSnRK1.2基因在红阳猕猴桃果实后熟软化阶段的表达模式如图9所示,随着贮藏时间的增加,AcSnRK1.1和AcSnRK1.2的表达量呈先下降后上升的趋势,在第6天表达量最低,6"d后表达量逐渐升高,说明AcSnRK1.1和AcSnRK1.2在果实后熟软化时期也发挥重要作用。
3""讨论
SnRK1是植物体内复杂信号网络的中心枢纽之一[18],参与植物碳氮代谢、生长发育、胁迫应答等多种生理过程的调控[19]。SnRK1属于保守的基因家族[20],本研究克隆得到红阳猕猴桃SnRK1家族的2个基因,命名为AcSnRK1.1和AcSnRK1.2,不同小写字母表示差异显著(Plt;0.05)。
分别含有1548、1545"bp的开放阅读框,分别编码515和514个氨基酸,预测其主要定位于细胞质中。迄今为止,已在多种植物中克隆得到SnRK1蛋白家族成员,如拟南芥3个[21]、水稻4个[22]。草莓FaSnRK1α在叶片中表达量最高,果实中表达量最低[20]。番茄SlSnRK1.2在根和茎中表达量较高,在幼嫩叶片中表达量较低[13]。PdSnRK1α在桃的根尖中表达量最高,在花蕊、韧皮部、雄蕊、叶中表达水平较低[23]。在平邑甜茶中,MhSnRK1和MhAKINβγ基因均在叶中表达量最高[24]。而AcSnRK1.1和AcSnRK1.2在红阳猕猴桃的6种组织中均有表达,在果实中表达量最高。本研究只对红阳猕猴桃AcSnRK1家族中与果实发育最相关的2个基因进行了分析,在红阳猕猴桃中可能还有成员尚未被鉴定。
相关研究表明,SnRK1基因与激素信号存在紧密联系,尤其是ABA信号[19]。本研究分析AcSnRK1.1和AcSnRK1.2对ABA、GA3、ET、CPPU处理的响应发现,果实中的AcSnRK1.1和AcSnRK1.2在ABA处理前期下调表达,其中AcSnRK1.1持续下调表达,AcSnRK1.2在ABA处理后期上调表达,这与小麦中SnRK1基因受ABA负调控的结果一致[7]。但罗静静等[20]研究表明,草莓果实中FaSnRK1α在ABA处理后表达量上调,说明不同物种中SnRK1基因对ABA是存在应答,但是应答模式存在差异。AcSnRK1.1和AcSnRK1.2在GA3处理时呈先上升后下降的趋势,处理6"h的表达量最高,6"h后表达量开始下调;AcSnRK1.1在ET处理时整体表达量呈下降趋势,AcSnRK1.2在ET处理3~6"h时,表达量呈上升趋势,6"h后表达量开始下调;AcSnRK1.1和AcSnRK1.2在CPPU处理3~9"h时表达量呈上升趋势,9"h后表达量开始下调。这表明AcSnRK1.1和AcSnRK1.2的表达受ABA、GA3、ET、CPPU的调控。AcSnRK1.1和AcSnRK1.2的顺式作用元件中包括响应脱落酸、赤霉素、水杨酸、茉莉酸甲酯、生长素、光响应、生长调节、干旱、低温等应答元件。该结果表明,AcSnRK1.1和AcSnRK1.2受ABA、GA3、ET、CPPU的调控,为后续红阳猕猴桃通过外源激素调控SnRK1基因的表达提供了理论基础。
FaSnRK1α在果实发育过程中的表达量不断升高,到果实成熟后表达量略有下降,在果实发育过程中,FaSnRK1a基因可以上调FaSUS1和FaSUS3基因的表达,表明该基因在果实发育时期调控了蔗糖合酶的表达,促进了果实的发育进程[20]。MdSnRK1.1在番茄中过表达会影响碳氮代谢,在果实成熟进程中起重要作用[25]。本研究中AcSnRK1.1和AcSnRK1.2的表达量在果实发育时期和后熟软化阶段表达量均呈先下降后上升的趋势。在果实发育过程中,花后38~118"d属于果实快速膨大期,需要提供大量的蔗糖,AcSnRK1.1和AcSnRK1.2的表达量在这个阶段明显上调。本实验室前期对蔗糖合酶的研究结果表明,红阳猕猴桃中蔗糖合酶家族的成员中存在果实快速膨大期明显上调的基因,在后熟软化阶段也存在表达量先下降后上升的基因(数据未发表),与本研究结果一致。因此,推测AcSnRK1.1和AcSnRK1.2基因在果实快速膨大期和果实后熟软化阶段都参与了蔗糖合酶的调控,在果实快速膨大期和果实后熟软化阶段起着重要的作用。
4""结论
本研究探讨了AcSnRK1.1和AcSnRK1.2基因在红阳猕猴桃果实发育和贮藏过程中可能调控蔗糖合酶的表达,并且AcSnRK1.1和AcSnRK1.2的表达受ABA、GA3、ET、CPPU的调控,为进一步阐述AcSnRK1.1和AcSnRK1.2基因的功能奠定基础。
参考文献
[1]"任东立."‘红阳’猕猴桃叶片蔗糖代谢关键酶的酶学和基因表达特性研究[D]."贵阳:"贵州师范大学,"2024."REN"D"L."Enzymatic"properties"and"gene"expression"of"key"sucrose"metabolizing"enzymes"in"leaves"of"‘Hongyang’"kiwifruit[D]."Guiyang:"Guizhou"Normal"University,"2024."(in"Chinese)
[2]"RUAN"Y"L."Sucrose"metabolism:"gateway"to"diverse"carbon"use"and"sugar"signaling[J]."Annual"Review"of"Plant"Biology,"2014,"65(1):"33-67.
[3]"王海波,"郭俊云,"田雪莲."小桐子SnRK1蛋白激酶α亚基基因的克隆及原核表达分析[J]."生物技术通报,"2019,"35(6):"39-47.WANG"H"B,"GUO"J"Y,"TIAN"X"L."Molecular"cloning"and"prokaryotic"expression"analysis"of"protein"kinase"SnRK1"subunit"α"gene"from"Jatropha"curcas[J]."Biotechnology"Bulletin,"2019,"35(6):"39-47."(in"Chinese)
[4]"张余,"余舜武,"李佳,"李天菲,"陈晨,"高宁宁,"罗立军."植物SnRK1蛋白激酶研究进展[J]."上海农业学报,"2018,"34(5):"139-148.ZHANG"Y,"YU"S"W,"LI"J,"LI"T"F,"CHEN"C,"GAO"N"N,"LUO"L"J."Research"progress"of"plant"SnRK1"protein"kinase[J]."Acta"Agriculturae"Shanghai,"2018,"34(5):"139-148."(in"Chinese)
[5]"CROZRT"P,"MARGALHA"L,"CONFRARIA"A,"MARTINHO"C."Mechanisms"of"regulation"of"SNF1/"AMPK/SnRK1"protein"kinases[J]."Frontiers"in"Plant"Science,"2014,"5(1):"190.
[6]"CREPIN"N,"ROLLAND"F."SnRK1"activation,"signaling,"and"networking"for"energy"homeostasis[J]."Current"Opinion"Plant"Biology,"2019,"51(1):"29-36.
[7]"罗静静."FaSnRK1α对草莓果实蔗糖代谢、灰霉病抗性和抗涝性的影响[D]."泰安:"山东农业大学,"2022.LUO"J"J."Effects"of"FaSnRK1α"on"fruit"sucrose"metabolism,"gray"mold"and"water"logging"resistance"of"strawberry[D]."Tai’an:"Shandong"Agricultural"University,"2022."(in"Chinese)
[8]"PURCELL"P"C,"SMITH"A"M,"HALFORD"N"G."Antisense"expression"of"sucrose"non-fermenting-1-related"protein"kinase"sequence"in"potato"results"in"decreased"expression"of"sucrose"synthase"in"tubers"and"loss"of"sucrose"inducibility"of"sucrose"synthase"transcripts"innbsp;leaves[J]."The"Plant"Journal,"1998,"14(2):"195-203.
[9]"ZHANG"Y,"SHEWRY"P"R,"JONES"H,"BARCELO"P,"LAZZERI"P"A,"HALFPRD"N"G."Expression"of"antisense"SnRK1"protein"kinase"sequence"causes"abnormal"pollen"development"and"male"sterility"in"transgenic"barley[J]."The"Plant"Journal,"2001,"28(4):431-441.
[10]"JOSSIER"M,"BOULY"J"P,"MEIMOUN"P,"ARJMAND"A,"LESSARD"P,"HAWLEY"S,"GRAHAME"HARDIE"D,"THOMAS"M."SnRK1"(SNF1-related"kinase1)"has"a"central"role"in"sugar"and"ABA"signalling"in""Arabidopsis"thaliana[J]."The"Plant"Journal,"2009,"59(1):"316-328.
[11]"张维,"付复华,"罗赛男,"赖灯妮,"朱向荣,"张群."湖南红心猕猴桃品种品质评价及综合分析[J]."食品与发酵工业,"2021,"47(5):"201"-210.ZHANG"W,"FU"F"H,"LUO"S"N,"LAI"D"N,"ZHU"X"R,"ZHANG"Q."Quality"analysis"and"evaluation"of"Hunan"red"kiwifruit"varieties[J]."Food"and"Fermentation"Industries,"2021,"47(5):"201-210."(in"Chinese)
[12]"黎晓茜,"龙友华,"尹显慧,"吴小毛,"赵志博,"樊荣,"莫飞旭,"蒋艳玲,"黄亚欣,"唐靖文."茉莉酸甲酯处理对猕猴桃软腐病菌作用机制及果实品质的影响[J]."食品科学,"2019,"40(15):"239-248.LI"X"Q,"LONG"Y"H,"YIN"X"H,"WU"X"M,"ZHAO"Z"B,"FAN"R,"MO"F"X,"JIANG"Y"L,"HUANG"Y"X,"TANG"J"W."Mechanism"of"action"of"methyl"jasmonate"against"kiwifruit"soft"rot"and"its"effect"on"fruit"quality[J]."Food"Science,"2019,"40(15):"239-248."(in"Chinese)
[13]"梁郅林."番茄SlSnRK1.2基因在番茄与灰霉菌互作过程中的功能研究[D]."合肥:"安徽农业大学,"2023.LIANG"Z"L."Functional"analysis"of"SlSnRK1.2"in"interaction"between"tomato"and"Botrytis"cinerea[D]."Hefei:"Anhui"Agricultural"University,"2023.nbsp;(in"Chinese)
[14]"黄兴成,"朱华清,"杨叶华,"李渝,"张雅蓉,"刘彦伶,"蒋太明."贵州省猕猴桃产量特征及影响因素分析[J]."中国果树,"2023(2):"117-121.HUANG"X"C,"ZHU"H"Q,"YANG"Y"H,"LI"Y,"ZHANG"Y"R,"LIU"Y"L,"JIANG"T"M."Analysis"on"yield"characteristics"and"influencing"factors"of"kiwifruit"in"Guizhou"province[J]."China"Fruits,"2023(2):"117-121."(in"Chinese)
[15]"任东立,"黄亚成,"刘林娅,"何斌,"鲁明秋,"龚小见."‘红阳’猕猴桃蔗糖合成酶(AcSUS1)的克隆与表达分析[J/OL]."分子植物育种."(2023-03-15)[2024-08-14]."http://kns.cnki.net/"kcms/detail/46.1068.s.20230314.1512.024.html.REN"D"L,"HUANG"Y"C,"LIU"L"Y,"HE"B,"LU"M"Q,"GONG"X"J."Cloning"and"expression"analysis"of"sucrose"synthase"(AcSUS1)"in"‘Hongyang’"kiwifruit[J/OL]."Molecular"Plant"Breeding."(2023-03-15)[2024-08-14]."http://kns.cnki.net/kcms/"detail/46.1068.s.20230314.1512.024.html."(in"Chinese)
[16]"刘林娅,"杨那,"罗宇璇,"何斌,"赵艳妹,"宋姝熠,"黄亚成."‘红阳’猕猴桃金属硫蛋白基因AcMT2的克隆、表达分析及功能鉴定[J/OL]."分子植物育种,"(2024-02-26)[2024-08-23]."http://kns.cnki.net/kcms/detail/46.1068.S.20240223.1502.010."html.LIU"L"Y,"YANG"N,"LUO"Y"X,"HE"B,"ZHAO"Y"M,"SONG"S"Y,"HUANG"Y"C."Cloning"expression"analysis"and"functional"characterization"of"AcMT2"in"Actinidia"chinensis"var."‘Hong"yang’[J/OL]."Molecular"Plant"Breeding,"(2024-02-26)[2024-"08-23]."http://kns.cnki.net/kcms/detail/46.1068.S.20240223."1502.010.html."(in"Chinese)
- 刘林娅,"杨那,"代玥,"罗彩,"陈婷."一种大量提取猕猴桃不同组织高质量总RNA的方法[J]."江西农业学报,"2020,"32(9):"30-34.LIU"L"Y,"YANG"N,"DAI"Y,"LUO"C,"CHEN"T."An"efficient"method"for"isolating"high-quality"total"RNA"from"different"tissues"of"kiwifruit"(Actinidia"chinensis)[J]."Acta"Agriculturae"Jiangxi,nbsp;2020,"32(9):"30-34."(in"Chinese)
- LASTDRAGER"J,"HANSON"J,"SMEEKENS"S."Sugar"signals"and"the"control"of"plant"growth"and"development[J]."Journal"of"Experiment"Botany,"2014,"65(1):"799-807.
[19]"EMANUELLE"S,"DOBLIN"M"S,"STAPLETON"D"I."Molecular"insights"into"the"enigmatic"metabolic"regulator,"SnRK1[J]."Trends"in"Plant"Science,"2016,"21(1):"341-353.
[20]"罗静静,"张亚飞,"张淑辉,"彭福田,"肖元松."草莓蔗糖非发酵-1-相关蛋白激酶1(SnRK1)α亚基编码基因的克隆及表达分析[J]."植物生理学报,"2018,"54(8):"1341-1348.LUO"J"J,"ZHANG"Y"F,"ZHANG"S"H,"PENG"F"T,"XIAO"Y"S."Cloning"and"expression"analysis"of"the"gene"encoding"the"α-subunit"of"strawberry"sucrose"non-fermentation-1-associ ated"protein"kinase"1(SnRK1)[J]."Plant"Physiology"Journal"2018,"54(8):"1341-1348."(in"Chinese)
[21]"刘月."拟南芥SnRK1蛋白激酶调控气孔运动的分子机制研究[D]."济南:"山东大学,"2020.LIU"Y."Functional"analysis"of"SnRK1"kinase"regulating"stomatal"movement"in"Arabidopsis[D]."Jinan:"Shandong"University,"2020."(in"Chinese)
[22]"何艺琴."小麦SnRK基因家族鉴定、进化及功能分析[D]."荆州:"长江大学,"2021.HE"Y"Q."Identification,"evolution"and"functional"analysis"of"SnRK"gene"family"in"wheat[D]."Jingzhou:"Yangtze"University,"2021."(in"Chinese)
[23]"于文英."桃SnRK1α促进根毛发生和生长的机理研究[D]."泰安:"山东农业大学,"2024.YU"W"Y."The"mechanism"of"SnRK1α"promoting"the"generation"and"growth"of"root"hair"in"peach[D]."Tai’an:"Shandong"Agricultural"University,"2024."(in"Chinese)
[24]"李光杰."平邑甜茶SnRK1基因的克隆、表达及其功能的研究[D]."泰安:"山东农业大学,"2009.LI"G"J."Cloning"and"expressing"regulation"of"sucrose"non-fermenting-1-related"protein"kinase-1"(SnRK1)"from"Pingyitiancha"(Malus"hupehensis"Rehd.)"and"researching"ofits"function[D]."Tai’an:"Shandong"Agricultural"University,"2009."(in"Chinese)
[25]"WANG"X,"PENG"F,"LI"M."Expression"of"a"heterologous"SnRK1"in"tomato"increases"carbon"assimilation,"nitrogen"uptake"and"modifies"fruit"development[J]."Journal"of"Plant"Physiology,"2012,"169(12):"1173-1182.
