2 型转谷氨酰胺酶对人胶质母细胞瘤细胞U251放射敏感性的影响
2024-11-12蓝瑞隆伍兵王锃






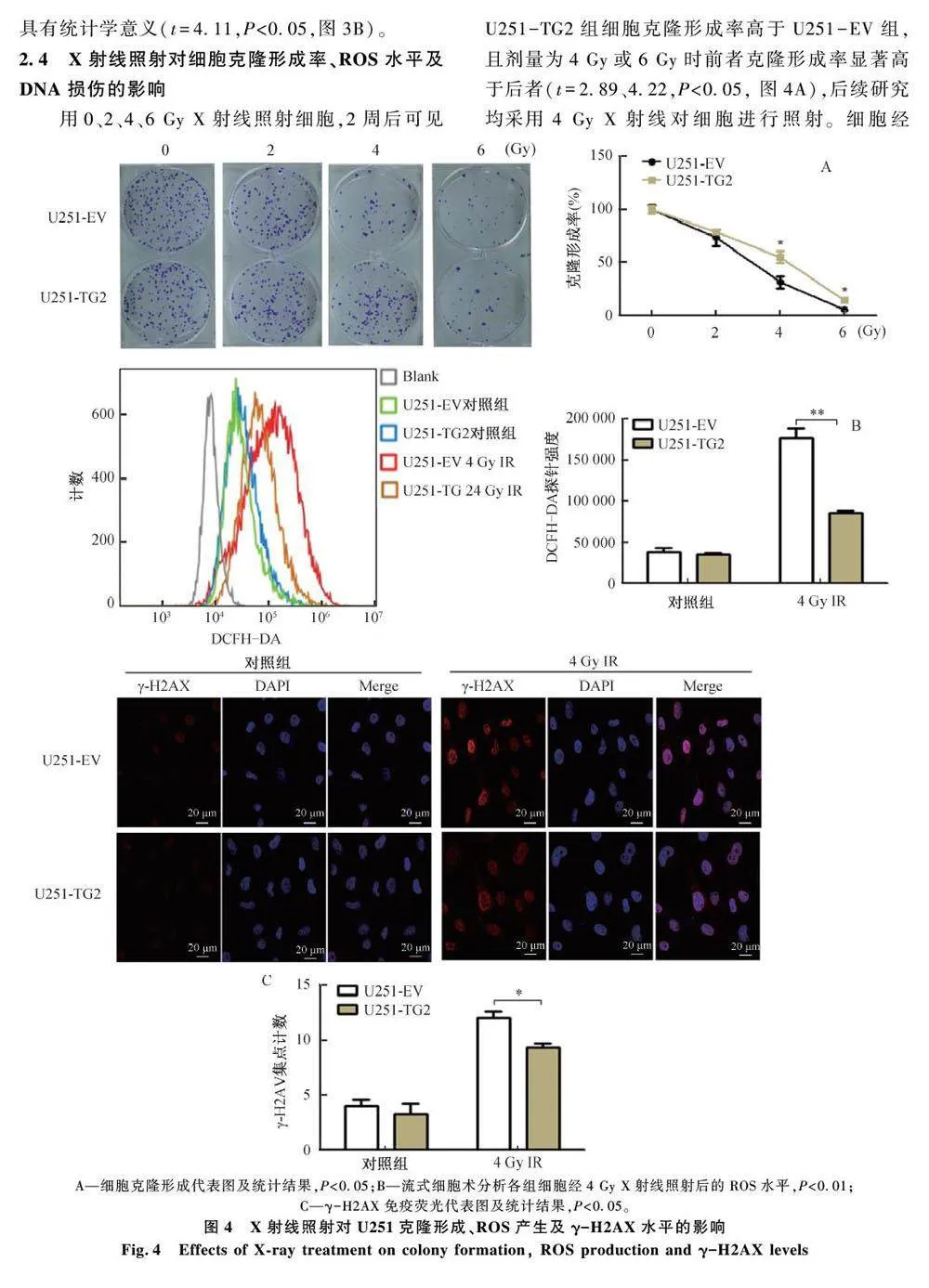
摘 要:为探讨2 型转谷氨酰胺酶( transglutaminase 2,TG2) 对胶质母细胞瘤( glioblastoma,GBM) 放射敏感性的影响。通过生信分析TG2 表达与胶质瘤病人预后的关系,并分析了其在GBM 放射抵抗细胞株U251 中的水平;瞬时转染得到TG2 过表达细胞( U251-TG2) 或空载细胞( U251-EV) ;CCK8 法绘制生长曲线;transwell 检测细胞迁移能力;不同剂量X 射线照射后,检测细胞克隆形成能力、ROS 水平;并通过免疫荧光检测γ-H2AX 水平;Westernblot 检测自噬关键分子Beclin-1、LC3 及mTOR 磷酸化水平。结果显示,TG2 高表达胶质瘤患者具有更差的无进展间隔期及总生存期,TG2 在放射抵抗型U251 中的表达显著高于野生型U251;U251-TG2 细胞增殖能力高于U251-EV,且前者迁移能力高于后者;经X 射线照射后,U251-TG2 细胞克隆形成率高于U251-EV,前者ROS 水平及γ-H2AX 荧光焦点数均低于后者;自噬关键蛋白Beclin-1 及自噬活性指标LC3-Ⅱ / Ⅰ比值在U251-TG2 的水平均高于U251-EV,且前者mTOR 磷酸化水平低于后者。实验结果证明,X 射线照射后,TG2 可能通过抑制mTOR 磷酸化的方式促进自噬,进而降低GBM 细胞U251 的放射敏感性。
关键词:胶质母细胞瘤;2 型转谷氨酰胺酶;放射敏感性
中图分类号:Q274 文献标识码:A
胶质母细胞瘤( glioblastoma,GBM) 是一种高度侵袭性的原发性脑肿瘤,全世界每年发病约17万例。传统的外科手术、放疗以及同时辅以替莫唑胺,是治疗 GBM 的主要方式,但过去的20 年并未观察到GBM 生存率的显著改善[1] ,中位生存期为12 ~ 15 个月,只有5% ~ 7%的患者存活超过5 年。放疗是包括GBM 在内的实体瘤传统治疗方式之一,可改善肿瘤的局部控制、提高患者生存期。但 GBM 对放疗并不敏感,GBM 患者经常出现放疗抵抗,这是其死亡率高的主要原因之一[ 2-3] 。因此,阐明GBM 放射抵抗机制、寻找放射抵抗的关键靶点对于提高放疗疗效迫在眉睫。
2 型转谷氨酰胺酶( transglutaminase 2,TG2)作为转谷氨酰胺酶(transglutaminases, TGs))家族成员,主要催化蛋白质的翻译后修饰,产生具有稳定功能的共价交联[4] ,参与多种疾病生理过程。研究显示,TG2 高表达与胃癌的病理分级密切相关,并与胃癌患者生存率较低有关,它可通过抑制TRIM21 介导的STAT1 泛素化降解促进胃癌的恶性进展[5] ; 下调TG2 可通过调节 IL - 6/ JAK/STAT3 信号通路抑制 T 细胞淋巴瘤细胞增殖[6] ;抑制TG2 可通过调节c/ EBPβ 信号转导逆转胶质瘤干细胞的间质转化[7] ;等等。目前,TG2 与肿瘤放射敏感性相关研究鲜有报道。
前期,课题组通过TCGA 数据分析发现,TG2的表达与胶质瘤患者的预后不良有关;进一步通过GEO 分析发现,TG2 mRNA 在人GBM 放射抵抗细胞株U251 中的水平显著高于野生型细胞株,且U251 经不同剂量X 射线照射后TG2 mRNA 呈不同程度上调,故本研究通过对GBM 细胞U251 行TG2 过表达,初步探讨了X 射线作用下,TG2 对U251 细胞放射敏感性的影响及其可能机制。
