花椒精油及其主要成分对番茄链格孢菌的抑制作用
2024-11-05熊诗洁朱学栋袁继荣万发兴李京花贾切



摘要:【目的】探明花椒精油对番茄链格孢菌(Alternaria alternata)的抑菌效果及作用机制,以期为利用花椒精油作为植物源熏蒸剂进行茄果类蔬菜链格孢腐烂病的生物防治提供理论依据。【方法】以番茄链格孢菌菌株HJF-1为试验对象,设不同浓度(40、80、120、160和200μg/mL)花椒精油及其3种主要成分芳樟醇、柠檬烯、月桂烯熏蒸HJF-1菌丝试验,以无菌水处理作为空白对照,评价不同物质对番茄链格孢菌的抑菌效果。通过显微镜观察、生理生化检测及离体接种等方法,进一步分析花椒精油和芳樟醇对病原菌的菌丝形态、孢子萌发、芽管长度、细胞膜完整性及致病力的影响,阐明花椒精油和芳樟醇熏蒸对番茄链格孢腐烂病菌的抑菌效果及作用机制。【结果】不同浓度的花椒精油及其3种主要成分熏蒸后,HJF-1菌落直径与对照之间存在明显差异,熏蒸抑菌效果表现为花椒精油>芳樟醇>月桂烯>柠檬烯,花椒精油和芳樟醇的抑菌效果相对较强,二者的最小抑菌浓度(MIC)均为160μg/mL。不同浓度花椒精油和芳樟醇熏蒸处理的菌丝生长抑制率存在显著差异(P<0.05,下同),以200μg/mL的浓度熏蒸72 h后,其菌丝生长抑制率分别达99.10%和99.00%。熏蒸浓度与生长抑制率呈剂量效应关系,花椒精油和芳樟醇对菌株HJF-1的半致死浓度(EC50)分别为85.98和89.84μg/mL。花椒精油和芳樟醇熏蒸处理不仅能显著降低孢子萌发率,还可显著抑制孢子芽管伸长,以浓度为200μg/mL花椒精油和芳樟醇熏蒸6 h后,菌孢子萌发率最低,分别为1.0%和1.2%,此时孢子芽管长度也最小,分别为9.2和10.8μm。此外,花椒精油和芳樟醇还能引起病原菌畸形和细胞膜氧化破损,导致菌丝丙二醛含量在熏蒸12 h时上升至6.3和4.0 nmol/mL;熏蒸24 h时,胞外可溶性蛋白含量分别上升至11.9和9.1μg/L,胞外可溶性糖含量分别上升至263.8和237.2μg/L,最终在熏蒸72 h时导致胞外相对电导率达最大值,分别为62.5%和50.5%。离体试验结果表明,2×MIC的花椒精油及芳樟醇熏蒸72 h可大幅降低链格孢菌的致病力,对链格孢腐烂病的相对防效分别达83.9%和75.6%。【结论】花椒精油及其主要成分芳樟醇通过抑制链格孢菌菌丝生长和孢子萌发而阻断病原菌侵染及延缓扩展,破坏细胞表面完整性而引起胞内物质渗漏及细胞功能紊乱,最终导致病原菌致病力降低。
关键词:花椒精油;番茄;链格孢菌;抑菌机理;相对防效
中图分类号:S573.909.9文献标志码:A文章编号:2095-1191(2024)08-2473-12
Inhibition effects of Chinese prickly ash essential oil and its main components on Alternaria alternata in tomato
XIONG Shi-jie ZHU Xue-dong YUAN Ji-rong WANG Fa-xing LI Jing-hua JIA Qie1*
(1College of Horticulture and Gardening,Yangtze University/Spice Crops Research Institute,Jingzhou,Hubei 434025,China;2Southeast Chongqing Academy of Agricultural Sciences,Chongqing 408000,China)
Abstract:【Objective】This research aimed to explore the antifungal effect and mechanism of Chinese prickly ash es-sential oil against Alternaria alternata in tomato,which would provide th7fw8D61yy96I/IYqWbe8IT0b/HG4NnknUXwFOaM5meM=eoretical reference for the application of Chinese prickly ash essential oil as a botanical fumigant to control A.alternatarot disease in solanaceous vegetable.【Method】Using tomato A.alternata strain HJF-1 as the the tested material,a fumigation experiment was conducted on the mycelium of HJF-1 with different concentrations(40,80,120,160,200μg/mL)of Chinese prickly ash essential oil and its 3 maincomponents(linalool,limonene and mycrene),with sterile water treatment as the blank control.The antifungal effect of different substances on A.alternata were evaluated.Through microscopy observations,physiological and biochemical analysis and in vitro inoculation methods,further analysis was conducted to study the effect of Chinese prickly ash essen-tialoiland linalool on the mycelial morphology,spore germination,germ tube length,cell membrane integrity and patho-genicityofA.alternata,aiming to clarify the antifungal effect and mechanism of fumigation of Chinese prickly ash essen-tialoiland linalool against A.alternata.【Result】After fumigation with different concentrations of Chinese prickly ash es-sential oil and its 3 main components,there were great differences in the colony diameter of HJF-1 compared to the con-trol.The inhibition effect showed as Chinese prickly ash essential oil>linalool>myrcene>limonene.The inhibition effects of Chinese prickly ash essential oil and linalool were stronger than those of other components,and the minimum inhibi-tory concentration(MIC)of the two was both 160μg/mL.There was significant difference in the inhibition rates of myce-lial growth fumigated with different concentrations of Chinese prickly ash essential oil and linalool(P<0.05,the same be-low)with mycelial growth inhibition rates of 99.10%and 99.00%treated with 200μg/mL of Chinese prickly ash essential oil and linalool respectively.There was a dose-effect relationship between fumigation concentration and growth inhibition rate of HJF- and the half lethal concentrations(EC50)of Chinese prickly ash essential oil and linalool were 85.98 and 89.84μg/mL respectively.Fumigation with Chinese prickly ash essential oil and linalool not only significantly reduced spore germination rate,but also inhibited spore tube elongation.By fumigation with 200μg/mL Chinese prickly ash essen-tialoiland linalool for 6 h,spore germination rates were the lowest(1.0%and 1.2%respectively).At the same time,the lengthes of spore tubes were the minimum(9.2 and 10.8μm respectively).In addition,Chinese prickly ash essential oil and linalool could also cause pathogen deformity,cell membrane oxidative damage,and increased mycelium malondialde-hyde content to 6.3 and 4.0 nmol/mL after panthogenfumigatied for 12 h compared with before fumigation.By fumigation with the two essential oil for 24 h,the inextracellular soluble proteins contents showed an increase and reached 11.9 and 9.1μg/L respectively,and a increase in extracellular soluble sugars contents to 263.8 and 237.2μg/L respectively.At 72 h of fumigation,extracellular relative conductivity reached the maximun,compared with before fumigation which were 62.5%and 50.5%.In vitro experiment indicated that fumigation with Chinese prickly ash essential oil and linalool(2×MIC)for 72 h greatly reduced the pathogenicity of A.alternata with relative control effects of 83.9%and 75.6%to Alter-naria rot respectively.Chinese prickly ash essential oil and its main components linalool can block the infection and delay the spread of A.alternata by inhibiting mycelium growth and spore germination,causing intracellular leakage and func-tion disorders through damage of cell surface integrity,and ultimately resulting in reduced pathogenicity ofA.alternata.
Key words:Chinese prickly ash essential oil;tomato;Alternaria alternata;antifungal mechanism;relative control effect
Foundation items:Hubei Key Research and Development Plan Project(2022BBA0061);Hubei Natural Science Foundation(2023AFB1001);General Project of Chongqing Natural Science Foundation(CSTB2022NSCQ-MSX1558);Science and Technology Special Project of Yiling District,Yichang City(2023D-101)
0引言
【研究意义】番茄(Solanum lycopersicum L.)在贮藏过程中易受环境变化影响出现生理失调,发生由链格孢菌(Alternaria alternata)、青霉菌(Penicil-liumexpansum)等引起的腐烂病,造成产量和品质的严重损失(乔镜澄和麻杰,2015;赵焕兰等,2022)。目前,番茄的防腐保鲜主要依赖于冷藏、气调保藏及化学防腐剂熏蒸等理化方法,由于成本高、安全性低及病原菌抗药性等原因,上述方法在实际生产过程中应用有限(凌丽晨,2021)。精油是来源于植物不同部位的小分子、易挥发的天然混合物,具有来源广、毒性低、抑菌强等优点,可作为天然的抑菌杀虫剂(程作慧等,2020;罗怡华等,2020;程志敏等,2022;刘全俊等,2022)。因此,研究植物精油对番茄腐烂病原菌的抑制效果及作用机理,对于开发绿色高效的果蔬防腐保鲜剂及提供番茄采后腐烂的生态友好防治策略具有重要意义。【前人研究进展】前人研究表明,植物精油可对多种植物病原菌的形态结构、生长萌发和代谢生理产生显著影响,具有良好的抑菌防腐效果(Fallehetal.,2020;刘全俊等,2022;Luo et al.,2022)。肉桂精油和大蒜精油对链铬孢菌具有显著抑制作用,其最小抑菌浓度(MIC)分别为0.313和1.250μL/mL,二者复配体积比为3∶1时抑菌效果良好,72 h后的抑菌直径可达22.4 mm(许倩等,2013)。300μg/mL的丁香酚不仅能完全抑制链格孢菌菌丝的生长及孢子萌发,还可导致链格孢菌菌体严重变形,表面出现大量褶皱,胞内物质流失,破坏完整细胞器,其胞外可溶性蛋白含量和电导率分别提高1.18和8.02倍(葛达娥,2020)。近年来,有研究发现花椒精油也是一种效果显著的生物抑菌熏蒸剂(Wang et al.,2020b)。Ma等(2021)通过气质联用方法检测发现,花椒精油富含烯烃类、醇类、酮类、醛类、环氧化合物、酯类和芳烃类等物质,能有效抑制果蔬上的病原微生物,起到果蔬防腐保鲜的功效。全二维气相色谱—飞行时间质谱分析结果显示,花椒精油富含芳樟醇、柠檬烯、β-月桂烯、桧烯和β-蒎烯等物质,其相应的组分含量分别为22.00%、14.84%、12.70%、8.93%和6.41%(程志敏等,2022)。Wang等(2021)研究发现,花椒精油对金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli)和单核细胞增多性李斯特菌(Listeria monocyto-genes)具有显著抗菌活性。体外抑菌试验结果也证明,花椒精油对青霉菌和链格孢菌均具有显著抑制效果,14.2μL/L的花椒精油熏蒸5.6 h可有效控制损伤苹果上的青霉菌生长(王聪等,2021)。【本研究切入点】近年来,有离体试验结果表明,花椒精油溶液浸泡处理能有效控制番茄果实腐烂病害的发生,且番茄果实上链格孢菌菌丝体和孢子生长量显著低于对照(Slathia et al.,2021)。但有关花椒精油对链格孢菌起抑菌作用的主要成分及其相关的抑菌机制仍不明确,有待于进一步解析。【拟解决的关键问题】以樱桃番茄腐烂病原菌链格孢菌为研究对象,通过熏蒸抑菌评价、光学及扫描电子显微镜观察、生理生化检测和果实离体接种试验,分析花椒精油及其主要成分对病原菌的生长、萌发、细胞膜完整性及致病力的影响,阐明花椒精油熏蒸对番茄链格孢菌的抑菌效应及作用机制,为利用花椒精油作为植物源熏蒸剂进行茄果类蔬菜链格孢腐烂病的生物防治提供理论依据。
1材料与方法
1.1试验材料
1.1.1菌株、培养基及主要试剂供试菌株HJF-1为番茄链格孢菌,由长江大学园艺园林学院香辛作物研究院保存。樱桃番茄果实购自湖北省荆州市果品批发市场。
PDA培养基:称取去皮的新鲜马铃薯200 g,置于800 mL蒸馏水中煮沸20 min后,用4层纱布过滤。向过滤后的土豆汁中加入20 g葡萄糖、15 g琼脂,以蒸馏水定容至1000 mL,于121℃下高压灭菌20 min后备用。PDB培养基:培养基营养配方同PDA,但不加琼脂。水琼脂培养基:称取琼脂粉16 g加入适量蒸馏水,定容至1000 mL,于121℃下高压灭菌20min后备用。
主要试剂:花椒精油由花椒果实通过水蒸气提取法获得(罗怡华等,2020);芳樟醇(纯度≥98%)、柠檬烯(纯度≥95%)、月桂烯(纯度≥90%)购自上海麦克林生化股份有限公司;碘化丙啶(PI,分析纯)购自生工生物工程(上海)股份有限公司;丙二醛测定试剂盒(BC0020)购自北京索莱宝科技有限公司。
1.1.2仪器和设备主要仪器设备包括LDZX-40SBI型电热压力蒸汽灭菌锅(上海申安医疗器械厂)、HPS-250生化培养箱(青岛精诚仪器仪表有限公司)、E600光学显微镜(日本Nikon公司)、EVO 18扫描电子显微镜[卡尔蔡司(上海)管理有限公司]、Ni-U荧光显微镜(日本Nikon公司)、DDS-307A电导仪(上海仪电科学仪器股份有限公司)、UV-8000紫外可见分光光度计(上海美谱达仪器有限公司)。
1.2试验方法
1.2.1菌株活化将低温(-80℃)保藏的菌株HJF-1菌丝块移至PDA斜面培养基,于25℃条件下暗培养72 h。然后挑取PDA斜面培养基上长出的HJF-1菌株菌丝,置于新鲜PDA平板培养基上,于25℃条件下暗培养72h后备用。
1.2.2抑菌活性测定采用滤纸片熏蒸法进行抑菌活性测定。挑取直径为6mm的HJF-1菌丝块,置于PDA平板培养基上,再以贴有5 mm直径滤纸圆片的培养皿盖密封,于25℃条件下暗培养。通过在滤纸圆片上滴加不同质量精油(包括花椒精油及其3种主要成分芳樟醇、柠檬烯和月桂烯),使培养皿内的精油熏蒸浓度分别达40、80、120、160和200μg/mL。于24、48和72h时,通过十字交叉法测量不同处理时间的菌落直径,以48 h内完全无菌丝生长的精油质量浓度作为MIC,并计算不同浓度精油熏蒸对HJF-1菌丝生长的抑制率。生长抑制率按照以下公式计算:
生长抑制率(%)=(处理菌落直径-菌丝块直径)/(对照菌落直径-菌丝块直径)×100
通过不同精油浓度值与相应菌丝生长抑制率进行回归分析,以SPSS 26.0估算毒力方程及半致死浓度(EC50)。每处理重复3次,每次重复使用6个培养皿,以无菌水处理作为空白对照。
1.2.3孢子萌发率及芽管长度测定以无菌水洗脱菌株HJF-1的分生孢子,调整为1×105个/mL浓度的孢子悬液。吸取该孢子悬液200μL,涂布于水琼脂培养基上,参照1.2.2的方法,以浓度40、80、120、160和200μg/mL的花椒精油和芳樟醇熏蒸孢子。在熏蒸6h后通过光学显微镜观察孢子萌发,并计算孢子萌发率,测量芽管长度,以芽管长度大于孢子半径为萌发标准。每处理重复3次,每次重复观察3个视野,每个视野下统计100个分生孢子。以无菌水处理作为空白对照。
1.2.4病原菌菌丝形态观察参照1.2.2的方法,以MIC浓度的花椒精油和芳樟醇熏蒸HJF-1菌丝,在25℃条件下暗培养72h后,收集菌丝并按照Yu等(2015)的方法以戊二醛固定2h。通过不同浓度(30%、50%、70%、85%、95%、100%)乙醇溶液依次脱水,以真空冷冻干燥机干燥2 h,以离子溅射镀膜机镀膜60 s,然后在扫描电子显微镜下观察菌丝形态。每处理重复3次,以无菌水处理作为空白对照。
1.2.5病原菌细胞膜完整性测定PI染色观察:参照1.2.2的方法,挑取经MIC浓度的花椒精油和芳樟醇熏蒸72 h的HJF-1菌丝,置于10μg/mL的PI染液中,在30°C、暗条件下染色20 min。再以PBS溶液漂洗菌丝3次,通过荧光显微镜在546和590 nm激发波长下观察菌丝荧光强度。每处理重复3次,以无菌水处理作为空白对照。
相对电导率测定:吸取1×105个/mL浓度的孢子悬液2 mL,置于150 mL的PDB培养基中,于25℃、150 r/min条件下振荡培养72h。将滤得的菌丝以无菌水冲洗3次,置于含有MIC浓度的花椒精油和芳樟醇的150 mL去离子水中,于25℃、150 r/min条件下再振荡培养,分别于0、6、12、24、48和72 h时,将培养液以5000 r/min离心5 min。参考Wang(2020a)等的方法,使用便携式电导率仪测定上清液的胞外电导率L,然后将其煮沸处理10 min后冷却至室温,再次测定电导率L',初始电导率为L0,计算相对电导率。每处理重复3次,以无菌水作为空白对照。相对电导率按以下公式计算:
相对电导率(%)=(L-L0)/(L'-L0)×100
丙二醛含量测定:按照测定相对电导率的方法处理菌丝,分别于0、6、12、24、48和72 h离心获得菌丝培养上清液。取0.1 g菌丝,加入提取液,充分研磨,于4℃、5000 r/min下离心5 min。取上清液,参照丙二醛检测试剂盒说明书,测定不同时间处理菌丝的丙二醛含量。每处理重复3次,以无菌水处理作为空白对照。
可溶性蛋白含量测定:按照测定相对电导率的方法处理菌丝,分别于0、6、12、24、48和72 h离心获得菌丝培养上清液。参照石志琦等(2004)的方法,取0.2 mL上清液置于玻璃试管中,再加入5 mL考马斯亮蓝溶液,5 min后于595nm波长下测定吸光度,计算菌丝可溶性蛋白含量。每处理重复3次,以无菌水处理作为空白对照。可溶性蛋白含量按以下公式计算:
可溶性蛋白含量(µg/L)=c×V2×N×1000/V1
式中,c为从标准曲线查得的可溶性蛋白浓度(μg/mL),V1为提取液的总体积(mL),V2为测定时所取样品提取液体积(mL),N为样品提取液的稀释倍数。
可溶性糖含量测定:按照测定相对电导率的方法处理菌丝,分别于0、6、12、24、48和72 h离心获得菌丝培养上清液。参照蒲小龙等(2017)的方法,取0.1 mL上清液置于玻璃试管中,再加入1.9 mL蒸馏水和0.5 mL蒽酮试剂,然后缓慢加入5.0 mL浓硫酸,迅速混匀后置于80℃恒温水浴中保温10min,冷却至室温,在630 nm波长下测定吸光度,计算菌丝可溶性糖含量。每处理重复3次,以无菌水处理作为空白对照。可溶性糖含量按以下公式计算:
可溶性糖含量(µg/L)=c×V2×N×1000/V1
式中,c为从标准曲线查得的可溶性糖浓度(μg/mL),V1为提取液的总体积(mL),V2为测定时所取样品提取液体积(mL),N为样品提取液的稀释倍数。
1.2.6病原菌致病力测定选取大小一致、色泽均匀、健康的樱桃番茄果实,通过针刺法将6 mm的HJF-1菌丝块接种到樱桃番茄果实上。再将接种的樱桃番茄果实置于食品盒内,以保鲜膜密封并置于25℃下培养。接种24 h后,在食品盒内放置1块棉球,滴加精油至棉球上使食品盒内精油浓度达到MIC和2×MIC。于25℃下熏蒸培养72h后,测定果实病斑大小,并计算不同精油对链格孢腐烂病害的防治效果。每处理重复3次,每个重复检测20枚樱桃番茄果实,以无菌水处理作为空白对照。相对防效按以下公式计算:
相对防效(%)=(对照斑病直径-处理病斑直径)/对照病斑直径×100
1.3统计分析
通过SPSS 26.0计算不同处理下数据的平均值,采用单因素(One-way ANOVA)和Duncan’s法进行方差分析和多重比较,以Excel 2010制图。
2结果与分析
2.1花椒精油及其3种主要成分熏蒸对菌株HJF-1菌丝生长的影响
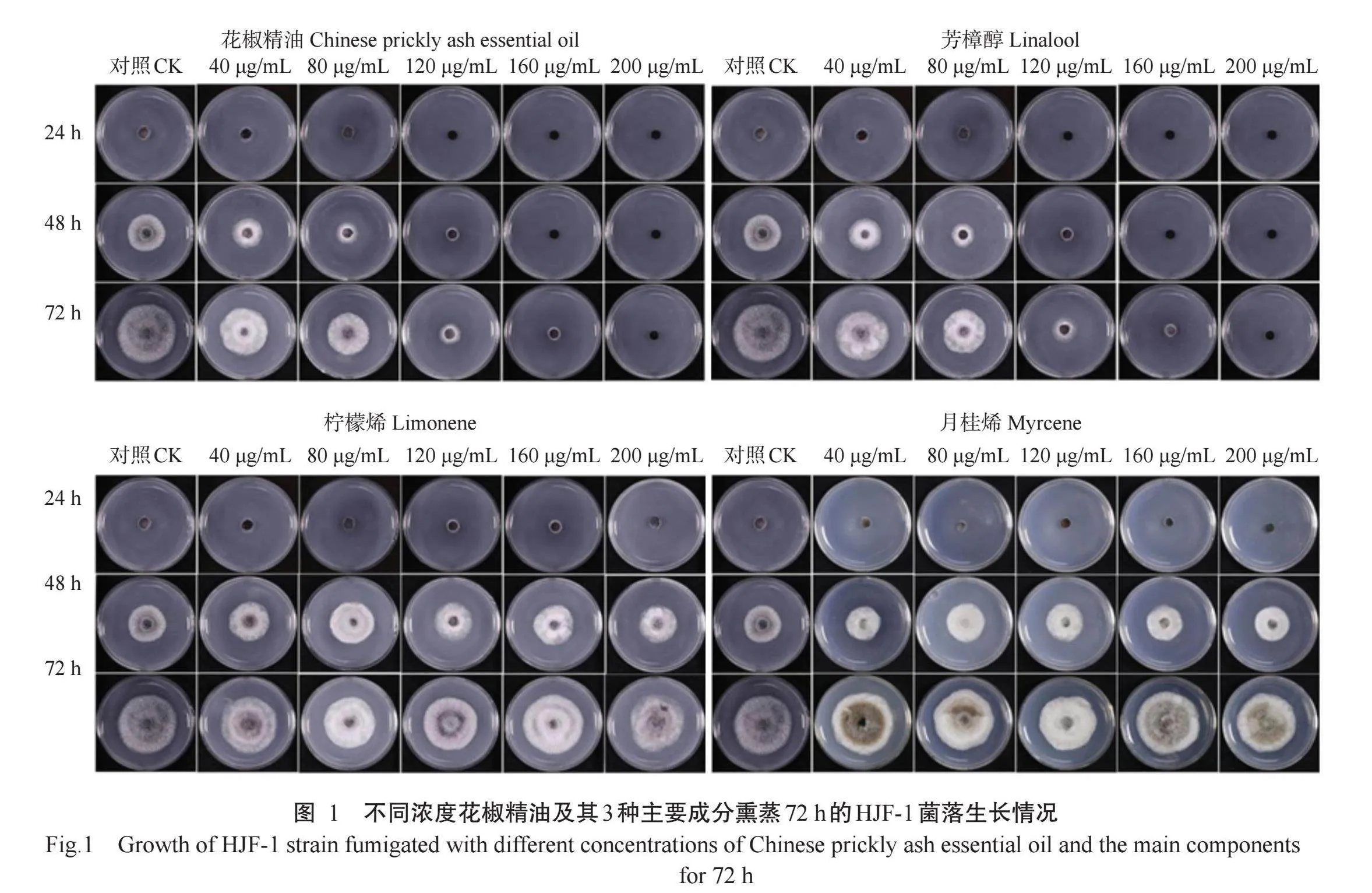
由图1可知,不同浓度的花椒精油及其3种主要成分熏蒸后,HJF-1菌落直径与对照之间存在明显差异,熏蒸抑菌效果表现为花椒精油>芳樟醇>月桂烯>柠檬烯。当熏蒸时间为24h时,不同浓度的花椒精油、芳樟醇、月桂烯和柠檬烯处理的菌饼均未形成明显的菌落;当熏蒸时间为48h时,120μg/mL浓度的花椒精油和芳樟醇处理的菌饼刚形成菌落,其直径分别为6.5和6.8 mm,而相同浓度柠檬烯和月桂烯处理的菌饼已形成较大菌落,其直径分别为21.5和22.4 mm,表明花椒精油和芳樟醇的抑菌效果强于柠檬烯和月桂烯,且花椒精油和芳樟醇的MIC均为160μg/mL。随着花椒精油或芳樟醇熏蒸浓度的逐渐升高,HJF-1菌落直径不断减小。以40~200μg/mL浓度梯度的花椒精油熏蒸72h时,HJF-1菌落直径分别为30.8、23.7、15.3、7.2和6.0 mm;而以同样浓度梯度的芳樟醇熏蒸72 h时,HJF-1菌落直径分别为31.8、24.2、16.2、7.7和6.3 mm,菌落直径与花椒精油和芳樟醇熏蒸浓度之间均呈一定的剂量效应关系。
根据花椒精油及其3种主要成分熏蒸72h后的HJF-1菌落直径,进一步计算不同精油对病原菌的生长抑制率。结果(图2)表明,不同浓度的花椒精油及其主要成分熏蒸对HJF-1菌丝生长的抑制率存在显著差异(r<0.05,下同),花椒精油和芳樟醇相对于柠檬烯和月桂烯的抑菌效果更强。当花椒精油和芳樟醇浓度为40μg/mL时,菌丝生长抑制率最低,分别为26.31%和23.34%,当2种精油浓度提高至200μg/mL时,菌丝生长抑制率最高,分别为99.10%和99.00%。随着精油浓度的不断升高,生长抑制率不断增大,二者呈剂量效应关系。在相同浓度下,花椒精油和芳樟醇对HJF-1菌丝生长的抑制率无明显差异,表明花椒精油的抑菌效果可能主要来自芳樟醇组分。
2.2花椒精油和芳樟醇熏蒸对菌株HJF-1的毒力评价
根据菌丝生长抑制结果,进一步评价花椒精油和芳樟醇对菌株HJF-1的熏蒸毒力。由表1可知,以精油对菌株HJF-1的抑菌率为y,以精油浓度的对数值为x建立回归方程,花椒精油和芳樟醇对应的相关系数分别为0.980和0.984,且均达显著水平,表明2个方程均能较好拟合精油浓度梯度与毒力效应变化之间的关系。此外,花椒精油对菌株HJF-1的EC50(85.98μg/mL)稍小于芳樟醇对菌株HJF-1的EC50(89.84μg/mL),表明花椒精油对病原菌的熏蒸毒力稍强于芳樟醇。
2.3花椒精油和芳樟醇熏蒸对菌株HJF-1孢子萌发的影响
图3-A显示,不同浓度花椒精油和芳樟醇熏蒸6 h后,菌株HJF-1的孢子萌发数量明显低于对照。图3-B显示,除0μg/mL外,花椒精油和芳樟醇浓度为40μg/mL时,菌株HJF-1孢子萌发率最高,分别为5.5%和7.4%;当2种精油浓度上升至200μg/mL时,菌株HJF-1孢子萌发率最低,分别为1.0%和1.2%,不同浓度花椒精油和芳樟醇处理的孢子萌发率均显著低于0μg/mL的萌发率,且各浓度处理间差异也达显著水平。此外,花椒精油熏蒸还能显著抑制菌株HJF-1孢子芽管伸长。除0μg/mL外,花椒精油和芳樟醇浓度为40μg/mL时,孢子芽管长度最大,分别为30.8和42.2μm,二者分别较0μg/mL显著降低44.7%和26.4%;当2种精油浓度提高至200μg/mL时,孢子芽管长度最小,分别为9.2和10.8μm,二者分别较0μg/mL显著降低83.5%和81.2%(图3-C)。由此可知,花椒精油和芳樟醇熏蒸不仅能影响病原菌菌丝生长,还能显著抑制其孢子萌发及芽管伸长。
2.4花椒精油和芳樟醇熏蒸对菌株HJF-1菌丝形态的影响
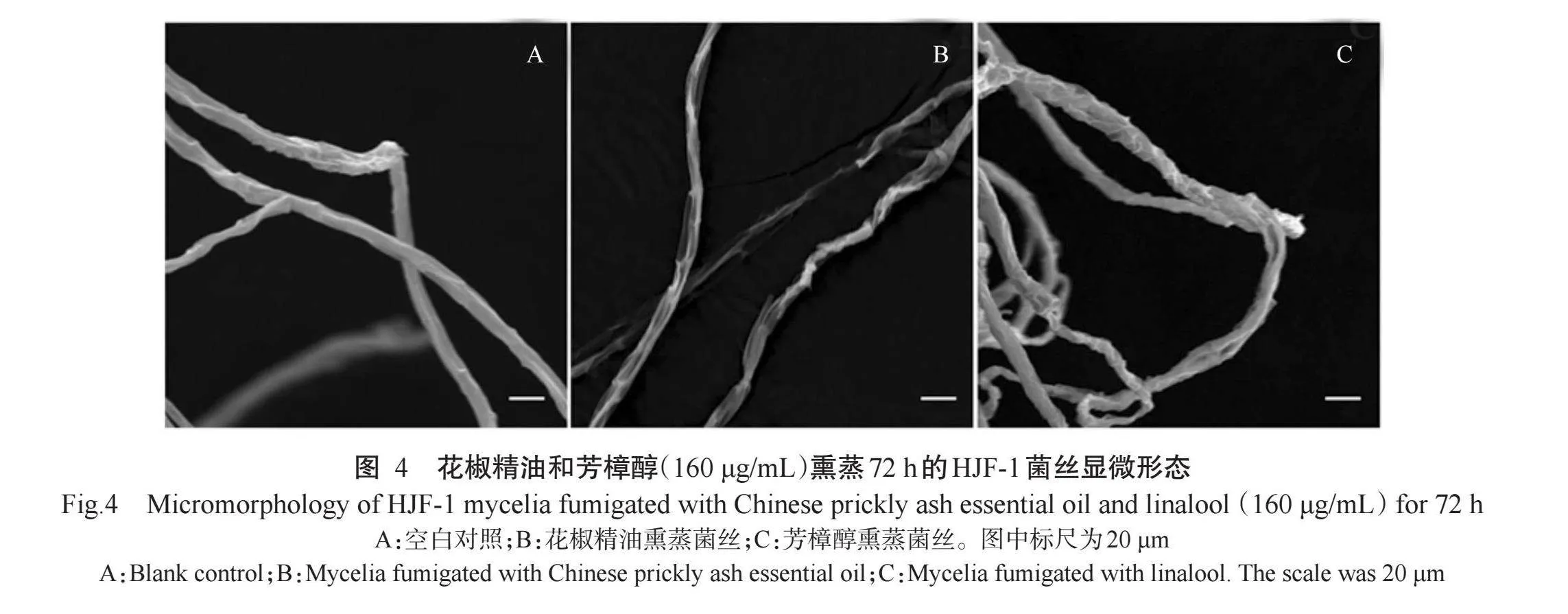
通过扫描电子显微镜观察160μg/mL(MIC)花椒精油和芳樟醇熏蒸72h后的HJF-1菌丝形态。结果表明,对照的菌丝表面平滑,菌丝舒展,边界清晰(图4-A);而花椒精油和芳樟醇熏蒸后HJF-1菌丝形态异常,表现为菌丝体膨胀、扭曲、表面粗糙、分枝增多变短等畸形,尤其是花椒精油熏蒸的菌丝甚至出现表面缺损、菌丝消解的现象(图4-B和图4-C)。由此可知,花椒精油和芳樟醇熏蒸对HJF-1菌丝细胞结构造成了不可逆的损伤,花椒精油熏蒸甚至造成菌丝体消解。
2.5花椒精油和芳樟醇熏蒸对菌株HJF-1细胞膜完整性的影响
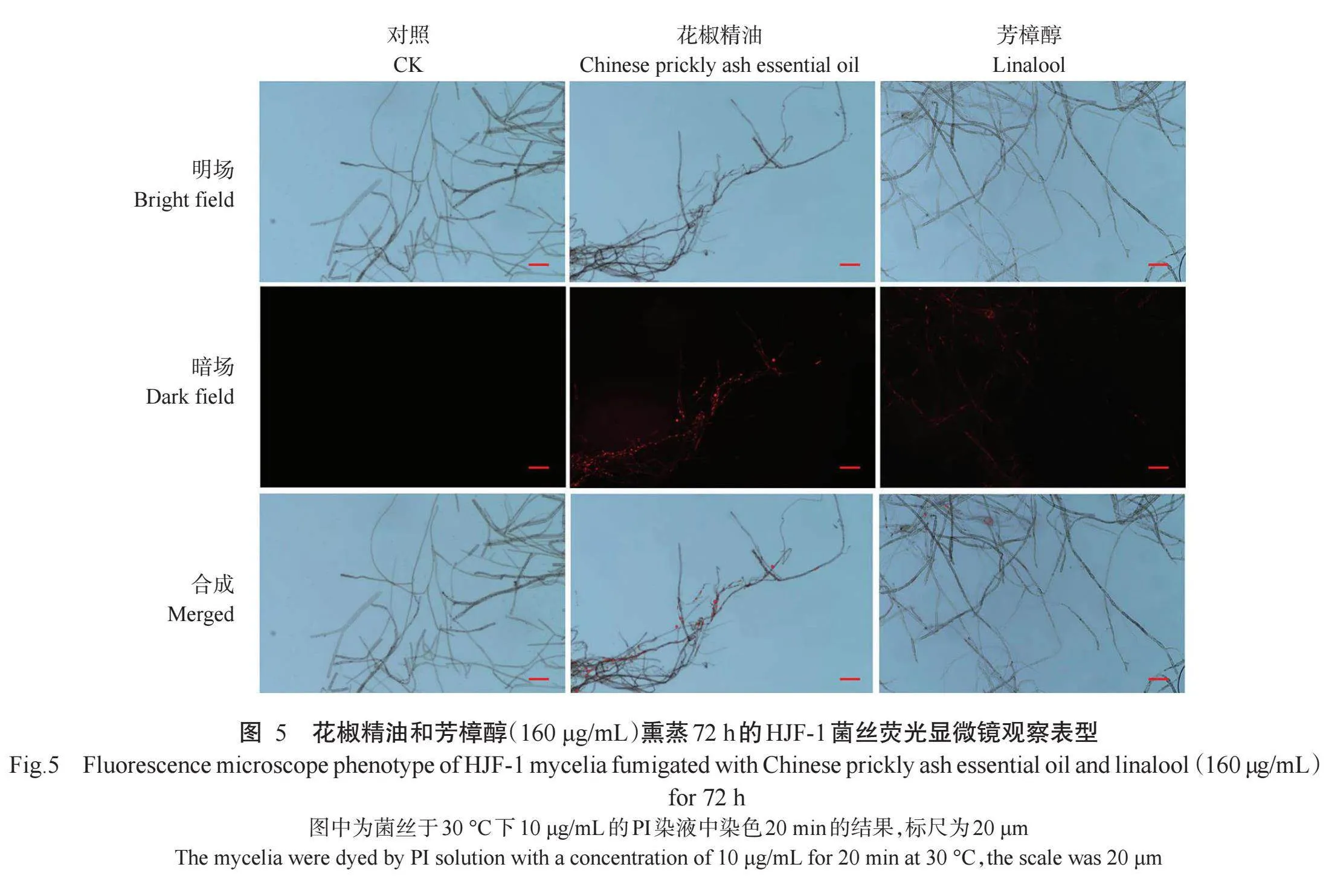
2.5.1 PI染色观察结果图5显示,经浓度160μg/mL(MIC)花椒精油和芳樟醇熏蒸72h后,HJF-1菌丝内均出现明显的红色荧光信号,并遍布于菌丝内部各个部位,而对照菌丝内部未见红色荧光信号。由此可知,PI荧光染料的渗入,可能是由于花椒精油和芳樟醇熏蒸破坏了病原菌菌丝的细胞膜完整性,进而造成细胞内含物泄露。另外,花椒精油熏蒸的菌丝荧光信号强度稍高于芳樟醇,表明花椒精油对病原菌菌丝细胞膜系统造成了更大损伤。
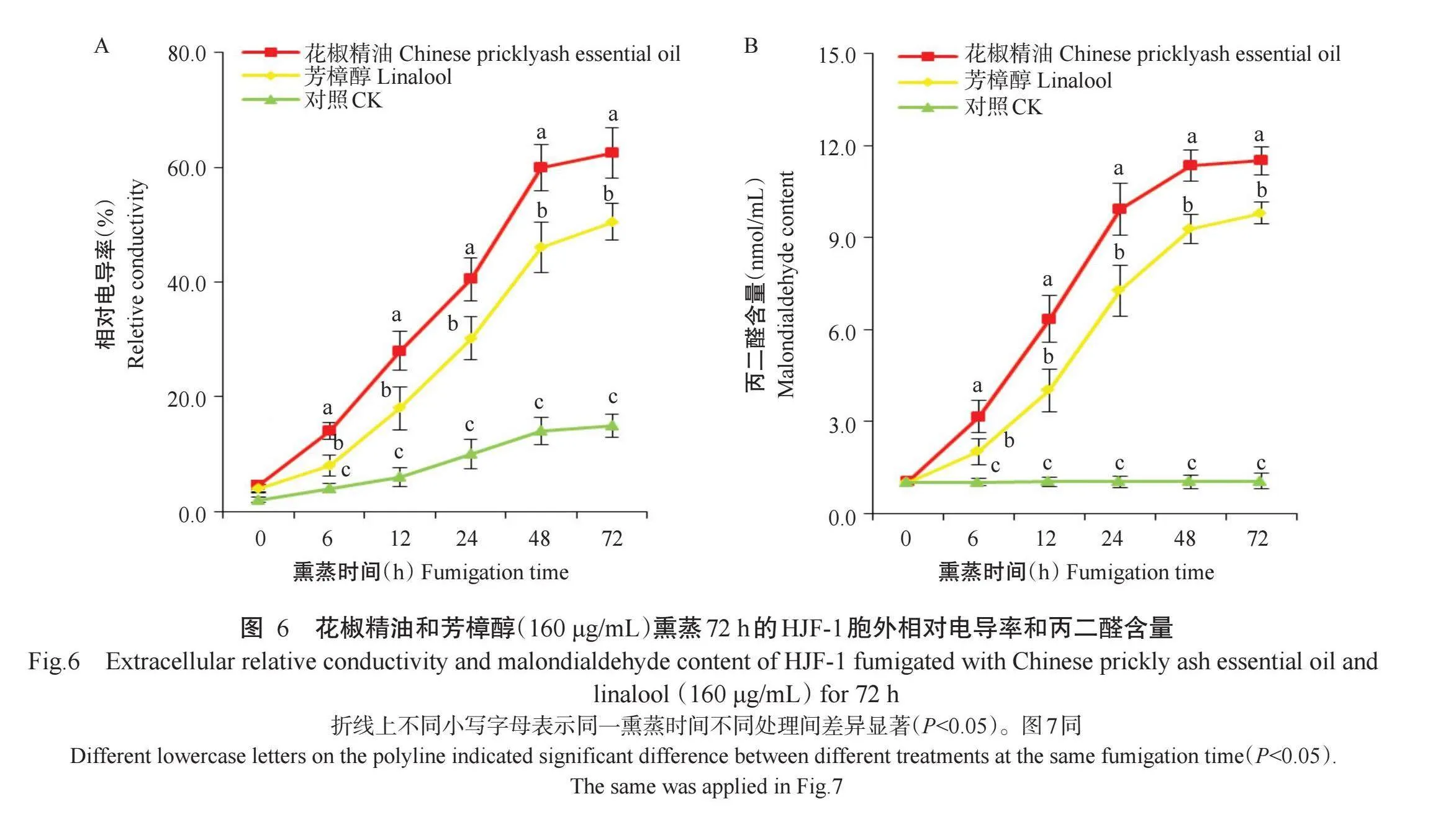
2.5.2胞外相对电导率和丙二醛含量如图6-A所示,以浓度160μg/mL(MIC)花椒精油和芳樟醇熏蒸6~72 h后,菌株HJF-1胞外相对电导率均显著高于对照;且随着熏蒸时间的不断延长,胞外相对电导率逐渐上升。在花椒精油和芳樟醇熏蒸24h时,胞外相对电导率大幅上升,分别为40.5%和30.2%,较熏蒸前增加8.0和6.6倍;熏蒸72h时,胞外相对电导率达最大值,分别为62.5%和50.5%,较熏蒸前增加12.9和11.6倍。
如图6-B所示,以浓度160μg/mL(MIC)花椒精油和芳樟醇熏蒸6~72 h后,HJF-1菌丝丙二醛含量也存在显著差异;且随着熏蒸时间延长,丙二醛含量逐渐上升。在花椒精油和芳樟醇熏蒸12h时,菌丝丙二醛含量大幅上升,分别为6.3和4.0 nmol/mL,较熏蒸前增加5.2和2.9倍;在2种精油熏蒸72h时,丙二醛含量达最大值,分别为11.5和9.8 nmol/mL,较熏蒸前增加10.2和8.6倍。表明花椒精油和芳樟醇熏蒸12h后,开始造成病原菌细胞膜严重氧化损伤,并提高细胞膜的通透性,继而对链格孢菌的生长萌发产生抑制作用。
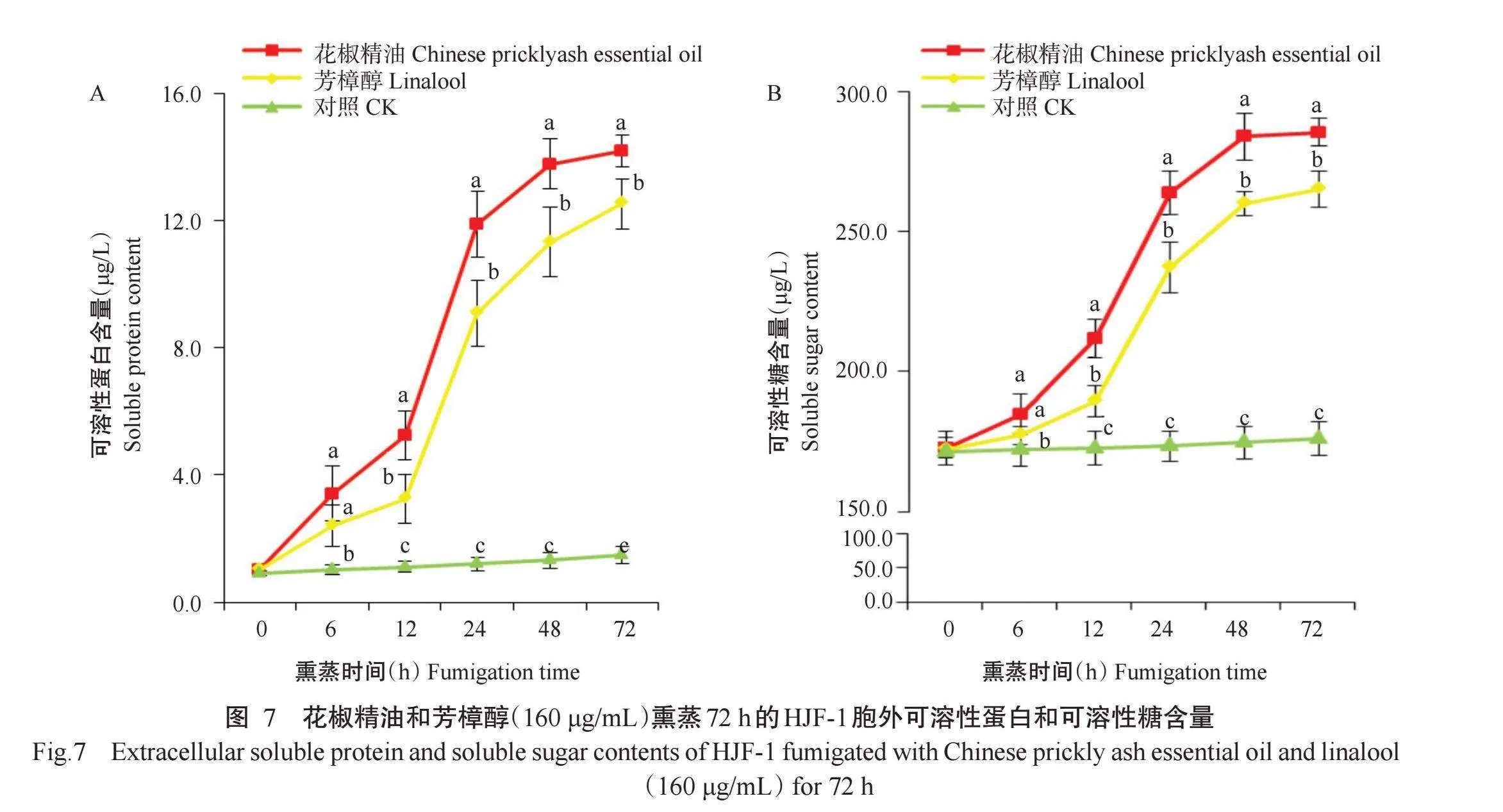
2.5.3胞外可溶性蛋白和可溶性糖含量如图7-A所示,以浓度160μg/mL(MIC)花椒精油和芳樟醇熏蒸6~72 h后,HJF-1的胞外可溶性蛋白含量与对照存在显著差异;且随着熏蒸时间延长,胞外可溶性蛋白含量逐渐上升。在花椒精油和芳樟醇熏蒸24 h时,胞外可溶性蛋白含量开始大幅度上升,分别为11.9和9.1μg/L,较熏蒸前增加10.7和7.8倍;在2种精油熏蒸72h时可溶性蛋白含量达最大值,分别为14.2和12.5μg/L,较熏蒸前增加13.0和11.1倍。
如图7-B所示,以浓度160μg/mL(MIC)花椒精油和芳樟醇熏蒸6~72 h后,HJF-1的胞外可溶性糖含量也均高于对照;且随着熏蒸时间延长,胞外可溶性糖含量逐渐上升。在花椒精油和芳樟醇熏蒸24 h时,胞外可溶性糖含量开始大幅上升,分别为263.8和237.2μg/L,较熏蒸前增加52.7%和37.8%;在2种精油熏蒸72 h时,胞外可溶性糖含量达最大值,分别为285.5和265.0μg/L,较熏蒸前增加65.2%和53.9%。表明花椒精油及芳樟醇熏蒸24 h后,病原菌细胞表面损伤,造成可溶性蛋白和可溶性糖等物质渗漏,以及细胞生理功能紊乱,最终导致病原菌生长停止。另外,不同物质渗漏结果也显示花椒精油对链格孢菌的破坏程度稍强于芳樟醇。
2.6花椒精油和芳樟醇熏蒸对菌株HJF-1致病力的影响
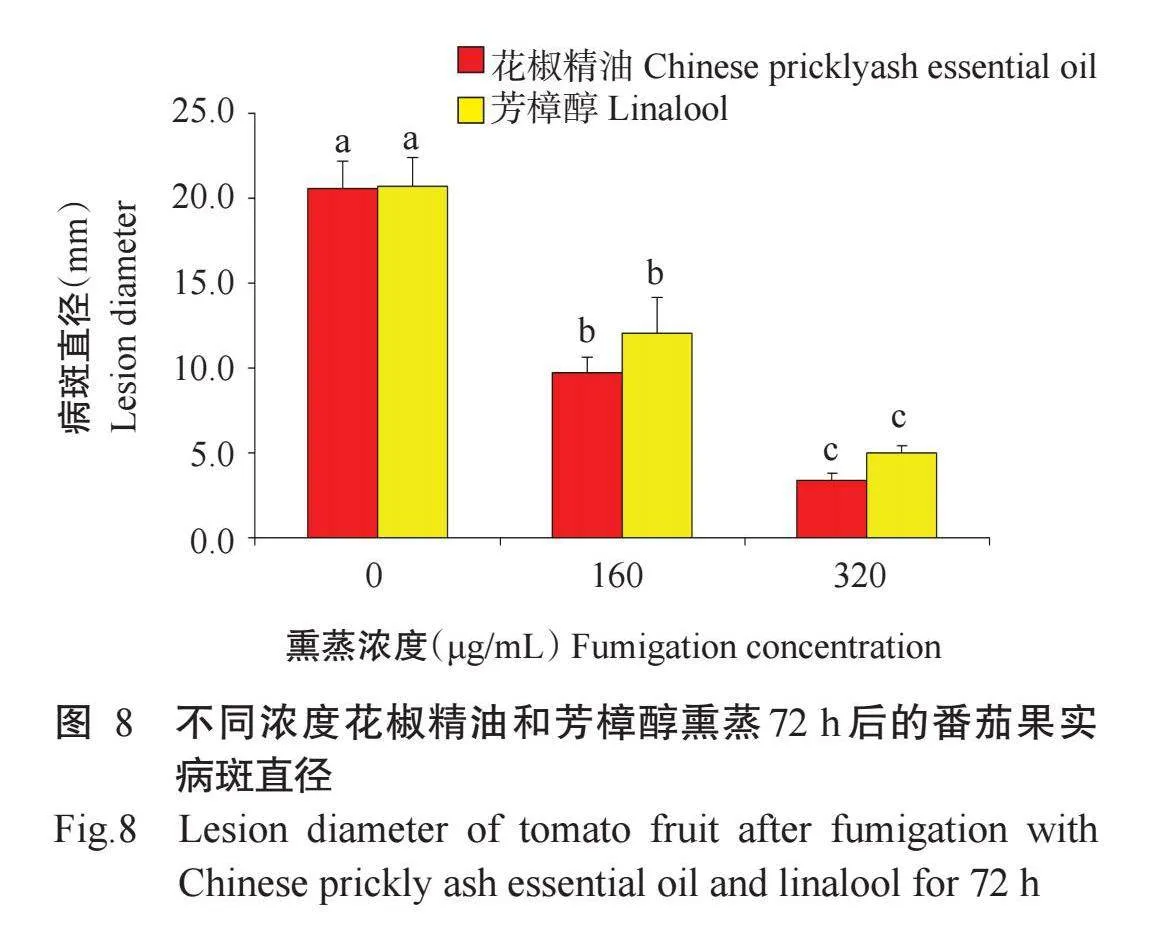
由图8可知,不同浓度花椒精油和芳樟醇熏蒸72 h后,番茄果实病斑直径存在显著差异,但相同浓度的花椒精油和芳樟醇处理的番茄果实间病斑直径差异不明显。当花椒精油和芳樟醇熏蒸浓度为160μg/mL(MIC)时,番茄果实病斑直径相对较大,分别为9.7和12.0 mm,其相对防效分别为53.3%和41.5%;熏蒸浓度为320μg/mL(2×MIC)时,二者的果实病斑直径相对较小,分别为3.3和5.0 mm,其相对防效分别为83.9%和75.6%。由此可知,花椒精油和芳樟醇熏蒸不仅能抑制番茄链格孢菌的生长萌发和细胞物质渗漏,还对其致病力产生显著抑制,且二者的病害防治效果相当。
3讨论
链格孢腐烂病是番茄的一种重大贮藏病害,通过生物抑菌剂熏蒸防治是目前该领域研究的热点(Tian et al.,2006)。花椒精油不仅广泛用于调料、香料和食品添加剂等,还可作为一种天然环保的抑菌物质进行多种植物病害的控制,是理想的果蔬采后熏蒸防腐剂选择之一(Yang et al.,2017;Raveau et al.,2020)。开展花椒精油及其主要成分对番茄链格孢腐烂病的防治效果与作用机理研究,对拓展利用植物源活性物质抑菌防腐具有理论与实践价值(Chouhan et al.,2017;Dehsheikhetal.,2020)。
前人研究表明,花椒精油对细菌和真菌生长均有显著抑制效果(Wang et al.,2020a)。宋丽雅等(2016)研究发现,花椒精油对金黄色葡萄球菌、大肠杆菌及白色念珠菌均具有显著抑制效果,其相应的MIC分别为7.5、7.5和10.0 mg/mL。本研究也得到类似结果,花椒精油和芳樟醇对番茄链格孢菌表现出显著抑制作用,其MIC为160μg/mL;相较于柠檬烯和月桂烯,花椒精油和芳樟醇对番茄链格孢菌的抑制效果更佳,以200μg/mL熏蒸72h后,菌丝生长抑制率分别达99.1%和99.0%。不同物质的抑菌效果存在差异可能是由病原菌对花椒精油不同成分的敏感性不同所造成。其中,花椒精油和芳樟醇的EC50分别为85.98和89.84μg/mL,表明花椒精油和芳樟醇能显著抑制病原菌生长,延缓病害发生。但本研究的EC50较王启方等(2023)研究中的EC50结果偏大,其原因可能是不同试验菌株对药剂的敏感性及试验处理方法(前人研究方法为直接触杀法)存在差异。另外,花椒精油的EC50略小于芳樟醇,显示前者对链格孢菌的毒力稍强于后者。
由于番茄链格孢菌多以分生孢子等繁殖体进行传播致病,孢子萌发的效率及快慢能显著影响病害发生的程度,因此抑制孢子萌发和芽管伸长也具有重要的病害防治意义(Ma etal.,2022)。王启方等(2023)的研究结果显示,芳樟醇对灰葡萄孢菌孢子萌发有显著抑制作用,且随着芳樟醇处理浓度的提高,抑制率不断升高。香叶醇处理12 h后也对甜橙酸腐病菌的孢子萌发具有显著抑制效果(翁甜等,2023)。本研究通过花椒精油和芳樟醇熏蒸也得到类似结果,经200 mg/mL花椒精油熏蒸6 h后,番茄链格孢菌孢子萌发率和芽管长度均显著低于对照,其孢子萌发率和芽管长度分别降低98.8%和83.5%,芳樟醇熏蒸6h后的孢子萌发率和芽管长度也分别降低98.7%和81.2%,表明花椒精油和芳樟醇能显著抑制链格孢菌孢子的萌发,阻断该病原菌的再侵染过程。
细胞膜是真菌细胞的重要结构,负责维持细胞的正常形态,调节细胞内环境稳定,参与细胞与外界物质的交换和信息传递过程,保障正常生命活动(Ju et al.,2022)。PI是一种核荧光染料,可通过破损表面进入细胞内,反映细胞的衰亡状况(Wang et al.,2022)。王启方等(2023)通过PI染色观察发现,芳樟醇处理后的灰葡萄孢菌内部呈红色荧光,细胞表现出衰亡现象。本研究中,以花椒精油和芳樟醇熏蒸72h的链格孢菌丝,经PI染色后内部也出现大量红色荧光信号,表明PI染料进入细胞内,病原菌进入衰亡状态。而扫描电镜观察结果也显示,花椒精油和芳樟醇熏蒸会导致菌丝膨胀、扭曲、边界模糊等,甚至发生表面消解,该现象也从另一角度印证了链格孢菌受到精油熏蒸抑制而发生衰亡的现象。
番茄链格孢菌经过熏蒸发生衰亡的原因也可从渗漏试验结果进行解释。丙二醛为细胞膜脂质过氧化产物,其浓度反映细胞膜的氧化损伤程度。本研究中,经花椒精油和芳樟醇熏蒸12h后,菌丝丙二醛含量呈大幅上升,较熏蒸前分别增加5.2和2.9倍,表明链格孢细胞膜受到了严重的氧化损伤。而细胞表面损伤的进一步危害则是引起胞内物质渗漏,包括可溶性蛋白质、可溶性糖和核酸等,导致胞外电导率不断增加,致病力下降,细胞死亡加速(胡晶鼎,2022)。本研究中,经花椒精油和芳樟醇熏蒸24 h后,链格孢菌胞外相对电导率开始大幅上升,较熏蒸前分别增加8.0和6.6倍,表明因细胞表面氧化造成损伤可能带来了胞内物质渗漏。而同样熏蒸处理也使胞外可溶性蛋白和可溶性糖含量在24h后开始大幅上升,最终在72h时,前者较熏蒸前分别增加13.0和11.1倍,后者较熏蒸前分别增加65.2%和53.9%。另外,2种精油熏蒸可使果实腐烂病斑直径显著减小,病原菌致病力降低,对链格孢腐烂病分别产生83.9%和75.6%的防治效果。综上可知,花椒精油和芳樟醇熏蒸造成细胞表面不可逆的破损,引起胞内物质渗漏,影响细胞正常的形态和生理活动,最终导致病原菌生长减缓和致病力丧失。
此外,花椒精油及芳樟醇还能引起病原菌的细胞膜组分合成减少、能量代谢系统紊乱及植株抗病系统的激活等生理生化变化。前人研究表明,随着芳樟醇处理浓度的增加,红色毛癣菌(Trichophyton rubrum)细胞膜麦角甾醇含量减少,芳樟醇抑制其细胞膜组分的合成(成福等,2022);芳樟醇处理可导致荧光假单胞菌(Pseudomonas fluorescens)和腐败希瓦氏菌(Shewanella putrefaciens)的三羧酸循环关键酶活性和Na+/K+-ATP酶活性显著下降,可干扰病原菌的能量合成代谢(郭俸钰,2021);花椒精油处理还可提高番茄水杨酸、茉莉酸、乙烯信号通路中相关防卫基因PR1、PIN2的表达(王丹,2015)。本研究仅分析了花椒精油及其主要成分对链格孢菌菌丝生长和孢子萌发的抑制作用及其对病原菌细胞破坏和致病力的影响,今后尚需深入开展上述物质对病原菌的生理代谢、致病基因表达及植物防卫反应的影响等研究,以期为番茄链格孢腐烂病的新型无公害生物防治药剂开发提供更科学的借鉴参考。
4结论
花椒精油及其主要成分芳樟醇通过抑制链格孢菌菌丝生长和孢子萌发而阻断病原菌侵染及延缓扩展,破坏细胞表面完整性而引起胞内物质渗漏及细胞功能紊乱,最终导致病原菌致病力下降。
参考文献(References):
成福,张秋寒,唐晓莲,王万能.2022.芳樟醇体外抗红色毛癣菌活性及机理研究[J].中国真菌学杂志,17(6):441-447.[Cheng F,Zhang Q H,Tang X L,Wang W N.2022.Study on the activity and mechanism of linalool against Trichophyton rubrum in vitro[J].Chinese Journal of Myco-logy,17(6):441-447.]doi:10.3969/j.issn.1673-3827.2022.06.001.
程志敏,陈彦荣,王建辉,刘冬敏,方芳,张博,牟鸣薇,谢雨菲,易金枝.2022.青花椒精油对致龋菌的体外抑菌活性[J].食品科学,43(21):70-77.[Cheng Z M,Chen Y R,Wang J H,Liu D M,Fang F,Zhang B,Mou M W,Xie Y F,Yi J Z.2022.Antibacterial activity of essential oils from Zanthoxylum schinifoliumSiebold&Zucc.againstcario-genic bacteria[J].Food Science,43(21):70-77.]doi:10.7506/spkx 1002-6630-20211216-187.
程作慧,田永明,樊芳芳,李锐,李生才,赵一航,杨琨.2020.迷迭香精油对朱砂叶螨保护酶活性的影响[J].甘肃农业大学学报,55(5):129-135.[Cheng Z H,Tian Y M,Fan F F,Li R,Li S C,Zhao Y H,Yang K.2020.The effects of Rosmarinus officinalis essential oil against Tetranychuscinnabarinus(Acari:Tetranychidae)on protective enzyme activities[J].Journal of Gansu Agricultural University,55(5):129-135.]doi:10.13432/j.cnki.jgsau.2020.05.015.
葛达娥.2020.丁香酚对链格孢霉的抑制作用及其在蓝莓保鲜中的应用[D].上海:上海海洋大学.[Ge D E.2020.The inhibitory of eugenol against Alternaria sp.and its application in blueberry preservation[D].Shanghai:Shang-hai Ocean University.]doi:10.27314/d.cnki.gsscu.2020.000632.
郭俸钰.2021.芳樟醇对荧光假单胞菌和腐败希瓦氏菌的抑菌机理研究[D].海口:海南大学.[Guo F Y.2021.Anti-bacterial mechanism of linalool against Pseudomonas fluo-rescens and Shewanella putrefaciens[D].Haikou:Hainan University.]doi:10.27073/d.cnki.ghadu.2021.000809.
胡晶鼎.2022.桂花纯露香气成分分析及芳樟醇的抗菌活性研究[D].咸宁:湖北科技学院.[Hu J D.2022.Analysis of aroma components in osmanthus pure dew and study on the antibacterial activity of linalool[D].Xianning:Hubei University of Science and Technology.]doi:10.27862/d.cnki.ghkxy.2022.000008.
凌丽晨.2021.贝莱斯芽孢杆菌S3-1对樱桃番茄采后果腐病的防治及果实保鲜的研究[D].上海:上海师范大学.[Ling L C.2021.Study on the control of cherry tomato harvest rot by Bacillus velezensis S3-1 and its fresh kee-ping effect[D].Shanghai:Shanghai Normal University.]doi:10.27312/d.cnki.gshsu.2021.001338.
刘全俊,付立新,张扬,李丰超,于航,李金梁,秦小萍.2022.坡柳种子精油对5种植物病原真菌的熏蒸活性及化学成分分析[J].南方农业学报,53(7):1935-1943.[Liu Q J,Fu L X,Zhang Y,Li F C,Yu H,Li J L,Qin X P.2022.Fumigant activity and chemical component analysis of essential oil of Dodonaeaviscosa seed against 5 patho-genic fungi[J].Journal of Southern Agriculture,53(7):1935-1943.]doi:10.3969/j.issn.2095-1191.2022.07.016.
罗怡华,张军军,桑延霞.2020.花椒精油提取工艺优化及其抗氧化性探究[J].广东化工,47(15):24-25.[Luo Y H,Zhang J J,Sang Y X.2022.Optimization of extraction pro-cess and activity of Zanthoxylum bungeanum essential oil[J].Guangdong Chemical Industry,47(15):24-25.]doi:10.3969/j.issn.1007-1865.2020.15.012.
蒲小龙,郭志雄,姚婷婷,秦军,徐世荣,潘东明.2017.水仙鳞茎膨大期各器官可溶性糖的含量及分布[J].热带作物学报,38(3):395-402.[Pu X L,Guo Z X,Yao T T,Qin J,Xu S R,Pan D M.2017.Soluble sugars content and distri-bution of different organs of Narcissus tazettaL.var.chi-nensis(M.Roem.)in bulb swelling stage[J].Chinese Jour-nal of Tropical Crops,38(3):395-402.]doi:10.3969/j.issn.1000-2561.2017.03.002.
乔镜澄,麻杰.2015.番茄黑斑病病原菌—链格孢菌的分离与鉴定[J].内蒙古农业大学学报(自然科学版),36(6):91-94.[Qiao J C,Ma J.2015.Isolation and identification of the patnogen of tomato Alternaria nail headspod[J].Jour-nal of Inner Mongolia Agricultural University(Natural Science Edition),36(6):91-94.]doi:10.16853/j.cnki.1009-3575.2015.06.016.
石志琦,沈寿国,徐朗莱,范永坚.2004.蛇床子素对植物病原真菌抑制机制的初步研究[J].农药学学报,6(4):28-32.[Shi Z Q,Shen S G,Xu L L,Fan Y J.2004.Inhibition mechanism of osthol to plant fungus pathogens[J].Chinese Journal of Pesticide Science,6(4):28-32.]doi:10.3321/j.issn:1008-7303.2004.04.006.
宋丽雅,倪正,樊琳娜,李婷,于群.2016.花椒抑菌成分提取方法及抑菌机理研究[J].中国食品学报,16(3):125-130.[Song LY,Ni Z,Fan L N,Li T,Yu Q.2016.Antibacterial effect and extraction method from chinese prickly ash[J].Journal of Chinese Institute of Food Science and Techno-logy,16(3):125-130.]doi:10.16429/j.1009-7848.2016.03.017.
王聪,沈浩,蒲国顺,任丽,李贞子,王军节.2021.花椒精油对苹果梨采后青霉病的控制及感官和质地品质的影响[J].食品与发酵工业,47(24):219-225.[Wang C,Shen H,Pu G S,Ren L,Li Z Z,Wang J J.2021.Control of Zanthoxy-lumbungeanum essential oil on postharvest blue mold of Pyrus bretchneidericv.Pingguoli and its effect on sensory and texture quality[J].Food and Fermentation Industries,47(24):219-225.]doi:10.13995/j.cnki.11-1802/ts.026922.
王丹.2015.花椒精油提高对青枯病抗性及促进番茄生长的效应研究[D].南京:南京农业大学.[Wang D.2015.Effect of Chinese prickly ash essential oil on improving theresis-tance to tomato bacterial wilt and promoting tomato growth[D].Nanjing:Nanjing Agricultural University.]
王启方,王晓云,李浩森,杨晓玉,张锐敏,巩彪,李秀明,史庆华.2023.芳樟醇对灰葡萄孢生长的影响及对番茄灰霉病的防控效果[J].应用生态学报,34(1):213-220.[Wang Q F,Wang X Y,Li H S,Yang X Y,Zhang R M,Gong B,Li X M,Shi Q H.2023.Effects of linalool on Botrytis cinerea growth and control of tomato gray mold[J].Chinese Journal of Applied Ecology,34(1):213-220.]doi:10.13287/j.1001-9332.202301.011.
翁甜,王昱晴,龙超安.2023.香叶醇对柑橘酸腐病菌的抑菌机制[J].食品科学,44(1):14-21.[Weng T,Wang Y Q,Long C A.2023.Inhibitory mechanism of geraniol against Geotrichum citri-aurantii in citrus[J].Food Science,44(1):14-21.]doi:10.7506/spkx 1002-6630-20220214-087.
许倩,牛希跃,李述刚,潘丽娜.2013.肉桂、大蒜精油对链格孢霉和青霉抑菌特性研究[J].食品工业,34(4):144-147.[Xu Q,Niu X Y,Li S G,Pan LN.2013.The research of cinnamon and garlic oil on antifungal properties of Alternaria sp.and Penicillium sp.[J].The Food Industry,34(4):144-147.]
赵焕兰,曹嘉灿,管媛媛,张苑珩,刘雯鑫,苗敏.2022.生防菌A4的鉴定及其对樱桃番茄采后主要病害的抑制作用[J].保鲜与加工,22(4):82-89.[Zhao H L,9Ww4qVV4vcv2gqfmxpJVvlalBhzDMS3pdrhnQ+ioyL0=Cao J C,Guan Y Y,Zhang Y H,Liu W X,Miao M.2022.Identification of biocontrol strain A4 and the inhibitory effects on main postharvest diseases of cherry tomato[J].Storage and Pro-cess,22(4):82-89.]doi:10.3969/j.issn.1009-6221.2022.04.011.
Chouhan S,Sharma K,Guleria S.2017.Antimicrobial activity of some essential oils—Present status and future perspec-tives[J].Medicines,4(3):58.doi:10.3390/medicines 4030058.
Dehsheikh A B,Sourestani M M,Dehsheikh P B,Mottaghi-pisheh J,Vitalini S,Iriti M.2020.Monoterpenes:Essential oil components with valuable features[J].Mini Reviews in Medicinal Chemistry,20(11):958-974.doi:10.2174/1389 557520666200122144703.
Falleh H,Ben Jemaa M,Saada M,Ksouri R.2020.Essential oils:A promising eco-friendly food preservative[J].Food Chemistry,330:127268.doi:10.1016/j.foodchem.2020.12 7268.
Ju J,Xie Y,Yu H,Guo Y H,Cheng Y L,Qian H,Yao W R.2022.Synergistic interactions of plant essential oils with antimicrobial agents:A new antimicrobial therapy[J].Criti-cal Reviews in Food Science and Nutrition,62(7):1740-1751.doi:10.1080/10408398.2020.1846494.
Luo J J,Ke J X,Hou XY,Li S S,Luo Q Y,Wu H J,Shen G H,Zhang Z Q.2022.Composition,structure and flavor mechanism of numbing substances in Chinese prickly ash in the genus Zanthoxylum:A review[J].Food Chemistry,373:131454.doi:10.1016/j.foodchem.2021.131454.
Ma D Y,Wang Z J,Chen Y C,Qi Z H,Wang H,Zhu YY,Luo X D.2022.Antifungal compounds of Chinese prickly ash against drug-resistant Candida albicans[J].Food Chemis-try:X,15:100400.doi:10.1016/J.FOCHX.2022.100400.
Ma Y,Tian J Y,Chen Y B,Chen M,Liu Y L,Wei A Z.2021.Volatile oil profile of prickly ash(Zanthoxylum)pericarps from different locations in China[J].Foods,10(10):2386.doi:10.3390/foods 10102386.
Raveau R,Fontaine J,Lounès-Hadj Sahraoui A.2020.Essentialoils as potential alternative biocontrol products against plSyXiFC4S1hkxs+rI15BR68EBeXv8ETj+/4IgsIUSZtc=ant pathogens and weeds:A review[J].Foods,9(3):365.doi:10.3390/foods9030365.
Slathia S,Sharma Y P,Hakla H R,Urfan M,Yadav N S,Pal S.2021.Post-harvest management of Alternaria induced rot in tomato fruits with essential oil of Zanthoxylum armatum DC[J].Frontiers in Sustainable Food Systems,5:679830.doi:10.3389/FSUFS.2021.679830.
Tian S P,Wan Y K,Qin G Z,Xu Y.2006.Induction of defense responses against Alternaria rot by different elicitors in harvested pear fruit[J].Applied Microbiology and Biotech-nology,70(6):729-734.doi:10.1007/s00253-005-0125-4.
Wang B,Li P R,Yang J J,Yong X H,Yin M,Chen Y,Feng X,Wang Q Z.2022.Inhibition efficacy of Tetradiumglabrifo-lium fruit essential oil against Phytophthora capsici and potential mechanism[J].Industrial Crops and Products,176:114310.doi:10.1016/j.indcrop.2021.114310.
Wang B,Sui J,Yu B,Yuan C,Guo L,Abd El-Aty A M,Cui B.2021.Physicochemical properties and antibacterial activity of corn starch-based films incorporated with Zanthoxylum bungeanum essential oil[J].Carbohydrate Polymers,254:117314.doi:10.1016/j.carbpol.2020.117314.
Wang T L,Li Y C,Bi Y,Zhang M,Zhang T T,Zheng X Y,Dong Y P,Huang Y.2020a.Benzyl isothiocyanate fumiga-tion inhibits growth,membrane integrity and mycotoxin production in Alternaria alternata[J].RSC Advances,10(3):1829-1837.doi:10.1039/c9ra09225k.
Wang Y C,Liu M H,Han X B,Zheng Y F,Chao J M,Zhang C S.2020b.Prickly ash seed kernel:A new bio-fumigation material against tobacco black shank[J].Agronomy,10(6):770.doi:10.3390/agronomy 10060770.
Yang J L,Sun C,Zhang Y Y,Fu D,Zheng X D,Yu T.2017.Induced resistance in tomato fruit byγ-aminobutyric acid for the control of Alternaria rot caused by Alternaria alter-nata[J].Food Chemistry,221:1014-1020.doi:10.1016/j.foodchem.2016.11.061.
Yu D,Wang J,Shao X,Xu F,Wang H.2015.Antifungal modes of action of tea tree oil and its two characteristic compo-nents against Botrytis cinerea[J].Journal of Applied Micro-biology,119(5):1253-1262.doi:10.1111/jam.12939.
(责任编辑王晖)
