野酿2号毛葡萄果实发育进程中苹果酸代谢规律及相关基因表达分析
2024-11-05覃红梅杨国顺梁晓文罗飞雄何建军




摘要:【目的】分析野酿2号毛葡萄果实发育进程中苹果酸代谢规律及相关基因表达情况,为提高野酿2号毛葡萄的酿造品质及优质葡萄酒生产提供参考依据。【方法】以5年生野酿2号毛葡萄为试验材料,于盛花后5~17周采集不同生长发育阶段果实,测定果实单粒重、pH、可溶性固形物和可滴定酸含量,采用高效液相色谱法测定果实中苹果酸、柠檬酸和酒石酸含量;使用酶标仪测定苹果酸代谢关键酶[苹果酸脱氢酶(NAD-MDH)、NADP-苹果酸酶(NADP-ME)和磷酸烯醇式丙酮酸羧化酶(PEPC)]活性;采用实时荧光定量PCR检测苹果酸代谢相关基因PEPC、MDH和ME的相对表达量,并分析3个基因与苹果酸含量的相关性。【结果】野酿2号毛葡萄果实单粒重在转色期前增长较快,转色期的果实pH、可溶性固形物、苹果酸含量分别是盛花后5周的1.03、1.36和2.38倍,盛花后11周可滴定酸含量达峰值,为35.68 mg/g。盛花后5~17周,野酿2号毛葡萄果实中酒石酸和柠檬酸含量变化不明显,而苹果酸含量变化幅度较大。盛花后8周,NAD-MDH和NADP-ME活性最高,分别为736.06和453.50 nmol/(g·min),幼果期PEPC活性较高。转色期果实中MDH基因的相对表达量是盛花后5周的1.62倍,而PEPC和ME基因的相对表达量均低于盛花后5周。相关分析结果表明,苹果酸含量与MDH基因呈极显著正相关(P<0.01),与PEPC基因呈显著正相关(P<0.05,下同),与ME基因呈显著负相关。【结论】野酿2号毛葡萄苹果酸含量变化是影响总酸变化趋势的主要因素,转色期是苹果酸含量由积累到降低的转折期,苹果酸含量受相关基因MDH、PEPC和ME表达调控。
关键词:野酿2号毛葡萄;果实不同发育阶段;苹果酸;酶活性;基因表达
中图分类号:S663.1文献标志码:A文章编号:2095-1191(2024)08-2332-10
Malic acid metabolism regulation and related genes expression VCVGugDZEF3ZTa6SaI165g==during berry development in Vitis heyneanacv.Yeniang No.2
QIN Hong-mei YANG Guo-shun LIANG Xiao-wen LUO Fei-xiong1*,HE Jian-jun2*
(1College of Horticulture,Hunan Agricultural University/Hunan Engineering and Technology Research Center for Grapes,Changsha,Hunan 410128,China;2Guangxi Academy of Special Crops/Laboratory of Germplasm Innovation andUtilization of Specialized Economic Crops in North Guangxi,Guilin,Guangxi 541004,China)
Abstract:【Objective】This study aimed to analyze the dynamics of malic acid metabolism and the expression patterns of related genes during berry development in Vitis heyneanacv.Yeniang No. provided reference for improving the brewing quality of V.heyneanacv.Yeniang No.2 and facilitating the production of high-quality wines.【Method】Five-year-old V.heyneanacv.Yeniang No.2 grapes were used as experimental materials,berries at different developmental stages were collected at 5-17 weeks after full bloom.The single berry weight,pH,soluble solids content(SSC)and titrata-ble acidity(TA)content were measured.High-performance liquid chromatography(HPLC)was employed to determine the contents of malic acid,citrate,and tartrate in the berries.Enzyme-linked immunosorbent assay(ELISA)was used to assess the activities of key enzymes in malic acid metabolism:activities of NAD-dependent malate dehydrogenase(NAD-MDH),NADP-malic enzyme(NADP-ME)and phosphoenolpyruvate carboxylase(PEPC).Real-time fluorescence quan-titative PCR was conducted to quantify the relative expression levels of genes related to malic acid metabolism(PEPC,MDHand ME),and the correlations between these genes and malic acid content were analyzed.【Result】The single berry weight of V.heyneanacv.Yeniang No.2 grapes increased rapidly before the veraisonstage.Duringveraison,pH,SSC and malic acid content of the berries were as 1.03,1.36,and 2.38 times as those of 5 week after full bloom respectively.The TA peaked at 11 weeks after full bloom,reaching 35.68 mg/g.From 5 to 17 weeks after full bloom,the contents oftartrate and citrate did not change greatly,while the malic acid content fluctua-ted greatly.The activities of NAD-MDH and NADP-ME peaked at 8 weeks after full bloom,with values of 736.06 and 453.50 nmol/(g·min)respectively,while PEPC activity was high during the early berry development stage.Duringveraison,the relative expression of MDH gene was as 1.62 times as that at 5 weeks after full bloom,while the relative expression levels of PEPC and ME genes werelower than that at 5 weeks after full bloom.Correlation analysis revealed extremely significant positive correlation be-tween malic acid content and MDH gene expression(P<0.01),significant positive correlation with PEPC gene expression(P<0.05,the same below),and significant negative correlation with ME gene expression.【Conclusion】Malic acid con-tent variation is the primary factor influencing the trend of total acidity in V.heyneanacv.Yeniang No.2 grapes.Theverai-son stage marks a transition from malic acid accumulation to degradation.The expression of related genes MDH,PEPC and ME regulates malic acid content during berry development.
Key words:Vitisheyneanacv.Yeniang No.2;different development stages of berries;malic acid;enzyme activity;gene expression
Foundation items:National Key Research and Development Program of China(2021YFD1200200);China Agricul-ture Research System(CARS-29-zp-9,CARS-29-22)
0引言
【研究意义】毛葡萄(Vitis heyneana)是葡萄属东亚种群中分布最广泛的种之一,截至2020年,广西毛葡萄栽培面积超过7986ha(谢林君等,2022)。目前有关毛葡萄的研究多集中在品种选育、种质资源调查、花色苷等果实品质分析方面(王西锐等,2000;成果等,2017;赵明等,2020)。酿酒葡萄总酸度最高的是东亚种群,其次是北美种群,欧亚种群最低,毛葡萄为低糖高酸种(江雨等,2017)。毛葡萄成熟果实味道较酸,其苹果酸含量高是主要原因之一。使用苹果酸含量高的果实酿制的葡萄酒具有未成熟苹果的酸味和涩味,且在葡萄酒后期贮藏时容易变酸或变质(朱磊等,2022)。因此,研究野酿2号毛葡萄果实苹果酸积累规律及与代谢酶的相关性,对提高野酿2号毛葡萄的酿造品质及优质葡萄酒生产具有重要意义。【前人研究进展】关于葡萄果实有机酸组分构成、含量和各组分代谢规律的研究已有较多报道(陈国品等,2014;郑丽静等,2015;陈晓丽,2019;李治苇等,2021)。根据成熟果实有机酸中含量最高的酸组分分类,可将果实分为三大类:酒石酸、苹果酸和柠檬酸优势型水果(陈发兴等,2005)。葡萄是酒石酸优势型水果,葡萄成熟果实中主要含有酒石酸、苹果酸及少量柠檬酸和琥珀酸。葡萄果实中的酒石酸在花后1个月内迅速积累,转移到液泡中储存(杨巧锋等,2023)。葡萄果实成熟过程中,酒石酸含量下降较少,未成熟葡萄果实酒石酸含量高于成熟果实(Weiet al.,2022)。苹果酸代谢贯穿整个葡萄果实生长发育过程,苹果酸对增加果实风味和提高酿酒质量具有重要意义。苹果酸参与葡萄果实中的三羧酸循环、糖酵解、呼吸作用等多个代谢过程,苹果酸是葡萄果实中含量较高且能被显著高效代谢的关键有机酸之一(Sweetman et al.,2009)。苹果酸代谢受苹果酸代谢关键酶的调控,其中苹果酸脱氢酶(NAD-dependent malate dehydrogenase,NAD-MDH)、NADP-苹果酸酶(Cytoplasmic NADP-dependent ma-lic enzyme,NADP-ME)、磷酸烯醇式丙酮酸羧化酶(Phosphoenolpyruvate carboxylase,PEPC)是参与果实苹果酸代谢的部分关键酶。苹果酸在葡萄浆果中的长期积累主要由NAD-MDH和PEPC这2种酶共同驱动,MDH和PEPC基因编码的蛋白酶主要参与苹果酸合成,ME基因的表达主要与苹果酸降解相关(王西成等,2017)。NAD-MDH活性在葡萄果实发育初期较高,发育中期降至最低,并在发育末期出现波动升高(Taureilles-Saurel et al.,1995)。因此,推测NAD-MDH活性变化与果实中苹果酸的合成和分解有关。裴英豪等(2020)通过研究酿酒葡萄赤霞珠果实发育过程中有机酸的积累规律,发现果实中可滴定酸、苹果酸和酒石酸含量的变化趋势相似,均为先上升后下降。Diakou等(2000)通过比较正常酸和低酸含量葡萄品种的酸度及酸代谢关键酶差异,结果表明2个品种果实之间的PEPC活性差异并未造成苹果酸含量差异,低pH品种果实PEPC活性显著高于正常pH品种。苹果酸代谢关键酶也参与了其他果树果实中苹果酸积累,如骏枣和酸枣果实中NAD-MDH活性与苹果酸含量呈显著正相关(马倩倩等,2017)。果梅品种荔波-3和荔波-11果实中苹果酸的积累差异主要由NAD-MDH、PEPC和NADP-ME活性协同变化引起(刘雅兰等,2017)。红宝石苹果在果实不同生长发育期以积累苹果酸为主,NADP-ME和NAD-MDH协同调节果实中苹果酸积累(杨光凯等,2023)。【本研究切入点】毛葡萄在广西分布广泛,其成熟果实中苹果酸含量高是导致其酿造品质不高的主要原因,目前关于其他葡萄品种有机酸合成代谢途径的研究已相对成熟,但是毛葡萄苹果酸的合成代谢途径仍存在诸多疑问,野酿2号是从广西野生毛葡萄中选育出的优良两性花毛葡萄品种(邹瑜等,2013),是目前广西毛葡萄的主栽品种,目前尚未见有关该品种果实中苹果酸积累规律及与相关基因表达分析的研究报道。【拟解决的关键问题】以野酿2号毛葡萄为试验材料,测定果实单粒重、pH、可溶性固形物和可滴定酸含量等指标,采用高效液相色谱(HPLC)法测定该品种果实发育过程中的苹果酸含量,使用酶标仪测定苹果酸代谢关键酶NADP-ME、NAD-MDH和PEPC活性,并采用实时荧光定量PCR检测果实苹果酸代谢相关基因PEPC、MDH和ME的相对表达量;分析3个基因与苹果酸的相关性,为提高野酿2号毛葡萄的酿造品质及优质葡萄酒生产提供参考依据。
1材料与方法
1.1试验材料
以种植于广西桂林市临桂区南边山镇东山基地的东亚种毛葡萄野酿2号(5年生)为试验材料,株行距为2.0 m×2.5 m,选取9穗生长一致、健壮无病虫害的果穗,挂牌标记,田间水肥管理和病虫害防治按照常规管理。
1.2试验方法
于盛花后5周开始采集样品,每周采集1次样品直至果实成熟期(盛花后17周)。采样时间为上午9:00-10:00,每次随机挑选大小相近、色泽一致的葡萄果粒,采集约250 g果粒。果实用铝箔采样袋包裹,一部分用液氮速冻后带回实验室,保存于-80℃超低温冰箱中备用;另一部分使用冰盒带回实验室用于测定果实品质、有机酸含量及苹果酸代谢相关酶活性。
1.3测定指标及方法
1.3.1果实理化性质测定使用电子天平(泉州货集贸易有限公司)测定果实单粒重;参考郭淑萍等(2022)的方法采用氢氧化钠酸碱滴定法测定可滴定酸含量;使用pH计(上海佑科仪器仪表有限公司)测定pH;采用电子糖度计(广州市爱宕科学仪器有限公司)测定可溶性固形物含量。
1.3.2果实有机酸含量测定葡萄果实中酒石酸、苹果酸和柠檬酸提取及含量测定参照胡志群等(2005)的方法。取0.2%磷酸10 mL在4℃低温下预冷20 min,准确称取1.000 g样品,装进已经预冷的0.2%磷酸中,旋涡混匀,在4℃条件下12000r/min离心10 min,若有沉淀悬浮则离心2次。用一次性注射器吸取1 mL待测液,经0.45μm微孔滤膜过滤后注入棕色进样瓶待测,使用LC-20A型高效液相色谱仪(日本岛津公司)测定酒石酸、苹果酸和柠檬酸含量。
色谱条件:色谱柱为InertSustain C18柱(5μm,4.6 mm×250 mm),流动相为甲醇∶0.2%磷酸=4∶96,流速1.0 mL/min,进样量10μL,柱温30℃,检测器为SPD-20A紫外检测器,检测波长210nm。以标准溶液浓度(mg/L)为横坐标,峰面积(mAU·min)为纵坐标,确定出峰时间绘制标准曲线,利用标准曲线计算样品的酸含量。试验所用苹果酸为分析纯(AR≥99.5%),色谱级磷酸。标准曲线回归方程线性关系良好,符合分析方法的要求(表1)。
1.3.3果实苹果酸代谢相关酶活性测定采用酶活试剂盒(苏州格锐思生物科技有限公司)测定酶活性。称取0.100 g粉末果实样品,加入1 mL提取液,进行冰浴匀浆。4℃条件下12000r/min离心10min,取上清液置于冰上待测。酶活性反应体系总体积为200μL,加入相应的反应底物后使用酶标仪测定其吸光度,重复3次记录吸光度变化,按样本鲜重计算,酶活性以每克鲜样组织在反应体系中每分钟生成1nmol NADP-ME、NAD-MDH和PEPC表示。
1.3.4果实苹果酸代谢相关基因表达水平测定葡萄果实总RNA的提取使用多糖多酚植物专用RNA提取试剂盒Quick RNA Isolation Kit(北京华越洋生物科技有限公司)。以提取的果实总RNA为模板,按照SuperScript gDNA Removal cDNA Synthesis Kit试剂盒(北京华越洋生物科技有限公司)说明书反转录合成第一链cDNA。
采用MonAmpTMSYBR®Green qPCR Mix试剂盒[莫纳(苏州)生物科技有限公司]对果实苹果酸代谢相关基因PEPC、MDH和ME表达特性进行实时荧光定量PCR检测。以UBI(XM_002266714.1)为葡萄内参基因,引物序列信息见表2(王西成等,2017),内参及目的基因引物均委托武汉天一辉远生物科技有限公司合成。反应体系10.0μL:cDNA模板1.0μL,上、下游引物各0.4μL,MonAmpTMSYBR®Green qPCR Mix 5.0μL,ddH2O补足至10.0μL。扩增程序:95℃预变性h4nP/nq3zz2b6mwLOpg+aA6/cdiEEeBJESvoHWT/ctA=1 min;95℃10 s,60℃20 s,72℃30 s,进行40个循环。重复3次。采用2-∆∆Ct方法计算目的基因的相对表达量(Livak and Schmitt-gen,2001)。
1.4统计分析
采用Excel 2016和SPSS 27.0处理试验数据并进行显著性分析,使用Origin 2022制图。
2结果与分析
2.1野酿2号毛葡萄果实发育过程中单粒重变化趋势
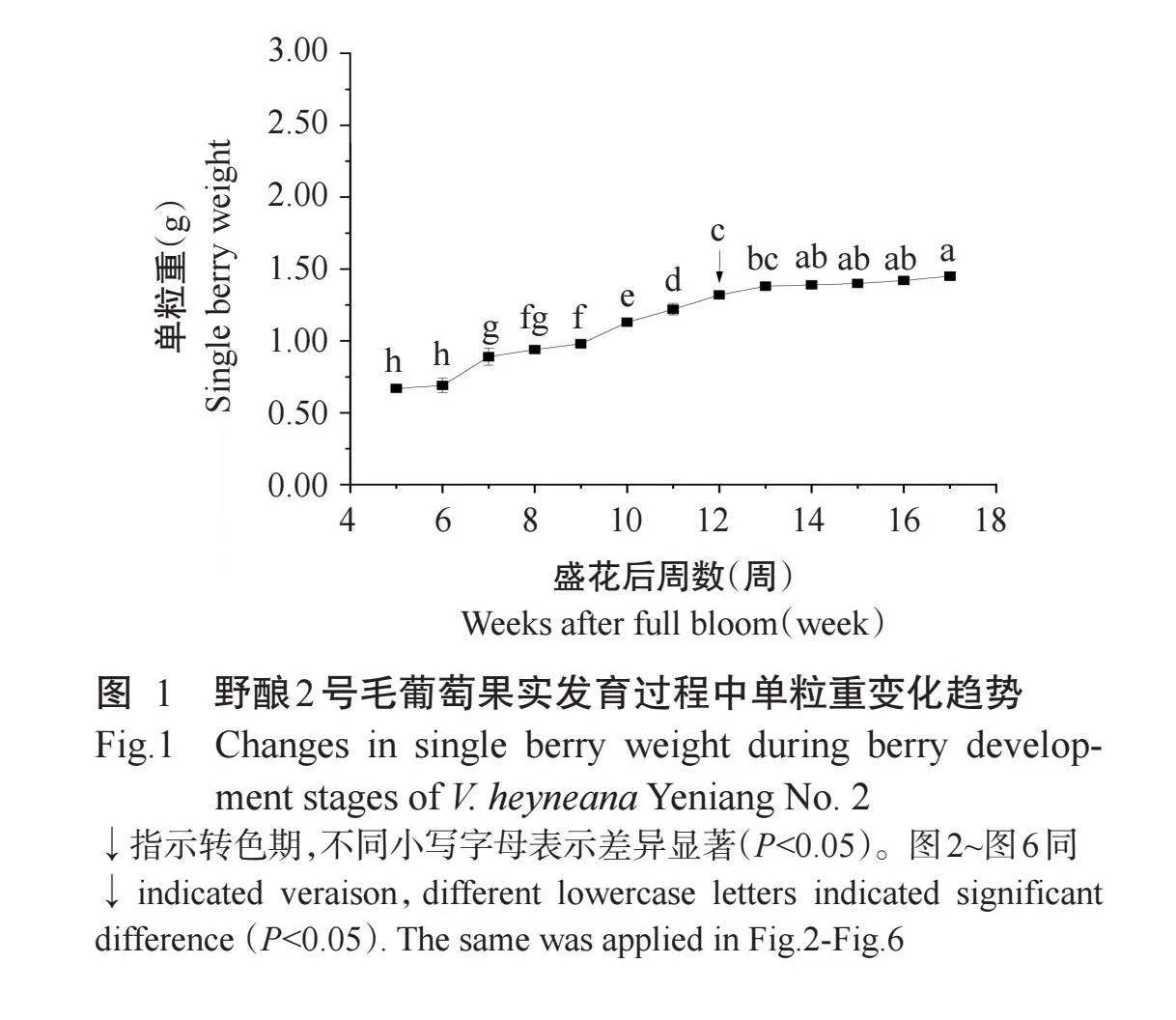
由图1可知,随着野酿2号毛葡萄果实逐渐成熟,果实单粒重逐渐增加,转色期前单粒重增加速度较快,转色期后增速减缓。野酿2号果粒较小,最大单粒重为1.45 g。
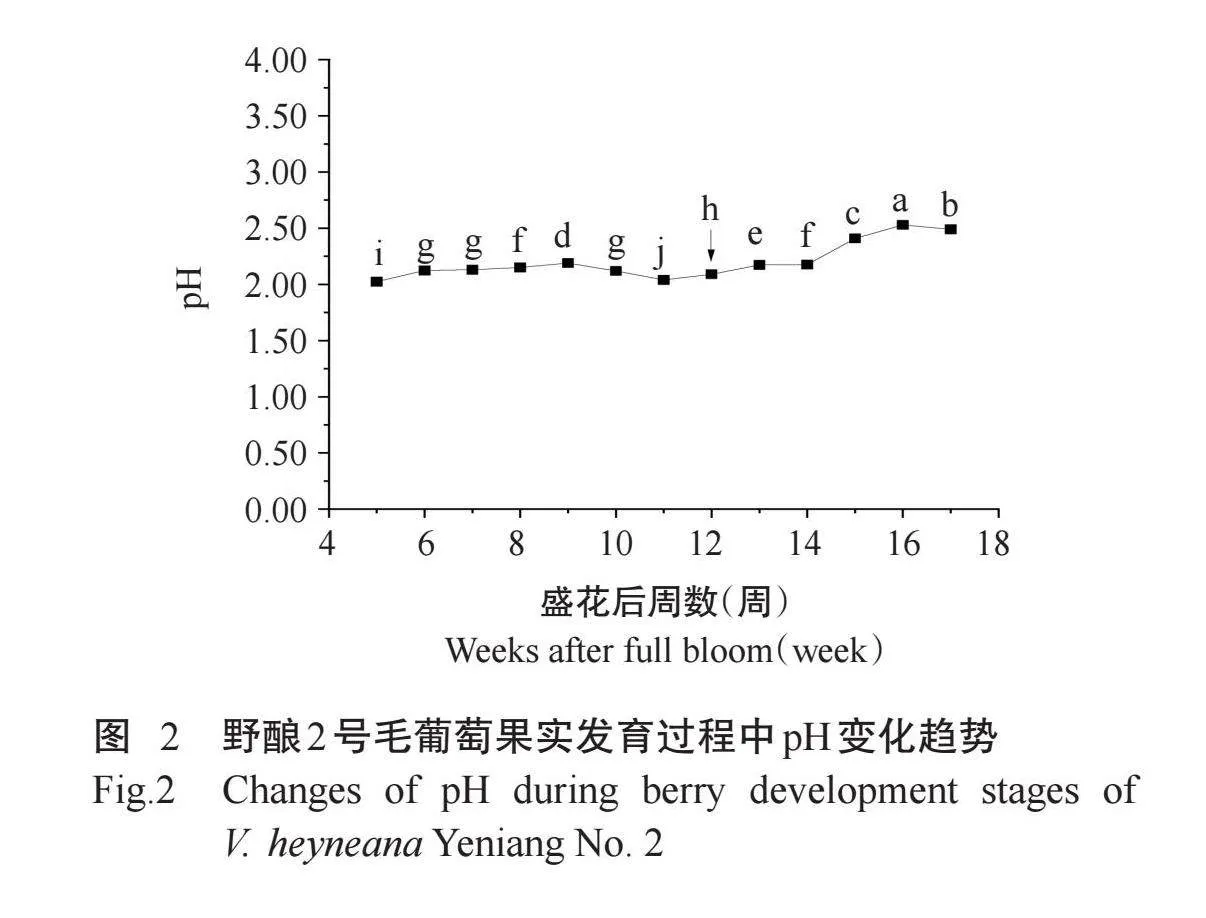
2.2野酿2号毛葡萄果实发育过程中pH变化趋势
由图2可知,盛花后6~10周和12~17周野酿2号毛葡萄果实pH显著高于盛花后5周(P<0.05,下同)。从采样开始到果实成熟,pH整体上呈升高趋势,盛花后16周果实pH达到峰值,为2.53。转色期果实pH是盛花后5周的1.03倍,成熟期果实pH较盛花后5周、转色期分别显著升高16.06%和18.88%。
2.3野酿2号毛葡萄果实发育过程中可溶性固形物含量变化趋势
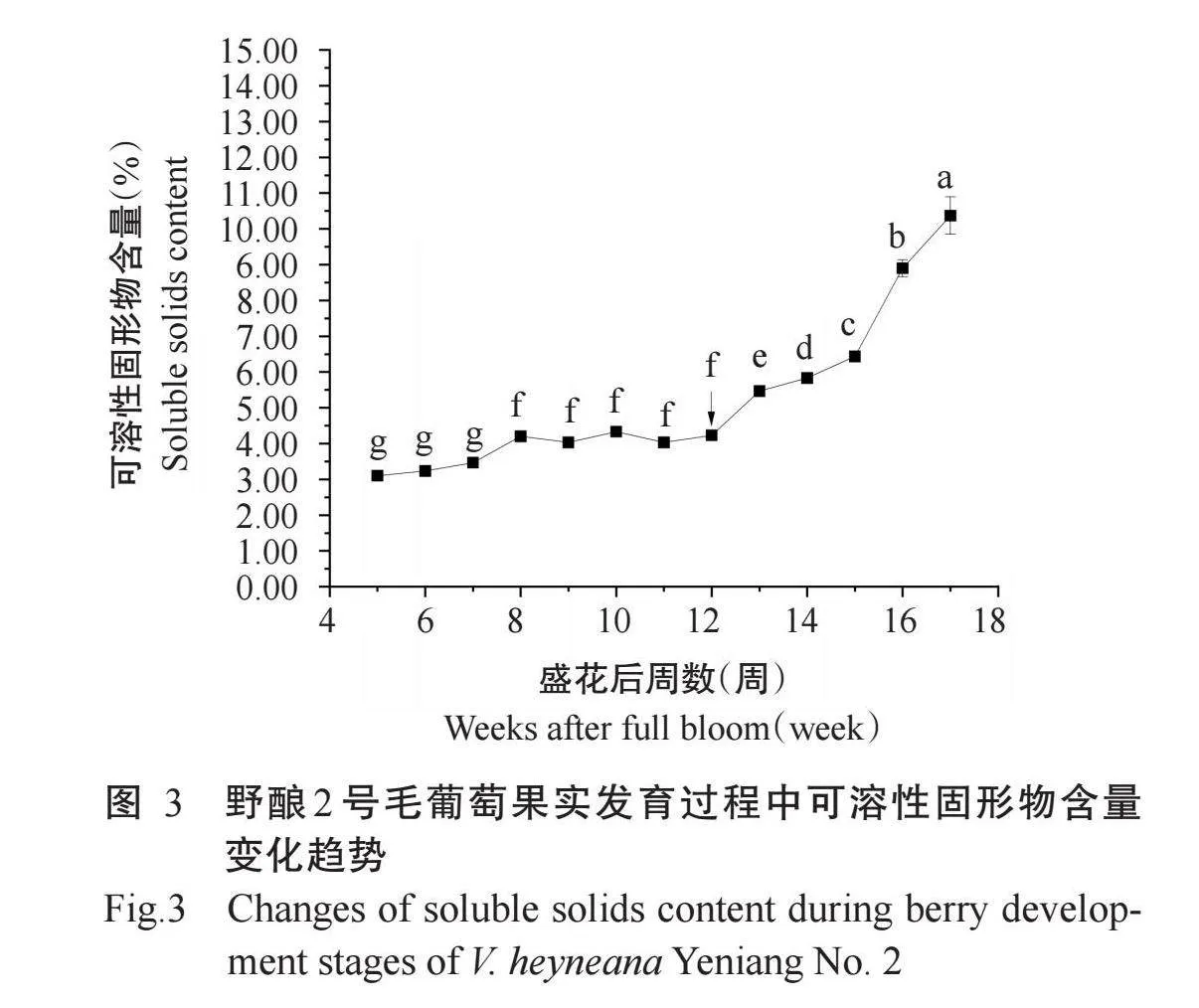
由图3可知,盛花后5~17周,野酿2号毛葡萄果实中可溶性固形物含量整体上持续升高,转色期前升高幅度较小,转色期后升高幅度增加。转色期后1周至成熟期果实可溶性固形物含量显著高于盛花后5~12周。转色期果实可溶性固形物含量是盛花后5周的1.36倍,成熟期果实可溶性固形物含量最高,为10.37%,较盛花后5周果实可溶性固形物含量高234.52%。
2.4野酿2号毛葡萄果实发育过程中酸含量变化趋势
野酿2号毛葡萄果实可滴定酸含量呈先升高后降低的变化趋势(图4-A)。随着果实的发育成熟,除盛花后10周可滴定酸含量与盛花后9周无显著差异外(P>0.05),自盛花后5周开始至转色前1周(盛花后11周),果实可滴定酸含量显著升高,盛花后11周达峰值,为35.68 mg/g,较盛花后5周增加96.15%。转色期果实中可滴定酸含量是成熟期的2.32倍。盛花后11周开始,果实可滴定酸含量逐渐降低。成熟期果实可滴定酸含量降至13.60 mg/g。由图4-B可知,盛花后5~12周,该品种果实苹果酸含量持续积累,盛花后12周(转色期)达到峰值,为24.75 mg/g,转色期后果实苹果酸含量开始下降,成熟期降至最低值,为8.28 mg/g,与最高值相比下降66.55%。盛花后5周至转色期,该品种葡萄果实苹果酸含量升高138.29%。转色期该品种果实苹果酸含量显著高于盛花后5周和成熟期果实苹果酸含量,分别是盛花后5周、成熟期果实苹果酸含量的2.38和2.99倍。野酿2号毛葡萄果实中可滴定酸和苹果酸含量变化趋势相似,均呈先升高后降低的变化趋势,分别在转色期前1周和转色期含量达到最高值,转色期后含量迅速下降(图4-A和图4-B)。
由图4-C可知,盛花后5~17周,野酿2号毛葡萄果实中酒石酸和柠檬酸含量变化不明显,而苹果酸含量变化幅度较大,说明苹果酸含量变化是影响可滴定酸含量变化趋势的关键因素。果实中酒石酸含量在果实发育过程中起伏变化,盛花后5周含量最高,为18.32 mg/g,成熟期含量最低,为14.15 mg/g,下降22.76%。转色期后1周,果实中柠檬酸含量达到峰值,为2.12 mg/g,成熟期降至1.38 mg/g,降低34.91%。转色期,果实中苹果酸含量(24.75 mg/g)明显高于酒石酸和柠檬酸,分别为同一时期酒石酸和柠檬酸含量的1.63和11.85倍。盛花后5周和成熟期,果实中酒石酸含量最高,其次是苹果酸,柠檬酸含量最低。
2.5野酿2号毛葡萄果实发育过程中苹果酸代谢关键酶活性变化趋势
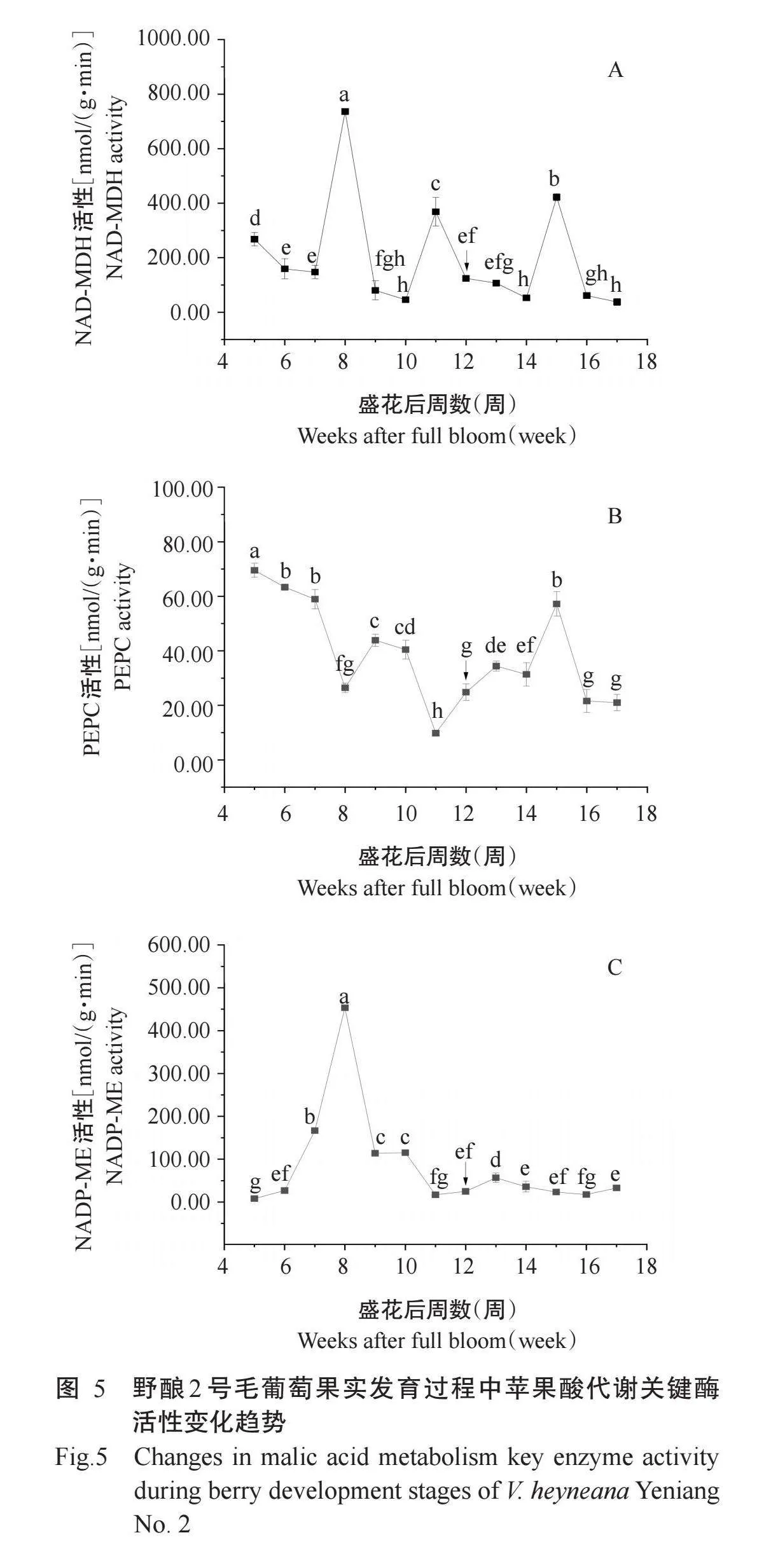
由图5-A可知,野酿2号毛葡萄果实的NAD-MDH活性呈起伏波动变化趋势,盛花后8周,果实中酶活性最高,为736.06 nmol/(g·min),转色期NAD-MDH活性为124.16 nmol/(g·min)。成熟期NAD-MDH活性最低,为37.64 nmol/(g·min),显著低于盛花后5周和转色期。
由图5-B可知,野酿2号毛葡萄果实PEPC活性变化趋势呈波动变化趋势。幼果期(盛花后5~7周)PEPC活性较高,盛花后5~8周,果实中PEPC活性持续降低,转色前1周PEPC活性最低,为9.79 nmol/(g·min)。随着果实成熟,盛花后11~15周,果实PEPC活性整体上呈持续升高趋势,盛花后15~16周PEPC活性大幅降低。转色期和成熟期果实PEPC活性显著低于盛花后5周。
由图5-C可知,盛花后5~17周野酿2号毛葡萄果实中NADP-ME活性呈先升高后降低的变化趋势。盛花后5~8周,野酿2号果实NADP-ME活性显著升高,盛花后8周,NADP-ME活性最高,为453.50 nmol/(g·min),盛花后8~17周总体呈波动下降趋势。转色期和成熟期果实NADP-ME活性均显著高于盛花后5周。成熟期NADP-ME活性为32.86 nmol/(g·min)。转色期、成熟期果实中NADP-ME活性分别是盛花后5周的3.09和4.09倍。
2.6野酿2号毛葡萄果实发育过程中苹果酸代谢相关基因表达情况
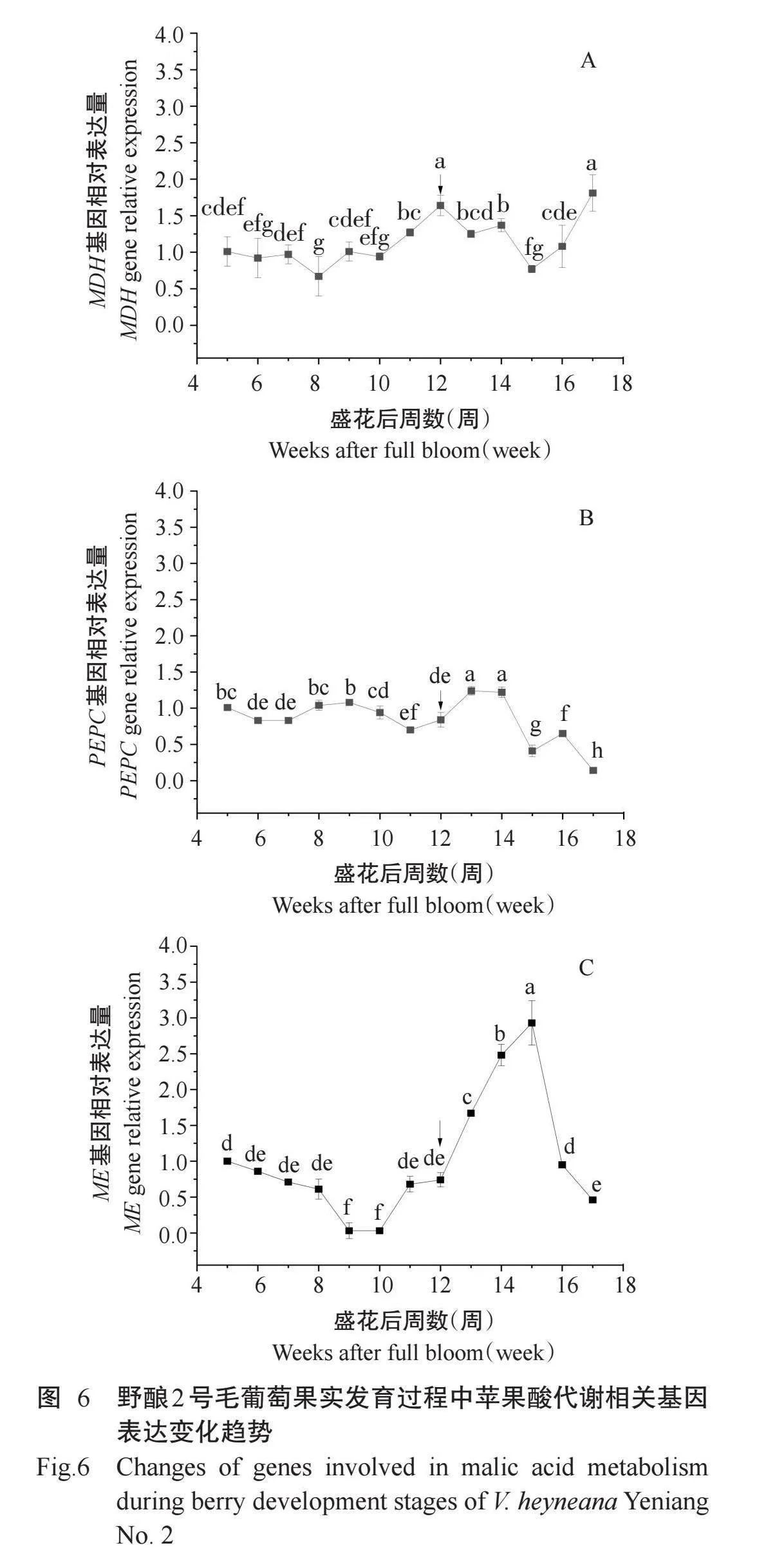
由图6-A可知,野酿2号毛葡萄果实中MDH基因的相对表达量整体上呈先降低后升高再降低再升高的起伏变化趋势。盛花后8周至转色期,果实中MDH基因的相对表达量整体上呈升高趋势,转色期果实中MDH基因的相对表达量较盛花后8周显著增加144.32%转色期果实中MDH基因的相对表达量是盛花后5周的1.62倍,且达到显著差异水平。成熟期果实中MDH基因的相对表达量最高,显著高于除转色期外的11个调查日期。
由图6-B可知,盛花后5~7周和9~11周,野酿2号毛葡萄果实中PEPC基因的相对表达量呈下降趋势,盛花后7~9周和11~13周果实中PEPC基因相对表达量呈上升趋势,盛花后13~17周果实中PEPC基因的相对表达量整体上呈降低趋势,盛花后14~15周和16~17周下降幅度较大。转色期后1周即盛花后13周,果实中PEPC基因的相对表达量最高。转色期与成熟期果实PEPC基因的相对表达量均显著低于盛花后5周,分别显著降低16.80%和86.34%。
由图6-C可知,野酿2号毛葡萄在果实生长发育过程中,ME基因的相对表达量整体上呈先下降后上升再下降的变化趋势,盛花后5~9周果实中ME基因相对表达量持续降低,10~15周该基因的相对表达量大幅度升高,盛花后15~17周该基因的相对表达量大幅度下降,到成熟期,果实中ME基因相对表达量显著低于盛花后5周。转色期至盛花后15周,果实中ME基因的相对表达量呈近直线上升趋势,盛花15周之后ME基因的相对表达量又呈近直线下降趋势。成熟期果实中ME基因的相对表达量显著低于盛花后5周。
2.7苹果酸代谢相关基因与苹果酸含量的相关分析结果
由表3可知,野酿2号毛葡萄果实中3个苹果酸代谢相关基因与苹果酸含量均拟合为一次方程。MDH基因与苹果酸含量呈极显著正相关(P<0.01),相关系数为0.849;PEPC基因与苹果酸含量呈显著正相关,相关系数为0.602;ME基因与苹果酸含量显著负相关,相关系数为-0.123。
3讨论
成熟果实中苹果酸含量是酿酒葡萄品种的重要品质指标(刘蕊等,2013),苹果酸在评估葡萄酒质量方面发挥着重要作用,研究毛葡萄果实中苹果酸的积累规律对葡萄酒酿造具有重要意义。苹果酸较酒石酸受温度、湿度等环境因素影响更大,且热敏性高于酒石酸。本研究通过测定野酿2号毛葡萄不同生长发育期果实中有机酸含量,研究苹果酸动态变化规律,结果表明在转色期前,果实中可滴定酸和苹果酸含量呈上升趋势,转色期达到最大值,与美乐葡萄果实中有机酸含量变化规律相似(李治苇等,2021)。Ruffner和Hawker(1977)研究发现欧亚种葡萄苏丹娜果实转色前1周苹果酸含量最高,为120.0 mmol/kg,盛花后10周苹果酸含量最低,为3.2 mmol/kg,果实苹果酸含量下降97.33%。而本研究中野酿2号毛葡萄果实转色期苹果酸含量最高,为24.75 mg/g,成熟期苹果酸含量最低,为8.28 mg/g,苹果酸含量下降66.55%。转色期前后野酿2号毛葡萄果实中苹果酸含量下降幅度明显小于欧亚种葡萄苏丹娜,推测这是导致毛葡萄成熟果实中苹果酸含量较高的原因。本研究中野酿2号毛葡萄成熟期果实有机酸中含量最高的是酒石酸,其次是苹果酸,柠檬酸含量最低,与在鲜食葡萄果实发育过程中有机酸组分的积累规律一致(任言等,2024)。野酿2号毛葡萄苹果酸含量变化是影响总酸变化趋势的主要因素,转色期开始果实苹果酸含量下降幅度较大,而可溶性固形物含量在转色期开始大幅度升高,因此造成转色期苹果酸含量下降的原因可能是苹果酸被分解参与糖分积累,三羧酸循环与果实体积增大导致苹果酸含量下降(问亚琴等,2009);其次,也可能是由于葡萄成熟期正值炎热夏季,总酸和苹果酸含量代谢及降解速率较快,导致苹果酸含量降低(Reshefetal.,2022)。
果实生长过程中逐渐积累苹果酸,当果实生长发育减缓时,果实会逐渐变软,苹果酸含量也会迅速降低。葡萄果实苹果酸代谢过程复杂,受多个基因及相关酶综合调控,苹果酸的积累水平取决于苹果酸代谢相关基因的表达与调控,MDH、PEPC和ME基因是参与苹果酸代谢的部分关键酶合成基因,这些基因的相对表达量在果实发育过程中受到温度、湿度等环境因子的影响(刘蓉等,2016)。PEPC将PEP缩合成草酰乙酸(OAA)为MDH合成提供原料,在三羧酸循环中MDH催化苹果酸与OAA的可逆反应,幼果期PEPC活性保持较高水平,成熟前活性迅速降低。MDH和PEPC联合驱动葡萄果实苹果酸的合成,ME在葡萄果实成熟过程中的苹果酸降解中起主要作用(Ruffneretal.,1984),本研究结果与之基本一致,幼果期PEPC活性较高。本研究中野酿2号毛葡萄MDH基因的相对表达量在转色期达到最高水平,转色之后MDH基因相对表达量下降,与果实转色前苹果酸大量积累的情况相符。盛花后9周至转色期前1周,野酿2号果实PEPC基因的相对表达量降低,猜测此时期苹果酸含量较高限制了PEPC活性。野酿2号果实转色期1周后PEPC基因的相对表达量逐渐降低,与果梅和苹果果实中NAD-MDH和PEPC调控苹果酸合成的结果一致(姚玉新等,2010;刘雅兰等,2017)。猜测原因是此时果实不再进行光合作用积累苹果酸,果实代谢所需的碳源不再由叶片合成的蔗糖来提供,而是需要苹果酸的降解提供,但具体作用机制有待进一步研究。
本研究发现,转色前2周,即盛花后10周,野酿2号毛葡萄果实中的ME基因相对表达量最低,而后开始升高,转色期后苹果酸含量开始降低,野酿2号毛葡萄果实中ME基因与苹果酸含量呈显著负相关,与菠萝(张秀梅等,2007)和苹果(杨光凯等,2023)中的研究结果一致。进入转色期,野酿2号果实PEPC基因相对表达量增加,说明在转色期果实中的PEPC仍参与苹果酸的合成。
综上所述,野酿2号成熟果实苹果酸含量高是由于转色前合成量多、转色期后降解量较少造成的。下一步将继续针对野酿2号毛葡萄转色期苹果酸的代谢机制进行深入研究。在实际生产中可在果实转色后通过促进野酿2号毛葡萄果实苹果酸降解的栽培措施以降低成熟果实中苹果酸含量,提高其酿造品质。
4结论
野酿2号毛葡萄苹果酸含量变化是影响总酸变化趋势的主要因素,转色期是苹果酸含量由积累到降低的转折期,苹果酸含量受相关基因MDH、PEPC和ME表达调控。
参考文献(References):
陈发兴,刘星辉,陈立松.2005.果实有机酸代谢研究进展[J].果树学报,22(5):526-531.[Chen F X,Liu X H,Chen L S.2005.Advances in research on organic acid metabolism in fruits[J].Journal of Fruit Science,22(5):526-531.]doi:10.13925/j.cnh1Y+kjR6+aNO+N1BKU2OBckGQ6gRmp/j/H6i6fjAmJ4=ki.gsxb.2005.05.020.
陈国品,白先进,李洪艳,韩佳宇,盘丰平,谢蜀豫,曹慕明.
2014.葡萄冬果成熟过程中有机酸变化的研究[J].河北林业科技,(Z1):37-40.[Chen G P,Bai X J,LXUAHeC6p0CHeKvHviY+cCa9/sqMgUhSZIZkgYPnlLA0=i H Y,Han J Y,Pan F P,Xie S Y,Cao M M.2014.Studies on changes in organic acids during ripening of grape winter berries[J].Journal of Hebei Forestry Science and Techno-logy,(Z1):37-40.]doi:10.16449/j.cnki.issn 1002-3356.2014.z 1.033.
陈晓丽.2019.高效液相色谱法测定酿酒葡萄果实中的有机酸[J].河北果树,(4):12-14.[Chen X L.2019.Determi-nation of organic acids in wine grape berries by high per-formance liquid chromatography[J].Hebei Fruits,(4):12-14.]doi:10.19440/j.cnki.1006-9402.2019.04.006.
成果,周思泓,张劲,张瑛,管敬喜,杨莹,谢林君,文仁德.2017.毛欧杂种葡萄‘NW196’花色苷组成与相关基因表达分析[J].园艺学报,44(6):1073-1084.[Cheng G,Zhou S H,Zhang J,Zhang Y,Guan J X,Yang Y,Xie L J,Wen R D.2017.Analysis of anthocyanin composition and genes expression patterns of Vitis quinquangularis×V.vinifera‘NW196’[J].Acta Horticulturae Sinica,44(6):1073-1084.]doi:10.16420/j.issn.0513-353x.2016-0693.
郭淑萍,杨顺林,杨玉皎,张永辉,孟富宣,何建军,张俊松,金杰.2022.GA3和CPPU对无核翠宝葡萄果实品质的影响[J].果树学报,39(10):1834-1844.[Guo S P,Yang S L,Yang Y J,Zhang Y H,Meng F X,He J J,Zhang J S,Jin J.2022.Effect of GA3 and CPPU treatments on fruit quality of WuheCuibao grape[J].Journal of Fruit Science,39(10):1834-1844.]doi:10.13925/j.cnki.gsxb.20220074.
胡志群,王惠聪,胡桂兵.2005.高效液相色谱测定荔枝果肉中的糖、酸和维生素C[J].果树学报,22(5):582-585.[Hu Z Q,Wang H C,Hu G B.2005.Measurement of su-gars,organic acids and vitamin C in litchi fruit by high performance liquid chromatography[J].Journal of Fruit Science,22(5):582-585.]doi:10.13925/j.cnki.gsxb.2005.05.035.
江雨,孟江飞,刘崇怀,姜建福,樊秀彩,严静,张振文.2017.中国野生葡萄果实基本品质、酚类物质含量及其抗氧化活性分析[J].食品科学,38(7):142-148.[Jiang Y,Meng J F,Liu C H,Jiang J F,Fan X C,Yan J,Zhang Z W.2017.Quality characteristics,phenolics content and antioxidant activity of Chinese wild grapes[J].Food Science,38(7):142-148.]doi:10.7506/spkx 1002-6630-201707023.
李治苇,张萍,李庆,王云霞,靳磊.2021.酿酒葡萄果实发育过程中糖酸积累规律的研究[J].食品安全质量检测学报,12(19):7738-7743.[Li Z W,Zhang P,Li Q,Wang Y X,Jin L.2021.Study on the accumulation regularity of sugar and acid in the development process of wine grape fruit[J].Journal of Food Safety&Quality,12(19):7738-7743.]doi:10.19812/j.cnki.jfsq 11-5956/ts.2021.19.034.
刘蓉,丁文魁,徐彬,杨吉萍,张春松,马中华.2016.温室葡萄生育期管理及气象条件分析[J].中国农学通报,32(19):130-135.[Liu R,Ding W K,Xu B,Yang J P,Zhang C S,Ma Z H.2016.Greenhouse grapes:Growth period manage-ment and meteorological condition analysis[J].ChineseAgricultural Science Bulletin,32(19):130-135.]
刘蕊,高茜,段长青,潘秋红.2013.避雨栽培对酿酒葡萄有机酸的影响[J].热带生物学报,4(3):251-256.[Liu R,Gao Q,Duan C Q,Pan Q H.2013.Effects of rain-shelter culti-vation on the organic acid content of wine grape berry[J].Journal of Tropical Biology,4(3):251-256.]doi:10.15886/j.cnki.rdswxb.2013.03.013.
刘雅兰,靳志飞,陈红.2017.果梅果实发育过程中有机酸含量及相关代谢酶活性的变化特征[J].西北植物学报,37(1):130-137.[Liu Y L,Jin Z F,Chen H.2017.Changes of the organic acid concentrations and the relative meta-bolic enzyme activities during the development of Prunus mume fruit[J].Acta Botanica Boreali-Occidentalia Sinica,37(1):130-137.]doi:10.7606/j.issn.1000-4025.2017.01.0130.
马倩倩,蒲小秋,王德,于军,吴翠云.2017.枣果实发育过程中有机酸质量分数及相关代谢酶活性的变化[J].西北农业学报,26(12):1821-1827.[Ma Q Q,Pu X Q,Wang D,Yu J,Wu C Y.2017.Changes in organic acid concentra-tion and acid-metabolising enzymatic activities during development of jujube fruits[J].Acta AgriculturaeBoreali-Occidentalis Sinica,26(12):1821-1827.]doi:10.7606/j.issn.1004-1389.2017.12.011.
裴英豪,王云霞,李浩浩,邹倩,文炳南,靳磊.2020.‘赤霞珠’葡萄果实中有机酸的积累规律[J].安徽农学通报,26(21):19-20.[Pei Y H,Wang Y X,Li H H,Zou Q,Wen B N,Jin L.2020.Accumulation of organic acids in‘Caber Sauvignon’grape berries[J].Anhui Agricultural Science Bulletin,26(21):19-20.]doi:10.16377/j.cnki.issn 1007-7731.2020.21.008.
任言,刘婉君,李美璇,乔月莲,王莉,师校欣,杜国强.2024.鲜食葡萄果实发育过程中有机酸积累差异研究[J].中外葡萄与葡萄酒,(3):67-74.[Ren Y,Liu W J,Li M X,Qiao Y L,Wang L,Shi X X,Du G Q.2024.Study on dif-ferences of organic acid accumulation during fruit develop-ment of table grape[J].Sino-Overseas Grapevine&Wine,(3):67-74.]doi:10.13414/j.cnki.zwpp.2024.03.009.
王西成,钱亚明,吴伟民,赵密珍,周蓓蓓,王壮伟,巫建华.2017.6-BA对葡萄果实中有机酸积累及相关基因表达的影响[J].华北农学报,32(5):149-153.[Wang X C,Qian Y M,Wu W M,Zhao M Z,Zhou B B,Wang Z W,Wu J H.2017.Effect of 6-BA on organic acidc content and related genes expression in grape berry[J].Acta Agricul-turaeBoreali-Sinica,32(5):149-153.]doi:10.7668/hbnxb.2017.05.023.
王西锐,阮仕立,李华.2000.毛葡萄酿酒及其利用研究初报[J].中外葡萄与葡萄酒,(3):63-65.[Wang X R,Ruan S L,Li H.2000.A preliminary report on the study of wine-making and utilization of the vitisheyneana[J].Sino-Overseas Grapevine&Wine,(3):63-65.]doi:10.13414/j.cnki.zwpp.2000.03.026.
问亚琴,张艳芳,潘秋红.2009.葡萄果实有机酸的研究进展[J].海南大学学报(自然科学版),27(3):302-307.[Wen Y Q,Zhang Y F,Pan Q H.2009.Progress on organic acids in grape berries[J].Journal of Hainan University(Natural Science),27(3):302-307.]doi:10.15886/j.cnki.hdxbzkb.2009.03.016.
谢林君,张劲,吴代东,李洪艳,曹慕明,周思泓,张瑛,庞丽婷,成果.2022.广西9个酿酒葡萄品种果实糖酸组分特征解析[J].中外葡萄与葡萄酒,(5):37-45.[Xie L J,Zhang J,Wu D D,Li H Y,Cao M M,Zhou S H,Zhang Y,Pang L T,Cheng G.2022.Characteristics of sugar and acid components in nine wine grape varieties in Guangxi region[J].Sino-Overseas Grapevine&Wine,(5):37-45.]doi:10.13414/j.cnki.zwpp.2022.05.006.
杨光凯,薛诗怡,李嘉祯,李汇斌,高燕,张小军,郝燕燕.2023.红宝石苹果果实有机酸组分及苹果酸代谢酶活性分析[J].果树学报,40(5):884-892.[Yang G K,Xue S Y,Li J Z,Li H B,Gao Y,Zhang X J,Hao Y Y.2023.Analysis of organic acid components and malic acid metabolizing enzyme activity in Hongbaoshi apple fruits[J].Journal of Fruit Science,40(5):884-892.]doi:10.13925/j.cnki.gsxb.20220451.
杨巧锋,李长林,裴忺,龚林忠,金莉,王俊芳,方林川.2023.葡萄果实酒石酸研究进展[J].中外葡萄与葡萄酒,(2):66-72.[Yang Q F,Li C L,Pei X,Gong L Z,Jin L,Wang J F,Fang L C.2023.Research progress on tartaric acid of grape berries[J].Sino-Overseas Grapevine&Wine,(2):66-72.]doi:10.13414/j.cnki.zwpp.2023.02.011.
姚玉新,李明,由春香,刘志,王冬梅,郝玉金.2010.苹果果实中苹果酸代谢关键酶与苹果酸和可溶性糖积累的关系[J].园艺学报,37(1):1-8.[Yao Y X,Li M,You C X,Liu Z,Wang D M,Hao Y J.2010.Relationship between malic acid metabolism-related key enzymes and accumulation of malic acid as well as the soluble sugars in apple fruit[J].Acta Horticulturae Sinica,37(1):1-8.]doi:10.16420/j.issn.0513-353x.2010.01.031.
张秀梅,杜丽清,孙光明,弓德强,陈佳瑛,李伟才,谢江辉.2007.菠萝果实发育过程中有机酸含量及相关代谢酶活性的变化[J].果树学报,24(3):381-384.[Zhang X M,Du L Q,Sun G M,Gong D Q,Chen J Y,Li W C,Xie J H.2007.Changes in organic acid concentrations and therela-tive enzyme activities during the development of Cayenne pineapple fruit[J].Journal of Fruit Science,24(3):381-384.]doi:10.13925/j.cnki.gsxb.2007.03.029.
赵明,武鹏,龙芳,林茜,何海旺,邹瑜,潘永杰,李贤高,吕朝安,韩晓华.2020.野生毛葡萄新品种野酿3号的选育及栽培技术要点[J].中国南方果树,49(4):167-168.[Zhao M,Wu P,Long F,Lin X,He H W,Zou Y,Pan Y J,Li X G,LüC A,Han X H.2020.Selection and breeding of new wild Vitis heyneanae variety Yeniang No.3 and the main points of cultivation technology[J].South China Fruits,49(4):167-168.]doi:10.13938/j.issn.1007-1431.20190655.
郑丽静,聂继云,闫震.2015.糖酸组分及其对水果风味的影响研究进展[J].果树学报,32(2):304-312.[Zheng L J,Nie J Y,Yan Z.2015.Advances in research on sugars,organic acids and their effects on taste of fruits[J].Journal of Fruit Science,32(2):304-312.]doi:10.13925/j.cnki.gsxb.20140271.
朱磊,陈芸华,胡禧熙,李新月,战川,吕珊珊.2022.葡萄有机酸的研究进展[J].中外葡萄与葡萄酒,(6):88-95.[Zhu L,Chen Y H,Hu X X,Li X Y,Zhan C,LüS S.2022.Research progress of organic acids in grape[J].Sino-Overseas Grapevine&Wine,(6):88-95.]doi:10.13414/j.cnki.zwpp.2022.06.015.
邹瑜,林贵美,牟海飞,吕朝安,吴代东,张进忠,覃柳燕,赵明.2013.两性花野生毛葡萄新品种——“野酿2号”的选育[J].中国南方果树,42(5):107-108.[Zou Y,Lin G M,Mou H F,LüC A,Wu D D,Zhang J Z,Qin LY,Zhao M.2013.Selection and breeding of a new variety of wild Vitis heyneana——“Yeniang No.2”[J].South China Fruits,42(5):107-108.]doi:10.13938/j.issn.1007-1431.2013.05.037.
Diakou P,Svanella L,Raymond P,Gaudillère J P,Mong A.2000.Phosphoenolpyruvate carboxylase during grape berry development:Protein level,enzyme activity and regulation[J].Functional Plant Biology,27(3):221-229.doi:10.1071/PP99141.
Livak K J,Schimittgen T D.2001.Analysis of relative gene expression data using real-time quantitative PCR and the 2-∆∆Ct method[J].Methods,25(4):402-408.doi:10.1006/meth.2001.1262.
Reshef N,Karn A,Manns D C,Mansfield A K,Cadle-Davidson L,Reisch B,Sacks G L.2022.Stable QTL for malate levels in ripe fruit and their transferability across Vitis species[J].Horticulture Research,9:uhac009.doi:10.1093/hr/uhac009.
Ruffner H P,Hawker J S.1977.Control of glycolysis in ripe-ning berries of Vitis vinifera[J].Phytochemistry,16(8):1711-1175.doi:10.1016/S0031-9422(00)94354-1.
Ruffner H P,Possner D,Brem S,Rast D.M.1984.The physio-logical role of malic enzyme in grape ripening[J].Planta,160:444-448.doi:10.1007/BF00429761.
Sweetman C,Deluc L G,Cramer G R,Ford C M,Soole K L.2009.Regulation of malate metabolism in grape berry and other developing fruits[J].Phytochemistry,70(11-12):1329-1344.doi:10.1016/j.phytochem.2009.08.006.
Taureille-Ssaurel C,Romieu C G,Robin J P,Flanzy C.1995.Grape(Vitis vinifera L.)malate dehydrogenase.II.charac-terization of the major mitochondrial and cytosolic iso-forms and their role in ripening[J].American Journal of Enology and Viticulture,46:29-36.doi:10.5344/ajev.1995.46.1.29.
Wei M Y,Ma T T,Cao M M,Wei B S,Li C,Li C H,Zhang K K,Fang Y L,Sun X Y.2022.Biomass estimation and cha-racterization of the nutrient components of thinned unripe grapes in China and the global grape industries[J].Food Chemistry:X,15:15100363.doi:10.1016/j.fochx.2022.100363.
(责任编辑李洪艳)
