葡萄叶绿素荧光参数测量方法的优化与日变化特征分析
2024-11-05曹雄军韩佳宇谢蜀豫黄秋秘邓海燕盘丰平王博江春分时晓芳白先进



摘要:【目的】确定葡萄叶绿素荧光参数测量最适的暗适应时间、测量光强度,分析葡萄叶绿素荧光参数日变化特征并确定最适测量时间,提出优化测量方法的建议,为进一步研究葡萄光合特性提供理论依据,以提高研究数据的准确性和可靠性。【方法】选择阳光玫瑰葡萄和巨峰葡萄叶龄为40~50 d的健康成熟叶片,利用JIP测定(JIP-test)和主成分分析(PCA)研究葡萄叶片在不同暗适应时间(5、10、15、20、25、30、35和40 min)、不同测量光强度[500、1000、1500、2000、2500、3000和3500μmol/(m2·s)]和一天中不同时间点(8:00、10:00、12:00、14:00、16:00、18:00和20:00)的快速叶绿素荧光诱导动力学(OJIP)曲线特征,分析不同测量条件对葡萄叶片叶绿素荧光参数的影响。【结果】暗适应时间和测量光强度均明显影响葡萄叶片叶绿素荧光参数,较长的暗适应时间和较高的测量光强度能获得更稳定和可靠的测量结果。OJIP曲线特征显示,在较短的暗适应时间(5~15 min)内,各暗适应时间与暗适应5 min间的特征区间(OJ相、JI相和IP相)相对可变荧光差值(ΔWOJ、ΔWJI和ΔWIP)曲线变化幅度较大,初始荧光(Fo)、最大荧光(Fm)和最大光化学效率(Fv/Fm)等参数波动较大,当暗适应时间达30 min以上时,各参数再无显著变化(P>0.05,下同),趋于稳定。随着测量光强度的增加,Fm、Fv/Fm、OJIP曲线的初始斜率(Mo)和单位面积反应中心数量(RC/CSm)等参数呈上升趋势,各测量光强度与500μmol/(m2·s)测量光强度间的ΔWOJ、ΔWJI和ΔWIP曲线呈正K峰、负H峰和正G峰,当光强度达3000μmol/(m2·s)以上时,各参数均无显著变化。葡萄叶片的多数叶绿素荧光参数随着一天中时间点的推移而变化,光系统II(PSII)光化学效率在12:00之前较高,14:00时光化学效率下降,16:00之后PSII逐渐恢复至最佳状态。【结论】针对葡萄叶片进行OJIP曲线测定时,暗适应时间应为30 min以上,最小测量光强度为3000μmol/(m2·s),测量时间宜选择在12:00之前和16:00之后,以确保结果的准确性和可靠性。
关键词:葡萄叶绿素荧光;OJIP曲线;暗适应时间;测量光强度;日变化特征
中图分类号:S663.101文献标志码:A文章编号:2095-1191(2024)08-2248-14
Optimization of measurement methods for chlorophyllfluorescence parameters and analysis of diurnal variationcharacteristics in grape leaves
CAO Xiong-jun HAN Jia-yu XIE Shu-yu HUANG Qiu-mi DENG Hai-yan PAN Feng-ping WANG Bo3,JIANG Chun-fen SHI Xiao-fang BAI Xian-jin1*
(1Grape and Wine Research Institute,Guangxi Academy of Agricultural Sciences,Nanning,Guangxi 530007,China;2Horticultural Research Institute,Guangxi Academy of Agricultural Sciences,Nanning,Guangxi 530007,China;3College of Agriculture,Guangxi University,Nanning,Guangxi 530004,China)
Abstract:【Objective】To determine the optimal dark adaptation duration and measurement light intensity for asses-sing chlorophyll fluorescence parameters in grape leaves,and to analyze the diurnal variation characteristicss of these pa-rameters.This study aimed to provide recommendations for optimizing measurement protocols,thereby offering theoreti-cal reference for further research into grape photosynthetic characteristics and enhancing the accuracy and reliability of ex-perimental data.【Method】Healthy,mature leaves of Shine Muscat and Kyoho grape varieties aged 40-50 d were selected.The JIP-test and principal component analysis(PCA)were utilized to investigate the rapid chlorophyll fluorescence induc-tion kinetics(OJIP)curves under different dark adaptation durations(5,10,15,20,25,30,35 and 40 min),various measurement light intensities[500,1000,1500,2000,2500,3000 and 3500μmol/(m2·s)],and at different timesthroughout the day(8:00,10:00,12:00,14:00,16:00,18:00 and 20:00).The influence of these experimental condi-tions on the chlorophyll fluorescence parameters was evaluated.【Result】Dark adaptation duration and measurement lightintensity greatly influenced the chlorophyll fluorescence parameters of grape leaves.Extended dark adaptation durations and increased measurement light intensities resulted in more stable and reliable fluorescence parameter measurements.OJIP curve characteristics indicated that under short dark adaptations(5-15 min),the characteristic interval(OJ phase,JI phase and IP phase)relatively variable fluorescence difference(ΔWOJ,ΔWJI andΔWIP)curves between each dark adapta-tion duration and dark adaptation 5 min had a large variation,parameters such as initial fluorescence(Fo),maximumfluorescence(Fm)and maximum photochemical efficiency(Fv/Fm)fluctuated greatly.When dark adaptation exceeded 30 min,the parameters had no significant difference(P>0.05,the same below),and tended to be stablized.With increasing measurement light intensity,Fm,Fv/Fm the initial slope of OJIP curves(Mo),and number of reaction centers per unit area(RC/CSm)showed an upward trend,and theΔWOJ,ΔWJI andΔWIP curves between each measured light intensity and the measured light intensity at 500μmol/(m2·s)showed positive K peaks,negative H peaks and positive G peaks.Once thelight intensity exceeded 3000μmol/(m2·s),no further significant changes in fluorescence parameters were observed.Most chlorophyll fluorescence parameters of grape leaves changed with diurnal variations of times,with higher photosys-tem II(PSII)photochemical efficiency before 12:00,a decline at 14:00,and a gradual recovery of PSII to optimal le-vels after 16:00.【Conclusion】For accurate OJIP curve measurements of grape leaves,a dark adaptation duration of atleast 30 min and a minimum measurement light intensity of 3000μmol/(m2·s)are recommended.Optimal measurementtimes are before 12:00 and after 16:00 to ensure the accuracy and reliability of the results.
Key words:grape chlorophyll fluorescence;OJIP curve;dark adaptation duration;measuring light intensity;diur-nal variation characteristics
Foundation items:National Natural Science Foundation of China(U21A20227);Guangxi Natural Science Founda-tion(2022GXNSFAA035540);Science and Technology Development Project of Guangxi Academy of Agricultural Scien-ces(Guinongke 2023JZ11);Basic Research Project of Guangxi Academy of Agricultural Sciences(Guinongke 2021 YT126)
0引言
【研究意义】快速叶绿素荧光诱导动力学(OJIP)曲线是一种广泛应用于植物生理生态研究的工具,主要用于评估植物光合作用效率和生理状态。该方法因简便、快速且具有非破坏性,被广泛应用于植物光合作用研究(李鹏民等,2005;Liu et al.,2020;Swoczynaetal.,2022)。通过测量叶绿素荧光参数,可获得植物光系统的状态信息,从而深入了解植物光合性能及其对逆境的响应机制(林荣呈等,2021;杨文强等,2024;Pessarakli,2024)。然而,叶绿素荧光参数测量数据的准确性和可重复性受多种因素影响,包括暗适应时间、测量光强度和测量时间点的选择(Kalajietal.,2016;Lysenko et al.,2022)。合理优化上述测量条件能提高测量数据的准确性和可重复性,为植物光合作用研究提供更可靠的基础数据。【前人研究进展】葡萄(Vitis vinifera L.)的生长发育受多种生理和环境因素调控(Palliotti and Poni,2015;Liu et al.,2019;徐文清等,2023),其中光合作用是决定葡萄产量和品质的关键生理过程(谢计蒙等,2012;Naulleauetal.,2021;曹雄军等,2023;Zhou et al.,2024)。叶绿素荧光测量技术通过测定叶片对激发光的荧光响应,反映光系统II(PSII)的功能状态(Goltsev et al.,2016;Kalaji et al.,2017;Pessarakli,2024)。OJIP曲线是一种标准的荧光测量方法,JIP测定(JIP-test)是建立在生物膜能量流动理论基础上针对OJIP曲线的数据分析和处理方法,通过测量叶片在暗适应后受到强光照射时的荧光诱导动力学,采用JIP测定分析荧光诱导曲线O、J、I和P阶段的相位,能提供关于PSII反应中心和电子传递链的信息(Strasser,1981;Strasser and Strasser,1995)。叶绿素荧光参数是评估植物光合作用效率及其对环境压力响应的关键指标。研究表明,不同的环境应激条件,如光照强度、温度变化等,对叶绿素荧光参数有显著影响(Kalaji et al.,2017;Pessarakli,2024)。叶绿素荧光参数的测量通常需要在暗适应条件下进行,暗适应时间是影响叶绿素荧光参数测量准确性的关键因素之一(Murchie and Lawson,2013;Kalaji et al.,2018)。暗适应需要在测量前将植物样品置于黑暗中,以使光合色素完全恢复至原始状态。如果暗适应时间不足,PSII反应中心可能未能完全恢复至原始状态,会导致曲线中O、J、I和P阶段的特征不完整或有偏差,影响对光合性能的准确评估,使得对光合效率和光抑制的分析变得困难。而过长的暗适应时间增加了试验总时间,可能使试验过程过于冗长,且过长的暗适应时间可能会引发植物样品的生理变化,从而影响最终测量结果。测量光强度的选择对OJIP曲线的测量结果也有显著影响(Gaevskii et al.,2000;Janeeshma et al.,2022;Su et al.,2024)。OJIP曲线是利用光合色素荧光来评估光合作用效率的工具,测量光强度会直接影响曲线的形态和数据的解析。光强度不足可能无法完全激发PSII反应中心的电子传递,导致OJIP曲线的峰值和变化不明显,曲线的动态范围较小,难以准确捕捉光合作用的完整特征,使数据的准确性和可靠性下降。而使用过高的测量光强度可能会出现过度的荧光淬灭或信号饱和,导致光抑制或光损伤,使得电子传递链的负荷过重,对光合反应中心造成负面影响,从而影响OJIP曲线的动态特征。为获得准确的OJIP曲线,应选择适当的饱和光强度,以确保能激发PSII反应中心的电子传递,同时避免光抑制和荧光信号饱和。试验设计需要根据研究目标和植物特性选择合理的暗适应时间和测量光强度范围,以确保获得可靠的数据。此外,受光照强度、温度、湿度和其他环境因素变化的影响,植物光合作用具有明显的日变化特征,不同时间点的叶绿素荧光参数可能存在显著差异(Li and Chen,2009;Campbell et al.,2019)。测量时间点的选择对于光合作用相关研究的试验设计至关重要,分析植物样品在一天中不同时间点的叶绿素荧光参数变化可帮助确定最佳的测量时间点,从而提高数据的准确性和可靠性(Kalajietal.,2017;Pessarakli,2024)。【本研究切入点】葡萄产量和品质受光合作用影响,开展其光合作用研究需要对葡萄OJIP曲线测量方法进行优化。【拟解决的关键问题】探究不同暗适应时间、测量光强度对葡萄叶绿素荧光参数的影响,分析葡萄叶绿素荧光参数日变化特征,确定最适的暗适应时间、测量光强度和测量时间点,提出优化测量方法的建议,为进一步研究葡萄光合特性提供理论依据,以提高研究数据的准确性和可靠性。
1材料与方法
1.1试验材料
试验地点为广西农业科学院葡萄与葡萄酒研究所一年两收葡萄示范基地(22°51′19″N,108°14′46″E)。供试葡萄品种为欧美杂种阳光玫瑰和巨峰,其中阳光玫瑰葡萄树龄为5年,巨峰葡萄树龄为20年,均采用一年两收避雨栽培模式管理。选择叶龄为40~50 d的成熟健康叶片进行标记,2个品种各30~40片,标记的成熟叶片均位于新梢果实节位。
1.2试验方法
1.2.1暗适应时间测定分析设8组不同的暗适应时间处理,分别为5、10、15、20、25、30、35和40 min。在标记的叶片样本上放置专用叶夹暗适应5min后,使用Handy PEA+植物效率分析仪(英国Hansatech Instruments公司)进行OJIP曲线测量,测量光强度为3000μmol/(m2·s),测量时长为2 s,打开叶夹进行10 min阳光照射后,关闭叶夹暗适应10min,以相同测量光强度和测量时长再次进行OJIP曲线测量,重复此过程,每次将暗适应时间增加5 min,直至暗适应时间为40min。每组处理每个品种测量标记的叶片30片,每组处理共测量60次。所有测量均在QF4b0Bu2xiP0wOR3s1Gw/dlok9tjiA7Nt+tUJbVnLoA=12:00前完成,测量过程不破坏植物组织。
1.2.2测量光强度测定分析设7组不同的测量光强度处理,分别为500、1000、1500、2000、2500、3000和3500μmol/(m2·s)。在标记的叶片样本上放置专用叶夹暗适应30min后,使用植物效率分析仪进行OJIP曲线测量,设定光强度为500μmol/(m2·s),测量时长为2 s,测量后同样暗适应30 min,再次进行OJIP曲线测量,设定光强度为1000μmol/(m2·s),测量时长为2 s,重复此过程,每次将测量光强度增加500μmol/(m2·s),直至其为3500μmol/(m2·s)。每组处理每个品种测量标记的叶片30片,每组处理共测量60次。所有测量均在12:00前完成,测量过程不破坏植物组织。
1.2.3叶绿素荧光参数日变化特征分析选择晴天进行试验,分别于8:00、10:00、12:00、14:00、16:00、18:00和20:00测定叶绿素荧光参数,使用优化后的测量方法进行OJIP曲线测量,测量前,标记叶片使用专用叶夹在同一位置暗适应30 min,设定测量光强度为3000μmol/(m2·s),测量时长为2 s。每个时间点测量每个品种标记的叶片30片,每个时间点共测量60次。测量过程不破坏植物组织。
1.2.4 OJIP曲线的JIP测定分析OJIP曲线在荧光强度随时间变化时出现明显的特征点,即起始点(O)、初期上升点(J)、中期上升点(I)和峰值点(P)。上述特征点代表光合作用过程中不同的状态,OJIP曲线中蕴藏着丰富的信息,其形态的变化反映光合机构的功能和状态发生的变化。通过JIP测定可对OJIP曲线变化进行定量分析(Kalajietal.,2018;Pes-sarakli,2024),具体计算公式和参数含义参照Golt-sev等(2016)的研究,见表1。
相对可变荧光差值(ΔVt)曲线,以及OJIP曲线4个特征区间(OK相、OJ相、JI相和IP相)的双归一化相对可变荧光差值(ΔWOK、ΔWOJ、ΔWJI和ΔWIP)曲线可用于比较分析不同处理叶片的荧光特性,差值曲线的计算参照Kalaji等(2018)的方法,ΔVt=Vt(处理)-Vt(对照);ΔWOK=WOK(处理)-WOK(对照),ΔWOJ=WOJ(处理)-WOJ(对照),ΔWJI=WJI(处理)-WJI(对照),ΔWIP=WIP(处理)-WIP(对照);暗适应时间测定分析以暗适应5min为对照,测量光强度测定分析以测量光强度500μmol/(m2·s)为对照,叶绿素荧光参数日变化特征分析以8:00为对照。
ΔWOK(L峰,L-band)反映了PSII单元间的连通性和能量传递能力,正L峰表示PSII单元间的连通性减小,可能是由于PSII反应中心的数量减少或能量传递效率降低,导致光能的捕获和转化效率降低;负L峰则表示PSII单元间的连通性增加,可能是由于PSII反应中心的数量增加或能量传递效率提高,从而使光能的捕获和转化效率提高(Kalaji et al.,2018;Dimitrova et al.,2020;Zagorchevetal.,2020)。ΔWOJ(K峰,K-band)反映了PSII供体侧的放氧复合体(OEC)状态,正K峰表示供体侧的电子传递速率较慢,表明OEC受损及电子供给和进一步将电子转移到醌受体QA间的不平衡;负K峰则表示供体侧的电子传递速率增加或受体侧的电子流出速率减少。ΔWJI(H峰,H-band)反映了2个光系统间质体醌(PQ)池还原的动态,与PQ池的大小(活跃的PQ分子数量)及其还原程度密切相关,正H峰意味着PSII反应中心能提供给PQ池的电子数量减少,PQ池相对变小;而负H峰则表示PSII反应中心能提供给PQ池的电子数量增加,PQ池相对变大。ΔWIP(G峰,G-band)反映的是光系统I(PSI)受体侧的还原情况,即电子从PQ池传递到PSI受体侧的过程,当G峰为正时,表示PSI受体侧的电子传递受阻或减慢,从PSI受体侧的电子流出速率增加,PSI受体侧的电子接受池相对变小;相反,如果G峰为负时,表示供体侧的电子传递速率增加,从PSI受体侧的电子流出速率减少,PSI受体侧的电子接受池相对较大(Dimitrova et al.,2020;Zagorchevetal.,2020)。
1.3统计分析
试验数据使用SPSS 26.0进行分析,采用单因素方差分析(One-way ANOVA)比较不同处理间叶绿素荧光参数的差异。采用主成分分析(PCA)对多维数据进行降维处理,探究不同试验条件下叶绿素荧光参数的主要变化趋势并筛选代表性参数。使用Origin 2021绘图。
2结果与分析
2.1不同暗适应时间下葡萄叶绿素荧光参数的变化趋势
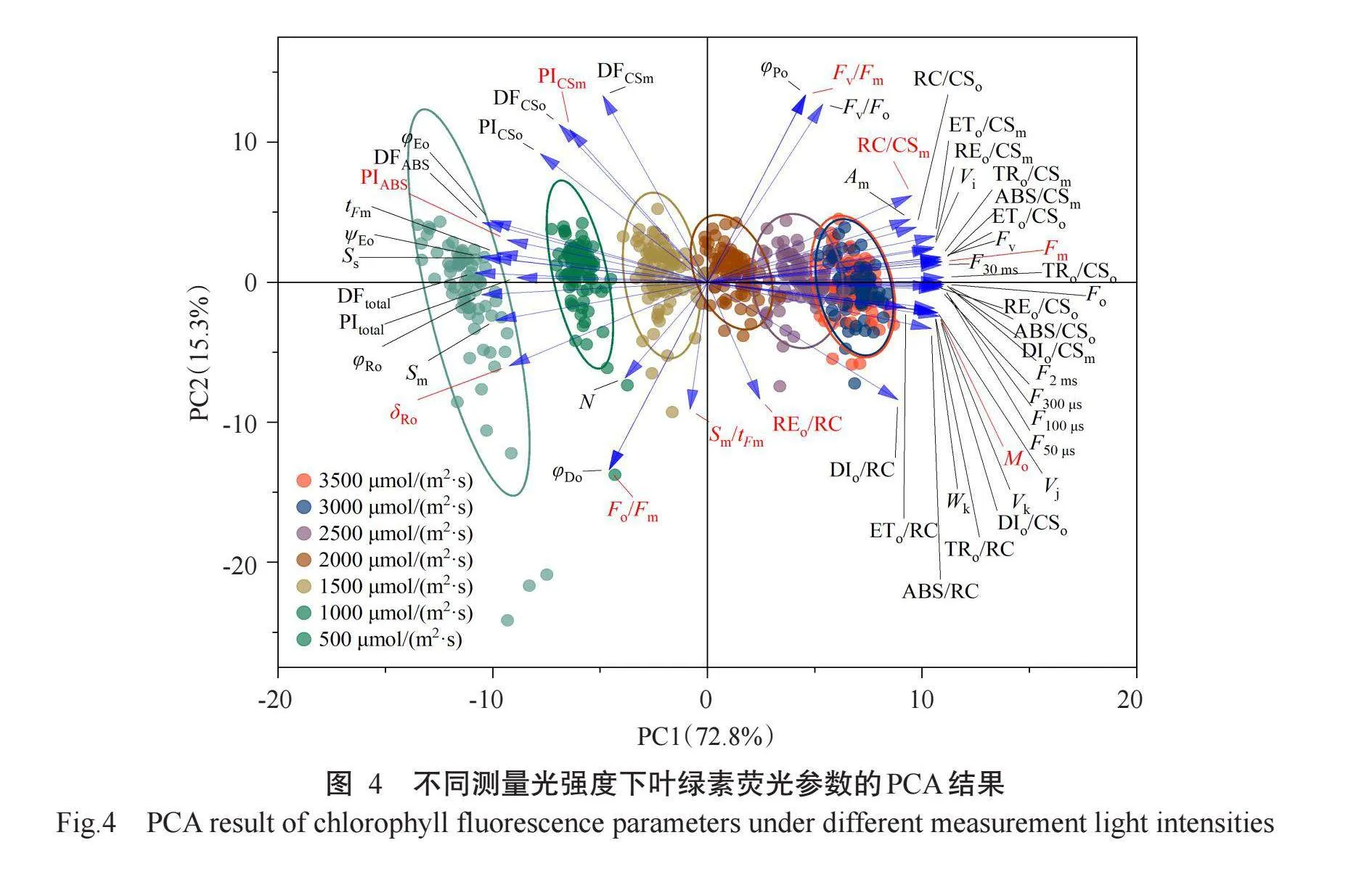
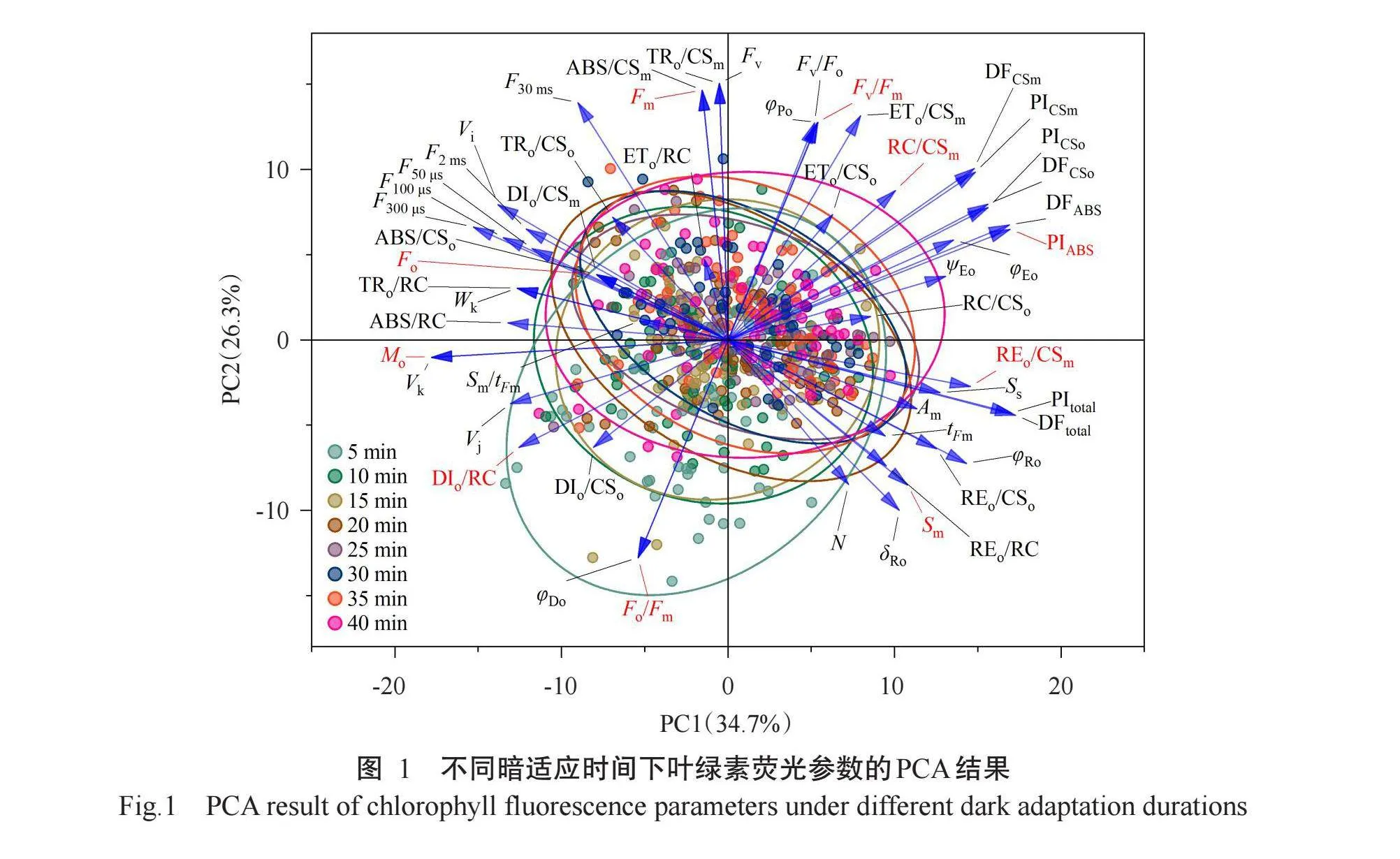
对不同暗适应时间的叶绿素荧光参数进行PCA,结果发现各暗适应时间下的叶绿素荧光参数聚类分布存在明显差异(图1)。暗适应时间达20 min以上时,数据点聚集性较好,表明较长时间的暗适应有助于获得更加稳定和可靠的测量结果。在PCA中,聚集在一起的参数可能存在相关性,Fv/Fm、Fv/Fo、φPo等聚集在一起,表明这些参数在不同暗适应时间下的变化趋势相似。
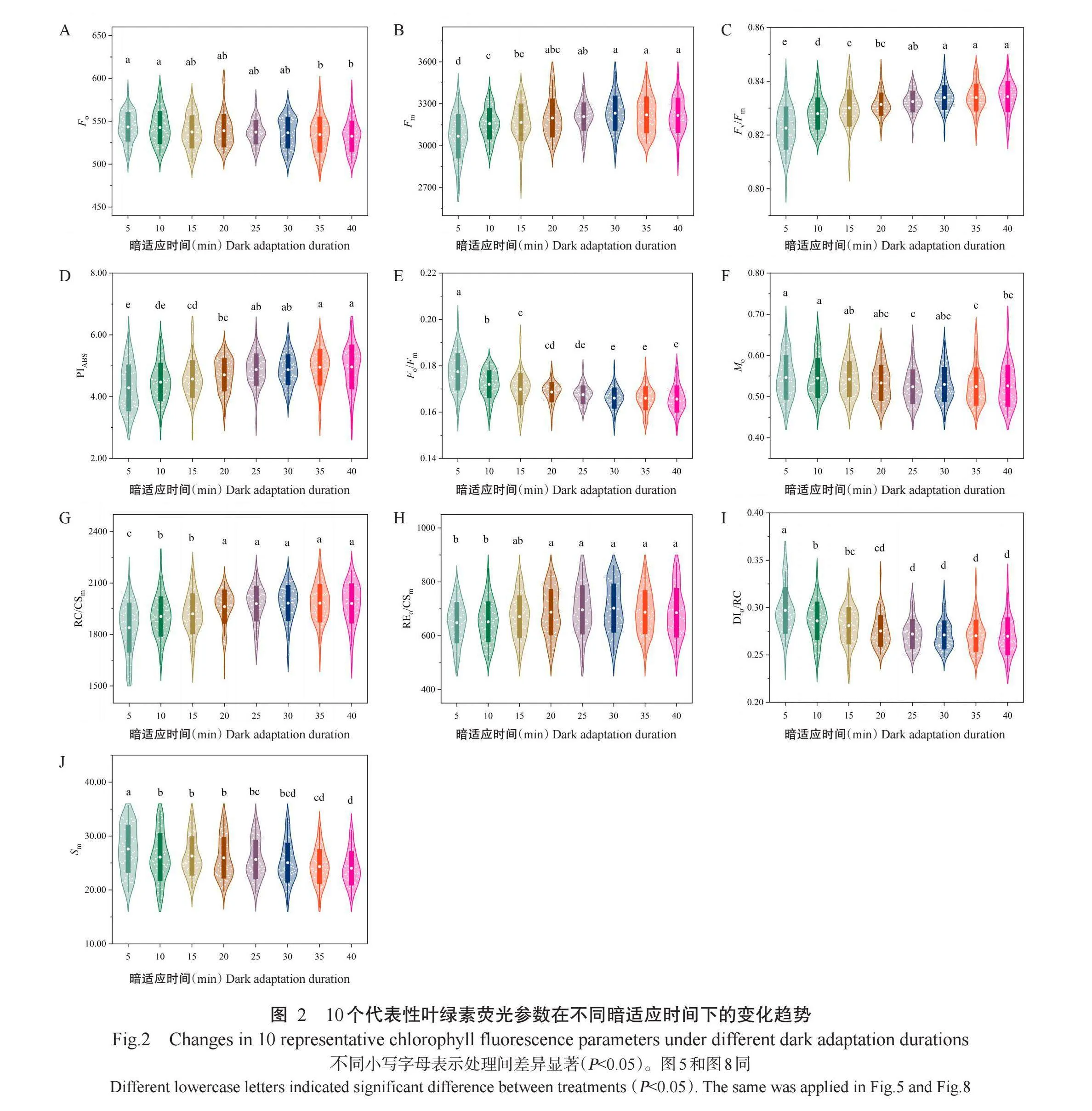
根据PCA结果,选择10个具有代表性的叶绿素荧光参数进一步分析,包括Fo、Fm、Fv/Fm、PIABS、Fo/Fm、Mo、RC/CSm、REo/CSm、DIo/RC和Sm(图2)。这些参数的变化趋势表明暗适应时间对PSII的各项参数均有明显影响。Fo和REo/CSm在暗适应15 min后再无显著变化(P>0.05,下同),趋于稳定;Fm、Mo、RC/CSm和DIo/RC在暗适应时间达20 min后趋于稳定;Fv/Fm、Fo/Fm和PIABS在暗适应25 min后趋于稳定;Sm在暗适应30 min后均趋于稳定,上述结果反映了PSII在不同暗适应时间下的性能变化。
不同暗适应时间的OJIP曲线特征反映葡萄叶片在不同暗适应时间下的荧光响应(图3)。如图3-B所示,以暗适应5 min为对照,随着暗适应时间的延长,能明显观察到ΔVt曲线中的ΔJ负峰和ΔH、ΔG正峰,ΔJ负峰表示PQ池的还原速度较慢,ΔH正峰表示PQ池的相对大小减小,ΔG正峰表示PSI受体侧的电子传递受阻或减慢。
如图3-C所示,不同的暗适应时间下ΔWOK区别不大,表明不同的暗适应时间不会影响PSII单元间连通的稳定性,暗适应时间的长短不会对PSII反应中心间的能量传递能力产生明显影响。ΔWOJ曲线如图3-D所示,在较短的暗适应时间(5~15 min)内,供体侧的电子传递速率较慢,但暗适应时间增加至20 min以上时,供体侧的电子传递速率增加,且荧光变化趋于平稳。ΔWJI曲线如图3-E所示,当暗适应时间在5~25 min内,随着暗适应时间的延长,PQ池相对大小越来越小,即PSII反应中心能提供给PQ池的电子数量减少,当暗适应时间为30~40 min时,PQ池的相对大小趋于稳定,可能此时PSII反应中心几乎没有电子提供给PQ池。ΔWIP曲线如图3-F所示,在5~30 min的暗适应时间内,随着暗适应时间的延长,PSI受体侧的电子接受池相对大小越来越小,即电子从PSII通过PQ池传递到PSI的速率越来越慢,当暗适应时长为35~40 min时,PSI受体侧的电子接受池的相对大小不再发生明显变化,达到一个新的稳态,此时PSII反应中心可能已完全处于开放状态,几乎没有电子传递到PSI受体侧。
综上所述,暗适应5~15 min时,各叶绿素荧光参数波动较大,ΔWOJ、ΔWJI和ΔWIP曲线变化幅度较大。随着暗适应时间延长,各参数波动减少,开始趋于稳定。当暗适应时间延长至30 min时,各参数变化幅度较小,表明此时叶片的叶绿素荧光参数已达到相对稳定状态,进一步延长暗适应时间至40min,各参数变化不显著。因此,测定葡萄叶片叶绿素荧光参数的暗适应时间应为30 min以上,以确保各参数的稳定性和一致性。
2.2不同测量光强度下葡萄叶绿素荧光参数的变化趋势
不同测量光强度下叶绿素荧光参数的PCA结果如图4所示,随着测量光强度的变化,叶绿素荧光参数存在明显差异。在低光强度下,数据点的分布相对分散,而在高光强度下,数据点的分布相对集中,表明测量光强度达到一定水平后,叶绿素荧光参数的变化才趋于一致。
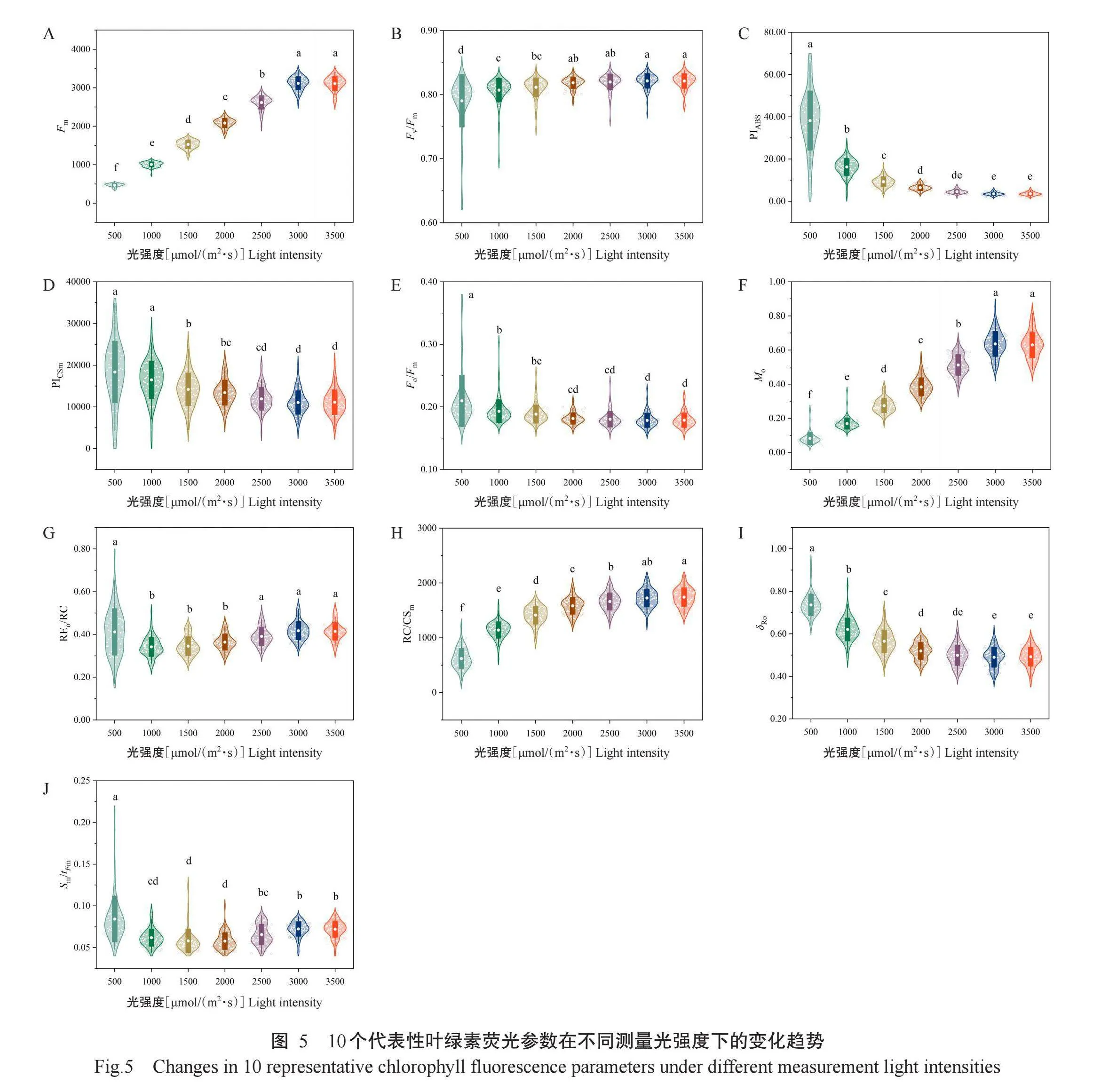
根据PCA结果选择10个代表性叶绿素荧光参数进一步分析,包括Fm、Fv/Fm、PIABS、PICSm、Fo/Fm、Mo、REo/RC、RC/CSm、δRo和Sm/tFm(图5),上述参数主要反映PSII在不同光强度下的性能和效率。Fm、Fv/Fm、Mo和RC/CSm随着测量光强度增加整体呈上升趋势,当光强度达2000μmol/(m2·s)后,Fv/Fm再无显著变化,而Fm、Mo和RC/CSm则在光强度达3000μmol/(m2·s)时才趋于稳定。Fo/Fm、PIABS、PICSm和δRo随着光强度增加整体呈下降趋势,Fo/Fm在光强度达2000μmol/(m2·s)后趋于稳定,PIABS、PICSm和δRo在光强度达2500μmol/(m2·s)后测量数据无显著差异。随着光强度增加,REo/RC和Sm/tFm下降后又上升,且REo/RC和Sm/tFm在测量光强达2500μmol/(m2·s)后再无显著变化。上述参数的变化趋势表明,在不同测量光强度下,葡萄PSII的性能和效率有所不同,但在3000μmol/(m2·s)以上的测量光强度下,其性能和效率均趋于稳定。
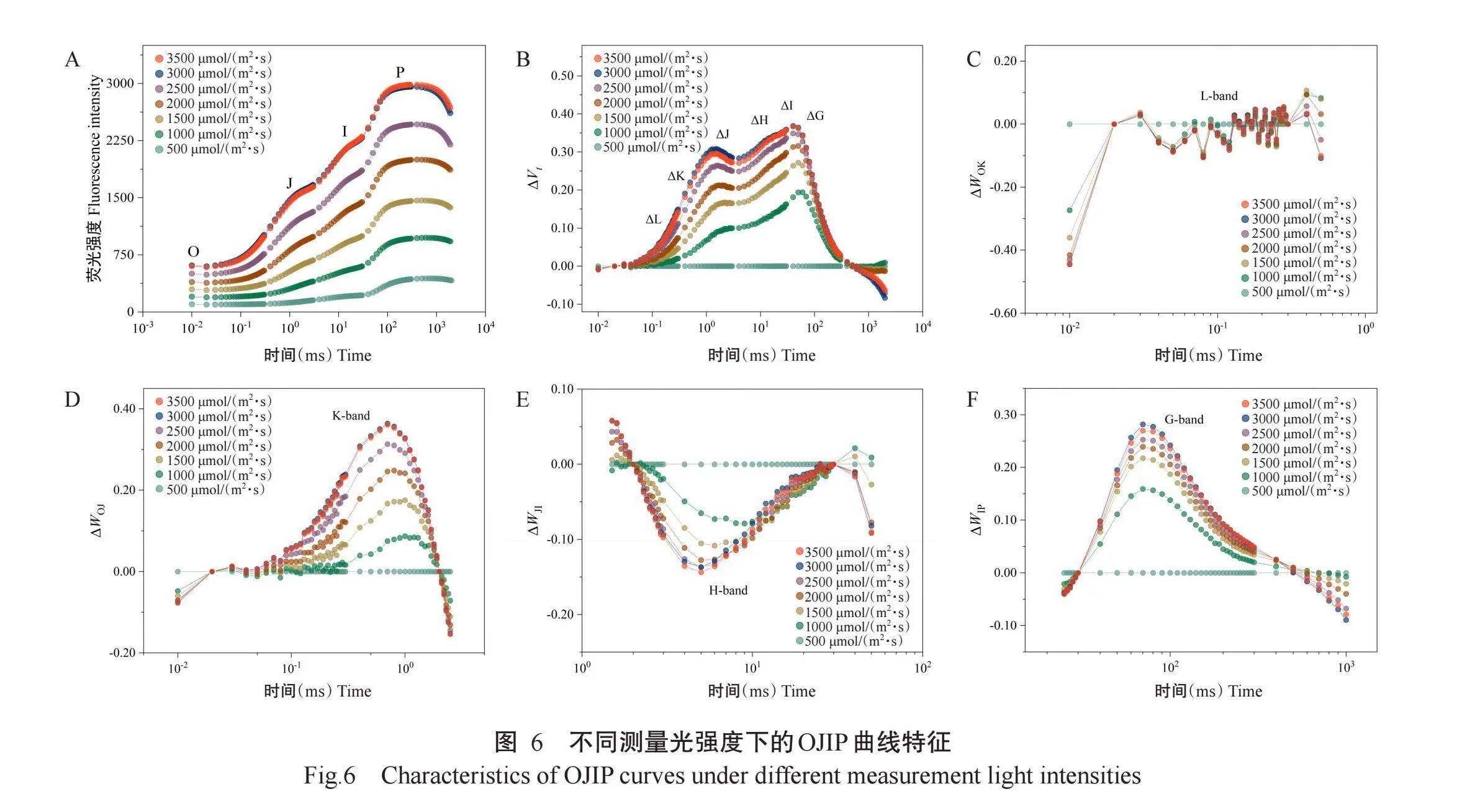
不同测量光强度下的OJIP曲线特征表明测量光强度对叶绿素荧光参数有明显影响(图6)。当测量光强度从500μmol/(m2·s)增加至3000μmol/(m2·s)时,OJIP曲线的荧光强度逐渐增加(图6-A),当测量光强度超过3000μmol/(m2·s)时,荧光强度再无明显变化。以测量光强度500μmol/(m2·s)为对照,可观察到其他测量光强度的ΔWOJ(图6-D)、ΔWJI(图6-E)和ΔWIP曲线(图6-F)呈正K峰、负H峰和正G峰,但ΔWOK变化幅度很小(图6-C),表明本研究设定的测量光强度基本不影响PSII单元间连通的稳定性,随着测量光强度的增强,PSII反应中心能提供给PQ池的电子数量逐渐增加,PQ池相对变大,PSI受体侧的电子流出速率逐渐增加,但供体侧的电子传递速率逐渐减慢,意味着随着测量光强度的增强,光系统间的电子传递效率逐渐增加,光合作用效率逐渐提高。当测量光强度达3000μmol/(m2·s)以上时,ΔWOJ、ΔWJI和ΔWIP曲线振幅再无明显变化,说明此时PSII光合作用效率达最大值,光合系统达到一个新的稳定状态。
因此,针对葡萄叶片测量OJIP曲线时,合理的最小测量光强度应选择3000μmol/(m2·s),此时各参数不再发生明显变化,PSII性能和效率保持稳定,能真实反映植物的光合状态,而测量光强度小于3000μmol/(m2·s)时,叶绿素荧光参数变化较大,会导致试验误差较大。
2.3葡萄叶绿素荧光参数的日变化特征
采用30 min暗适应时间和3000μmol/(m2·s)光强度测量一天中不同时间点(8:00、10:00、12:00、14:00、16:00、18:00、20:00)OJIP曲线。PCA结果(图3-A)表明,8:00和20:00的数据点相对靠近,而12:00和14:00的数据点则更分散,意味着叶绿素荧光参数在一天中存在明显变化。
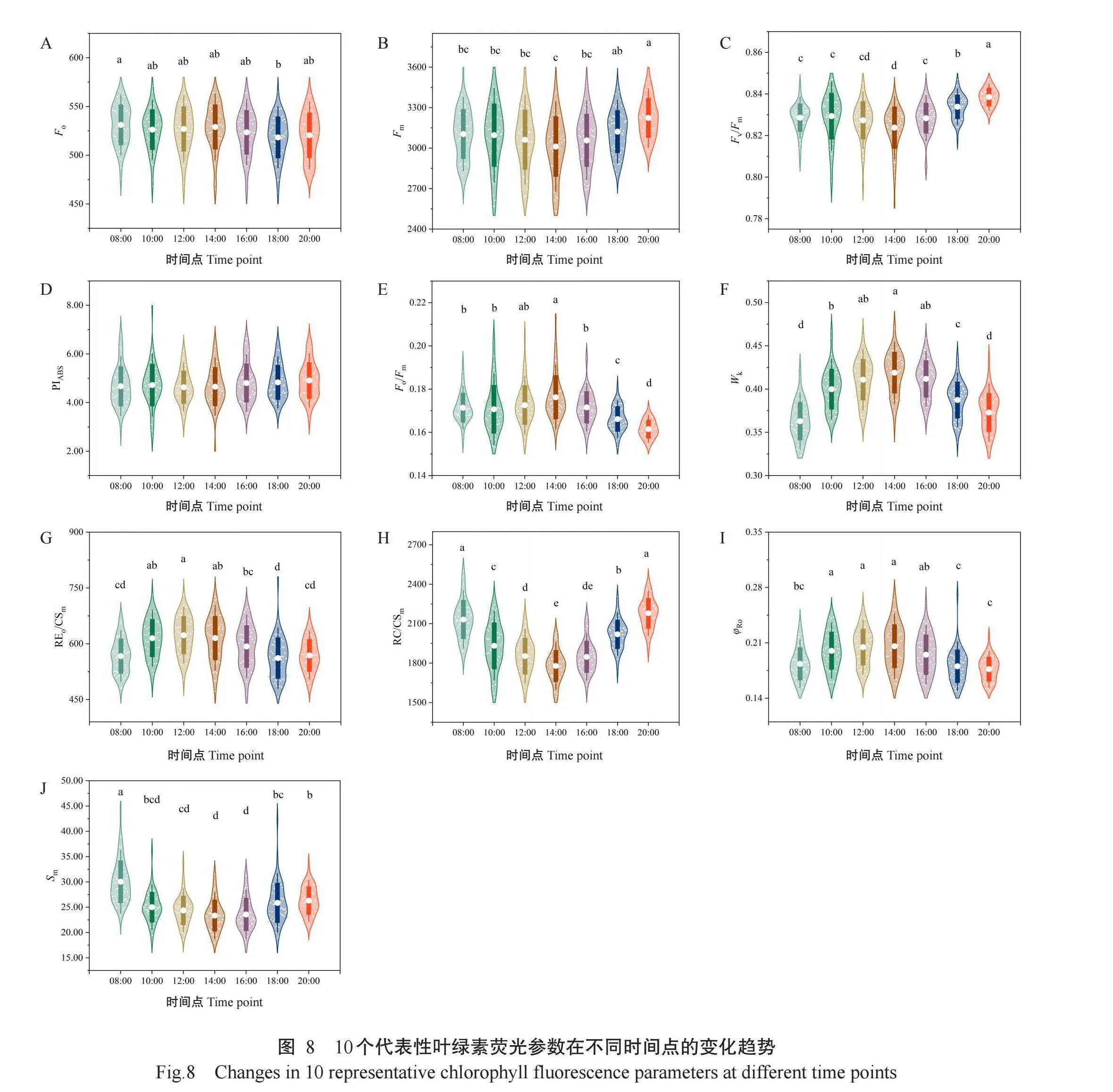
通过PCA选择10个代表性叶绿素荧光参数进一步分析,包括Fo、Fm、Fv/Fm、PIABS、Fo/Fm、Wk、REo/CSm、RC/CSm、φRo和Sm(图8)。Fo和Fm在8:00—16:00各时间点间均无显著差异,但14:00时,Fo略升高,Fm略下降,导致Fo/Fm比值升高,可能与PSII受强光胁迫时发生光抑制现象有关。而PIABS从早至晚变化不大,各时间点间均无显著差异,表明葡萄叶片在一天中的PSII整体光合性能相对稳定。Fv/Fm、RC/CSm和Sm随着一天中时间点的推移整体呈先下降后上升的变化趋势,数值在早上较高,随后开始下降,至14:00达到最低值,之后开始上升,晚上数值较高。Fv/Fm、RC/CSm和Sm的下降共同反映了葡萄在PSII功能、光合反应中心数量和能量分布方面发生了不利变化,光合作用效率降低,可能是光抑制或环境胁迫导致。表明在14:00,PSII的最大光化学效率、反应中心数量等低于其他时间点。Fo/Fm、Wk、REo/CSm和φRo则随着一天中时间点的推移整体呈先上升后下降的变化趋势,早上的数值较低,随后开始上升,至14:00达最大值(除REo/CSm在12:00达最大值),之后开始下降,晚上的数值较低。这些参数的升高表明葡萄光合作用的增强,反映出PSII在光能捕获、电子GFMi0J5Xy7tW0WJOHZRRO8yA/5ZGcjIvIHBka4giCjA=传递和光化学反应等方面的性能得到改善,可能是由于光照强度增加,使更多光能被吸收和转化为化学能。然而,在高温和强光条件下,Wk的上升表明OEC受到了潜在损伤或光抑制现象的发生,这反映了葡萄PSII在高温和强光条件下的应激状态,随着应激的加剧,PSII的光化学效率降低。
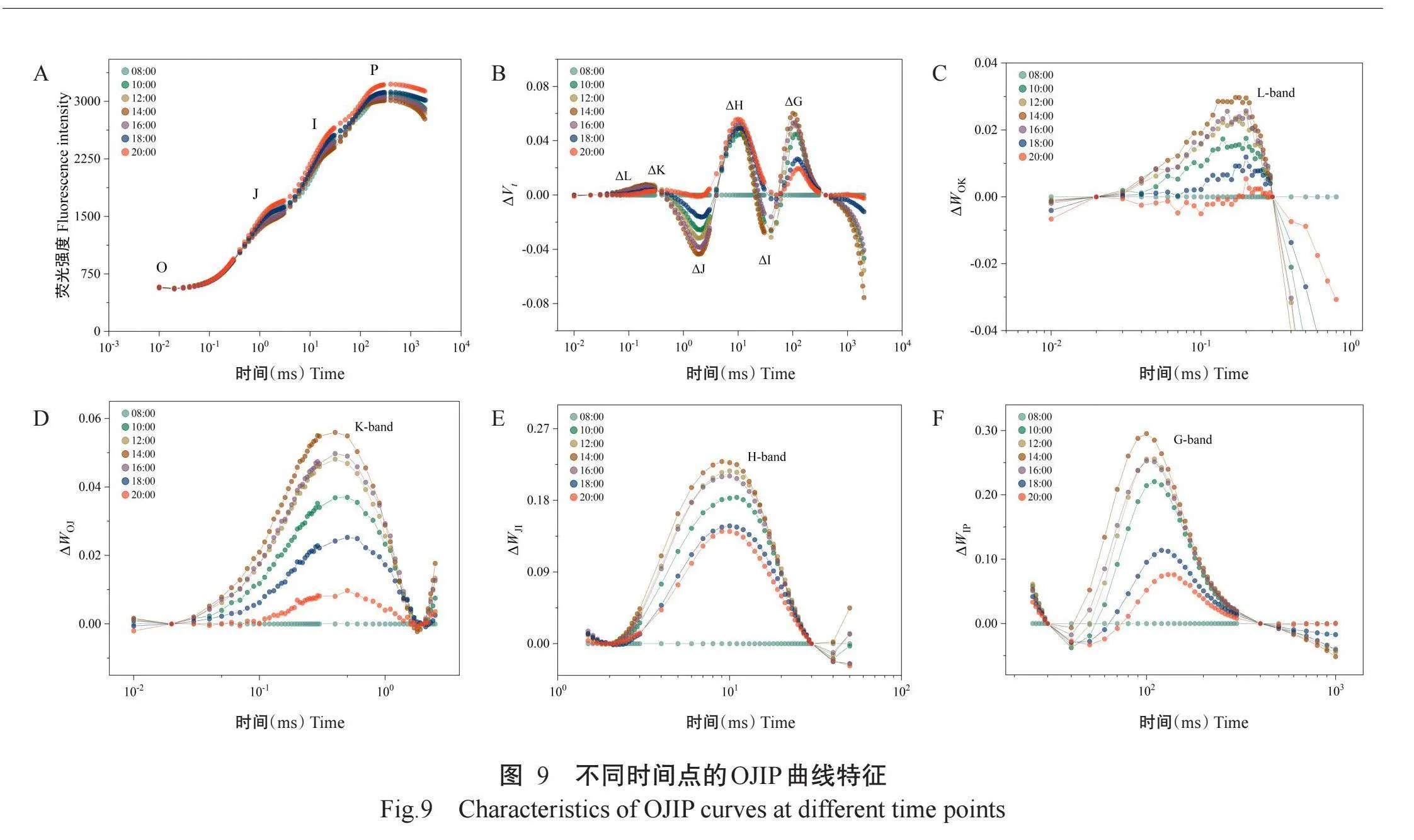
不同时间点的OJIP曲线特征反映葡萄叶片在一天中的荧光响应(图9)。OJIP曲线表明,葡萄在8:00的荧光强度较高,之后荧光强度逐渐降低,14:00降至最低值,然后逐渐上升,至20:00达最大值(图9-A),表明PSII的活性在中午光照最强的时间点有所降低。
以8:00测量的结果为对照,能明显观察到其他时间点的ΔWOK(图9-C)、ΔWOJ(图9-D)、ΔWJI(图9-E)和ΔWIP曲线(图9-F)呈正L峰、正K峰、正H峰和正G峰,表明从8:00开始,PSII单元间的连通性和能量交换效率逐渐降低,供体侧的电子传递速率逐渐下降,PSII反应中心提供给PQ池的电子数量逐渐减少,PQ池相对大小也逐渐变小,电子从PSII通过PQ池传递到PSI的速率逐渐减慢,至14:00后,PSII单元间的连通性和能量交换效率逐渐升高,供体侧的电子传递速率逐渐上升,PSII反应中心提供给PQ池的电子数量逐渐增加,PQ池相对大小也逐渐变大,电子从PSII通过PQ池传递到PSI的速率逐渐加快,推测与外界光照强弱和温度高低变化有关。
因此,OJIP曲线和参数的日变化趋势反映了葡萄叶片在一天中的光合作用变化,12:00之前,葡萄处于活跃状态,PSII光化学效率较高;14:00时,PSII光化学效率下降,光系统可能受到潜在损伤或光抑制现象开始显现;16:00之后,PSII逐渐恢复至最佳状态,效率回升。
3讨论
3.1暗适应时间对葡萄叶绿素荧光参数的影响
暗适应对于分析Fv/Fm和非光化学淬灭(NPQ)至关重要(Murchie and Lawson,2013)。暗适应可消除NPQ和其他干扰因素,使PSII达到完全氧化状态,暗适应时间通常设为20~30 min,以确保所有快速和慢速的NPQ成分完全消失。通过暗适应,可获得准确的Fo和Fm,从而准确评估Fv/Fm,对确保测量数据的准确性和可靠性至关重要。
本研究结果表明,暗适应时间对葡萄叶绿素荧光参数有明显影响,较长时间的暗适应有助于获得更加稳定可靠的测量结果。Fo和REo/CSm在暗适应15 min后趋于稳定;Fm、Mo、RC/CSm和DIo/RC在暗适应20 min后趋于稳定;Fv/Fm、Fo/Fm和PIABS在暗适应25 min后趋于稳定;Sm在暗适应30min后趋于稳定。因此,测定葡萄叶片叶绿素荧光参数的暗适应时间应在30min以上,以确保各参数的稳定性和一致性。
3.2测量光强度对葡萄叶绿素荧光参数的影响
光强度对光合作用速率影响较大(Wang et al.,2017;Janeeshma et al.,2022;Su et al.,2024)。选择合适的测量光强度,尤其是最小饱和光强度,对准确评估植物光合效率至关重要。光强度在初期会提升光合效率,直至光饱和点,此时光系统的电子传递速率和最大量子产率达到顶峰;最小饱和光强度是指光合作用速率不再显著增加的最低光强度。在测量光合效率时,采用合适的饱和光强度不仅能确保光合作用速率的最大化,还能避免低光强度导致的低估和高光强度引发的光抑制及荧光淬灭现象,从而防止试验结果失真(Li et al.,2023;Longoni et al.,2023)。因此,选择适当的光强度是确保光合效率测量数据准确和可靠的关键(Kalajietal.,2017;Pessara-kli,2024)。
本研究结果表明,不同测量光强度下葡萄叶绿素荧光参数发生明显变化,高光强度能获得更稳定的测量结果。Fv/Fm和Fo/Fm在光强度达2000μmol/(m2·s)后再无显著变化,PIABS和REo/RC等参数在光强度达2500μmol/(m2·s)时趋于稳定,光强度达3000μmol/(m2·s)时,各参数均无显著变化。因此,测量葡萄叶片OJIP曲线的最小测量光强度为3000μmol/(m2·s)。在实际测量中,还应根据具体的试验目的选择适当的测量光强度,以确保结果的准确性和可重复性。
3.3测量时间点对葡萄叶绿素荧光参数的影响
选择合适的时间点进行叶绿素荧光测量对光合作用研究的试验设计至关重要。了解葡萄在一天中不同时间点的叶绿素荧光参数变化有助于确定最适合的测量时间点,从而提高数据的准确性和可靠性。本研究结果表明,葡萄叶片的多数叶绿素荧光参数随着一天中时间点的推移而变化。PCA结果表明,8:00和20:00叶绿素荧光参数的数据点靠近,而12:00和14:00的数据点分散。随着一天中时间点的推移,Fv/Fm、RC/CSm和Sm整体呈先下降后上升的变化趋势,Fo/Fm、Wk、REo/CSm和φRo整体呈先上升后下降的变化趋势,而Fo、Fm、PIABS变化不大,但Fo在14:00时略升高,Fm略下降,说明14:00时PSII效率下降,而早晚的PSII效率较高。
葡萄叶片叶绿素荧光参数的日变化特征与环境光照强度、温度及植物自身的光合节律有关。白天光强度变化较大,早晨和傍晚光强度较低,中午光强度最高,这些变化会影响光合作用效率和叶绿素荧光参数。温度在一天中也会变化,通常中午温度最高,中午高温和强光可能导致PSII部分抑制,光化学量子产量下降。此外,气孔导度的变化影响二氧化碳吸收和水分蒸腾,从而进一步影响光合作用和叶绿素荧光(Li and Chen,2009;Campbell et al.,2019;Akinyemietal.,2023;Zhuang et al.,2023)。因此,在实际研究中,应结合环境因素和植物生理状态,综合分析叶绿素荧光参数的变化规律,选xUZZviVfR8JOvCZzN+dynePRHsvD/tvsTpHXQCEayrg=择最适合的测量时间点。
4结论
针对葡萄叶片进行OJIP曲线测定时,暗适应时间应为30 min以上,最小hV2qf7Nf/190Gmi+m8C53cGSKWeaNoONDjH8t7gYfTk=测量光强度为3000μmol/(m2·s),测量时间点宜选择在12:00之前和16:00之后,以确保结果的准确性和可靠性。
参考文献(References):
曹雄军,韩佳宇,成果,王博,马广仁,林玲,谭宗琨,黄秋秘,陈潇,陈孚仪,时晓芳,盘丰平,白先进.2023.光照时数及强度对‘阳光玫瑰’葡萄产量形成的影响[J].园艺学报,50(8):1739-1746.[Cao X J,Han J Y,Cheng G,Wang B,Ma G R,Lin L,Tan Z K,Huang Q M,Chen X,Chen F Y,Shi X F,Pan F P,Bai X J.2023.Effects of light dura‐tion and intensity on yield formation of‘Shine-Muscat’grape[J].Acta Horticulturae Sinica,50(8):1739-1746.]doi:10.16420/j.issn.0513-353x.2022-0669.
李鹏民,高辉远,Strasser R J.2005.快速叶绿素荧光诱导动力学分析在光合作用研究中的应用[J].植物生理与分子生物学学报,31(6):559-566.[Li P M,Gao H Y,Strasser RJ.2005.Application of the fast chlorophyll fluorescenceinduction dynamics analysis in photosynthesis study[J].Journal of Plant Physiology and Molecular Biology,31(6):559-566.]doi:10.3321/j.issn:1671-3877.2005.06.001.
林荣呈,杨文强,王柏臣,于龙江,王文达,田利金,迟伟,卢庆陶,韩广业,匡廷云.2021.光合作用研究若干前沿进展与展望[J].中国科学:生命科学,51(10):1376-1384.[Lin R C,Yang W Q,Wang B C,Yu L J,Wang W D,Tian L J,Chi W,Lu Q T,Han G Y,Kuang T Y.2021.Advances and perspectives in several areas of photosynthesis research[J].Scientia Sinica(Vitae),51(10):1376-1384.]doi:10.1360/SSV-2021-0217.
谢计蒙,王海波,王孝娣,王宝亮,郑晓翠,魏长存,刘凤之.2012.设施葡萄品种连年丰产能力与光合生理特性关系研究[J].果树学报,29(5):843-851.[Xie J M,Wang H B,Wang X D,Wang B L,Zheng X C,Wei C C,Liu F Z.2012.Relationship between the ability of sustainable pro‐ductivity and photosynthetic indexes of grape cultivars in greenhouse[J].Journal of Fruit Science,29(5):843-851.]doi:10.13925/j.cnki.gsxb.2012.05.026.
徐文清,李少楠,方啸宇,宋思言,葛孟清,宋长年,房经贵.2023.盐胁迫对2个葡萄品种扦插苗光合特性及抗氧化能力的影响[J].南方农业学报,54(10):3000-3009.[Xu W Q,Li S N,Fang X Y,Song S Y,Ge M Q,Song C N,Fang J G.2023.Effects of salt stress on photosynthetic characteristics and antioxidant capacity of cutting seed‐lings of two grape varieties[J].Journal of Southern Agri‐culture,54(10):3000-3009.]doi:10.3969/j.issn.2095-1191.2023.10.018.
杨文强,林荣呈,端木德强,李磊,卢从明,欧阳敏,王文达,孙韬,田利金,王柏臣,朱新广.2024.近10年光合作用领域若干重要研究进展[J].植物生理学报,60(2):211-247.[Yang W Q,Lin R C,Duanmu D Q,Li L,Lu C M,Ou-yang M,Wang W D,Sun T,Tian L J,Wang B C,Zhu X G.2024.Multiple of important progress on photosynthesis inthe last 10 years[J].Plant Physiology Journal,60(2):211-247.]doi:10.13592/j.cnki.ppj.600007.
Akinyemi O O,Čepl J,Keski-Saari S,TomáškováI,Stejskal J,Kontunen-Soppela S,Keinänen M.2023.Derivative-based time-adjusted analysis of diurnal and within-tree variationin the OJIP fluorescence transient of silver birch[J].Photo‐synthesis Research,157(2-3):133-146.doi:10.1007/s 11120-023-01033-x.
Campbell P K E,Huemmrich K F,Middleton E M,Ward LA,Julitta T,Daughtry C S T,Burkart A,Russ A L,Kustas W P.2019.Diurnal and seasonal variations in chlorophyll fluorescence associated with photosynthesis at leaf and canopy scales[J].Remote Sensing,11(5):488.doi:10.3390/rs 11050488.
Dimitrova S,Paunov M,Pavlova B,Dankov K,Kouzmanova M,Velikova V,Tsonev T,Kalaji H M,Goltsev V.2020.Photosynthetic efficiency of two Platanus orientalisL.ecotypes exposed to moderately high temperature-JIP-test analysis[J].Phojug54Ghcy1REuEmJ7Vx0ew==tosynthetica,58(SI):657-670.doi:10.32615/ps.2020.012.
Gaevskii N A,Kolmakov V I,Popel'nitskii V A,Gold V M,Dubovskaya O P.2000.Evaluation of the effect of light intensity on the measurement of the photosynthetic rate in plankton microalgae by the chlorophyll fluorescence method[J].Russian Journal of Plant Physiology,47:820-825.doi:10.1023/A:1026671531500.
Goltsev V N,Kalaji H M,Paunov M,Bąba W,Horaczek T,Mojski J,Kociel H,Allakhverdiev S I.2016.Variable chlo‐rophyll fluorescence and its use for assessing physiological condition of plant photosynthetic apparatus[J].Russian Journal of Plant Physiology,63:869-893.doi:10.1134/S1021443716050058.
Janeeshma E,Johnson R,Amritha M S,Noble L,Aswathi K PR,Telesiński A,Kalaji H M,Auriga A,Puthur J T.2022.Modulations in chlorophyll a fluorescence based on inten‐sity and spectral variations of light[J].International Jour‐nal of Molecular Sciences,23(10):5599.doi:10.3390/ijms23105599.
Kalaji H M,Bąba W,Gediga K,Goltsev V,Samborska I A,Cetner M D,Dimitrova S,Piszcz U,Bielecki K,Kar‐mowska K,Dankov K,Kompała-Bąba A.2018.Chloro‐phyll fluorescence as a tool for nutrient status identifica‐tion in rapeseed plants[J].Photosynthesis Research,136(3):329-343.doi:10.1007/s 11120-017-0467-7.
Kalaji H M,Jajoo A,OukarroumA,Brestic M,Zivcak M,Sam‐borska I A,Cetner M D,Łukasik I,Goltsev V,Ladle R J.2016.Chlorophyll a fluorescence as a tool to monitor physiological status of plants under abiotic stress condi‐tions[J].ActaPhysiologiae Plantarum,38:102.doi:10.1007/s11738-016-2113-y.
Kalaji M H,Goltsev V N,Żuk-Gołaszewska K,Zivcak M,Brestic M.2017.Chlorophyll fluorescence:Understan-ding crop performance—Basics and applications[M].Boca Raton:CRC Press:37-55.doi:10.1201/9781315153605.
Li R Q,He Y,Chen J Y,Zheng S Y,Zhuang C X.2023.Research progress in improving photosynthetic efficiency[J].International Journal of Molecular Sciences,24(11):9286.doi:10.3390/ijms24119286.
Li X W,Chen S L.2009.Diurnal changes in gas exchange and chlorophyll fluorescence parameters of Fritillaria cirrhosa and F.delavayi under field conditions[J].Photosynthetica,47(2):191-198.doi:10.1007/s 11099-009-0032-5.
Liu G T,Jiang J F,Liu X N,Jiang J Z,Sun L,Duan W,Li R M,Wang Y,Lecourieux D,Liu C H,Li S H,Wang L J.2019.New insights into the heat responses of grape leaves via combined phosphoproteomic and acetylproteomic analyses[J].Horticulture Research,6:100.doi:10.1038/s41438-019-0183-x.
Liu Y X,Jiang J F,Fan X C,Zhang Y,Wu J Y,Wang L J,Liu C H.2020.Identification of heat tolerance in Chinese wildgrape germplasm resources[J].Horticulturae,6(4):68.doi:10.3390/horticulturae6040068.
Longoni F,Grieco M,Santabarbara S,Harbinson J.2023.Edi-torial:Photosynthesis under fluctuating light[J].Frontiers in Plant Science,14:1220360.doi:10.3389/fpls.2023.1220360.
Lysenko V,D Rajput V,Kumar Singh R,Guo Y,Kosolapov A,Usova E,Varduny T,Chalenko E,Yadronova O,Dmitriev P,Zaruba T.2022.Chlorophyll fluorometry in evaluating photosynthetic performance:Key limitations,possibilities,perspectives and alternatives[J].Physiology and Molecu-lar Biology of Plants,28(11-12):2041-2056.doi:10.1007/s12298-022-01263-8.
Murchie E H,Lawson T.2013.Chlorophyll fluorescence analy-sis:A guide to good practice and understanding some new applications[J].Journal of Experimental Botany,64(13):3983-3998.doi:10.1093/jxb/ert208.
Naulleau A,Gary C,Prévot L,Hossard L.2021.Evaluating strategies for adaptation to climate change in grapevine production-A systematic review[J].Frontiers in Plant Science,11:607859.doi:10.3389/fpls.2020.607859.
Palliotti A,Poni S.2015.Grapevine under light and heat stresses[M]//Gerós H,Chaves M M,Gil H M,DelrotS.Grapevine in a changing environment:A molecular and ecophysiologicalperspective.West Sussex:John Wiley&Sons,Ltd.:148-178.doi:10.1002/9781118735985.ch7.
Pessarakli M.2024.Handbook of photosynthesis[M].The 4th Edition.Boca Raton:CRC Press:714-722.doi:10.1201/b22922.
Strasser B J,Strasser R J.1995.Measuring fast fluorescence transients to address environmental questions:The JIP-test[M]//Mathis P.Photosynthesis:From light to biosphere:Vol 5.Dordrecht:Kluwer Academic Publishers:977-980.doi:10.1007/978-94-009-0173-5_1142.
Strasser R J.1981.The grouping model of plant photosynthe-sis:Heterogeneity of photosynthetic units in thylakoids[M]//AkoyunoglouG.PhotosynthesisⅢ.Structure and molecular organization of the photosynthetic apparatus.Philadelphia:Balaban International Science Services:727-737.
Su P F,Ding S S,Wang D C,Kan W J,Yuan M,Chen X,Tang C G,Hou J Y,Wu L F.2024.Plant morphology,secondary metabolites and chlorophyll fluorescence of Artemisia argyi under different LED environments[J].Photosynthe-sis Research,159(2-3):153-164.doi:10.1007/s 11120-023-01026-w.
Swoczyna T,Kalaji H M,Bussotti F,Mojski J,Pollastrini M.2022.Environmental stress—What can we learn from chlo-rophyll a fluorescence analysis in woody plants?A review[J].Frontiers in Plant Science,13:1048582.doi:10.3389/fpls.2022.1048582.
Wang Y,Tong Y F,Chu H L,Chen X M,Guo H P,Yuan H W,Yan D L,Zheng B S.2017.Effects of different light quali-ties on seedling growth and chlorophyll fluorescence parameters of Dendrobium officinale[J].Biologia,72(7):735-744.doi:10.1515/biolog-2017-0081.
Zagorchev L,Traianova A,Teofanova D,Li J,Kouzmanova M,Goltsev V.2020.Influence of Cuscuta campestris Yunck.on the photosynthetic activity of Ipomoea tricolor Cav.—in vivo chlorophyll a fluorescence assessment[J].Photo-synthetica,58(SI):422-432.doi:10.32615/ps.2020.004.
Zhou Y F,Mahmoud Ali H S,Xi J S,Yao D D,Zhang H H,Li X J,Yu K,Zhao F Y.2024.Response of photosynthetic characteristics and yield of grape to different CO2 concen-trations in a greenhouse[J].Frontiers in Plant Science,15:1378749.doi:10.3389/fpls.2024.1378749.
Zhuang J,Wang Q,Song G M,Jin J.2023.Validating and developing hyperspectral indices for tracing leaf chloro-phyll fluorescence parameters under varying light condi-tions[J].Remote Sensing,15(19):4890.doi:10.3390/rs15194890.
(责任编辑刘可丹)
