YY1对胶质瘤细胞迁移能力的影响及其分子机制
2024-10-17解冉冉吕志民赵高翔




[摘要]目的探讨转录因子阴阳1(YY1)对胶质瘤细胞迁移的影响及其分子机制。
方法体外培养人胶质瘤细胞U251和U87,对细胞过表达或敲低YY1后,通过Transwell实验、细胞划痕实验、克隆形成实验检测过表达或敲低YY1对胶质瘤细胞U251和U87迁移的影响;通过基因转录调控数据库(GTRD)预测YY1下游靶基因,应用实时荧光定量PCR(qRT-PCR)和蛋白印迹实验检测YY1下游靶基因基质金属蛋白酶15(MMP15)mRNA及其蛋白的表达情况;利用双荧光素酶报告实验检测YY1与MMP15启动子的结合区域。通过Transwell实验、细胞划痕实验、克隆形成实验检测过表达HA-YY1的同时敲低MMP15对胶质瘤细胞U251和U87迁移的影响。
结果Transwell实验结果表明,与未过表达HA-YY1的对照组相比,过表达HA-YY1组U251和U87细胞的迁移能力显著提高(t=13.300、5.847,P<0.05);划痕实验结果显示,过表达HA-YY1组U251和U87细胞的划痕间距较对照组明显变小(t=9.698、7.215,P<0.05);克隆形成实验结果显示,过表达HA-YY1组U251和U87细胞的克隆形成能力较对照组显著提高(t=5.871、5.095,P<0.05);双荧光素酶报告实验显示,YY1能够直接结合到MMP15的启动子区域,并促进MMP15的表达;而敲低MMP15可以抑制由于YY1过表达而促进的细胞迁移。
结论YY1通过转录激活MMP15促进胶质瘤细胞迁移。
[关键词]胶质母细胞瘤;YY1转录因子;基质金属蛋白酶15;细胞运动
[中图分类号]R34
[文献标志码]A
[文章编号]2096-5532(2024)04-0501-07
doi:10.11712/jms.2096-5532.2024.60.134
[开放科学(资源服务)标识码(OSID)]
[网络出版]https://link.cnki.net/urlid/37.1517.r.20240927.1331.001;2024-09-2909:18:45
Effect of Yin Yang 1 on the migration ability of gliomacells and its molecular mechanismXIE Ranran, LUZhimin, ZHAO Gao-xiang
(School of Basic Medicine, Qingdao University, Qingdao 266071, China); [Abstract]ObjectiveTo investigate the effect of the transcription factor Yin Yang 1 (YY1) on the migration of glioma cells and its molecular mechanism.
MethodsHuman glioma U251 and U87 cells were cultured in vitro, and after the overexpression or knockdown of YY1, Transwell assay, cell scratch assay, and colony formation assay were used to observe the effect of YY1 overexpression or knockdown on the migration of glioma U251 and U87 cells. The Gene Transcription Regulation Database was used to predict the downstream targetgenes of YY1, and quantitative real-time PCR and Western blot were used to measure the mRNA and protein expression levels of matrix metalloproteinase 15 (MMP15), a downstream target gene of YY1. Dual-luciferase reporter assay was used to investigate the binding region between YY1 and MMP15 promoter.Transwell assay, cell scratch assay, and colony formation assay were used to investigate the effect of HA-YY1 overexpression and MMP15 knockdown on the migration of glioma U251 and U87 cells.
ResultsTranswell assay showed that compared with the control group without HA-YY1 overexpression, the HA-YY1 overexpression group had a significant increase in the migration ability of U251 and U87 cells (t=13.300,5.847;P<0.05). Cell scratch assay showed that the HA-YY1 overexpression group had a significant reduction in scratch spacing (t=9.698,7.215;P<0.05). Colony formation assay showed significant increases in the colony formation ability of U251 and U87 cells with HA-YY1 overexpression (t=5.871,5.095;P<0.05). Dual-luciferase reporter assay showed that YY1 could directly bind to the promoter region of MMP15 and promote the expression of MMP15, while knockdown of MMP15 could inhibit cell migration promoted by YY1 overexpression.
ConclusionYY1 promotes the migration of glioma cells through transcriptional activation of MMP15.
[Key words]glioblastoma; YY1 transcription factor; matrix metalloproteinase 15; cell movement
胶质母细胞瘤(GBM)是最常见的具有高度侵袭性的原发性恶性脑肿瘤 [1-3],其具有的强大的血管生成能力、抗辐射性和侵袭性使其成为最致命的癌症之一[4]。转录因子阴阳1(YY1)是一种在进化上非常保守的含有C2H2锌指结构的双功能转录因子[5-7],在人类组织中广泛表达,并参与控制多种细胞机制,其中最显著的是YY1在细胞中分别以转录激活子和转录抑制子来发挥作用[7-8]。越来越多的研究表明,YY1在脑胶质瘤等许多癌症细胞中高度表达,并对癌症进展起着至关重要的作用[9-10]。基质金属蛋白酶(MMPs)是一个与Zn2+结合并具有Ga2+依赖性的蛋白酶家族[11],能够促进细胞增殖、迁移和分化,并在细胞凋亡、血管生成、组织修复和免疫应答中发挥关键作用[12]。基质金属蛋白酶15(MMP15)属于膜锚定MMPs(MT-MMP),可能与功能调节或定位相关的细胞内蛋白相互作用[13]。本研究探讨YY1促进脑胶质瘤细胞迁移的分子机制,现将结果报告如下。
1资料和方法
1.1实验材料
人脑胶质瘤细胞U87、U251(ATCC),DMEM培养基(Hyclone),胎牛血清(Gibco),链霉素和青霉素(Gibco),质粒pcDNA3.1-HA-YY1、PLKO-shMMP15、PLKO-shYY1均为自己构建,转染试剂H4000(英格恩生物公司Engreen Biosystem Co,Ltd.),Trizol试剂(思科捷),逆转录酶试剂盒(碧云天),BCA蛋白质定量试剂盒(诺唯赞),MMP15抗体(ABclonal),YY1(Santa Cruz),β-肌动蛋白(β-Actin)抗体(美国CST公司),二抗(美国CST公司),ECL试剂盒(雅酶生物)。
1.2实验方法
1.2.1细胞培养人脑胶质瘤细胞系U87、U251细胞加入含体积分数0.10胎牛血清、100 mg/L链霉素和100 kU/L青霉素的DMEM培养液,在含体积分数0.05 CO2的37 ℃培养箱中培养。每隔1 d观察细胞生长状况并进行传代,取对数生长期细胞进行实验。
1.2.2质粒构建分子克隆构建质粒pcDNA3.1-HA-YY1、PLKO-shMMP15、PLKO-shYY1及其相应的阴性对照质粒。所用引物及其序列见表1。
1.2.3细胞转染在细胞培养密度至70%~80%时用转染试剂H4000将质粒转染进入细胞中,转染后8 h换液,48 h后进行下一步实验。
1.2.4基因的过表达与敲除在细胞生长密度达70%~80%时使用H4000转染试剂将构建好的质粒pcDNA3.1-HA-YY1转染进入细胞中使其表达(过表达);将PLKO-shYY1、PLKO-shMMP15质粒转染进入细胞使其表达(相关基因被敲低),以转染PLKO.1质粒作为对照。
1.2.5蛋白质印迹法从细胞中收集总蛋白,用BCA蛋白质定量试剂盒测定蛋白质浓度,然后用SDS-PAGE电泳分离蛋白质并将其转移到PVDF膜上。用50 g/L 脱脂奶粉封闭1 h后,分别加入抗MMP15、YY1、β-actin抗体4 ℃孵育过夜,然后将膜与相应种属的二抗在室温共同孵育1 h,最后用ECL试剂盒检测蛋白质条带。
1.2.6细胞计数将培养皿中的贴壁细胞用胰酶消化,离心,用1 mL DMEM培养液重悬细胞并吹打混匀,取10 μL细胞悬液加入90 μL的1×PBS溶液吹打混合均匀,然后加入细胞计数板中进行细胞计数。
1.2.7Transwell实验细胞转染48 h后,用胰酶消化细胞,调整细胞密度为2×108/L。随后取180 μL细胞悬液加入涂有基质胶的小室中,在下室中加入含体积分数0.10胎牛血清的DMEM培养液600 μL,将小室放入下室中,一起放入37 ℃、含体积分数0.05 CO2的培养箱中培养48 h。随后取出小室擦掉内层基质胶,1×PBS溶液清洗后用40 g/L多聚甲醛固定1 h,再用结晶紫染色20 min,最后在显微镜下拍照并计数,观察细胞侵袭能力。
1.2.8细胞划痕实验在转染后的细胞生长至100%之后,用20 μL枪头垂直在细胞表层划线形成划痕,随后用无菌1×PBS溶液清洗划下的细胞,使留下的划痕肉眼清晰可见,然后更换新鲜无血清培养液,在37 ℃、含体积分数0.05 CO2培养箱中培养,分别在培养0、48 h时显微镜下拍照并测量划痕宽度。
1.2.9平板克隆形成实验将转染后的细胞制成细胞悬液,计数后取300个细胞接种于含有DMEM培养液的6孔板中,培养10~14 d,直至6孔板中出现肉眼可见的细胞克隆时终止培养。倒掉培养液,用1×PBS溶液洗2遍;随后用40 g/L多聚甲醛固定1 h,1×PBS洗3次;结晶紫染色20 min,1×PBS溶液洗3次。最后计数形成的克隆。
1.2.10实时荧光定量PCR(qRT-PCR)用Trizol试剂提取总RNA,随后用逆转录酶试剂盒逆转录得到cDNA,以其作为模板行qRT-PCR检测MMP15 mRNA表达。用β-Actin作为内参基因,采用比较阈值法进行结果分析,结果以2-△△CT表示。所用引物及其序列见表2。
1.2.11双荧光素酶活性检测使用JASPER(jaspar.elixir.no)网站预测YY1和 MMP15 的启动子之间的结合位点,将扩增的MMP15基因启动子片段插入pGL3-basic载体中以构建野生型(WT)质粒pMMP15-WT,并将MMP15基因启动子突变序列(CTTGGCAATCTG)插入到pGL3-basic 载体中以构建突变型(MUT)质粒pMMP15-MUT。再使用H4000将构建的野生型质粒pMMP15-WT和突变型质粒pMMP15-MUT分别转染入细胞,同时分别转染HA-YY1质粒并以转染了pcDNA3.1质粒的细胞作对照,使用双荧光素酶报告基因检测系统检测转染48 h后报告基因的活性,同时参考海肾萤光素酶活性进行结果分析。
1.3统计学分析
采用GraphPad Prism 8.3.0软件进行统计学分析。计量资料用±s表示,数据间比较采用独立样本t检验,P<0.05为差异有统计学意义。
2结果
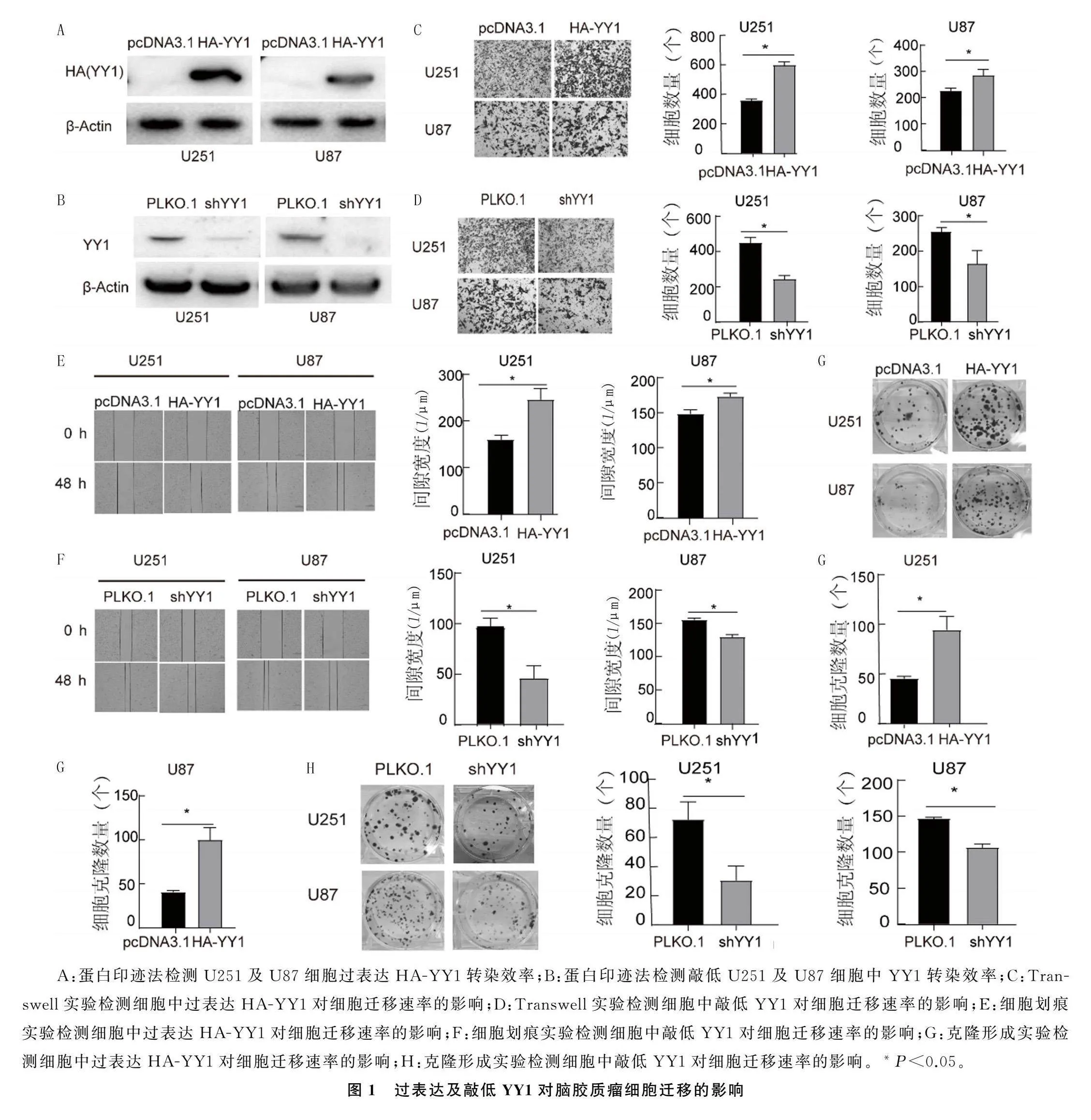
2.1YY1对脑胶质瘤细胞迁移的影响
蛋白印迹法检测结果显示,U251、U87细胞转染HA-YY1以及shYY1可分别有效过表达和敲除YY1(图1A、B)。Transwell实验结果显示,U251、U87细胞过表达HA-YY1组穿过小室的细胞数量与未过表达HA-YY1的对照组相比明显增多(t=13.300、5.847,P<0.05;图1C);而敲低细胞中的YY1后,穿过小室的细胞数量与未敲低YY1的对照组相比则明显减少(t=13.970、5.284,P<0.05;图1D)。细胞划痕实验结果显示,过表达HA-YY1后,U251、U87细胞的迁移速度与未过表达HA-YY1的对照组相比变快(t=9.698、7.215,P<0.05;图1E);而敲低YY1后,U251、U87细胞的迁移速度则明显变慢(t=7.137、15.220,P<0.05;图1F)。克隆形成实验结果显示,过表达HA-YY1组形成的细胞克隆数量与未过表达HA-YY1的对照组相比较明显增多(t=5.871、5.095,P<0.05;图1G);而YY1敲除组细胞克隆形成数量明显较对照组减少(t=4.349、8.786,P<0.05;图1H)。
2.2YY1对MMP15表达影响
通过基因转录调控数据库(GTRD数据库)预测出YY1可能的下游靶基因为EGFR、Wnt6、BCAT1、ATG4D、MMP15、FKBP3。qRT-PCR方法验证显示,过表达HA-YY1的U251和U87细胞中MMP15的表达明显上调(t=4.605、3.354,P<0.05;图2A),而敲除YY1则会显著下调U251和U87细胞中MMP15 mRNA的表达(t=12.630、9.235,P<0.05;图2B);蛋白质印迹实验结果显示,U251和U87细胞中过表达HA-YY1导致MMP15表达量上升(图2C),而敲除YY1则会导致MMP15表达量下降(图2D)。
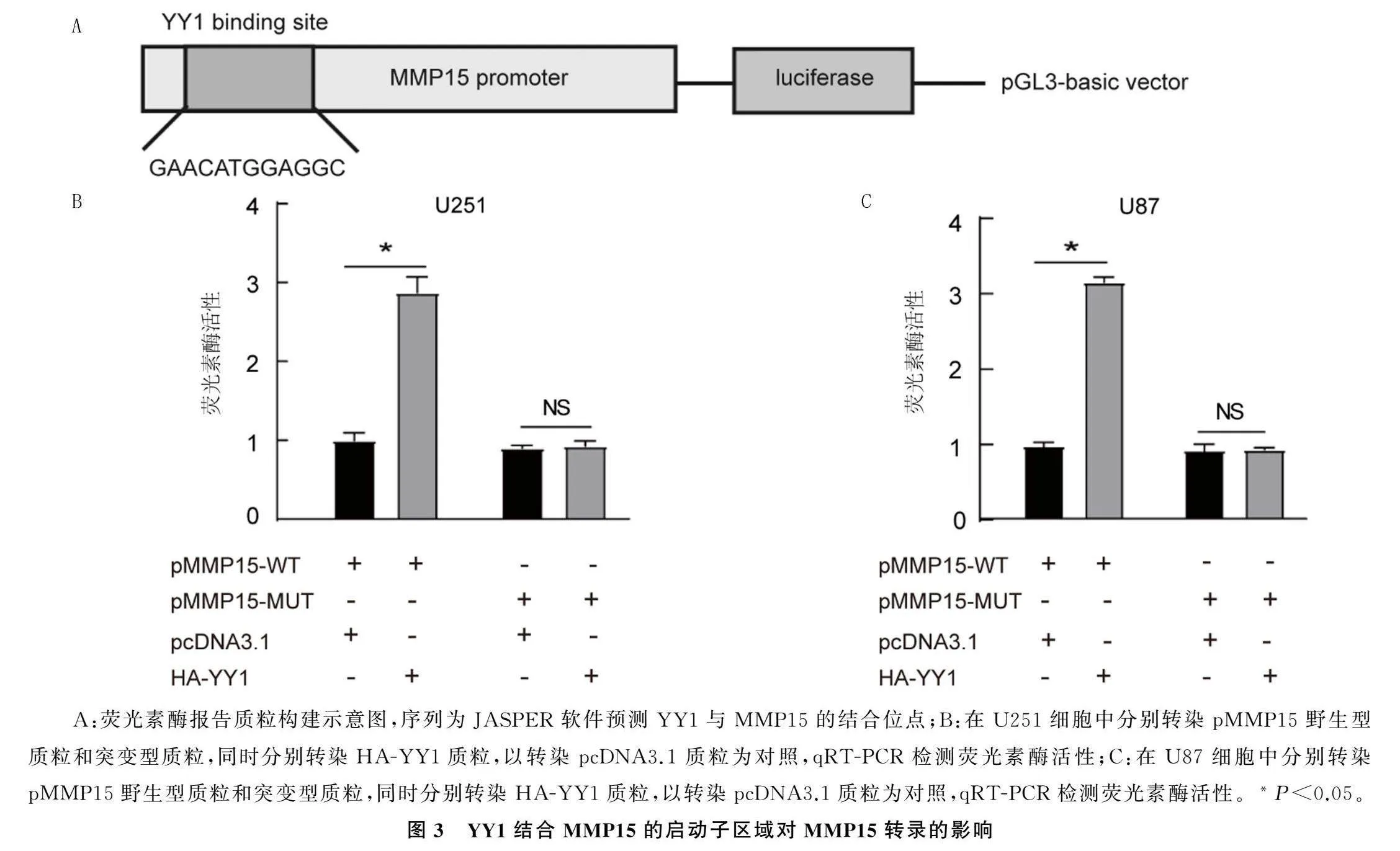
2.3YY1结合MMP15的启动子区域对MMP15转录的影响
双荧光素酶报告实验结果显示,与同时转染了pMMP15-MUT质粒和HA-YY1质粒的对照组相比较,转染了pMMP15-WT质粒和HA-YY1质粒的细胞相对荧光素酶活性有显著提高(t=14.610、40.490,P<0.05)。见图3。
2.4YY1上调MMP15表达对胶质瘤细胞迁移的影响
在U251和U87细胞中过表达HA-YY1的同时敲低MMP15,蛋白印迹法检测结果显示,YY1明显过表达而MMP15明显被敲低(图4A)。Transwell实验结果显示,过表达HA-YY1而敲低MMP15后穿过小室的细胞数量较过表达HA-YY1而未敲低MMP15组有明显减少(t=7.279、28.020,P<0.05;图4B)。划痕实验结果显示,过表达HA-YY1而敲低MMP15能够显著地抑制细胞的迁移(t=7.063、5.261,P<0.05;图4C)。克隆形成实验结果显示,与仅过表达HA-YY1组相比较,过表达HA-YY1而敲低MMP15组的克隆形成能力明显减弱(t=3.189、4.461,P<0.05;图4D)。
3讨论
GBM为恶性脑肿瘤,具有高发病率和高死亡率的特点[14]。目前已经有很多关于胶质瘤发生发展机制及影响因素的研究。XU等[15]研究显示,Slit2/Lobo1信号能够通过Cdc42 GTP的失活抑制胶质瘤细胞的迁移和侵袭;CHAO等[16]研究结果显示,Sry相关基因(Sox)家族转录因子Sox9能够促进胶质瘤细胞的迁移和侵袭。LI等[17]研究结果表明,LncRNA有望成为胶质瘤治疗的生物标志物。
YY1为双功能转录因子,根据其启动子环境、染色质结构和相互作用蛋白的不同,可以作为激活子、抑制子或启动子结合蛋白发挥作用[18]。有研究表明,YY1在结直肠癌、胶质瘤、前列腺癌、宫颈癌等癌症的发展中主要起促进作用[19-22],在胰腺癌中A:蛋白印迹法检测U251及U87细胞过表达HA-YY1转染效率;B:蛋白印迹法检测敲低U251及U87细胞中YY1转染效率;C:Transwell实验检测细胞中过表达HA-YY1对细胞迁移速率的影响;D:Transwell实验检测细胞中敲低YY1对细胞迁移速率的影响;E:细胞划痕实验检测细胞中过表达HA-YY1对细胞迁移速率的影响;F:细胞划痕实验检测细胞中敲低YY1对细胞迁移速率的影响;G:克隆形成实验检测细胞中过表达HA-YY1对细胞迁移速率的影响;H:克隆形成实验检测细胞中敲低YY1对细胞迁移速率的影响。*P<0.05。
A:qRT-PCR检测U251和U87细胞中过表达HA-YY1后MMP15 mRNA的表达;B:qRT-PCR检测U251和U87细胞中敲低YY1后MMP15 mRNA的表达;C:蛋白印迹法检测U251和U87细胞中过表达HA-YY1后MMP15的表达;D:蛋白印迹法检测U251和U87细胞中敲低YY1后MMP15的表达。*P<0.05。
A:荧光素酶报告质粒构建示意图,序列为JASPER软件预测YY1与MMP15的结合位点;B:在U251细胞中分别转染pMMP15野生型质粒和突变型质粒,同时分别转染HA-YY1质粒,以转染pcDNA3.1质粒为对照,qRT-PCR检测荧光素酶活性;C:在U87细胞中分别转染pMMP15野生型质粒和突变型质粒,同时分别转染HA-YY1质粒,以转染pcDNA3.1质粒为对照,qRT-PCR检测荧光素酶活性。*P<0.05。
主要起抑制作用[23],而在乳癌、肺癌等少数癌症中既起促进的作用又起抑制的作用。目前,对于YY1促进脑胶质瘤发展作用机制的研究更多地集中在miRNA、长链非编码RNA(lncRNA)上,例如miR-218、lncRNA SNHG5、lncRNA SNHG17、lncRNA LINC00466、lncRNA KB-1460A1.5、Circular RNA circ_0001588以及NF-κB家族成员RelB等,都被发现在胶质瘤细胞中能够与YY1发生相互作用进而影响胶质瘤的进展[4,14,17,24-25]。而本研究发现,YY1能够促进MMPs家族成员MMP15的表达,进
A:蛋白印迹检测U251及U87细胞中过表达HA-YY1的同时敲低MMP15转染效率;B:Transwell实验检测过表达HA-YY1的同时敲低MMP15对细胞迁移能力的影响;C:细胞划痕实验检测过表达HA-YY1的同时敲低MMP15对细胞迁移能力的影响;D:克隆形成实验检测过表达HA-YY1的同时敲低MMP15对细胞迁移能力的影响。*P<0.05。
而促进胶质瘤细胞的迁移。
本研究首先在胶质瘤细胞U251和U87中过表达HA-YY1,然后应用Transwell实验、细胞划痕实验、克隆形成实验检测过表达HA-YY1对胶质瘤细胞迁移的影响,结果显示过表达HA-YY1能够显著促进胶质瘤细胞的迁移,而敲低YY1会抑制胶质瘤细胞的迁移,表明YY1通过促进胶质瘤细胞迁移来促进胶质瘤发展。那么YY1又是如何促进细胞迁移的呢?本文通过GTRD数据库预测出YY1下游
靶基因为EGFR、Wnt6、BCAT1、ATG4D、MMP15、FKBP3,由于MMPs能够促进细胞增殖、迁移和分化[12],猜测YY1是通过调节MMP15来促进细胞
迁移的。于是本研究通过qRT-PCR方法及蛋白质
印迹实验检测YY1是否会影响MMP15的表达,结果显示,YY1能够明显上调MMP15的表达,提示MMP15可能是YY1的下游靶基因;进一步研究显示,YY1能够作为转录因子通过与MMP15的启动子区域结合进而上调MMP15的表达。鉴于YY1既可以促进胶质瘤细胞迁移又可以促进MMP15表达,本文接下来探究MMP15敲低后是否会抑制YY1对胶质瘤细胞迁移的促进作用。本文研究在U251和U87细胞中过表达HA-YY1的同时敲低MMP15来验证YY1是否是通过调节MMP15的表达来促进胶质瘤细胞的迁移,结果显示,敲低MMP15会抑制YY1过表达引起的促细胞迁移。
综上所述,YY1能够作为转录因子直接结合到MMP15的启动子区域,进而上调MMP15的表达,最终促进胶质瘤细胞的迁移。本研究发现了YY1促进胶质瘤进展的一种新的分子机制,为胶质瘤的治疗提供了一个新的可能的方向。
[参考文献]
[1]OSTROM Q T, GITTLEMAN H, TRUITT G, et al.
CBTRUS statistical report: primary brain and other central
nervous system tumors diagnosed in the United States in
2011—2015[J]. Neuro-oncology, 2018,20(suppl_4):iv1-iv86.
[2]OSTROM Q T, BAUCHET L, DAVIS F G, et al. The epidemiology of glioma in adults: a “state of the science” review[J]. Neuro-oncology, 2014,16(7):896-913.
[3]OMURO A, DEANGELIS L M. Glioblastoma and other malignant gliomas: a clinical review[J]. JAMA, 2013,310(17):1842-1850.
[4]WATERS M R, GUPTA A S, MOCKENHAUPT K, et al. RelB acts as a molecular switch driving chronic inflammation in glioblastoma multiforme[J]. Oncogenesis, 2019,8(6):37.
[5]TAN A C, ASHLEY D M, LPEZ G Y, et al. Management of glioblastoma: state of the art and future directions[J]. CA: a Cancer Journal for Clinicians, 2020,70(4):299-312.
[6]SHI Y, LEE J S, GALVIN K M. Everything you have ever wanted to know about Yin Yang 1[J]. Biochimicaet Biophysica Acta, 1997,1332(2):F49-F66.
[7]SARVAGALLA S, KOLAPALLI S P, VALLABHAPURAPU S. The two sides of YY1 in cancer: afriend and a foe[J]. Frontiersin Oncology, 2019,9:1230.
[8]SHI Y, SETO E, CHANG L S, et al. Transcriptional repression by YY1, a human GLI-Krüppel-related protein, and relief of repression by adenovirus E1A protein[J]. Cell, 1991,67(2):377-388.
[9]ATCHISON M, BASU A, ZAPRAZNA K, et al. Mechanisms of Yin Yang 1 in oncogenesis: the importance of indirect effects[J]. Critical Reviewsin Oncogenesis, 2011,16(3-4):143-161.
[10]ZHANG Q, STOVALL D B, INOUE K, et al. The oncogenic role of Yin Yang 1[J]. Critical Reviewsin Oncogenesis, 2011,16(3-4):163-197.
[11]COUSSENS L M, WERB Z. Matrix metalloproteinases and the development of cancer[J]. Chemistry& Biology, 1996,3(11):895-904.
[12]CUI N, HU M, KHALIL R A. Biochemical and biological attributes of matrix metalloproteinases[J]. Progressin Molecular Biology and Translational Science, 2017,147:1-73.
[13]RAEISI M, ZEHTABI M, VELAEI K, et al. Anoikis in can-
cer: the role of lipid signaling[J]. Cell Biology International, 2022,46(11):1717-1728.
[14]WANG Q, ZHENG D H, LI Y H, et al. Circular RNA circ_0001588 sponges miR-211-5p to facilitate the progression of glioblastoma via up-regulating YY1 expression[J]. The Journal of Gene Medicine, 2021,23(10):e3371.
[15]XU Y, LI W L, FU L, et al. Slit2/Robo1 signaling in glioma migration and invasion[J]. Neuroscience Bulletin, 2010, 26(6):474-478.
[16]CHAO M, LIU N, SUN Z C, et al. TGF-β signaling promotes glioma progression through stabilizing Sox9[J]. Frontiersin Immunology, 2020,11:592080.
[17]LI H X, LI T H, HUANG D H, et al. Long noncoding RNA SNHG17 induced by YY1 facilitates the glioma progression through targeting miR-506-3p/CTNNB1 axis to activate Wnt/β-catenin signaling pathway[J]. Cancer Cell International, 2020,20:29.
[18]KIM J D, YU S, KIM J. YY1 is autoregulated through its own DNA-binding sites[J]. BMC Molecular Biology, 2009,10:85.
[19]WAN M M, HUANG W W, KUTE T E, et al. Yin Yang 1 plays an essential role in breast cancer and negatively regulates p27[J]. The American Journal of Pathology, 2012,180(5):2120-2133.
[20]ZHU G Q, QIAN M P, LU L S, et al. O-GlcNAcylation of YY1 stimulates tumorigenesis in colorectal cancer cells by targeting SLC22A15 and AANAT[J]. Carcinogenesis, 2019,40(9):1121-1131.
[21]KASHYAP V, BONAVIDA B. Role of YY1 in the pathogenesis of prostate cancer and correlation with bioinformatic data sets of gene expression[J]. Genes& Cancer, 2014,5(3-4):71-83.
[22]BARITAKI S, SIFAKIS S, HUERTA-YEPEZ S, et al. Overexpression of VEGF and TGF-beta1 mRNA in Pap smears correlates with progression of cervical intraepithelial neoplasia to cancer: implication of YY1 in cervical tumorigenesis and HPV infection[J]. International Journal of Oncology, 2007,31(1):69-79.
[23]ZHANG J J, ZHU Y, XIE K L, et al. Yin Yang-1 suppresses invasion and metastasis of pancreatic ductal adenocarcinoma by downregulating MMP10 in a MUC4/ErbB2/p38/MEF2C-dependent mechanism[J]. Molecular Cancer, 2014,13:130.
[24]LI F, SHEN Z Z, XIAO C M, et al. YY1-mediated up-regulation of lncRNA LINC00466 facilitates glioma progression via miR-508/CHEK1[J]. The Journal of Gene Medicine, 2021,23(1):e3287.
[25]XU L X, WU Q L, YAN H, et al. Long noncoding RNA KB-1460A1.5 inhibits glioma tumorigenesis via miR-130a-3p/TSC1/mTOR/YY1 feedback loop[J]. Cancer Letters, 2022,525:33-45.
(本文编辑黄建乡)