促进学生认识发展的“化学反应与电能”教学研究
2024-10-15荣蓉




摘 要:本文以促进学生认识发展为目标,聚焦“化学能与电能的转化”这一核心问题,通过创设学生熟知的真实情境引发认知冲突,再通过不同能力水平的学习活动,建立对“化学反应与电能”的认识视角,形成设计原电池装置的一般思路与方法,培养“化学反应中物质的变化伴随着能量的变化,能量可以相互转化”的核心观念,以达到从“知识”向“认识”的转化。
关键词:认识发展;化学反应与电能;教学设计
文章编号:1008-0546(2024)11-0019-05
中图分类号:G632.41
文献标识码:B
一、教学主题内容及教学现状分析
1. 教学主题内容分析
《普通高中化学课程标准(2017年版2020年修订)》(以下简称《新课标》)对“化学反应与电能”的内容要求是:认识化学能与电能相互转化的实际意义及其重要应用。了解原电池及常见化学电源的工作原理。了解电解池的工作原理,认识电解在实现物质转化和储存能量中的具体应用。了解金属发生电化学腐蚀的本质,知道金属腐蚀的危害,了解防止金属腐蚀的措施。[1]
通过对《新课标》内容要求的分析可知,本课教学要求学生建立对“化学反应与电能”的认识视角:①从原理角度,认识氧化还原反应是化学能转化为电能的前提和本质。②从能量角度,认识化学能可以转化为电能。③从实际出发,认识原电池装置可以实现化学能与电能的转化。
2. 教学现状分析
在本课的教学中,教师常用的教学方式是根据教科书内容直接呈现“铜锌原电池”装置并进行演示实验,通过讨论电流表偏转背后的微观本质,得出原电池装置模型,再进行原电池构成要素的归纳总结。在这样的教学中,学生“被动接收”相关知识,缺乏认知冲突的产生和知识的自主构建。学生的学习多停留于得出结论性知识的层面,而未深入学科本质去理解原电池装置作用的原理,不能充分发挥知识的认识功能,容易形成迷思概念。
二、促进学生认识发展的教学设计思路
《新课标》指出,化学教学内容的组织,应有利于促进学生从学习化学学科知识向发展化学学科核心素养的转化。学生能在真实情境中利用所学知识解决实际问题是化学学科核心素养落地的重要体现。这就需要学生对化学学科乃至客观世界的认识不断发展,充分发挥知识的认识功能,从而由“知识”向“认识”转化。促进学生认识发展的教学是将科学知识转化为学生科学认识的教学[2],基于该教学理念和当下的教学现状,笔者以“化学反应与电能”为主题,结合案例探讨促进学生认识发展的教学策略。
促进学生认识发展的教学是基于过程的教学,要关注学生从已有认识到新认识的发展路径,创设能够激发学生已有认识的问题情境,在问题情境中产生认知冲突,通过驱动性问题和活动的设计推动新认识的构建,从而促进学生认识发展。
笔者参考胡久华等[3]提出的促进学生认识素养发展的化学教学设计程序与教学思路进行本次教学设计。首先,在学生熟悉的实验情境中提出问题,形成认知冲突(如在稀硫酸溶液中,铜片表面也产生气泡),并将此认知冲突作为探究方向,引出“化学能与电能的转化”这一核心问题,建构原电池的认知模型。其次,设计应用实践、迁移创新类的学习活动,学生通过分析类似原电池装置的原理,并基于熟悉的反应原理对装置进行简单设计,形成原电池装置设计的一般思路与方法,建立氧化还原反应与能量转化之间的联系,从而使“化学反应中物质的变化伴随着能量的变化,能量可以相互转化”这一核心观念不断结构化。最后,通过课后作业设计,在真实问题情境中逐步提升学生分析问题和解决问题的能力,促进学生核心素养的发展。三、教学目标
本节课的教学目标如下。
(1)通过对锌与稀硫酸反应的再探究,从已有认识出发,产生认知冲突,推动认识发展,建构原电池的概念,理解原电池的工作原理,诊断并发展证据推理与模型认知的学科核心素养。
(2)通过对原电池形成条件的探究,培养科学探究的能力,建立控制变量的思想方法,发展归纳、演绎等学习能力。
(3)通过对原电池装置的简单设计,建立设计原电池的一般思路与方法,诊断并发展对原电池认知模型的理解和应用水平。
四、教学流程
笔者基于教学设计思路,设置了“提出问题”“建构概念”“类比迁移”“简单设计”和“应用展望”五个环节,并据此展开教学,具体教学流程如表1所示。
五、教学实录
1. 提出问题
[教师]大家有没有思考过一个问题:燃油汽车与电动汽车行驶过程中的机械能来自哪里?
[学生]燃油汽车的机械能来自燃料燃烧产生的热能。电动汽车的机械能来自电能。
[教师]那电动汽车中的电能是如何产生的?
[学生]可能是电池装置中物质的化学能转化来的。
[教师]能量不可能凭空产生和消失,电动汽车中的电池就是将化学能转化为电能的装置,本节课我们将探索电池的原理与设计。
[设计意图]从生活情境出发,提出问题,激发学生的兴趣与学习欲望。
2. 建构概念
[教师]回忆一下,Zn和Cu能与稀硫酸反应吗?
[实验活动1]将锌片与铜片插入同一稀硫酸溶液,锌片和铜片不接触,实验装置如图1所示。描述实验现象,写出Zn与稀硫酸反应的离子方程式,标出氧化剂和还原剂。
[学生]锌片逐渐溶解,表面有气泡产生,铜片表面无明显现象。离子方程式:Zn+2H+Zn2++H2↑。Zn是还原剂,H+是氧化剂。
[过渡]教师在某次操作实验1时,不小心将铜片和锌片接触在了一起,看到了令人意想不到的现象。下面让我们一起来看看,如果用一条导线将铜片和锌片连接到一起会产生什么现象。
[实验活动2]将锌片与铜片用导线相连,并插入稀硫酸溶液,实验装置如图2所示。描述实验现象。
[学生]铜片表面也产生气泡。
[教师]铜片表面为什么会产生气泡?铜参与反应了吗?
[学生]铜不可能参与反应。
[引导]那铜片表面的气泡是什么?从微观角度进一步思考,气泡是体系中的哪种微粒发生了什么样的变化得来的?试着用离子方程式表示出来。
[学生]气泡应该是H2,体系中有H+,H+在铜片表面得到电子就生成了氢气。离子方程式:2H++2e-H2↑。
[追问1]电子来自哪里?
[学生]是锌片给的。离子方程式:Zn-2e-Zn2+。
[追问2]锌片给出电子后,电子是如何到达铜片表面而被H+ 得到的呢?可能的路径有:通过导线,或者穿过溶液。
[学生]电子是沿着导线移动到铜片表面。
[追问3]你推测的依据是什么?
[学生]因为在实验1中没有看到铜片表面有气泡,说明电子不能穿过溶液。
[教师]通过对比可以发现,实验2的装置比实验1多了一条导线,导线将电子“引”到了铜片表面。
[追问4]那如何通过实验验证电子确实是通过了导线?
[学生]在铜片和锌片中间接入一个电流表,如果电流表指针偏转,说明产生了电流,而电流的产生恰恰说明电子发生了定向移动。
[教师]那现在让我们一起来验证一下大家的猜想。
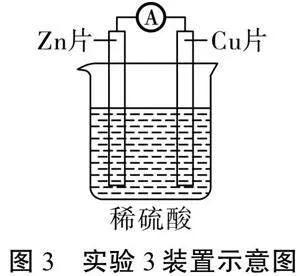
[实验活动3]在锌片与铜片中间连接一个电流表,实验装置如图3所示。观察到电流表指针发生偏转。
[追问5]既然铜没参与反应,那它起到了什么作用?为什么有了导线和铜片,电子就“自觉”地顺着导线定向移动了?
[学生]铜片有导电作用,且铜的活泼性比锌弱,与锌片连接后产生了电势差,从而导致电子定向移动。
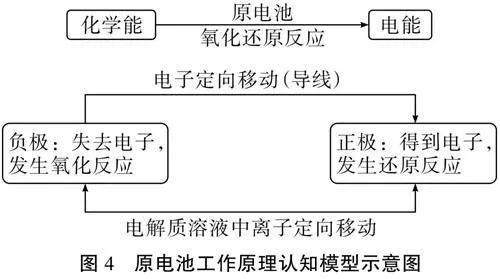
[小结]上述装置中产生了电势差,氧化反应和还原反应分开进行,进而“捕捉”到了电子,产生电流,从而实现了化学能向电能的转化。这种将化学能转化为电能的装置叫做原电池。原电池工作原理的认知模型如图4所示。
[设计意图]从学生已有知识出发,产生认知冲突,通过对宏观现象背后的微观本质进行分析和符号表征,帮助学生建立原电池装置的认知模型,理解化学能转化为电能的本质,通过推理论证活动发展学生证据推理与模型认知的学科核心素养。
3. 类比迁移
[教师]提供实验药品:铁片、铜片、石墨棒、稀硫酸。
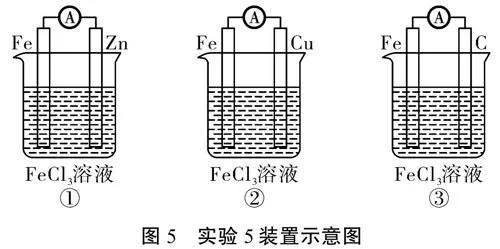
[学习活动]学生选择电极和电解质溶液组装出类似“铜锌原电池”的装置,并预测其能否构成原电池。
[成果展示]部分学生组装出的原电池装置和预测结果如表2所示。
[学习活动]以表2中装置②为例解释该装置可能产生电流的原因并写出电极反应式。
[学生]铁比碳活泼,用导线将铁片和碳棒相连插入稀硫酸溶液中,产生了电势差,铁片失去电子,电子沿导线到达碳棒表面,溶液中的H+ 在碳棒表面得到电子,产生氢气。同时,溶液中的H+移向碳棒,SO2-4移向铁片,离子的定向移动形成电流。Fe电极反应式为Fe-2e-Fe2+,C电极反应式为2H++2e-H2↑。
[实验活动4]学生根据表2中的实验装置分小组实施实验、记录现象,并与预测结果对比。学生发现,除了装置③以外,其他装置的实验结果均与表2中的预测结果一致。
[教师]电流表指针偏转说明构成了原电池,同学们大胆推测一下装置③的正极和负极分别是什么?
[学生]负极是铜片,正极是碳棒。但原理上铜片不能和溶液中的H+反应,实验中也未看到有气泡产生。
[教师]我们一起来寻找氧化剂。H+无法将铜片氧化,那么大家再观察一下装置③,该装置是一个敞开体系,最可能与铜反应的是什么?
[学生]空气中的氧气。
[教师]铜可以被空气中的氧气氧化,也就是铜被腐蚀,正是金属的电化学腐蚀构成了原电池。综合以上实验思考归纳一下,什么样的反应能够设计成原电池装置?
[学生]氧化还原反应。
[追问]是否所有的氧化还原反应都能设计成原电池装置。你的理由是什么?
[学生]放热的氧化还原反应才能设计成原电池装置。因为要将化学能转化为电能,这就要求反应物的总能量比生成物总能量高,所以需要一个放热的反应才能完成。
[小结]在化学反应中,物质的变化伴随着能量的变化,装置的设计要从物质和能量两个角度综合考虑。
[设计意图]在控制变量思想的引导下,发展学生的有序思维,并将原电池认知模型进行近迁移,归纳原电池构成要素,从物质和能量角度认识原电池装置。
4. 简单设计
[实验活动5]利用反应Fe+2Fe3+3Fe2+ 设计一个原电池装置,画出简单的装置示意图,标明所使用的用品。
[教师]提供用品:铜片、锌片、铁片、石墨棒、FeCl3溶液、FeCl2溶液、电流计、导线、烧杯。
[成果展示]学生设计的装置图如图5所示。
[问题讨论]分别对装置进行评价,评选出最符合要求的设计。
[学生1]根据还原性强弱顺序:Zn>Fe>Cu>Fe2+,装置①中是锌片作负极,反应原理是Zn+2Fe3+2Fe2++Zn2+ ,该装置不符合原理要求。
[学生2]装置②中铁片还原性更强,作负极,失去电子生成Fe2+ ,但由于铜片(正极)直接与FeCl3溶液接触,会发生反应:Cu+2Fe3+2Fe2++Cu2+,导致化学能直接转化为热能,同时使Fe3+浓度降低,影响其与Fe反应。铜片应该换成石墨棒,综合考虑装置③最佳。
[教师]总结设计原电池装置的一般思路与方法,成果如图6所示。
[设计意图]通过对原电池装置的简单设计,对原电池认知模型进行远迁移,形成设计原电池装置的一般思路与方法。
5. 应用展望
[课后作业]人们不仅利用氢气和氧气反应产生的热能为火箭升空提供动力,还利用氢气、氧气反应设计电池为航天器供电。请为中国空间站航天器设计一套氢氧燃料电池装置。材料自选,画出简单的装置示意图,标明所使用的用品,并简述基本原理。
[设计意图]通过航空事业中氢气与氧气反应能量的利用,体会化学反应中的能量转化。设计氢氧燃料电池进一步深化对原电池原理和构成要素的理解,对原电池装置设计的一般思路与方法进行迁移应用。
六、教学反思
1. 创设问题情境,激发已有认知
要关注学生认识发展的脉络,首先要通过问题情境激发其已有认知。本课例通过创设“燃油汽车与电动汽车”这一常见生活情境,迅速唤起学生的已有认知,从能量角度建立认识视角,并激发学生的学习欲望;通过创设“锌片和铜片与稀硫酸反应”这一学生熟知的实验情境,利用“反常”的实验现象引发新的问题,充分发挥情境的“激思”和“激疑”作用,为推动学生的认识发展奠定基础。
2. 开展探究实验,突破认知障碍
实验活动能让学生切身体会到已有认识的不足和障碍点,为新认识的构建提供证据。在本课例的教学过程中,通过“设计—预测—观察—解释”的完整探究过程,培养学生严谨的科学思维。同时,在实验活动中,学生通过小组内及小组间的表达、交流与评价,有效地突破了认知障碍,最终形成完善的实验设计方案,促进了有序思维的发展。
3. 进行深度对话,推动认识发展
设计驱动性的问题和开展具有挑战性的学习活动可以实现师生及生生之间的深度对话,为学生的认识发展提供有力载体。在本课例的教学中,教师通过驱动性问题设计让学生在产生疑问到问题解决的过程中都保持着学习的主动性。通过不断追问,启发学生不断自我反思与表达,在表达的过程中,通过多种评价手段不断修正学生的已有认识。
4. 建立认识视角,助力素养培育
认识视角的建立有助于促进学生学科观念的建构。在本课例教学中,教师不断引导学生从物质、装置与能量的角度建立对原电池模型的认识,从学生熟知的金属与硫酸的反应以及装置的组装与解释,到根据熟知的反应设计装置,再到燃烧反应的应用以及燃料电池的设计,最终达成陌生情境下的真实问题解决,实现学生核心素养的培育。
参考文献
[1]中华人民共和国教育部.普通高中化学课程标准(2017年版2020年修订)[M].北京:人民教育出版社,2020.
[2]胡久华,张银屏.促进学生认识发展的单元整体教学——以化学教学为例[J].教育科学研究,2014(8):63-68,76.
[3]胡久华,王磊.促进学生认识素养发展的化学教学[J].教育科学研究,2010(3):46-50.
