PEG-6000模拟干旱胁迫对小叶黑柴胡幼苗生理特性的影响
2024-10-10张立军彭云霞张东佳白波王国祥牛家瑜
摘要:通过探讨小叶黑柴胡对干旱胁迫的响应,为综合评价小叶黑柴胡的耐旱性提供科学依据,进而为大田栽培提供技术指导。以小叶黑柴胡幼苗为试验材料,采用PEG-6000模拟干旱胁迫方法,研究了干旱胁迫对其叶片抗氧化酶活性、细胞膜透性及渗透调节物质等生理指标的影响。结果表明,随着PEG-6000胁迫浓度(0~25%)的升高,小叶黑柴胡叶片中超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、过氧化氢酶(CAT)活性、丙二醛(MDA)含量、游离脯氨酸(Pro)含量及可溶性糖含量变化表现较为一致,均呈现先升高后下降的趋势,但峰值略有不同,MDA含量呈现持续上升趋势至PEG-6000胁迫最高浓度(25%)。综合分析认为,小叶黑柴胡具有一定的抗旱性,在适度的干旱胁迫下可以保持一定的抗渗透胁迫能力和清除活性氧的能力,进而保持膜的稳定。
关键词:小叶黑柴胡;PEG-6000;干旱胁迫;抗旱性;生理特性
中图分类号:S567.79 文献标志码:A 文章编号:2097-2172(2024)09-0843-05
doi:10.3969/j.issn.2097-2172.2024.09.012
Effects of PEG-6000 Simulated Drought Stress on Physiological
Characteristics of Bupleurum smithii var. Parvifolium Seedlings
ZHANG Lijun 1, 2, PENG Yunxia 1, 2, ZHANG Dongjia 1, 2, BAI Bo 1, 2, WANG Guoxiang 1, 2, NIU Jiayu 3
(1. Institute of Chinese Herbal Medicines, Gansu Academy of Agricultural Sciences, Lanzhou Gansu 730070, China; 2. Gansu Provincial Engineering Laboratory for Genetic Improvement and Quality Control of Chinese Herbal Medicine,
Lanzhou Gansu 730070, China; 3. Gansu Health Vocational College, Lanzhou Gansu 730207, China)
Abstract: By exploring the response of Bupleurum smithii var. parvifolium to drought stress, this study provides scientific evidence for comprehensively evaluating its drought tolerance, further offering technical guidance for field cultivation. Using Bupleurum smithii var. parvifolium seedlings as experimental materials, the drought stress was simulated with PEG-6000, and the effects of drought on leaf antioxidant enzyme activity, cell membrane permeability, and osmotic regulatory substances were studied. The results showed that with increasing PEG-6000 concentrations(0 to 25%), the activities of superoxide dismutase (SOD), peroxidase (POD), catalase (CAT), as well as contents of malondialdehyde (MDA), free proline (Pro), and soluble sugar in the leaves all exhibited similar trends, first increasing and then decreasing, although the peak values varied slightly. The MDA content continued to increase as the PEG-6000 stress reached its highest concentration(25%). Overall, the study concluded that Bupleurum smithii var. parvifolium possesses certain drought tolerance and can maintain osmotic stress resistance and reactive oxygen species scavenging abilities under moderate drought stress, thereby maintaining membrane stability.
Key words: Bupleurum smithii var. parvifolium; PEG-6000; Drought stress; Drought resistance; Physiological characteristic
在某些环境条件下,当植物蒸腾速率高于水分吸收速率或土壤中缺乏植物可利用的水分时,植物会出现水分亏缺现象,则视为植物发生了干旱胁迫[1 - 5 ]。在农林业生产中,干旱是发生频率最高、范围最广、危害最严重的一种逆境,全球大约有43%左右的耕地长期处于干旱、半干旱区域,因干旱导致农作物产量降低的现象远高于其他自然灾害带来的影响之和[6 ]。干旱在从植物种子萌发到幼苗形成、从营养生长到生殖生长的各个生长发育阶段都有可能发生。种子萌发、幼苗的生长和建植过程是植物生活史中极为重要的阶段,直接影响着种群的扩大和延续[7 ],而在我国北方地区,干旱常发生在春季植物幼苗时期,因此对干旱胁迫下植物幼苗时期的变化研究就显得尤为重要。
小叶黑柴胡(Bupleurum smithii var. parvifolium)为伞形科柴胡属植物,以干燥根入药,其味苦、性寒,有镇痛、解热、保肝、抗炎、抗癌、抗氧化及免疫调节的作用[8 ],主要用于治疗感冒发热、寒热往来、疟疾、胸肋胀满等症[9 ]。作为柴胡属药用植物,虽未被载入药典,但被甘肃、青海、宁夏等地地方中药材标准收录,一直作为药用柴胡的主流种类在市场流通[10 - 11 ]。有研究表明,小叶黑柴胡主要成分皂苷、甾醇的含量高于药典收录的北柴胡(Bupleurum chinense DC.),抗炎、保肝作用也好于北柴胡[12 ]。然而,目前小叶黑柴胡均为野生,长期无节制采挖使野生资源蓄积量逐年减少,因此,迫切需要对其进行人工驯化栽培。目前,对小叶黑柴胡的研究主要集中在化学成分、药理作用方面,对其幼苗抗性生理变化的研究鲜有报道。鉴于此,我们以小叶黑柴胡幼苗为材料,采用高渗溶液聚乙二醇(PEG-6000)模拟干旱胁迫的环境,研究干旱胁迫对小叶黑柴胡幼苗期生理特性的影响,探究小叶黑柴胡对干旱胁迫的响应,为综合评价小叶黑柴胡的耐旱性提供科学依据,为进一步大田引种栽培提供一定的技术指导。
1 材料与方法
1.1 供试材料
供试小叶黑柴胡种子于2021年9月在野生小叶黑柴胡种子成熟时采自合作市勒秀乡(103.00 °E、 34.83 ° N),经甘肃省农业科学院中药材研究所鉴定为小叶黑柴胡。采样地海拔3 165 m,年均降水量545 mm,年均气温1.7 ℃,年均无霜期48 d,全年日照充足,是典型的野生小叶黑柴胡适生区。
1.2 PEG-6000胁迫幼苗处理方法
试验于2022年3月在甘肃省农业科学院中药材研究所兰州试验基地的日光温室内进行。试验采用盆栽基质培养法,基质为草炭、蛭石、珍珠岩按体积比2∶1∶1的比例混合而成,将基质装入规格为35 cm×24 cm×20 cm的盆中。选取大小、饱满度基本一致,无病虫害的小叶黑柴胡种子进行播种,共播种18盆,每盆30粒种子,用Hoagland营养液进行定量浇灌。设6个干旱胁迫浓度处理,PEG-6000体积分数分别为0(CK)、5%、10%、15%、20%、25% ,对应溶液的水势分别为 0、-0.1、-0.2、-0.4、-0.6、-0.86 MPa[13 ],每处理3次重复。当幼苗长至10 cm时,按试验设计将不同体积分数的PEG-6000分别加入Hoagland营养液中,对幼苗进行干旱胁迫处理,处理2 d后,每盆取样10株,测定小叶黑柴胡叶片的生理指标。
1.3 测定指标及方法
超氧化物歧化酶(SOD)活性采用氮蓝四唑法测定[14 ],过氧化物酶(POD)活性采用愈创木酚显色法测定[15 ],过氧化氢酶(CAT)活性采用紫外吸收法测定[15 ],丙二醛(MDA)含量采用双组分光光度法测定[16 ],脯氨酸(Pro)含量采用茚三酮比色法测定[17 ],可溶性糖含量采用蒽酮比色法测定[17 ]。
1.4 数据处理与统计分析
采用Excel 2013软件进行试验数据处理,使用SPSS 17.0软件对数据进行方差分析。
2 结果与分析
2.1 PEG-6000胁迫对小叶黑柴胡抗氧化酶活性的影响
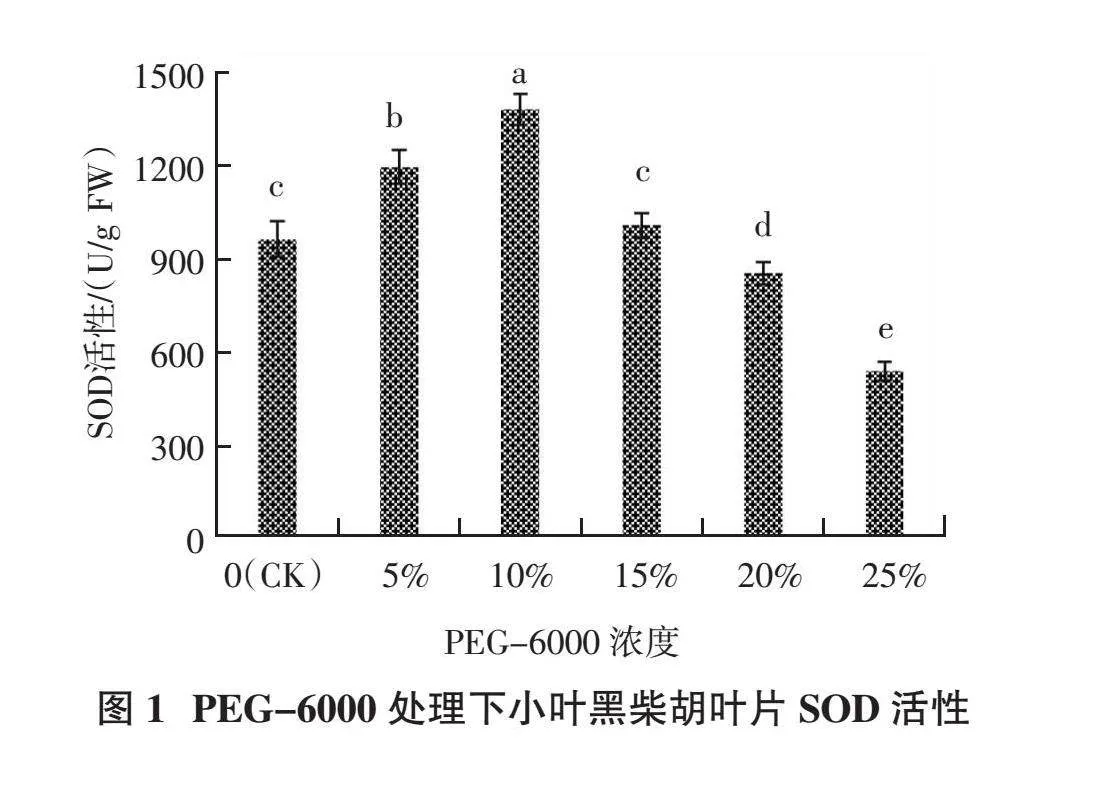
2.1.1 SOD活性 从图1可以看出,小叶黑柴胡叶片中超氧化物歧化酶(SOD)活性随着PEG-6000处理浓度的升高呈先升后降的趋势。当PEG-6000浓度从0上升到10%时,SOD活性缓慢升高;且在PEG-6000浓度为10%时SOD活性达到最大,为 1 380.77 U/g,较CK提高43.29%,显著高于其他处理(P < 0.05);随着PEG-6000浓度从10%增加至25%时,SOD活性开始降低,当PEG-6000浓度为25%时,SOD 活性降至537.12 U/g,较CK降低44.26%,显著低于其他处理(P < 0.05)。
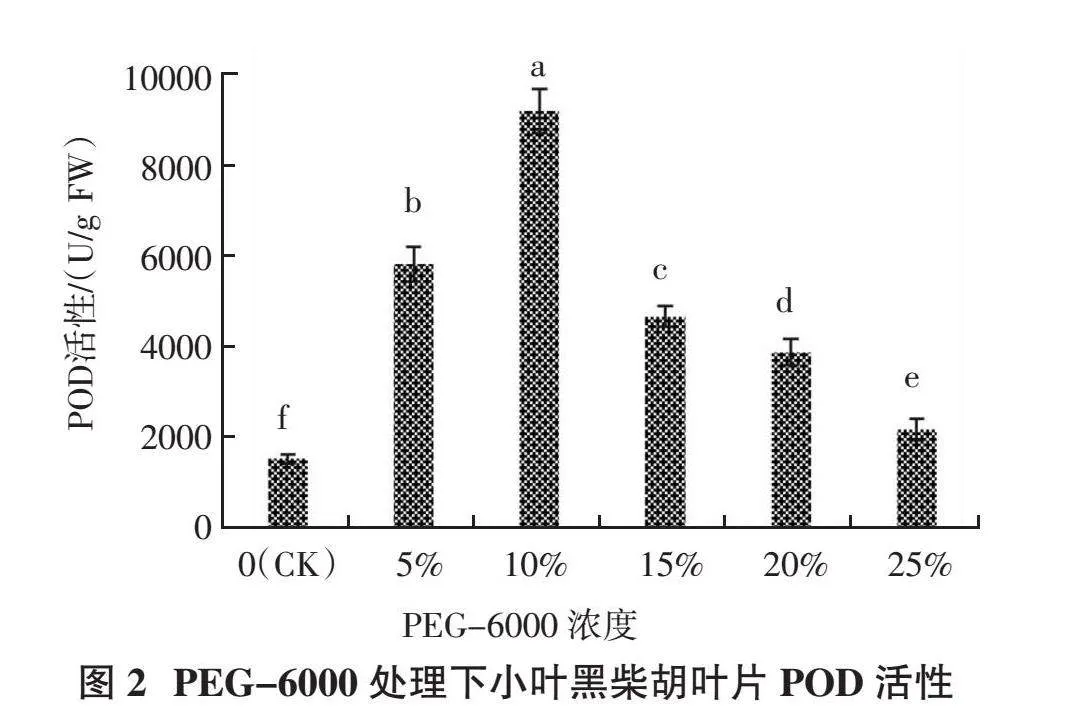
2.1.2 POD活性 由图2可以看出,随着PEG- 6000处理浓度的增加,小叶黑柴胡叶片中过氧化物酶(POD)活性呈先升后降的趋势。PEG-6000浓度从0上升到10%时,POD活性呈大幅度上升;且在PEG-6000浓度为10%时POD活性达到最大值,为9 217.86 U/g,较CK提高499.61%,显著高于其余处理(P < 0.05);当PEG-6000浓度为5%时,POD活性较高,较CK提高279.55%,与其余处理均差异显著(P < 0.05);当PEG-6000浓度大于10%时,POD活性开始下降,PEG-6000浓度为25%时,POD活性为2 186.66 U/g,但仍较CK提高42.23%,且与其余处理均差异显著(P < 0.05)。
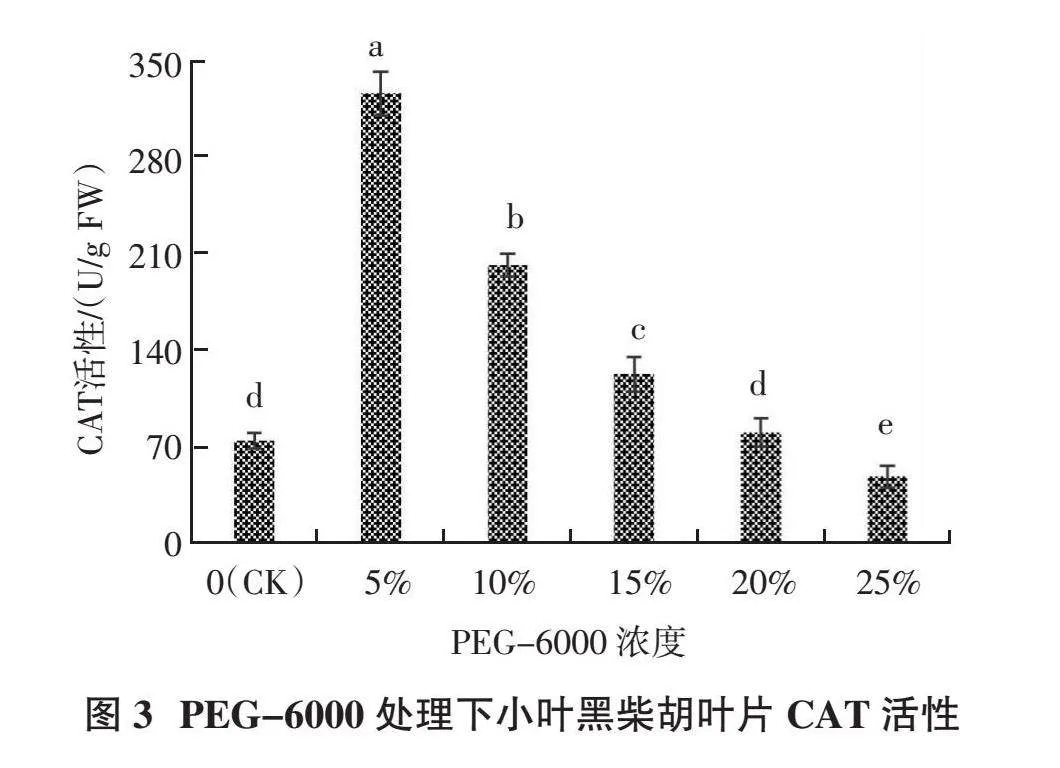
2.1.3 CAT活性 由图3可以看出,在不同PEG- 6000浓度胁迫下,过氧化氢酶(CAT)活性的变化趋势与超氧化物歧化酶(SOD)、过氧化物酶(POD)活性的变化趋势基本一致,即随着PEG-6000浓度的增加,CAT活性表现先升后降的变化趋势,但其峰值略有不同。当PEG-6000浓度从0上升到5%时,CAT活性大幅度上升,且在PEG-6000浓度为5%时CAT活性达最大值,为325.98 U/g,较CK提高333.02%,显著高于其他处理(P < 0.05);随着PEG-6000浓度增大至25%,CAT活性开始逐步降低,当PEG-6000浓度为25%时,CAT活性降至最低值49.15 U/g,显著低于CK(P < 0.05)。
2.2 PEG-6000胁迫对小叶黑柴胡细胞膜透性的影响
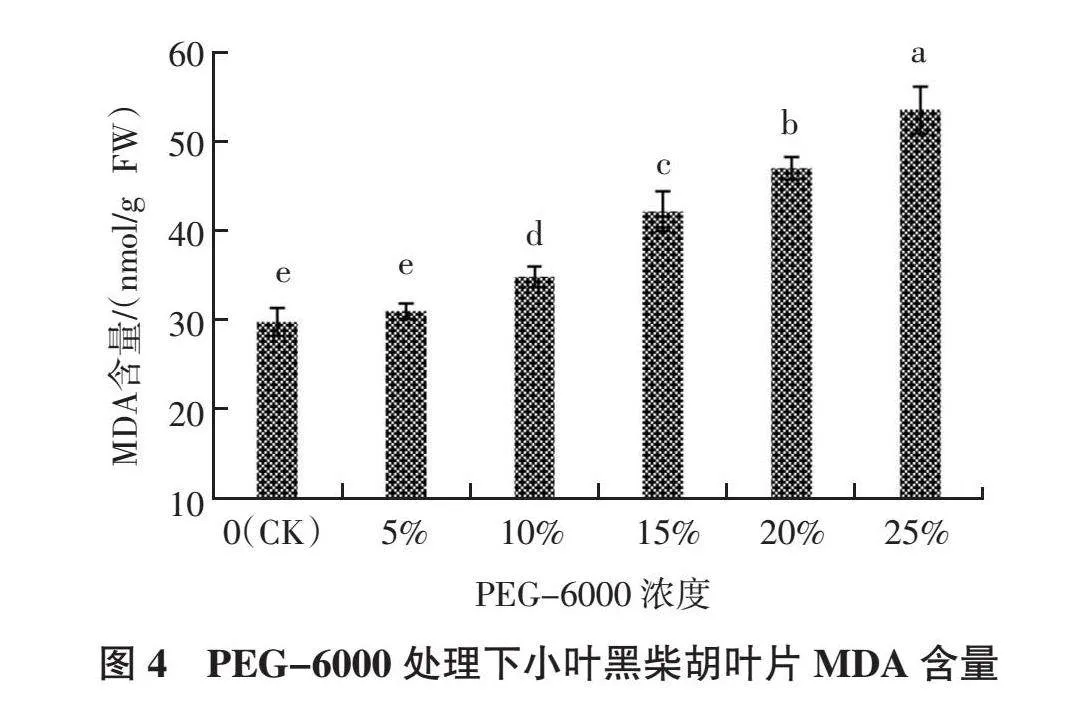
如图4所示,随着 PEG-6000胁迫程度的增加,小叶黑柴胡叶片中丙二醛(MDA)含量逐渐增加,其中PEG-6000浓度为5%时与CK相比差异不显著;之后随着PEG-6000浓度的继续增加,MDA含量较CK显著升高,并持续升高。PEG-6000浓度为10%、15%、20%、25%处理的MDA含量分别较CK显著提高了16.71%、41.14%、57.05%、78.84%。
2.3 PEG-6000胁迫对小叶黑柴胡渗透调节物质的影响
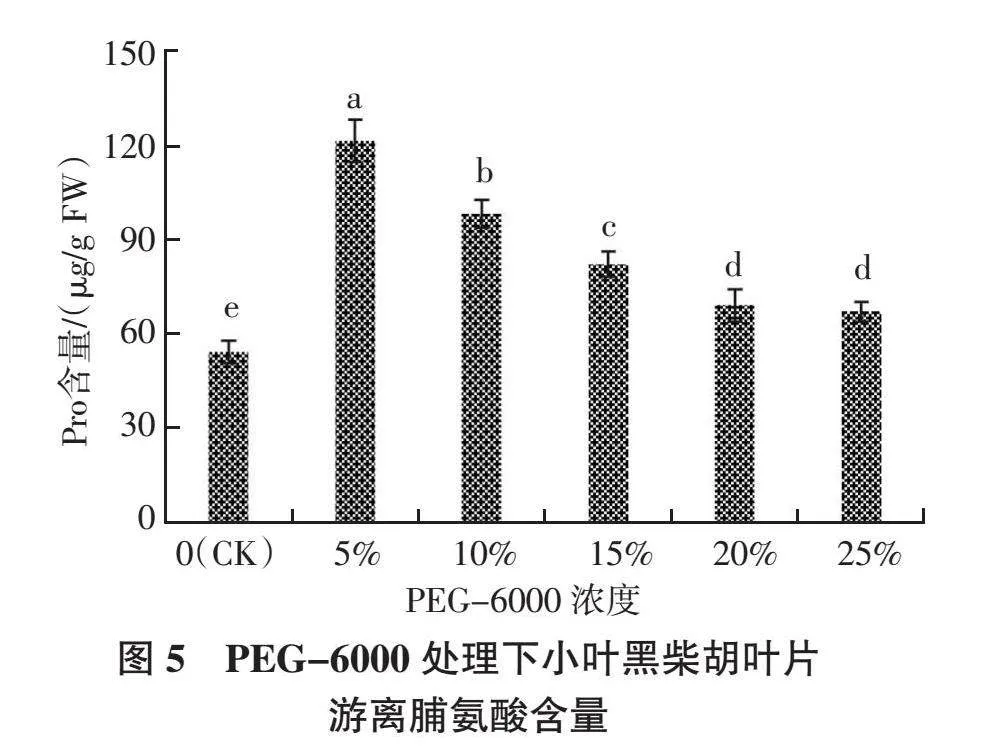
2.3.1 游离脯氨酸含量 如图5所示,随着PEG-6000处理浓度的增加,小叶黑柴胡叶片中游离脯氨酸(Pro)含量的变化趋势呈现先升高后降低的趋势。当PEG-6000浓度为5%时,游离脯氨酸含量达到最大值,为121.10 ?滋g/g,较CK提高了123.47%,且显著高于其他浓度处理(P < 0.05);随着PEG-6000浓度的升高,叶片游离脯氨酸含量开始缓慢降低,当PEG-6000浓度为25%时,游离脯氨酸含量降至最低值(66.96 ?滋g/g),但此时仍显著高于CK(P < 0.05)。
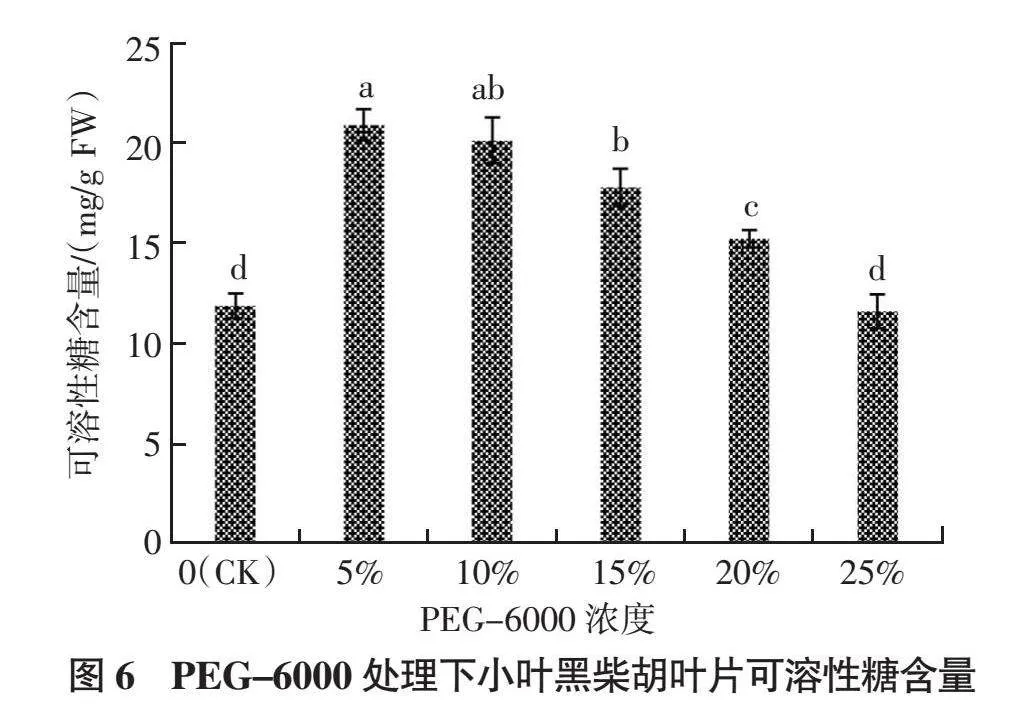
2.3.2 可溶性糖含量 如图6所示,试验PEG-6000处理浓度0~25%范围内,小叶黑柴胡叶片中可溶性糖含量变化趋势与游离脯氨酸含量的变化相似,呈先升后降的趋势。当PEG-6000浓度为5%时,可溶性糖含量达到最大值,为20.91 mg/g,较CK提高了75.60%,除与PEG-6000浓度10%处理相比差异不显著外,均显著高于其他处理(P < 0.05)。随着PEG-6000浓度继续增加,叶片中可溶性糖含量呈缓慢降低趋势,当PEG-6000浓度增加至25%时,可溶性糖含量降至最低值(11.63 mg/g),与CK差异不显著。
3 讨论与结论
植物重要的抗氧化保护酶有超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT),三者协同作用,可清除逆境下机体产生的有害自由基对细胞膜系统所造成的损伤[18 ]。大量研究表明,植物在胁迫处理下,其保护酶活性通常会随着胁迫程度的增加而升高,或呈先升后降的变化[19 - 20 ]。本研究结果显示,通过不同浓度PEG-6000模拟干旱胁迫,小叶黑柴胡叶片中超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性均呈先升后降的变化趋势,当PEG-6000浓度较低,干旱胁迫程度较轻时,胁迫会诱导抗氧化酶活性的增加,以此缓解胁迫所带来的伤害;但随着PEG-6000浓度的增加,干旱胁迫程度越来越重时,抗氧化酶的合成会受到抑制,抗氧化防御系统遭到破坏,导致活性氧积累,对细胞膜的保护作用失效。这与刘永华等[21 ]关于干旱胁迫对聚合草叶片生理变化的影响及廖沛然等[22 ]有关三七幼苗对聚乙二醇模拟干旱胁迫的生理响应研究结果相似。
丙二醛(MDA)是植物受到伤害时发生膜脂过氧化的最终产物,其含量的高低可作为判断细胞质膜遭受破坏程度的重要指标[23 ],含量升高,表现为细胞膜透性增高,从而使细胞的正常代谢活动受到阻碍[24 ]。本试验研究结果显示,PEG-6000浓度较低,干旱胁迫程度较轻时,丙二醛(MDA)含量也维持在较低的水平,说明此时的细胞质膜未受到损伤还在进行着正常的生理功能;随着PEG-6000处理浓度的升高,活性氧开始大量累积,引发膜脂过氧化,使得MDA 含量也越来越高,细胞质膜正常的生理功能发生紊乱,由此导致植物抗旱性变差,这与陈郡雯等[25 ]对白芷苗期抗旱性研究结果相符。说明小叶黑柴胡处于干旱胁迫环境中,丙二醛(MDA)的含量会有不同程度的升高,但在受到轻度胁迫时影响不太明显。
脯氨酸(Pro)是植物体内重要的渗透调节物质,其含量越高,抗旱性越强。植物在遭受干旱逆境时,体内会产生大量脯氨酸来防止植物过度失水,且其含量的增加对细胞生命物质及生物膜也起到保护作用[26 - 27 ]。在本研究中,随着PEG-6000浓度的增加,小叶黑柴胡叶片中游离脯氨酸含量呈先升后降的趋势,但所有PEG-6000浓度处理下的游离脯氨酸含量均高于PEG-6000胁迫浓度为0的处理。表明小叶黑柴胡在受到干旱胁迫时,脯氨酸在叶片细胞中的积累能够进行渗透调节,以防止干旱对其造成损伤。这与叶旭波等[28 ]关于不同种质资源的银柴胡对干旱胁迫的响应及刘长利[29 ]对2 a实生苗甘草抗旱特性的研究结果相一致。此外,植物细胞中的可溶性糖也被认为是植物体内重要的渗透调节物质,其含量的变化在一定程度上也能反映植物对干旱环境的适应能力[30 ]。
综上所述,通过测定干旱胁迫下小叶黑柴胡苗期叶片中超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、过氧化氢酶(CAT)活性,丙二醛(MDA)含量、游离脯氨酸(Pro)含量及可溶性糖含量,发现随着PEG-6000浓度的升高,小叶黑柴胡苗期叶片中SOD活性、POD活性、CAT活性,游离脯氨酸含量及可溶性糖含量变化趋势较为一致,均表现为先升高后下降,峰值略有不同,MDA含量持续上升至PEG胁迫最高浓度(25%)。由此可知,小叶黑柴胡苗期具有一定的抗旱性,在轻度干旱胁迫条件下可通过自身调节能力来缓解其受到的干旱胁迫伤害。
参考文献:
[1] 王 鸿,张 帆,张雪冰,等. 不同桃自根砧对干旱胁迫的生理响应及抗逆机理研究[J]. 寒旱农业科学,2022,1(1):66-72.
[2] 李 丹,石浏芃. PEG-6000模拟干旱胁迫对紫苏种子萌发的影响[J]. 寒旱农业科学,2022,1(2):167-170.
[3] 赵 锋,包奇军,张华瑜,等. 施用保水剂对干旱胁迫下大麦幼苗生长及光合特性的影响[J]. 寒旱农业科学,2022,1(3):227-230.
[4] 白锐琴. 2,4-表油菜素内酯对干旱胁迫下辣椒叶片生理指标及果实品质的影响[J]. 寒旱农业科学,2024,
3(2):141-145.
[5] 周 洁,郭兰萍,张 霁,等. 药用植物对干旱胁迫的响应及受控实验[J]. 中国中药杂志,2010,35(15):1919-1924.
[6] 胡树平,苏治军,于晓芳,等. 玉米自交系抗旱相关性状的主成分分析与模糊聚类[J]. 干旱地区农业研究,2016,34(6):81-88.
[7] 韩 春,陆嘉惠,周玲玲,等. 三种药用甘草种子位置效应对幼苗建植特性的影响[J]. 草业学报,2017,
26(7):128-137.
[8] 张婷婷,高 珊,贺建华. 小叶黑柴胡化学成分与药理作用研究进展[J]. 中药材,2013,36(9):1542-1545.
[9] 甘肃省食品药品监督管理局. 甘肃省中药材标准[S]. 兰州:甘肃文化出版社,2009.
[10] 贾守宁,刘 静,陈文娟. 青海省中药材地标品及习用品调查[J]. 中国现代中药,2016,18(6):737.
[11] 宁夏回族自治区食品药品监督管理局. 宁夏中药材标准[S]. 银川:黄河出版传媒集团:阳光出版社,2018.
[12] 曹纬国,陶燕铎,张有金,等. 青海产小叶黑柴胡中皂苷类成分的含量分析[J]. 中国现代应用药学,2012,29(4):323-326.
[13] MICHEL B E, KAUFFMAN M R. The osmotic potential of polyethylene glycol 6000[J]. Plant Physiology, 1973, 51: 914-916.
[14] 郑炳松. 现代植物生理生化研究技术[M]. 北京:气象出版社,2006.
[15] 孙 群,胡景江. 植物生理学研究技术[M]. 杨凌:西北农林科技大学出版社,2005.
[16] 郝建军,康宗利,于 洋. 植物生理学实验技术[M]. 北京:化学工业出版社,2006.
[17] 李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000.
[18] NEELAM M, AJAY K G. Effect of salt stress on proline metabolism in two high yidlding genotypes of green gram[J]. Plant Science, 2005, 169: 331-339.
[19] 钟 磊,廖沛然,刘长征,等. 干旱胁迫对肉桂幼苗生理生化及化学成分的影响[J]. 中国中药杂志,2021,46(9):2158-2166.
[20] 崔江慧,李 霄,常金华. PEG模拟干旱胁迫对高粱幼苗生理特性的影响[J]. 中国农学通报,2011,
27(9):160-165.
[21] 刘永华,李鲜花,崔 凡,等. PEG模拟干旱胁迫对聚合草叶片生理特性的影响[J]. 农学学报,2021,
11(6):25-28.
[22] 廖沛然,崔秀明,杨 野,等. 三七幼苗对聚乙二醇(PEG 6000)模拟干旱胁迫的生理响应研究[J]. 中国中药杂志,2015,40(15):2909-2914.
[23] 张 俊,刘 娟,臧秀旺,等. 不同生育时期干旱胁迫对花生产量及代谢调节的影响[J]. 核农学报,2015,29(6):1190-1197.
[24] 周 丽,郎多勇,张文晋,等. NaCl胁迫对银柴胡生长及生理生化特性的影响[J]. 中草药,2014,45(19):2829-2833.
[25] 陈郡雯,吴 卫,郑有良,等. 聚乙二醇(PEG-6000)模拟干旱条件下白芷苗期抗旱性研究[J]. 中国中药杂志,2010(2):149-153.
[26] 龙胜举. 景天三七响应干旱胁迫的形态特征及生理机制研究[D]. 雅安:四川农业大学,2018.
[27] ANJUM S A, XIE X Y, WANG L C, et al. Morphological, physio-logical and biochemical responses of plants to drought stress[J]. African Journal of Agricultural Ressearch, 2011, 6(9): 2062-2032.
[28] 叶旭波,马玲芳,李 阳,等. 不同种质资源银柴胡抗旱性研究[J]. 植物生理学报,2020,56(6):1295-1304.
[29] 刘长利. 甘草抗旱特性的初步研究[D]. 保定:河北农业大学,2002.
[30] 项雯慧. 甘草幼苗响应干旱胁迫生理生化特征研究[D]. 呼和浩特:内蒙古农业大学,2018.
