绵羊基质Gla蛋白基因克隆、表达谱及其在卵巢组织的定位
2024-09-26张欣如古丽米热·阿不都热依木陈莹马秀玲林嘉鹏汪立芹黄俊成吴阳升

摘要:本研究旨在克隆绵羊基质Gla蛋白(MGP)基因的蛋白质编码序列(CDS),制备特异抗体,并检测该基因在绵羊卵巢组织中的表达分布。以卵泡总cDNA为模板,扩增获得绵羊MGP基因CDS区全长序列;合成绵羊MGP蛋白C末端15个氨基酸长度的多肽,免疫小鼠,制备抗血清;利用实时荧光定量PCR(qPCR)和免疫印迹技术分析其在不同组织和不同大小的卵泡中的表达水平;通过免疫组织化学方法分析其在卵巢组织中的表达分布特征。结果表明,成功获得绵羊MGP基因的CDS区全长片段(467 bp),编码103个氨基酸,理论相对分子量为12 230.96,等电点为9.27;N末端19个氨基酸序列被预测为信号肽序列,成熟肽有84个氨基酸,为外泌性蛋白质,无胞内区; MGP总蛋白质氨基酸序列与山羊、牛的同源蛋白质相似性分别为100.0%、99.0%,与人、小鼠的相似性均为85.4%。MGP mRNA和蛋白质在绵羊心、肝、脾、肺、肾等组织中的相对表达量较低,在卵巢、输卵管、子宫等生殖系统或组织中的相对表达量较高,在黄体中的相对表达量也较高;MGP在卵巢组织颗粒细胞、卵丘细胞中均有表达,但在闭锁卵泡中不表达。本研究结果可为进一步研究MGP在卵巢组织中的生物学功能提供参考。
关键词:基质Gla蛋白;绵羊;卵巢;颗粒细胞;黄体
中图分类号:S826.2文献标识码:A文章编号:1000-4440(2024)07-1276-09Cloning, expression profile and ovarian localization of sheep matrix Gla protein geneZHANG Xinru Gulimire·Abudureyimu CHEN Ying MA Xiuling LIN Jiapeng WANG Liqin HUANG Juncheng WU Yangsheng
(1.Key Laboratory of Genetics Breeding and Reproduction of Grass Feeding Livestock, Ministry of Agriculture and Rural Affairs/Key Laboratory of Animal Biotechnology of Xinjiang/ Institute of Biotechnology, Xinjiang Academy of Animal Science, Urumqi 830011, China;2.College of Animal Science, Xinjiang Agriculture University, Urumqi 830052, China)
Abstract:The aim of this study was to clone the protein coding sequence (CDS) of sheep matrix Gla protein (MGP) gene to prepare specific antibody and to detect the expression distribution of the gene in sheep ovarian tissues. Total sheep follicle cDNA was used as the template to amplify and obtain the full-length sequence of the CDS region of sheep MGP gene. Peptide with a length of 15 amino acids from the C-terminal end of the sheep MGP protein was synthesized and was used to immunize mouse and perpare antiserum. Expression levels of MGP in different tissues and follicles of varying sizes were analyzed by real-time fluorescence quantitative PCR (qPCR) and immunoblotting technology. Immunohistochemistry method was used to analyze the expression and distribution characteristics of MGP in ovarian tissue. The results revealed that the overall fragment (467 bp) of sheep MGP gene CDS region was obtained successfully, and the fragment encoded 103 amino acids, with a theoretical relative molecular weight of 12 230.96 and an isoelectric point of 9.27. Sequence composed of 19 amino acids from the N-terminal was predicted as the signal peptide sequence, and the mature peptide contained 84 amino acids, which was extra-membranous domain protein without intracellular region. The total protein amino acid sequences of MGP shared similarities with those of the homologous proteins from goats and cows of 100.0% and 99.0% respectively, and the similarity with human and mouse was 85.4%. The relative expression levels of MGP mRNA and protein were low in sheep tissues such as heart, liver, spleen, lung and kidney, but were high in reproductive systems or tissues, such as ovary, fallopian tube and uterus, and the relative expression level was also high in corpus luteum. The expression levels of MGP granulosa cells and cumulus cells were high, whereas it didn’t expressed in atresia follicles. The study result can provide a basis for further investigation of the biological role of MGP in ovarian tissues.
Key words:matrix Gla protein;sheep;ovary;granular cell;corpus luteum
基质Gla蛋白(Matrix Gla protein, MGP)是一种由血管平滑肌和内皮细胞分泌的、非胶原细胞外基质蛋白质,主要存在于骨、软骨、肾、肺、心脏和血管平滑肌细胞等部位[1-3]。MGP是人体内最有效的天然钙化抑制剂[4-5],是维生素K依赖的血管钙化抑制因子,通过影响细胞分化抑制组织钙化过程[6-7]。MGP还具有促进局部肿瘤细胞发生及血管发生异常的作用[8-10],在卵巢癌等不同类型癌症发生过程中异常表达[11-12],其表达水平通常与肿瘤侵袭性相关[10, 13-15]。除病理性之外,MGP基因在正常发育的大鼠附睾分化期和成年大鼠附睾体部及尾部细胞中均高表达[16],雌激素可提高去卵巢大鼠MGP的表达水平[17]。补充生理剂量的雌激素有利于摘除卵巢的小鼠骨折部位愈合[18]。这些结果暗示了MGP基因可能在哺乳动物中具有生殖功能,目前仍不清楚其在哺乳动物生殖系统尤其是卵巢中的表达特征。
本研究拟针对绵羊MGP基因进行分子克隆,并对MGP蛋白氨基酸序列进行生物信息学分析,合成MGP多肽以制备特异鼠抗血清,利用实时荧光定量PCR(Real-time qPCR)、蛋白质印迹(Western Blot)及免疫组织化学技术分析MGP在绵羊卵巢及卵泡中的表达特征,为探索该基因在绵羊卵泡发育中的功能提供参考。
1材料与方法
1.1绵羊组织来源与处理
绵羊组织样品均来自乌鲁木齐华凌屠宰场,取健康母羊的心、肝、脾、肺、肾、肌肉、子宫、输卵管和卵巢等组织,将组织剪切成长、宽、高均不大于0.5 cm的组织块,迅速将组织块完全浸泡于5~10倍体积的AllProtectTM试剂(碧云天生物技术股份有限公司产品)中保存,卵巢在1~2 h内运抵实验室,用眼科镊子手工剥离卵泡(直径<3 mm的为小卵泡;直径 3~5 mm的为中卵泡;直径>5 mm的为大卵泡)后置于AllProtectTM试剂中保存,用于提取RNA和蛋白质。用于组织学分析的卵巢置于波恩(Bouin)固定液中固定,用常规方法进行石蜡包埋和石蜡切片。
1.2引物设计及合成
根据美国国家生物技术信息中心(NCBI)数据库绵羊MGP基因(GenBank ID:XM_004006833.4)的蛋白质编码区域(CDS)设计克隆引物和定量引物(表1),引物由生工生物工程(上海)股份有限公司合成。
1.3MGP基因CDS区的克隆
用RNA提取试剂TRIzol(白鲨生物科技有限公司产品)提取卵泡总RNA,利用反转录试剂盒(成都福际生物技术有限公司产品)合成cDNA。以卵泡总cDNA为模板,以MGP-F/MGP-R为引物PCR扩增MGP的开放阅读框序列。PCR的程序:95 ℃ 5 min;94 ℃ 10 s,58 ℃ 10 s,72 ℃ 30 s,35个循环;72 ℃ 1 min。采用凝胶电泳分析,回收467 bp预期大小的目的条带。回收PCR片段与pMD19 T载体[宝日医生物技术(北京)有限公司产品]连接,转化DH5α,挑取单克隆,菌落通过PCR扩增验证,选阳性克隆测序。将测序结果与NCBI数据库中绵羊MGP序列进行对比分析。
1.4绵羊MGP蛋白的生物信息学分析
利用在线软件SignalP-5.0(https://services. healthtech.dtu. dk/service. php? SignalP-5. 0)预测分析绵羊MGP蛋白的信号肽序列;利用TMHMM Server v. 2. 0(http://www. cbs. dtu. dk /services/TMHMM/)预测绵羊MGP蛋白氨基酸序列跨膜结构特征。将绵羊MGP与山羊(XP_017903930.1)、牛(NP_777132.1)、人(AAH05272.1)和小鼠(AAH79478.1)的同源蛋白氨基酸序列进行比较。使用STRING(https://cn.string-db.org/)单基因蛋白质互作网络进行预测分析。
1.5实时荧光定量PCR
提取各个组织和不同直径的卵泡的总RNA并反转录成cDNA。按照RT-qPCR EasyTM试剂盒(成都福际生物技术有限公司产品)说明书进行实时荧光定量PCR反应。反应程序:95 ℃ 5 min;95 ℃ 10 s, 58 ℃ 10 s, 72 ℃ 10 s, 40个循环。每个样品设置3个生物学重复。相对表达量的计算过程如下:△Ct=Ct目的基因 -Ct内参基因;△△Ct=△Ct试验组样品 -△Ct对照组样品;相对表达量=2-△△Ct。其中,Ct表示循环阈值。
1.6MGP的原核表达
绵羊MGP开放阅读框序列由南京金斯瑞生物科技有限公司合成并亚克隆至pET15b多克隆酶切位点(Nde I/Bam H Ⅰ),再转化至BL21(DE3)表达菌株,经0.3 mmol/L异丙基-β-D-硫代半乳糖苷(IPTG)诱导4 h重组蛋白质表达。收集诱导前和诱导后的菌体,分别制备诱导前总蛋白质、诱导后总蛋白质、超声破碎诱导后上清液蛋白质、沉淀蛋白质样品,经电泳和脱色,进行重组蛋白质的表达及可溶性分析。
1.7MGP 抗体的制备
因绵羊MGP蛋白氨基酸序列与人及小鼠同源蛋白氨基酸序列有差异,对应的抗体无法用于绵羊MGP蛋白的检测分析。经DNAman软件分析,选择绵羊MGP蛋白氨基酸序列C末端89~103位包含的15个氨基酸的多肽(NAAYDRYFRQRRGAK,命名为MGP89)进行化学合成,并偶联至血蓝蛋白(KLH)分子作为抗原免疫小鼠,制备小鼠多克隆抗体。抗体制备方法简述如下:用生理盐水将偶联好的抗原稀释至1 μg/μL;抗原和佐剂等体积迅速混匀,现用现配。取5只昆明白小鼠(20~25 g),第1 d每只小鼠后腿肌肉注射100 μL抗原佐剂混合物;第14 d同样剂量重复注射1次,第21 d摘小鼠眼球放血,分离血清。
1.8Western blot分析
利用原核表达蛋白质或组织蛋白质样品进行Western Blot分析。称取约0.1 g组织,加500 μL裂解液[含1% PMSF(苯甲磺酰氟)],用匀浆器匀浆以充分裂解组织,再加500 μL裂解液冰浴30 min,4 ℃离心5 min,取上清液,用二喹啉甲酸(BCA)蛋白测定试剂盒(碧云天生物技术股份有限公司产品)测定蛋白质浓度。
根据蛋白质浓度加入5×上样缓冲液,混匀后在沸水中煮10 min,使蛋白质变性。将变性蛋白质溶液保存于-80 ℃备用。制备聚丙烯酰胺凝胶,将蛋白质Marker、蛋白质样品加入凝胶中,80 V电压2 h;60 V电压1 h将蛋白质转到PVDF(聚偏二氟乙烯膜)上;在室温下用封闭液[含5%脱脂奶粉的PBS(磷酸缓冲盐溶液)]孵育2 h;将膜浸泡于自制小鼠MGP抗血清稀释液中,室温孵育1 h,用PBST(含0.05% Tween20的PBS)洗膜,3次×5 min;再将膜室温孵育在辣根过氧化物酶(HRP)标记羊抗鼠(碧云天生物技术股份有限公司产品)二抗稀释液中1 h,用PBST洗膜,5次×5 min;膜上点ECL(增强型化学发光试剂)化学发光底物工作液(白鲨生物科技有限公司产品),置于凝胶成像系统(Amersham Imager 600,GE,美国)中进行发光显影。取出曝光后的膜,用PBST清洗2次×5 min,用抗体洗脱液在室温下孵育15 min,再用PBST清洗3次×5 min。封闭后将膜置于HRP标记的内参蛋白抗体(β-actin)工作液中,室温孵育1 h,用PBST洗膜4次×5 min。用ECL发光液处理后使用凝胶成像系统检测、拍照。最后使用Image J软件对蛋白质条带进行灰度分析,并用β-actin进行均一化处理。使用Image J软件对蛋白质条带的化学发光强度进行定量分析。
1.9免疫组织化学分析
将石蜡切片上的蜡脱尽,进行复水,用PBS浸洗;进行抗原热修复,用PBS清洗3次;用3% H2O2封闭,用PBS清洗3次;用5% BSA室温封闭1 h;加MGP自制鼠抗,室温孵育60 min,用PBS清洗3次;加HRP标记山羊抗兔IgG二抗(碧云天生物技术股份有限公司产品)。室温孵育40 min,用PBS清洗3次;加入二氨基联苯胺(DAB)(白鲨生物科技有限公司产品)显色试剂,用自来水冲洗;放入苏木素染剂进行复染,用自来水清洗;用0.5%盐酸乙醇(1 mL 36%浓盐酸与7 mL 75%乙醇混合)进行分化,用自来水浸洗,然后进行脱水和透明处理;用树胶进行封片。用光学显微镜观察并拍照。
1.10统计分析
本研究使用GraphPad Prism 8.0软件进行统计分析,采用独立样本T检验和One-way方差分析(ANOVA)进行显著性分析,每个试验设3个独立的样本,并重复3次。数据结果用平均值±标准差表示,P>0.05为差异不显著,P<0.05为差异显著,P<0.01为差异极显著。
2结果与分析
2.1MGP基因序列分析
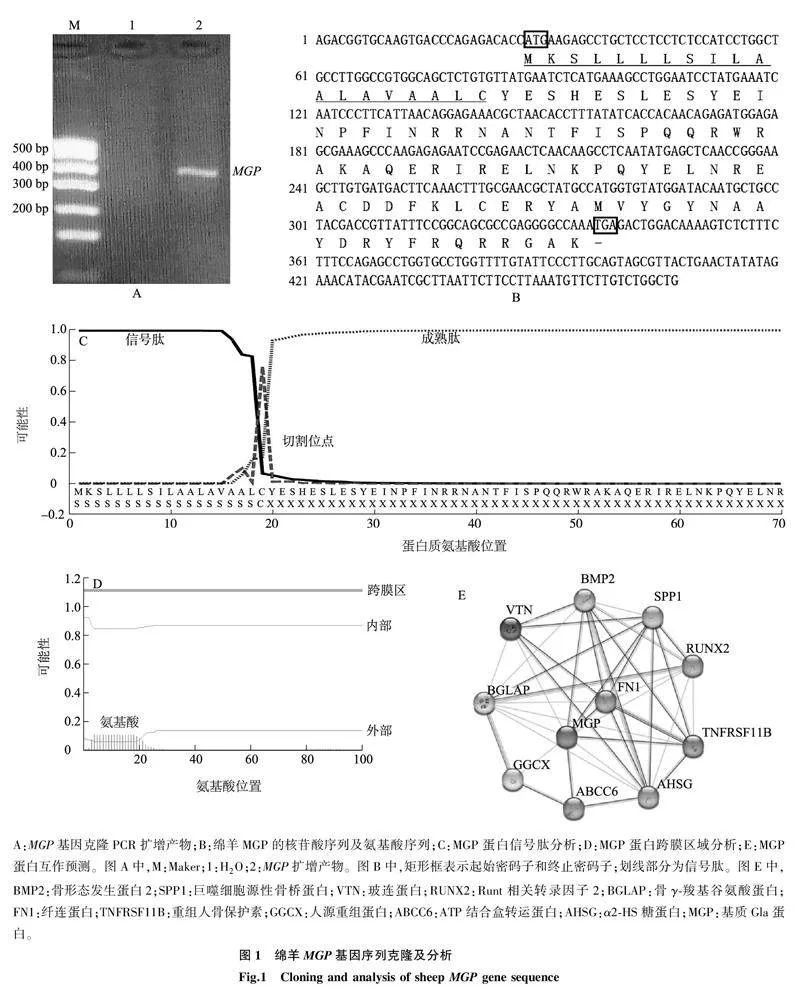
以卵泡cDNA为模板,用引物MGP-F和MGP-R PCR扩增MGP基因获得467 bp单一条带产物(图1A),克隆测序结果表明该片段为绵羊MGP基因,开放阅读框(ORF)共编码103个氨基酸(图1B),理论相对分子量为12 230.96,等电点为9.27。预测信号肽为N末端19个氨基酸(图1C),成熟肽有84个氨基酸,为外泌性蛋白质,无胞内区(图1D)。同其他物种MGP氨基酸序列比对结果显示,MGP蛋白氨基酸序列与山羊、牛的同源蛋白质相似性分别为100.0%、99.0%,与人、小鼠的同源蛋白质相似性均为85.4%(88/103)。蛋白质相互作用功能预测结果表明,MGP蛋白与BMP2(骨形态发生蛋白2)、SPP1(巨噬细胞源性骨桥蛋白)、VTN(玻连蛋白)、RUNX2(Runt相关转录因子2)、BGLAP(骨γ-羧基谷氨酸蛋白)、FN1(纤连蛋白)、TNFRSF11B(重组人骨保护素)、GGCX(人源重组蛋白)、ABCC6(ATP结合盒转运蛋白)和AHSG(α2-HS糖蛋白)等10种蛋白质存在相互作用(图1E)。
2.2绵羊MGP重组蛋白质表达及抗体制备
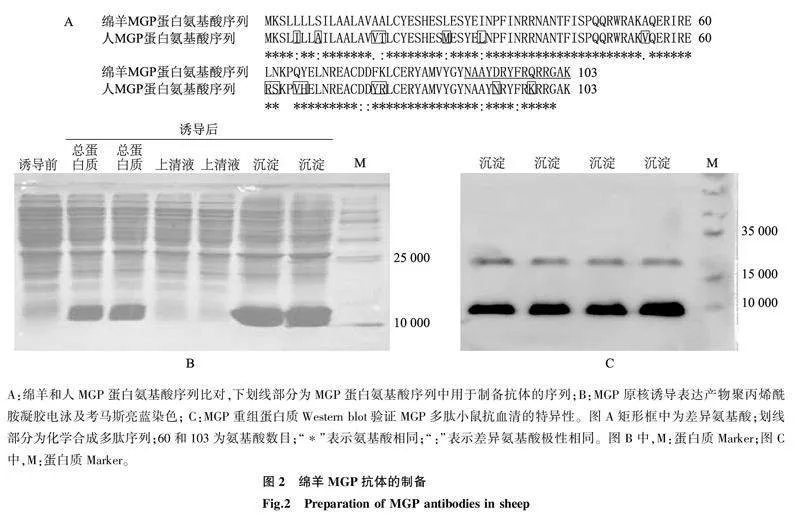
由于绵羊与人MGP蛋白序列103个氨基酸中存在15个氨基酸的差异且差异序列不连续分布(图2A),因此人源MGP抗体不适用于绵羊MGP的免疫学检测。为验证抗体特异性,合成绵羊MGP编码序列并亚克隆至pET15b原核细胞,经诱导表达分析,在相对分子量10 000附近有重组蛋白质表达(图2B),且以包涵体形式存在。重组蛋白质可被合成的用MGP89多肽免疫小鼠制备的抗血清所特异识别(图2C),表明该抗体可用于绵羊MGP蛋白的Western Blot检测分析。
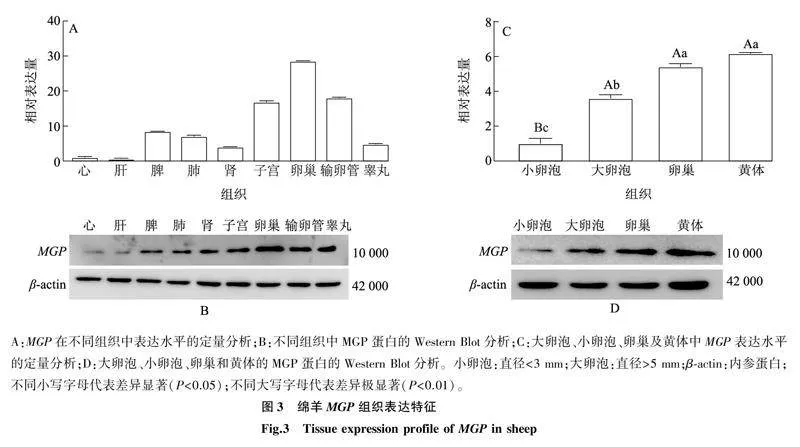
2.3绵羊MGP基因在不同组织及大小不同的卵泡中的表达特征利用Real-time qPCR和Western Blot分析绵羊心、肝、脾、肺、肾、子宫、卵巢、输卵管和睾丸等9个器官或组织中MGP基因及蛋白质的表达情况。PCR定量分析结果(图3A)显示,MGP在各组织中均有表达,mRNA相对表达量大小依次为卵巢、输卵管、子宫、脾、肺、睾丸、肾、心、肝。Western Blot检测结果表明,各组织中蛋白质表达水平与基因表达趋势基本一致,在生殖系统的子宫、输卵管、卵巢及睾丸组织中均有高含量的MGP蛋白,其他组织中MGP的表达水平很低甚至检测不到(图3B)。
在绵羊卵巢、小卵泡、大卵泡及黄体中MGP的表达情况见图3C,MGP基因在黄体中的相对表达量最高(图3C),极显著高于小卵泡(P<0.01),其次是卵巢、大卵泡,在小卵泡中相对表达量最低。Western Blot分析结果与PCR定量分析结果基本一致(图3D)。
2.4MGP在卵巢中的表达定位特征
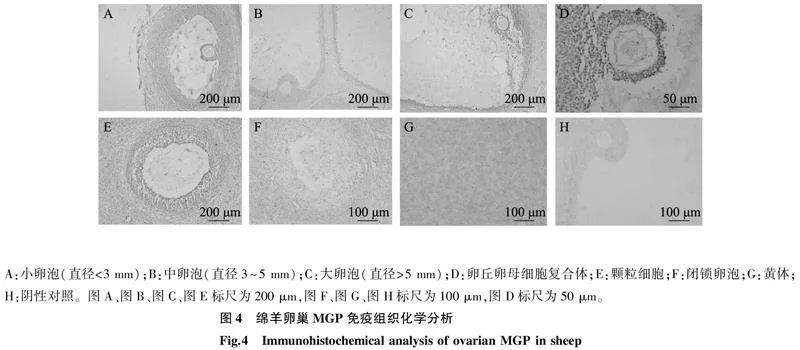
利用免疫组化方法检测MGP蛋白在卵巢中不同时期卵泡中的表达情况。结果表明,MGP蛋白在发育的有腔卵泡的颗粒细胞、卵丘细胞中均有表达(图4A~图4E),在闭锁卵泡中不表达(图4F),在黄体细胞中有高表达(图4G)。
3讨论
MGP蛋白是最早在人体内发现的血管钙化抑制剂,不仅影响细胞分化和钙磷离子复合物形成等途径,还影响多种致瘤过程。但关于该基因对哺乳动物卵巢正常生理功能影响的研究还未见报道,本研究首次利用绵羊卵巢组织克隆了MGP基因编码序列,并对其在卵巢中的表达特征进行了初步分析。
哺乳动物MGP蛋白长度通常为103个氨基酸,由4个外显子组成,在基因组中大多数是单拷贝形式。绵羊MGP序列与山羊一致,与牛相差1个氨基酸,与人相比存在15个氨基酸的差异,与人同源蛋白质的抗体通用性不高。我们利用多肽合成制备了小鼠抗绵羊MGP抗血清,并经原核表达重组MGP蛋白验证抗体,表明其特异性,然后进行Western Blot和免疫组化分析MGP蛋白的表达情况。本研究利用STRING数据库,对蛋白质的相互作用情况进行预测分析,结果显示,与MGP相互作用的有10种蛋白质,包括BMP2、SPP1、VTN、RUNX2、BGLAP、FN1、TNFRSF11B、GGCX、ABCC6和AHSG。其中BMP2、SPP1、AHSG、VTN等都与卵泡的发育及卵母细胞的质量有关[19-21]。
MGP与BMP2共定位在人小梁网细胞[22],前者是后者的调节蛋白质[23-24]。卵泡液中BMP2的含量与卵母细胞受精能力呈正相关[19],有研究结果表明MGP是BMP2的结合蛋白质[25]。MGP是否通过BMP2直接或间接影响卵泡的发育进程,还有待进一步验证。关于人卵泡转录组学的研究结果表明,在排卵前卵泡颗粒细胞(GCs)中表达的VTN可能是排卵前卵泡细胞和卵丘细胞扩展的关键调控因子[21]。SPP1和MGP是参与骨形成和钙化的蛋白质,SPP1同MGP类似,也具有抑制钙化作用[26]。SPP1可减少猪卵母细胞体外受精过程中的多精现象[27],也可促进猪胚胎体外发育,减少细胞凋亡[20]。MGP是否通过SPP1影响卵母细胞功能,目前仍不清楚。
Li等[28]报道,MGP定位于血管平滑肌细胞、软骨、骨和心脏的细胞外基质中。关于MGP在卵巢中表达的研究主要与卵巢癌相关[12],关于其在正常生殖生理方面的生物学功能研究尚未见报道。我们研究发现,MGP基因的相对表达量在黄体中显著高于小卵泡、大卵泡,在小卵泡中相对表达量最低。免疫组化检测结果表明,MGP在卵丘细胞、颗粒细胞中均有表达,在黄体细胞中高表达。上述结果表明,MGP可能影响绵羊卵泡的发育及黄体的生成过程。
在卵巢发育过程中钙离子至关重要,Li等[28]认为MGP可以上调胞内游离钙离子浓度,并在调节下游细胞信号通路的过程中发挥关键作用。Udagawa等[29]研究发现,调控线粒体分裂的相关基因Drp1参与调控卵泡发育进而影响卵子质量。缺乏Drp1的卵细胞线粒体、内质网和分泌泡等钙信号通路受损,导致卵子成熟出现异常。上述结果说明,Drp1通过调节钙离子浓度影响卵泡发育。通常认为MGP由血管平滑肌和内皮细胞分泌而来,而血管系统在成人卵巢的卵泡群中分布并不均匀,原始卵泡和生长缓慢的腔前卵泡本身并不存在血管,而是依赖于周围间质中的血管[30]。Jiang等[31]的研究结果表明,在中间毛囊,新生血管出现在毛细血管层的顶端;在优势毛囊,新生血管出现在毛细血管层的中部或下部。我们的研究发现,闭锁的卵泡中并无MGP的显著表达,而在健康的卵泡及黄体细胞中MGP则高表达,这表明MGP的存在可能对卵泡的正常发育以及黄体的生成具有重要的作用。我们推测,在卵泡发育过程中MGP可能从多方面影响着卵泡的发育与成熟,甚至是黄体的发育,但其具体作用机制以及调控机制还需进一步的试验验证。
4结论
本研究成功获得绵羊MGP基因的CDS区全长片段(467 bp)。对MGP基因及其编码的蛋白质进行了生物信息学分析,推测MGP是一种外泌性蛋白质。MGP基因在绵羊生殖系统组织中高表达,在卵泡的卵丘细胞、颗粒细胞中均有表达,在黄体细胞中高表达,但在闭锁卵泡中不表达。本研究结果表明,MGP在卵泡的发育、成熟及黄体的生成过程中可能起着重要的作用,在生殖系统中的具体功能和分子机制还有待于进一步研究和验证。
参考文献:
[1]PRICE P A, URIST M R, OTAWARA Y. Matrix Gla protein, a new gamma-carboxyglutamic acid-containing protein which is associated with the organic matrix of bone[J]. Biochemical and Biophysical Research Communications,1983,117(3):765-771.
[2]HALE J E, FRASER J D, PRICE P A. The identification of matrix Gla protein in cartilage[J]. Journal of Biological Chemistry,1988,263(12):5820-5824.
[3]CANCELA L, HSIEH C L, FRANCKE U, et al. Molecular structure, chromosome assignment, and promoter organization of the human matrix Gla protein gene[J]. J Biol Chem,1990,265(25):15040-15048.
[4]SHANAHAN C M, CROUTHAMEL M H, KAPUSTIN A, et al. Arterial calcification in chronic kidney disease: key roles for calcium and phosphate[J]. Circ Res,2011,109(6):697-711.
[5]IYEMERE V P, PROUDFOOT D, WEISSBERG P L, et al. Vascular smooth muscle cell et phenotypic plasticity and the regulation of vascular calcification[J]. Journal of Internal Medicine,2006,260(3):192-210.
[6]PRICE P A, WILLIAMSON M K. Primary structure of bovine matrix Gla protein, a new vitamin K-dependent bone protein[J]. Journal of Biological Chemistry,1985,260(28):14971-14975.
[7]LUO G, DUCY P, MCKEE M D, et al. Spontaneous calcification of arteries and cartilage in mice lacking matrix GLA protein[J]. Nature,1997,386(6620):78-81.
[8]SHARMA B, ALBIG A R. Matrix Gla protein reinforces angiogenic resolution[J]. Microvascular Research,2013,85:24-33.
[9]ZHAO J, WARBURTON D. Matrix Gla protein gene expression is induced by transforming growth factor-beta in embryonic lung culture[J]. American Journal of Physiology,1997,273(1):282-287.
[10]YOSHIMURA K, TAKEUCHI K, NAGASAKI K, et al. Prognostic value of matrix Gla protein in breast cancer[J]. Molecular Medicine Reports,2009,2(4):549-553.
[11]GHEORGHE S R, CRCIUN A M. Matrix Gla protein in tumoral pathology[J]. Clujul Medical,2016,89(3):319-321.
[12]STERZYNSKA K, KLEJEWSKI A, WOJTOWICZ K, et al. The role of matrix Gla protein (MGP) expression in paclitaxel and topotecan resistant ovarian cancer cell lines[J]. International Journal of Molecular Sciences,2018,19(10):2901.
[13]LEVEDAKOU E N, STROHMEYER T G, EFFERT P J, et al. Expression of the matrix Gla protein in urogenital malignancies[J]. International Journal of Cancer,1992,52(4):534-537.
[14]ZANDUETA C, ORMAZBAL C, PERURENA N, et al. Matrix-Gla protein promotes osteosarcoma lung metastasis and associates with poor prognosis[J]. Journal of Pathology,2016,239(4):438-449.
[15]NIEDDU V, MELOCCHI V, BATTISTINI C, et al. Matrix Gla protein drives stemness and tumor initiation in ovarian cancer[J]. Cell Death & Disease,2023,14(3):220.
[16]马赫,张葆荔,刘宝英,等. 基质Gla蛋白在大鼠附睾发育过程中的表达及定位[J]. 中国组织化学与细胞化学杂志,2019,28(1):1-5.
[17]陈雪英,姜醒华,赖晓阳,等. 雌二醇对去卵巢大鼠基质GLA蛋白表达的影响[J].中华妇产科杂志,2012,47(11):833-838.
[18]赵永强,王宏跃,李甲振,等. 卵巢摘除及补充雌激素对小鼠骨折愈合中钙沉积的影响[J]. 中医正骨,2000(5):3-4,63.
[19]SUGIYAMA R, FUZITOU A, TAKAHASHI C, et al. Bone morphogenetic protein 2 may be a good predictor of success in oocyte fertilization during assisted reproductive technology[J]. Human Cell,2010,23(3):83-88.
[20]HAO Y, MURPHY C N, SPATE L, et al. Osteopontin improves in vitro development of porcine embryos and decreases apoptosis[J]. Molecular Reproduction and Development,2008,75(2):291-298.
[21]ZHANG Y , YAN Z , QIN Q, et al. Transcriptome landscape of human folliculogenesis reveals oocyte and granulosa cell interactions[J]. Molecular Cell,2018,72(6):1021-1034.
[22]XUE W, WALLIN R, OLMSTED-DAVIS E A, et al. Matrix Gla protein function in human trabecular meshwork cells: inhibition of BMP2-induced calcification process[J]. Investigative Ophthalmology & Visual Science,2006,47(3):997-1007.
[23]ZEBBOUDJ A F, IMURA M, BOSTRM K. Matrix Gla protein, a regulatory protein for bone morphogenetic protein-2[J]. Journal of Biological Chemistry,2002,277(6):4388-4394.
[24]DEMIRAY S B, YILMAZ O, GOKER E N T, et al. Expression of the bone morphogenetic protein-2 (BMP2) in the human cumulus cells as a biomarker of oocytes and embryo quality[J]. Journal of Human Reproductive Sciences,2017,10(3):194-200.
[25]WALLIN R, CAIN D, HUTSON S M, et al. Modulation of the binding of matrix Gla protein (MGP) to bone morphogenetic protein-2 (BMP-2) [J]. Thrombosis and Haemostasis,2000,84(6):1039-1044.
[26]SPEER M Y, MCKEE M D, GULDBERG R E, et al. Inactivation of the osteopontin gene enhances vascular calcification of matrix Gla protein-deficient mice: evidence for osteopontin as an inducible inhibitor of vascular calcification in vivo[J]. Journal of Experimental Medicine,2002,196(8):1047-1055.
[27]HAO Y, MATHIALAGAN N, WALTERS E, et al. Osteopontin reduces polyspermy during in vitro fertilization of porcine oocytes[J]. Biology of Reproduction, 2006, 75(5): 726-733.
[28]LI X Q, WEI R, WANG M Z, et al. MGP promotes colon cancer proliferation by activating the NF-κB pathway through upregulation of the calcium signaling pathway[J]. Molecular Therapy-Oncolytics,2020,17:371-383.
[29]UDAGAWA O, ISHIHARA T, MAEDA M, et al. Mitochondrial fission factor Drp1 maintains oocyte quality via dynamic rearrangement of multiple organelles[J]. Current Biology,2014,24(20):2451-2458.
[30]STOUFFER R L, MARTNEZ-CHEQUER J C, MOLSKNESS T A, et al. Regulation and action of angiogenic factors in the primate ovary[J]. Archives of Medical Research,2001,32(6):567-575.
[31]JIANG J Y, MACCHIARELLI G, TSANG B K, et al. Capillary angiogenesis and degeneration in bovine ovarian antral follicles[J]. Reproduction,2003,125(2):211-223.
(责任编辑:陈海霞)
