淹水胁迫对菊芋幼苗生长形态及生理特性的影响
2024-09-25李小雪朱进梁华儒胡柳刘奕清


摘 要:为探究菊芋耐涝机制,以不淹水为对照,设0、3、9 d等3个淹水时间,共6个处理,研究了淹水胁迫对本地白皮菊芋的生长形态和生理特性的影响。结果表明,淹水3、9 d,菊芋的叶绿素含量、地上部干质量和地下部鲜干质量都显著低于对照;淹水3 d时,菊芋的可溶性糖含量、脯氨酸(Pro)含量和乳酸脱氢酶(LDH)活性均显著高于对照,分别比对照增加了114.15%、449.02%、333.33%;淹水9 d时,菊芋的茎粗和过氧化物酶(POD)活性均显著高于对照,分别比对照增加了11.23%、100.00%。说明本地白皮菊芋比较耐淹,通过提高其LDH活性进行乳酸发酵、提高POD活性、增加可溶性糖和Pro含量来适应淹水胁迫,使得植株少受或免受伤害。
关键词:菊芋;淹水胁迫;生长形态;生理特性
中图分类号:S632.9 文献标志码:A 文章编号:1673-2871(2024)09-136-08
Effects of waterlogging stress on growth morphology and physiological characteristics of jerusalem artichoke seedling
LI Xiaoxue, ZHU Jin, LIANG Huaru, HU Liu, LIU Yiqing
(College of Horticulture and Gardening, Yangtze University, Jingzhou 434025, Hubei, China)
Abstract: In order to explore the waterlogging tolerance mechanism of jerusalem artichoke(Helianthus tuberosus L.), a two-factor completely random design was adopted, the first factor was the waterlogging mode, and two levels of waterlogging and non-waterlogging (control) were set, and the second factor was the waterlogging time, and three levels of waterlogging were set to 0, 3 and 9 days, a total of 6 treatments were used to study the effects of waterlogging stress on the growth morphology and physiological characteristics of the local white bark jerusalem artichoke. The results showed that aboveground dry mass, underground fresh and dry mass of jerusalem artichoke seedlings were significantly lower than that of the control, as well as the cW50ML/zyHhzA7L2U0H3jSw==hlorophyll content. The soluble sugarcontent, proline content and lactate dehydrogenase activity(LDH)of jerusalem artichoke seedlings were significantly higher than the control after 3 days of waterlogging stress, increased by 114.15%, 449.02% and 333.33%, respectively. Stem diameter and peroxidase(POD)activity were significantly higher than the control after 9 days of waterlogging stress, increased by 11.28% and 100.00%, respectively. In summary, native white bark jerusalem artichoke was a waterlogging tolerant plant. It adapted to waterlogging stress by increasing LDH activity, POD activity, soluble sugar and Pro content,so that the plant was less harmed or protected from damage.
Key words: Helianthus tuberosus L.; Waterlogging stress; Growth morphology; Physiological characteristic
收稿日期:2024-03-08;修回日期:2024-04-10
基金项目:湖北省第四批现代农业产业技术体系高品质蔬菜产业技术体系(2023HBSTX4-06);湖北省重点研发计划项目(2022BBA0061);湖北省自然科学基金项目(2023AFB1001)
作者简介:李小雪,女,在读硕士研究生,研究方向为设施蔬菜栽培与逆境生理。E-mail:3367257609@qq.com
通信作者:朱 进,男,教授,研究方向为设施蔬菜栽培与逆境生理。E-mail:278162100@qq.com
菊芋,又名洋姜,菊科向日葵属多年宿根性草本植物,原产于北美[1-2]。菊芋对生长环境要求较低且产量高,常被认为是一种高产、高附加值的作物,用途非常广泛,被联合国粮农组织誉为“21世纪人畜共用作物”[3-5]。
在中国长江中下游地区,有区域性强降水过程,并呈现频率和强度增加的趋势[6]。持续性的暴雨和特大暴雨常引起洪涝灾害,农田中会出现大量积水,粮食生产受到显著影响[7]。淹水胁迫对植物生长、生理等多方面造成影响[8],出现植株变矮、发育期延迟、地上和地下部的干物质含量下降等现象;同时,植物通过一系列的生理生化反应来应对淹水胁迫。在低氧条件下,植物会从有氧呼吸转变为无氧呼吸,通过增加乳酸脱氢酶(LDH)、丙酮酸脱羧酶(PDC)、乙醇脱氢酶(ADH)等一系列酶的活性,加快碳水化合物代谢,维持能量[9]。植物通过提高抗氧化酶如超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性,减轻淹水胁迫下活性氧(ROS)大量积累对植物的毒害[10]。植物还可通过增加可溶性糖、可溶性蛋白、脯氨酸含量,保持细胞内外的渗透压平衡,维持细胞稳态,防止细胞受损[11]。
目前关于淹水胁迫对菊芋影响的研究鲜有报道,对于菊芋的耐涝性强弱和具体的淹水响应机制尚不明确。因此,笔者以荆州本地白皮菊芋为试材,对其进行耐涝性鉴定,从生长、生理特性两个方面研究淹水胁迫对菊芋的影响,探究其响应淹水胁迫的实质,以期为以后选育菊芋耐涝品种提供理论依据。
1 材料与方法
1.1 材料
供试材料品种为荆州本地白皮菊芋,由长江大学香辛作物研究院提供。
1.2 方法
试验于2022年12月至2023年8月在长江大学园艺试验基地内温室大棚和园艺植物生理实验室进行。采用双因素完全随机试验设计,因素一为淹水方式,设淹水(水面高出基质表面2 cm)和不淹水(对照)2个水平,因素二为淹水时间,设淹水0、3、9 d等3个水平,共6个处理,每个处理20盆,3次重复。2022年12月,选取20~30 g菊芋块茎进行3个月深埋贮藏,埋土深度25 cm;2023年3月开始播种于栽培盆中(口径27.5 cm、高31.0 cm),每盆1个种块,播种深度5~7 cm。待菊芋幼苗长至6叶1心时,选取大小一致的幼苗进行淹水处理(保持水面高出基质表面2 cm),在淹水0、3、9 d,各处理分别取样15株测定各项生长指标和生理指标,3次重复。
1.3 项目测定方法
1.3.1 生长指标的测定 将菊芋幼苗冲洗干净后,用卷尺从主茎基部测量株高(植株基部到顶端生长点);用游标卡尺测量茎粗(子叶下1 cm处的淹水部分);记录菊芋的真叶叶片数;用游标卡尺测量选取叶片的叶长(叶基部到叶尖长度)、叶宽(叶片横截面长度);记录幼苗分枝数量;用电子天平测定植株地上部和地下部鲜质量,然后于105 ℃烘箱中杀青15 min,72 ℃烘干至恒质量,用电子天平测定干质量。
1.3.2 生理指标的测定 参照吴强盛[12]的方法测定叶绿素、丙二醛(MDA)、超氧阴离子、脯氨酸(Pro)、可溶性糖、可溶性蛋白含量以及SOD、POD、CAT活性。采用硫代巴比妥酸法测定MDA含量;采用羟胺法测超氧阴离子含量;采用NBT法测定SOD活性、采用愈创木酚法测定POD活性、采用分光光度法测定CAT活性;采用水杨酸法测定Pro含量,采用蒽酮比色法测定可溶性糖含量,采用考马斯亮蓝法测定可溶性蛋白含量。则参照刘潜等[13]的方法测定PDC、ADH、LDH活性。
1.4 数据分析
采用Microsoft Excel 2019进行数据处理和绘制图表,使用Photoship 2020进行照片标记。用DPS 18.05软件进行统计分析,用邓肯式新复极差法进行差异显著性分析。
2 结果与分析
2.1 淹水胁迫对菊芋幼苗生长形态的影响
2.1.1 淹水胁迫对菊芋幼苗形态指标的影响 从图1中可以看出,淹水3 d,菊芋幼苗叶片边缘稍有卷曲;淹水9 d,植株叶片边缘黄褐化、下部少量叶片脱落,茎秆基部变色、弯曲、增粗,根系出现渍害,但是叶片大部分仍呈绿色。
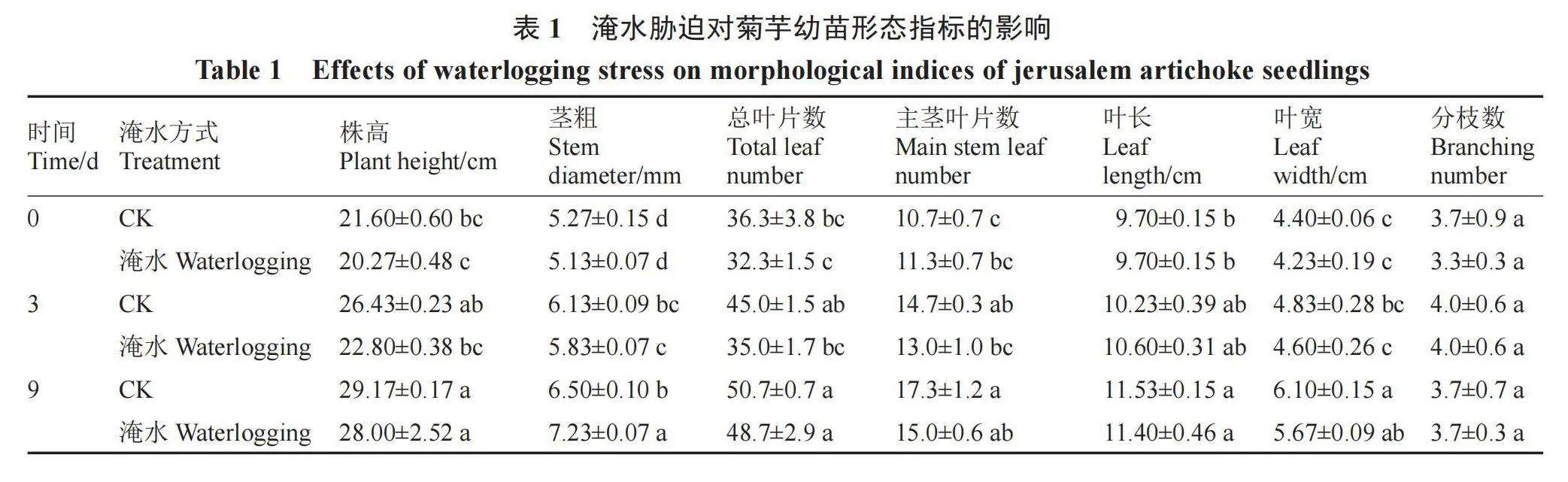
由表1可知,淹水0、3 d,菊芋株高、总叶片数、主茎叶片数、叶长、叶宽、分枝数与对照相比均差异不显著;淹水9 d时的菊芋茎粗显著大于对照,较对照增大了11.23%。
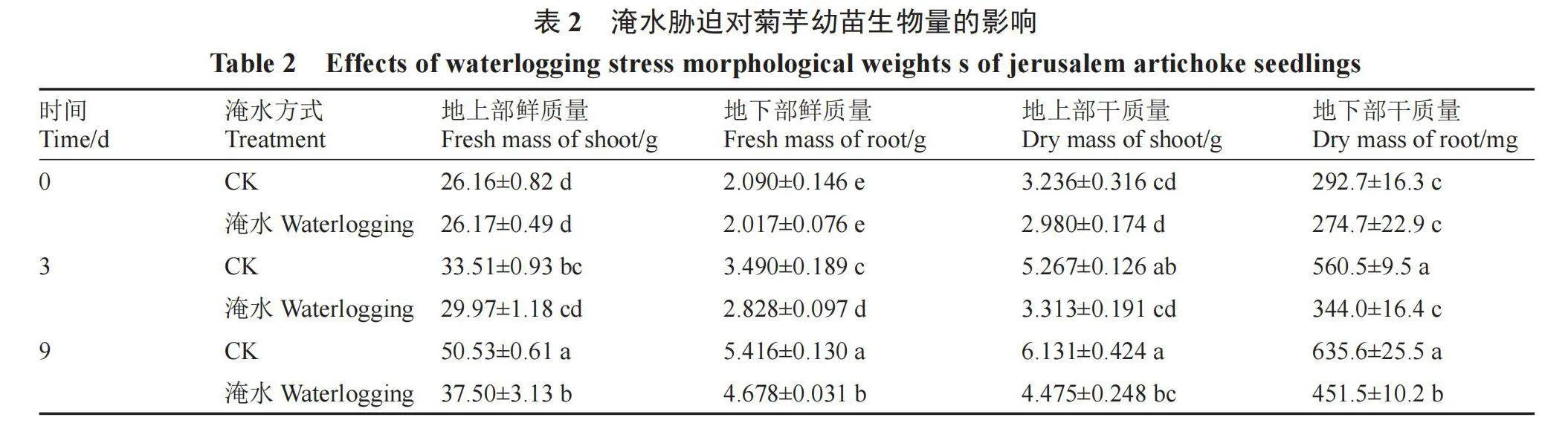
2.1.2 淹水胁迫对菊芋幼苗生物量的影响 由表2可知,淹水3 d,菊芋幼苗地上部干质量、地下部鲜质量和干质量均显著低于对照;淹水9 d,菊芋幼苗地上部鲜干质量和地下部鲜干质量均显著低于对照,地上部鲜质量较对照下降了25.79%;在淹水3、9 d,地下部干质量较对照分别下降了38.63%、28.96%,表明菊芋幼苗的生长发育一定程度上受到了淹水胁迫的抑制。
2.2 淹水胁迫对菊芋幼苗生理特性的影响
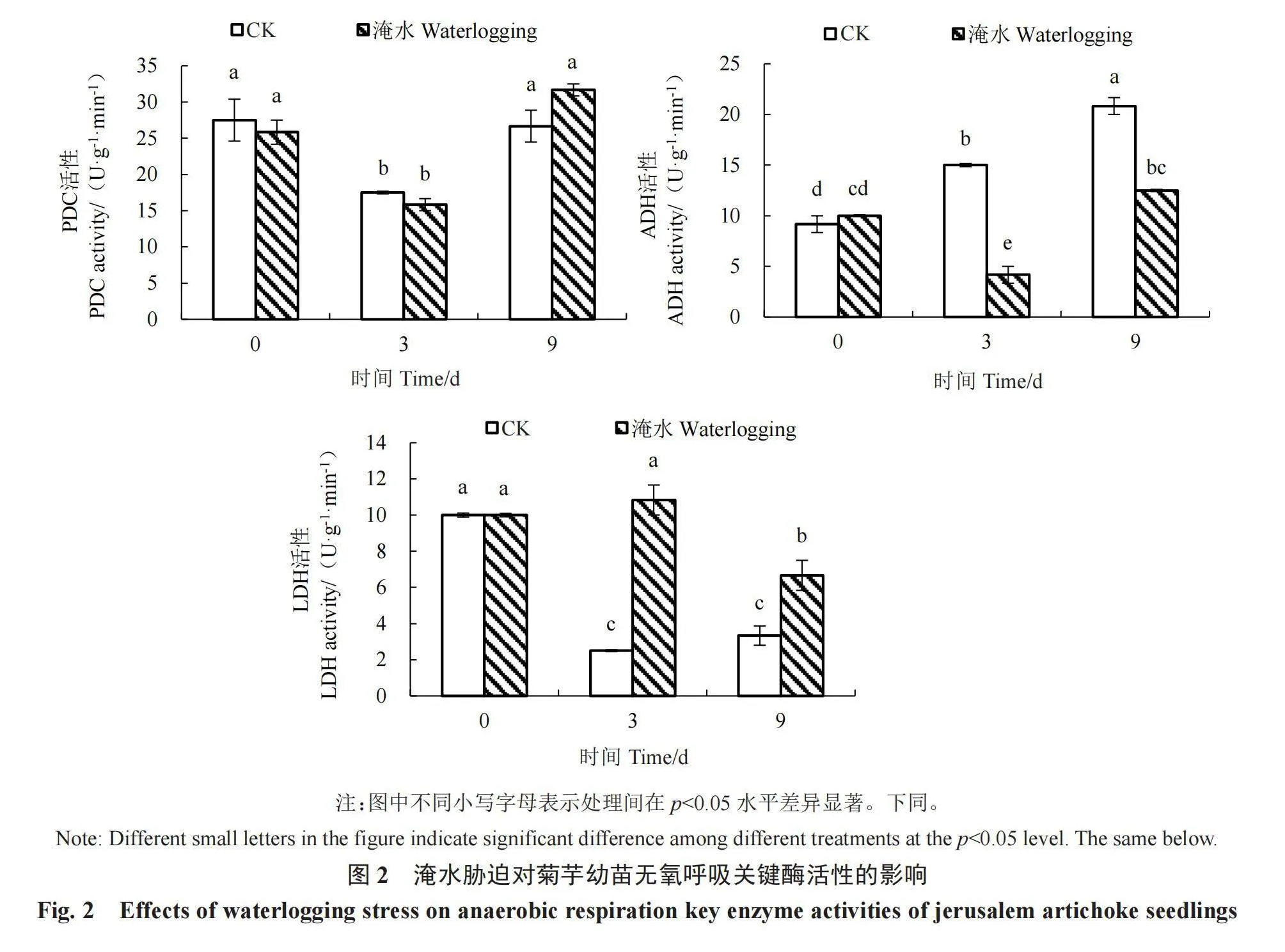
2.2.1 淹水胁迫对菊芋幼苗无氧呼吸关键酶活性的影响 由图2可知,在淹水后,菊芋幼苗PDC活性与对照无显著差异;在淹水3、9 d时,ADH活性显著低于对照,分别较对照下降了72.22%、40.00%;在淹水3 d和9 d时,LDH活性显著高于对照,分别比对照增高了333.33%、100.00%,表明菊芋幼苗通过乳酸发酵来适应淹水胁迫。
2.2.2 淹水胁迫对菊芋幼苗叶绿素含量的影响 由图3可知,淹水胁迫使得菊芋幼苗叶绿素a含量、叶绿素b含量、总叶绿素含量较对照均显著下降,类胡萝卜素含量与对照无显著差异。淹水3、9 d,叶绿素a含量较对照分别下降了11.59%、15.60%,叶绿素b含量较对照分别下降了41.40%、41.47%,总叶绿素含量较对照分别下降了22.14%、24.26%,表明淹水胁迫显著抑制了菊芋幼苗的光合作用。
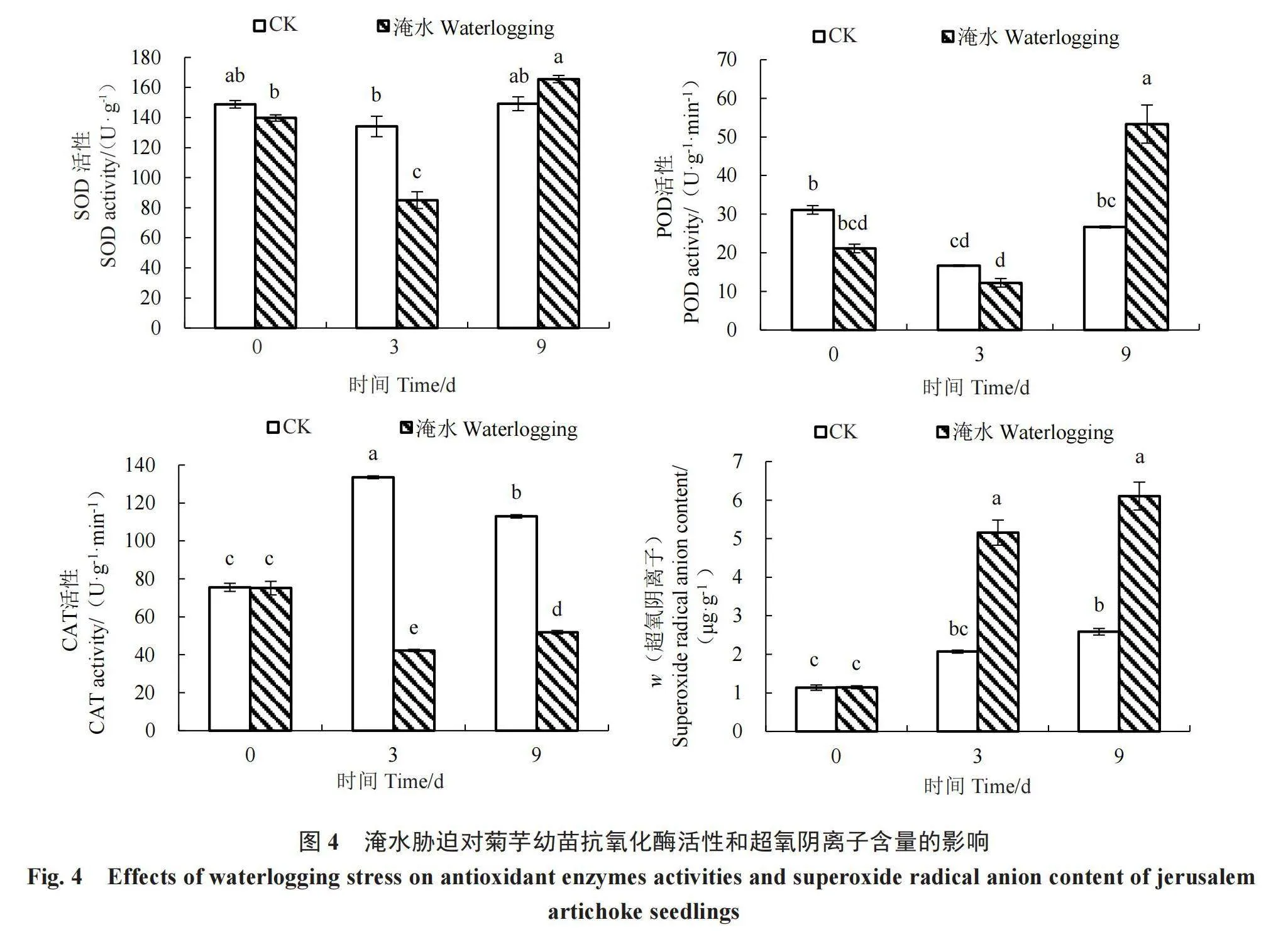
2.2.3 淹水胁迫对菊芋幼苗抗氧化酶活性和超氧阴离子含量的影响 由图4可知,淹水3 d时,菊芋幼苗SOD活性显著低于对照,比对照降低了36.55%;淹水9 d时,SOD活性与对照无显著差异。淹水3 d时,POD含量与对照无显著差异;淹水9 d时,POD活性显著高于对照,比对照增加了100.00%。CAT活性在淹水3、9 d时均显著低于对照,分别降低了68.35%、54.07%。淹水3、9 d时,超氧阴离子含量显著高于对照,分别比对照增加了149.07%、136.13%。
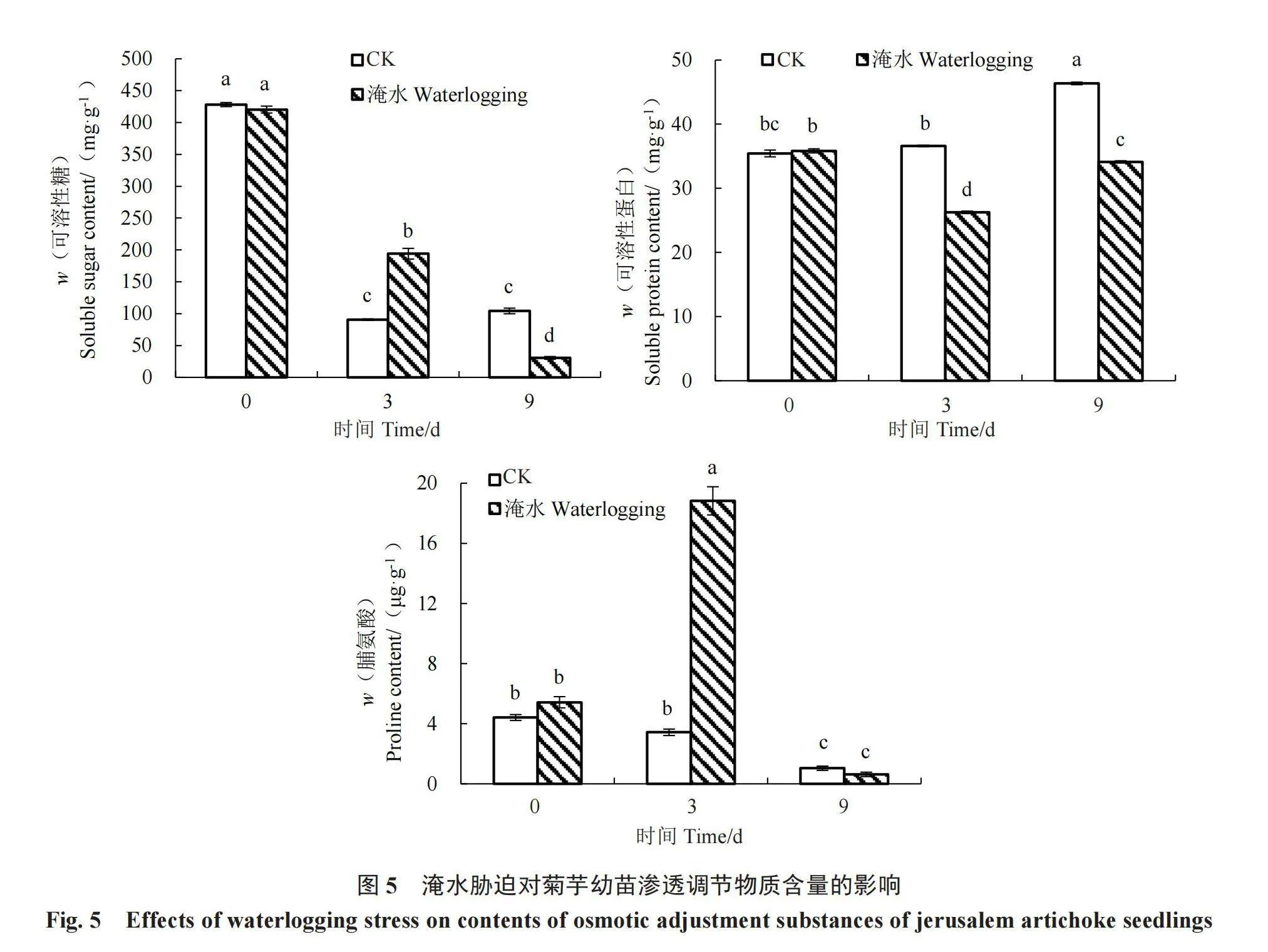
2.2.4 淹水胁迫对菊芋幼苗渗透调节物质含量的影响 由图5可知,淹水3 d时,菊芋幼苗可溶性糖含量显著高于对照,较对照增加了114.15%;淹水9 d时,可溶性糖含量显著低于对照,较对照降低了70.64%。可溶性蛋白含量则在淹水3、9 d时均显著低于对照,分别比对照降低了28.29%、26.40%。淹水3 d时,Pro含量显著高于对照,比对照增加了449.02%;淹水9 d时,Pro含量与对照无显著差异,表明在淹水胁迫后,可溶性糖和脯氨酸对菊芋幼苗的渗透调节起到重要的作用。
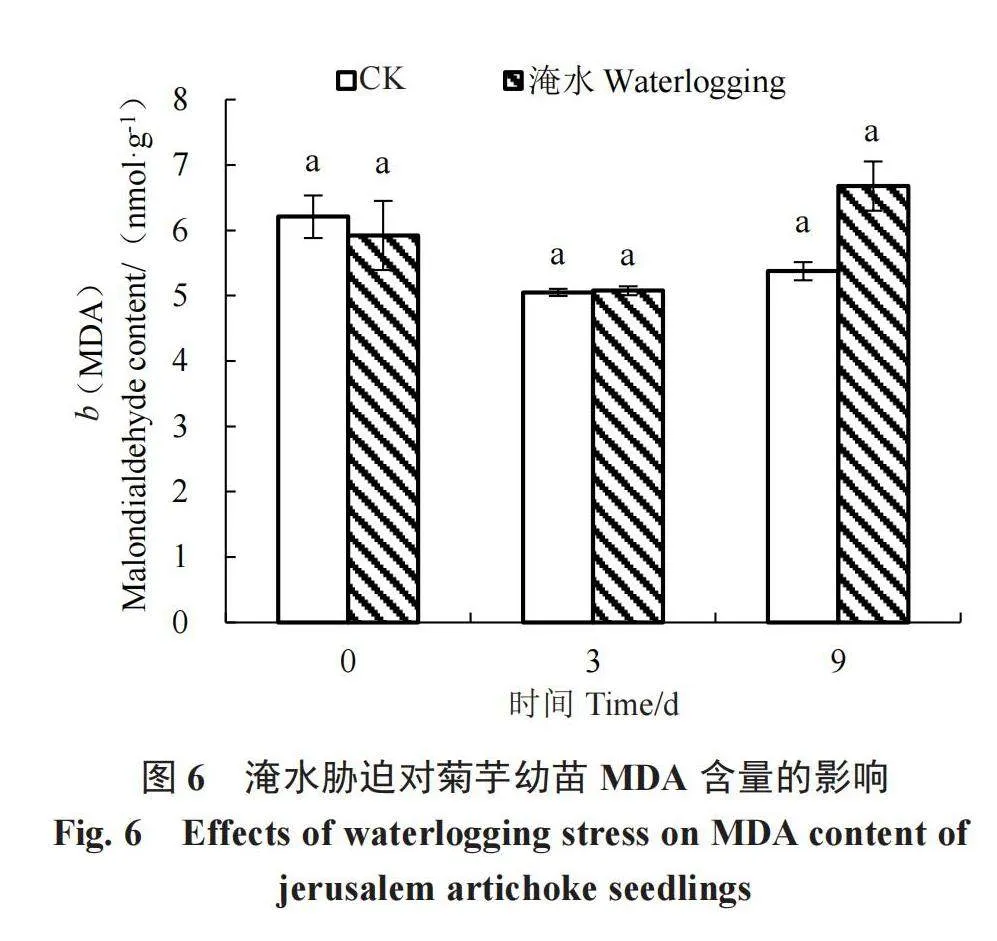
2.2.5 淹水胁迫对菊芋幼苗MDA含量的影响 由图6可知,淹水3、9 d时,MDA含量与对照无显著差异,说明淹水3、9 d对菊芋膜质过氧化未造成显著影响。
3 讨论与结论
淹水胁迫对植株的伤害直接表现在一些表型性状以及生物量的变化上[14]。在本试验中,淹水9 d后,菊芋幼苗叶片边缘黄褐化、下部少量叶片脱落,但在整个淹水过程中,叶片大部分仍为绿色,株高、总叶片数、主茎叶片数、叶长、叶宽、分枝数较对照均无显著差异,表明淹水9 d并未对菊芋幼苗造成较大的损害,说明本地白皮菊芋品种较耐淹水胁迫,这与不耐淹水的油菜、黄瓜的研究结果不同[15-16]。在淹水9 d后,菊芋幼苗基部茎粗显著大于对照,这与对耐涝性强的丝瓜[17]的研究结果一致,与耐涝性较弱的油菜[15]、黄瓜[18]不同,说明茎粗可作为选育菊芋耐淹水品种的重要形态指标。
植物受到淹水胁迫后,首先表现在淹水初期由有氧呼吸转为无氧呼吸,其中PDC、ADH、LDH作为无氧呼吸相关酶起到关键作用[11]。葡萄糖经糖酵解生成丙酮酸,丙酮酸可以通过LDH转化为乳酸,也可以通过PDC脱羧转化为乙醛,然后再通过ADH还原为乙醇和CO2[19]。Elkelish等[20]的研究表明,淹水胁迫触发番茄幼苗PDC、LDH活性上升,ADH基因上调;Liu等[21]的研究表明,淹水胁迫使猕猴桃AcADH1、AcADH2和AcPDC2的表达增强。在本试验中,淹水3、9 d,LDH活性均显著高于对照,而ADH活性则显著低于对照,PDC活性与对照无显著差异,表明菊芋幼苗主要通过提高LDH活性进行乳酸发酵促进无氧呼吸,产生ATP为幼苗提供能量,这与番茄、猕猴桃中的研究结果不同[20-21],说明LDH活性可作为选育菊芋耐淹水品种的重要生理指标。
淹水会导致植物气孔关闭,气体交换速率降低,光合速率下降。叶绿素是植物叶片中主要的光合色素,参与光能转化和传递,是评价植物生理状态的重要指标,也是反映叶片光合能力的重要指标[22]。在本试验淹水胁迫下,叶绿素a、叶绿素b、总叶绿素含量均显著下降,这与Zhang等[23]在高粱中的研究结果一致。光合色素含量的降低显著影响光合作用产率,最终会表现在作物生物量降低上,导致菊芋幼苗在淹水后9 d时地上部干质量、鲜质量和地下部干质量、鲜质量均较对照显著降低。
植物在淹水胁迫时的低氧气浓度使植物产生大量活性氧(ROS)[9],ROS积累会破坏细胞膜透性,细胞受损,致使膜质过氧化产物MDA增加,MDA含量是衡量植物受伤害程度的重要指标[24]。为抵御淹水胁迫条件下ROS的毒害作用,植物经过长期的进化与适应形成了相应的抗氧化防御系统,来减轻植物自身受伤害程度[25]。在笔者的试验中,淹水胁迫下,超氧阴离子含量显著上升;超氧化物歧化酶(SOD)活性前期显著低于对照,后期与对照差异不显著;过氧化物酶(POD)活性在淹水9 d时显著高于对照;过氧化氢酶(CAT)活性在淹水后均显著低于对照,MDA含量与对照差异不显著,这与Niu等[26]在番茄幼苗中超氧阴离子含量显著上升的结果相同,与前人在抗氧化酶活性和MDA含量变化上的结果不同[27-29],表明菊芋主要通过提高POD活性清除H2O2,提高幼苗的耐涝性,减轻植物的氧化损伤,POD活性可作为选育菊芋耐淹水品种的重要生理指标。虽然超氧阴离子含量显著上升,但是MDA含量始终与对照差异不显著,表明淹水胁迫对菊芋膜质过氧化未造成显著影响,MDA含量也可作为选育菊芋耐淹水品种的重要生理指标。而SOD、CAT不是菊芋中清除ROS的主要酶,是否与谷胱苷肽循环和抗氧化剂有关有待进一步研究。
在淹水胁迫下,细胞内外溶质分子浓度差异较大,细胞易吸水形成膨压破坏渗透压平衡[14]。在本试验中,淹水胁迫初期,菊芋幼苗中可溶性糖、脯氨酸含量均显著高于对照,与桔梗[30]、生菜[31]中研究结果一致。表明淹水初期菊芋幼苗通过增加可溶性糖、脯氨酸含量以抵抗淹水胁迫,降低细胞膨压,维持植株正常生长。可溶性糖、脯氨酸含量可作为选育菊芋耐淹水品种的重要生理指标。
综上所述,淹水胁迫抑制了菊芋幼苗光合作用,使得菊芋地上部干质量、地下部干质量和鲜质量均显著下降,淹水9 d后,菊芋地上部鲜质量显著降低,茎粗显著增加,但淹水胁迫对菊芋株高、总叶片数、主茎叶片数、叶长、叶宽、分枝数、MDA含量均无显著影响。菊芋在淹水后,通过提高LDH活性进行乳酸发酵,提高POD活性、增加可溶性糖、Pro含量来适应淹水胁迫,使植株少受或免受伤害。茎粗可作为选育菊芋耐淹水品种的重要形态指标,LDH和POD活性以及可溶性糖、Pro和MDA含量可作为选育菊芋耐淹水品种的重要生理指标。
参考文献
[1] 肖桂龙,丁光武.菊芋(洋姜)优质高产栽培实用技术[J].长江蔬菜,2019(1):36-38.
[2] PACANOSKI Z,MEHMETI A.The first report of the invasive alien weed Jerusalem artichoke(Helianthus tuberosus L.)in the republic of North Macedonia[J].Agriculture and Forestry,2020,66(1):115-127.
[3] LI N,CHEN M X,GAO X M,et al.Carbon sequestration and Jerusalem artichoke biomass under nitrogen applications in coastal saline zone in the northern region of Jiangsu, China[J].Science of the Total Environment,2016,568:885-890.
[4] SAWICKA B,DANILČENKO H,JARIENE E,et al.Nutritional value of Jerusalem artichoke tubers(Helianthus tuberosus L.)grown in organic system under Lithuanian and Polish conditions[J].Agriculture,2021,11(5):440.
[5] 章法源,邵扬.临夏高寒阴湿地区洋姜栽培技术[J].农业科技通讯,2018(7):312-313.
[6] 陈鲜艳,李威,张强,等.长江中下游地区雨涝指数构建及其应用[J].水科学进展,2021,32(6):834-842.
[7] 刘布春,刘园,郑飞翔,等.区域粮食产量因灾损失评估之东北三省灾情:产量模型再检验[J].中国农业气象,2022,43(6):487-498.
[8] WANG J,SUN H,SHENG J J,et al.Transcriptome,physiological and biochemical analysis of Triarrhena sacchariflora in response to flooding stress[J].BMC Genetics,2019,20(1):88.
[9] JETHVA J,SCHMIDT R R,SAUTER M,et al.Try or die:Dynamics of plant respiration and how to survive low oxygen conditions[J].Plants,2022,11(2):205.
[10] CORREA-ARAGUNDE N,FORESI N,LAMATTINA L.Nitric oxide is a ubiquitous signal for maintaining redox balance in plant cells:Regulation of ascorbate peroxidase as a case study[J].Journal of Experimental Botany,2015,66(10):2913-2921.
[11] 杨杰,唐志璇,杜雅雯,等.园林植物对淹水胁迫的生理及分子响应机理研究进展[J].南通大学学报(自然科学版),2023,22(1):34-43.
[12] 吴强盛.植物生理学实验指导[M].北京:中国农业出版社,2018.
[13] 刘潜,王朝云,易永健,等.麻育秧膜对水稻秧苗生长发育的影响及其机理研究[J].中国农学通报,2016,32(18):1-5.
[14] 聂功平,陈敏敏,杨柳燕,等.植物响应淹水胁迫的研究进展[J].中国农学通报,2021,37(18):57-64.
[15] 杨海云,艾雪莹,BATOOL Maria,等.油菜响应水分胁迫的生理机制及栽培调控措施研究进展[J].华中农业大学学报,2021,40(2):6-16.
[16] BARICKMAN T C,SIMPSON C R,SAMS C E.Waterlogging causes early modification in the physiological performance,carotenoids,chlorophylls,proline and soluble sugars of cucumber plants[J].Plants-Basel,2019,8(6):160.
[17] 于斌,朱进,周国林,等.淹水胁迫对丝瓜和苦瓜幼苗形态及不定根解剖结构的影响[J].中国蔬菜,2018(4):37-42.
[18] 于斌,朱进,周国林,等.淹水胁迫对黄瓜幼苗生长及不定根解剖结构的影响[J].北方园艺,2018(3):61-64.
[19] ZHOU W G,CHEN F,MENG Y J,et al.Plant waterlogging/flooding stress responses:From seed germination to maturation[J].Plant Physiology and Biochemistry,2020,148:228-236.
[20] ELKELISH A A,ALHAITHLOUL H A S,QARI S H,et al.Pretreatment with Trichoderma harzianum alleviates waterlogging-induced growth alterations in tomato seedlings by modulating physiological,biochemical,and molecular mechanisms[J].Environmental and Experimental Botany,2020,171:103946.
[21] LIU J,CHEN Y,WANG W Q,et al.Transcription factors AcERF74/75 respond to waterlogging stress and trigger alcoholic fermentation-related genes in kiwifruit[J].Plant Science,2022,314:111115.
[22] SU Q,SUN Z Y,LIU Y T,et al.Physiological and comparative transcriptome analysis of the response and adaptation mechanism of the photosynthetic function of mulberry(Morus alba L.)leaves to flooding stress [J].Plant Signaling & Behavior,2022,17(1):e2094619.
[23] ZHANG F,ZHU K,WANG Y Q,et al.Changes in photosynthetic and chlorophyll fluorescence characteristics of sorghum under drought and waterlogging stress[J].Photosynthetica,2019,57(4):1156-1164.
[24] YEUNG E,VAN VEEN H,VASHISHT D,et al.A stress recovery signaling network for enhanced flooding tolerance in Arabidopsis thaliana[J].Proceedings of the National Academy of Sciences of Sciences of the United States of America,2018,115(26):6085-6094.
[25] 崔慧萍,周薇,郭长虹.植物过氧化物酶体在活性氧信号网络中的作用[J].中国生物化学与分子生物学报,2017,33(3):220-226.
[26] NIU L F,JIANG F L,YIN J,et al.ROS-mediated waterlogging memory,induced by priming,mitigates photosynthesis inhibition in tomato under waterlogging stress[J].Frontiers in Plant Science,2023,14:1238108.
[27] LIU Z W,QIAO D D,LIU Z Y,et al.Evaluation of waterlogging tolerance and responses of protective enzymes to waterlogging stress in pumpkin[J].PeerJ,2023,11:e15177.
[28] 里程辉,王杰,王宏,等.淹水胁迫下不同中间砧对岳华苹果叶片和根系抗氧化酶、非酶类抗氧化物活性的影响[J].江苏农业科学,2022,50(11):130-135.
[29] LI C W,SU J S,ZHAO N,et al.CmERF5-CmRAP2. 3 transcriptional cascade positively regulates waterlogging tolerance in Chrysanthemum morifolium[J].Plant Biotechnology Journal,2023,21(2):270-282.
[30] JI H S,HYUN T K.Physiological and sucrose metabolic responses to waterlogging stress in balloon flower(Platycodon grandiflorus (Jacq.) A.DC)[J].Physiology and Molecular Biology of Plants,2023,29(4):591-600.
[31] KAL Ü,DAL Y,KAYAK N,et al.Application of nitrogen for mitigating the adverse effects of flooding stress in lettuce[J].Journal of Plant Nutrition,2023,46(20):4664-4678.
