槟榔芋脱毒试管芋的诱导及种苗繁育研究
2024-09-25黄绍力罗燕羽魏利国莫现城林荣善李天明




摘 要:为解决槟榔芋组培脱毒苗育苗成活率低、周期长、成本高、栽培后植株生长缓慢、子芋数量过多等问题,以炭步槟榔芋组培继代增殖8代的试管苗为材料,开展试管芋诱导、育苗基质和育苗时间,以及在高糖无激素培养基中进行不同周期培养对内源激素含量及生产影响的研究。结果表明,广东炭步槟榔芋单株试管苗在无激素培养基中,诱导试管芋的最佳蔗糖质量浓度为60 g·L-1;育苗基质以红壤土、泥炭土、珍珠岩/椰糠/蛭石体积比2∶1∶1为最佳,成活率可达100%;试管芋的最佳育苗时间为11月份,此时可以最大程度地保证种苗的大小,降低生产成本,且能避免冬季低温影响种苗成活率。试管苗在高糖无激素培养基中,随着培养周期的延长,试管芋随之增大,脱落酸(ABA)含量升高,生长素(IAA)含量先升高后降低,细胞分裂素(CTK)含量先降低后升高再降低,在试管芋形成过程中起重要的调控作用。研究结果可为槟榔芋健康种苗繁育和规模化生产提供重要参考依据,也为芋球茎生长发育机制研究奠定基础。
关键词:槟榔芋;试管芋;诱导;种苗繁育
中图分类号:S632.3 文献标志码:A 文章编号:1673-2871(2024)09-109-07
Study on induction and seedling breeding of virus-free in vitro taro of Binglang taro
HUANG Shaoli1, LUO Yanyu1, WEI Liguo1, MO Xiancheng2, LIN Rongshan2, LI Tianming3
(1. Guangzhou Academic279a58dbc5ca7fde4f9bd50641920a0c95ea5ded38ab9b673aa37707b3da2d5d of Agricultural Science, Guangzhou 510335, Guangdong, China; 2. Bureau of Agriculture and Rural Affairs of Hezhou City, Hezhou 542800, Guangxi, China; 3. Hezhou Seed and Planting Industry Workstation, Hezhou 542800, Guangxi, China)
Abstract: In order to solve the problems of low survival rate, long cycle, high cost, slow plant growth after cultivation, and excessive number of taro seeds in tissue culture virus-free seedlings of Binglang taro. This study used tissue culture and subculture of 8-generation in vitro seedlings of Binglang taro in Guangdong, Tanbu as experimental materials, in vitro taro induction, seedling substrate and seedling time were carried out. It also studied the endogenous hormone content and its impact on production after different transfer times in high sugar hormone free medium. The results showed that the optimal sucrose concentration for inducing in vitro taro in hormone free medium was 60 g·L-1. The optimal seedling substrate is red loam∶peat soil∶perlite/coconut bran/vermiculite =2∶1∶1, and the survival rate can reach 100%. The best time for cultivating in vitro taro seedlings is in November, which can maximize the size of the seedlings, reduce production costs, and avoid the impact of low temperatures in winter on the survival of seedlings. In high sugar hormone free culture medium, as the number of transfers increases, the size of in vitro taro, the content of ABA increases, the content of IAA first increases and then decreases, and the content of CTK first decreases and then increases and then decreases. They play an important regulatory role in the formation process of test tube tubers. These results can provide important reference for the healthy seedling breeding and large-scale production of the Binglang taro, and lay a foundation for the study of the growth and development mechanism of the taro bulb.
Key words: Binglang taro; In vitro taro; Induction; Seedling breeding
收稿日期:2024-04-19;修回日期:2024-05-30
基金项目:广州市基础研究计划项目(202201010065);广西科技计划项目(桂科AB23049007);广州市科技计划项目(2023B03J1274)
作者简介:黄绍力,男,推广研究员,研究方向为特色蔬菜新品种选育、栽培与示范推广。E-mail:1009845770@qq.com
通信作者:罗燕羽,女,农艺师,研究方向为植物新品种选育、栽培与示范推广。E-mail:874940453@qq.com
槟榔芋[Colocasia esculenta (L.) Schoot var. Binglang]为天南星科芋属芋种魁芋类型[1],母芋为主要食用器官,芋肉带紫红色槟榔花纹,煮食时,香味四溢,口感酥松、粉嫩、香醇[2]。芋头为无性繁殖作物,一般以子芋或孙芋作为繁殖体,长期反复留种易造成种性退化、产量下降和病虫害发生严重等问题[3]。目前较有效的解决方式是种植组培脱毒种苗,李火金[4]和阙玉林[5]的研究表明,利用芋头脱毒种苗栽培可以减少病虫害的发生、提高芋头的产量和品质,在相同的栽培管理条件下脱毒芋产量比未脱毒芋高出20%~30%。尽管组培脱毒苗优势明显,但由于组培脱毒苗育苗周期长、育苗成活率低、成本高[6],且栽培出的芋头子芋过多[7],影响母芋的生长。
试管芋是在脱毒苗基础上诱导形成的微型芋,前人研究结果表明,通过诱导离体微器官,可为无性繁殖作物的种质保存、交换以及无毒微型块茎的生产和运输提供一条便利的途径[8]。刘玉平等[9]对不同类型芋的试管芋诱导基本条件进行了探索,刘星月等[10]研究了铅山红芽芋的试管芋诱导条件,韩晓勇等[11]研究了靖江香沙芋的试管芋诱导条件。目前已经有不少关于试管芋的研究报道,但关于槟榔芋脱毒试管苗诱导及其种苗繁育方面的研究尚未见报道。笔者以广东炭步文冈槟榔芋为研究对象,通过开展蔗糖诱导试管芋研究,筛选出试管芋诱导最适蔗糖浓度,并对试管芋的育苗基质和育苗时间进行研究,以期提高育苗成活率、缩短育苗周期、降低生产成本;同时进一步开展试管苗在高糖无激素培养基中不同周期培养对内源激素含量及生产影响的研究,以解决脱毒苗栽培后生长慢、子芋数量多的问题,以期为槟榔芋的种苗繁育及规模化生产提供重要的理论依据。
1 材料与方法
1.1 材料
试验所用品种为炭步文冈槟榔芋,由广州市花都区炭步镇文冈香芋合作社提供;所用的组培脱毒试管苗为已经继代增殖8代,株高不低于2 cm的单株试管苗,由广州市农业科学研究院生物技术研究所提供。
1.2 方法
试验于2021年3月至2023年11月进行。试管芋的诱导试验在广州市农业科学研究院花都基地组培实验室进行,育苗试验在广州市农业科学研究院花都基地大棚进行,种植栽培试验在广州市花都区炭步镇文冈香芋合作社芋头种植基地进行,前茬均为水稻。试验按照随机区组设计。
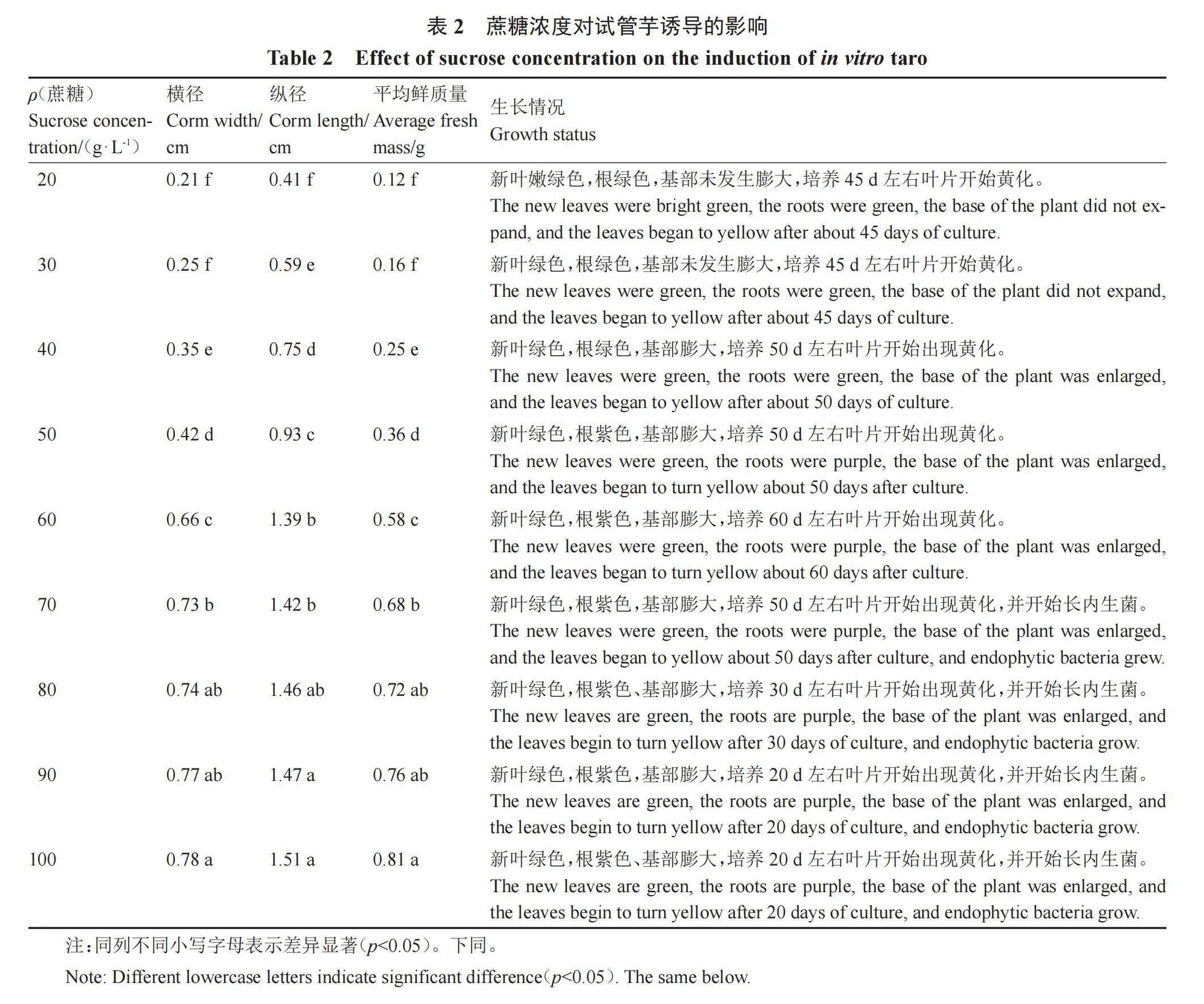
1.2.1 试管芋的诱导 将炭步文冈槟榔芋试管苗接种于不同蔗糖质量浓度(20、30、40、50、60、70、80、90和100 g·L-1)的MS无激素培养基中,卡拉胶质量浓度为6 g·L-1。培养条件为:光照度2000 lx,光照12 h·d-1,温度(28±2)℃,湿度65%。每个处理接种30瓶,每瓶接种10株,3次重复。每周对试管芋生长情况观察记录,培养60 d后利用游标卡尺和分析天平测量试管芋球茎的横径、纵径和鲜质量,每个处理组随机抽取20株测量。
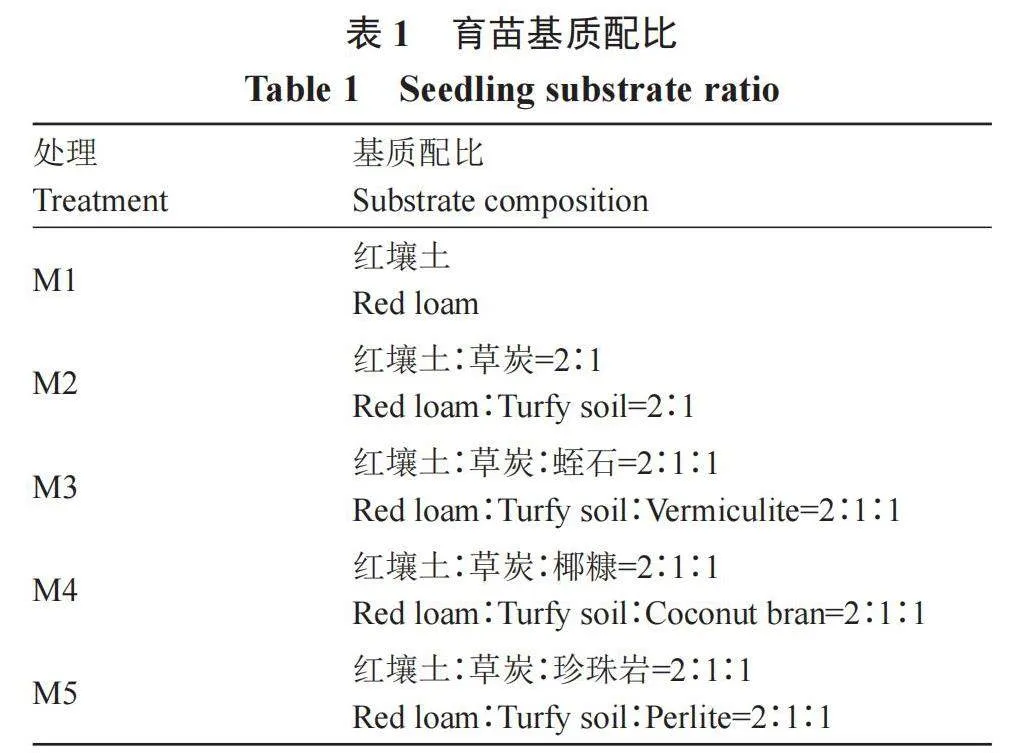
1.2.2 育苗基质的筛选 为提高试管芋的育苗成活率,取蔗糖质量浓度为60 g·L-1的试管芋移栽育苗,按表1基质的体积配比,共5个处理,每个处理50株,3次重复,以普通试管生根苗的红壤土育苗为对照(CK1)。培养条件为25 ℃,光照度4000 lx,70% RH(空气相对湿度),移栽30 d后统计成活率。成活率/%=成活株数/育苗总数×100。
1.2.3 育苗时间研究 将蔗糖质量浓度为60 g·L-1试管芋分别于9、10、11、12月份的月初进行穴盘育苗,穴盘大小为50 mm×50 mm,共4个处理,每个处理育苗150株,3个重复。育苗1个月后全部移栽于育苗杯(100 mm)中继续培育,参照黄新芳等[12]的方法,待第2年3月初利用钢尺测定种苗高、基部直径、叶片的长度和宽度,每个处理随机抽取20株测量。测定完成后将不同月份培育的种苗下地栽培,株距25 cm,行距50~60 cm,种植100株,至10月底采收时统计母芋大小,每个处理随机抽取20株测量,3次重复,管理方式参考钟建勇等[13]的方法,以单球茎鲜质量100 g左右的子芋为对照(CK2),以此筛选出最佳的芋头脱毒种苗育苗时间。
1.2.4 试管芋形成过程中激素含量的测定 通过1.2.1筛选出炭步槟榔芋试管芋诱导的最适蔗糖质量浓度,在该蔗糖质量浓度条件下采用无激素的MS培养基分别进行1、2和3个周期的转接培养,共3个处理,每个处理接种20瓶,每瓶10株,3个重复。转接时去掉根部和黄叶,1个培养周期为45 d,培养条件同1.2.1,以继代增殖8代的试管苗(0)为对照(CK3)。取每个周期培养完成后的试管芋球茎(植株基部)为样品,随机选取5个球茎为1个样品,3个重复,用液氮速冻后送至南京瑞源生物技术有限公司采用酶联免疫法(ELISA)测定生长素(IAA)、细胞分裂素(CTK)、脱落酸(ABA)、赤霉素(GA)、茉莉酸甲酯(ME-JA)和油菜素内酯(BR)的含量。
1.2.5 试管芋培养周期对芋头生产的影响 将1.2.4中不同周期培养后的试管芋用清水清洗掉附着的培养基,然后按照1.2.2中最优的育苗基质配比育苗,每个培养周期的试管芋育苗150株,3次重复。育苗完成后按照1.2.3中的方法种植和栽培管理,每个培养周期种植100株,3个重复,以100 g子芋常规栽培为对照(CK4),至10月底采收时利用电子秤测量母芋鲜质量,并计数子芋数量,每个处理测量20株。
1.3 数据分析
采用Microsoft Excel 2010进行数据的统计与作图,采用SPSS17.0进行Ducan’s显著性分析。
2 结果与分析
2.1 不同蔗糖质量浓度对试管芋诱导的影响
由表2和图1可以看出,随着蔗糖质量浓度的升高,试管芋球茎的横径、纵径和鲜质量均呈上升趋势,蔗糖质量浓度在30~60 g·L-1的范围内,试管芋球茎大小增长最明显,在60 g·L-1之后试管芋球茎大小的增长放缓,相邻各浓度之间的差异不显著。在蔗糖质量浓度为20和30 g·L-1时,组培苗植株基部不发生膨大,生长45 d左右叶片开始黄化;在蔗糖质量浓度为40 g·L-1时,组培苗植株基部膨大明显,叶片黄化时间延迟,生长50 d左右叶片开始黄化;在质量浓度为50 g·L-1时,组培苗开始出现紫色根系,基部进一步膨大,叶片在生长50 d左右开始黄化;在质量浓度为60 g·L-1时,叶片黄化时间进一步延迟,生长60 d左右叶片才开始出现黄化;在质量浓度达到70 g·L-1时,组培苗开始出现内生菌,叶片在50 d左右开始出现黄化;随着蔗糖质量浓度的进一步升高,内生菌生长更明显,且叶片出现黄化的时间也更早,当蔗糖质量浓度在80~100 g·L-1时,各处理组之间组培苗基部膨大变化不明显,横径、纵径和鲜质量均不存在显著差异。基于上述结果,最适的蔗糖质量浓度为60 g·L-1,此时不仅组培苗基部膨大明显,横径和鲜质量与其他各处理之间均呈显著差异,而且叶片出现黄化时间迟,也未发现有内生菌生长,对试管芋球茎横切,发现试管芋同成品槟榔芋一样有槟榔花纹(图2)。
2.2 育苗基质对试管芋移栽成活率的影响
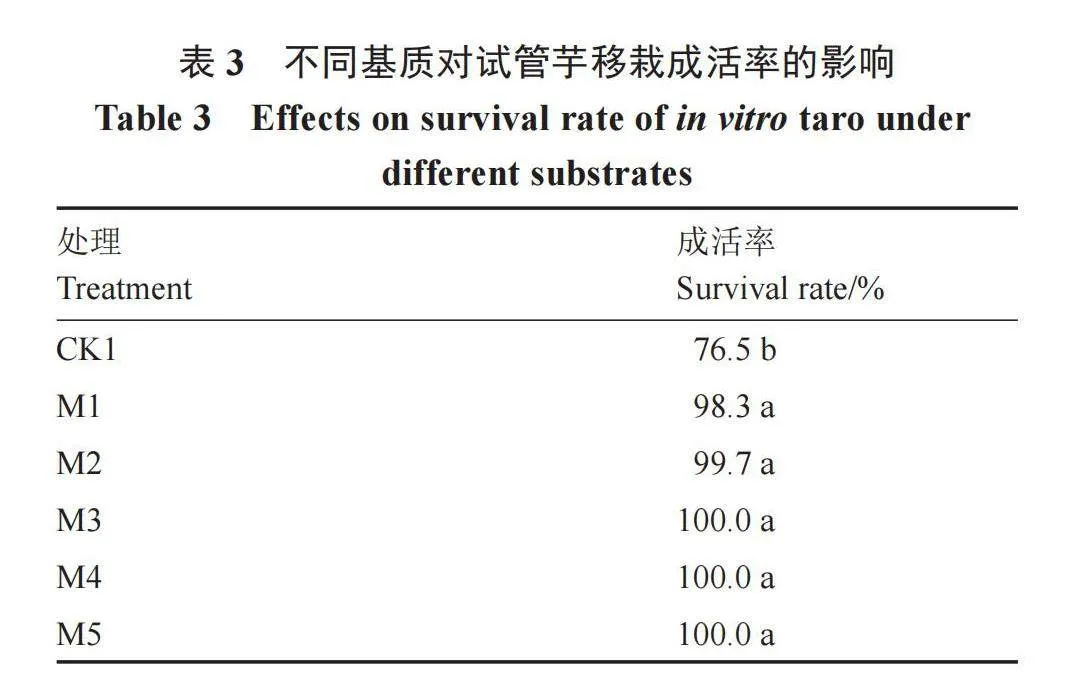
将长势一致的试管芋清洗掉根部培养基,移栽到不同的基质中,生长30 d后统计试管芋的成活率。由表3可知,通过诱导试管芋进行育苗移栽可有效提高成活率,以纯红壤土作为移栽基质,试管芋移栽的成活率显著高于普通试管生根苗;试管芋在不同的育苗基质中总体成活率高,不同育苗基质之间差异不显著,在红壤土中适当添加泥炭土等基质,移栽成活率可达100%。
2.3 育苗时间对芋头生产的影响
由表4可以看出,在不同月份进行育苗对假植苗的高度和叶片大小影响显著,育苗时间越早假植苗越高,叶片越大。9月份开始育苗至第2年2月底,苗高可达43.29 cm,植株基部直径2.79 cm,叶片宽度为16.81 cm,叶片长度20.67 cm。育苗时间越推后,假植苗越小,12月份开始育苗至第2年3月初,苗高仅有19.77 cm,基部直径1.68 cm,叶片宽度为7.42 cm,叶片长度10.74 cm,均显著低于其他月份。但是育苗时间对栽培后母芋的质量影响不显著,在试验的时间范围内育苗,经8个月栽培后母芋质量在2.5 kg左右。与对照相比,尽管利用试管芋生产出来的芋头母芋偏小,但差异并不显著。
2.4 不同培养周期对试管芋生长的影响
由表5可知,随着培养周期的延长,试管芋也随之增大,培养3个周期的试管芋球茎横径为0.83 cm,纵径为2.59 cm,平均质量可达1.39 g。在不同培养周期之间,试管芋球茎的横径、纵径和平均质量均呈显著差异。
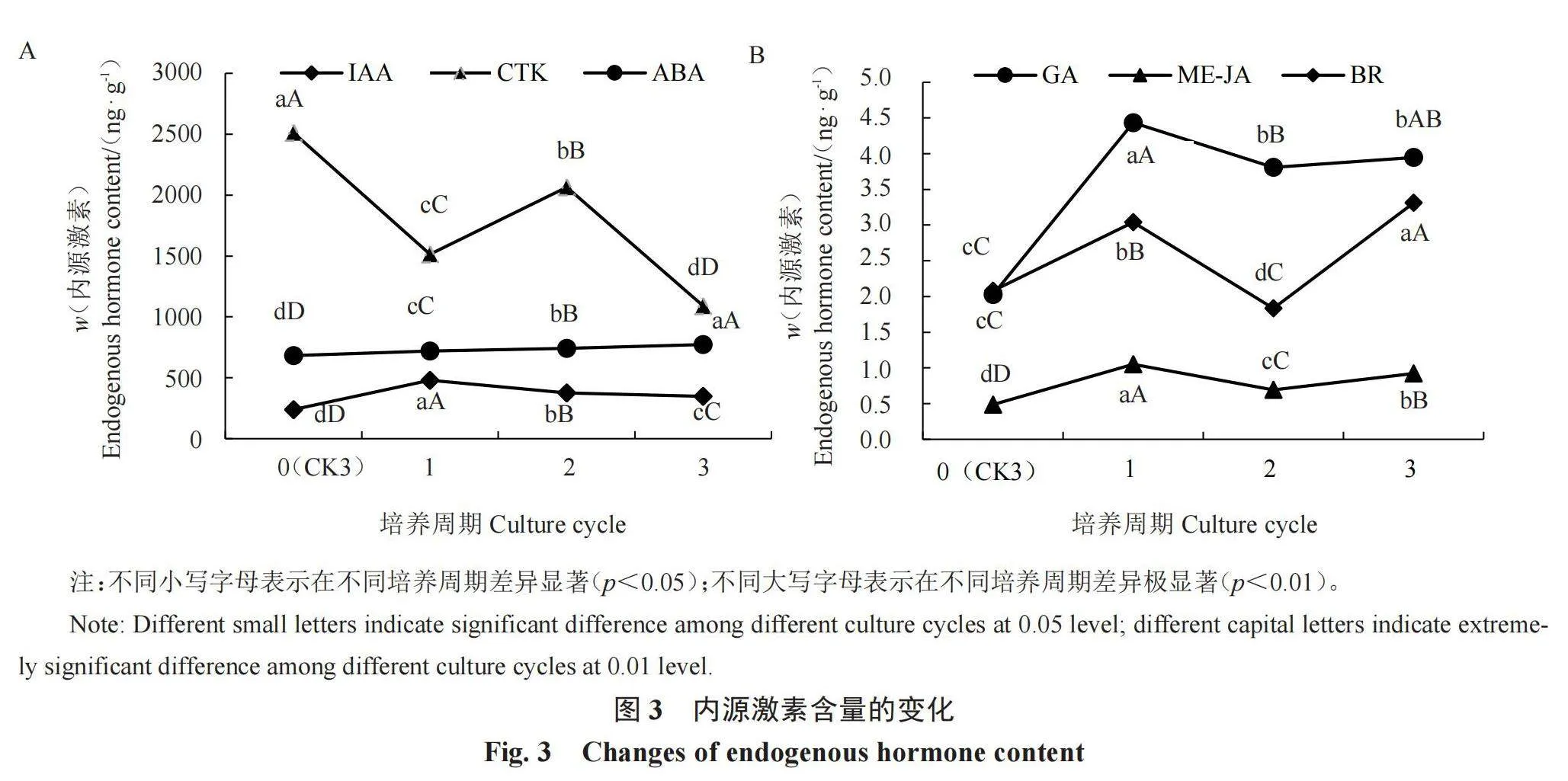
2.5 不同培养周期试管芋激素含量的变化
由图3-A可知,随着培养周期的延长,IAA含量呈先升高后降低的趋势,但均高于对照;培养1个周期的IAA含量(w,后同)最高,为479.934 ng·g-1,对照组的IAA含量最低,为239.312 ng·g-1。随着试管芋的生长,CTK含量呈先下降后升高再下降的趋势,不同培养周期之间存在极显著差异,未进行高糖无激素培养的对照组CTK含量最高,为2 511.349 ng·g-1,培养3个周期的CTK含量最低,为1 090.113 ng·g-1。ABA含量在试管芋生长过程中呈上升的趋势,未进行高糖无激素培养的对照组最低,为682.298 ng·g-1,培养3个周期时最高,为772.729 ng·g-1。由图3-B可知,GA含量呈先上升后下降的趋势,对照组含量最低,为2.024 ng·g-1,培养1个周期的含量最高,为4.435 ng·g-1。ME-JA含量在试管芋生长过程中呈先上升后下降再上升的趋势,对照组的含量最低,为0.486 ng·g-1,培养1个周期的含量最高,为1.051 ng·g-1。BR含量也呈先上升后下降再上升的趋势,培养2个周期的含量最低,为1.834 ng·g-1,培养3个周期的含量最高,为3.310 ng·g-1。
2.6 不同培养周期试管芋对芋头生产的影响
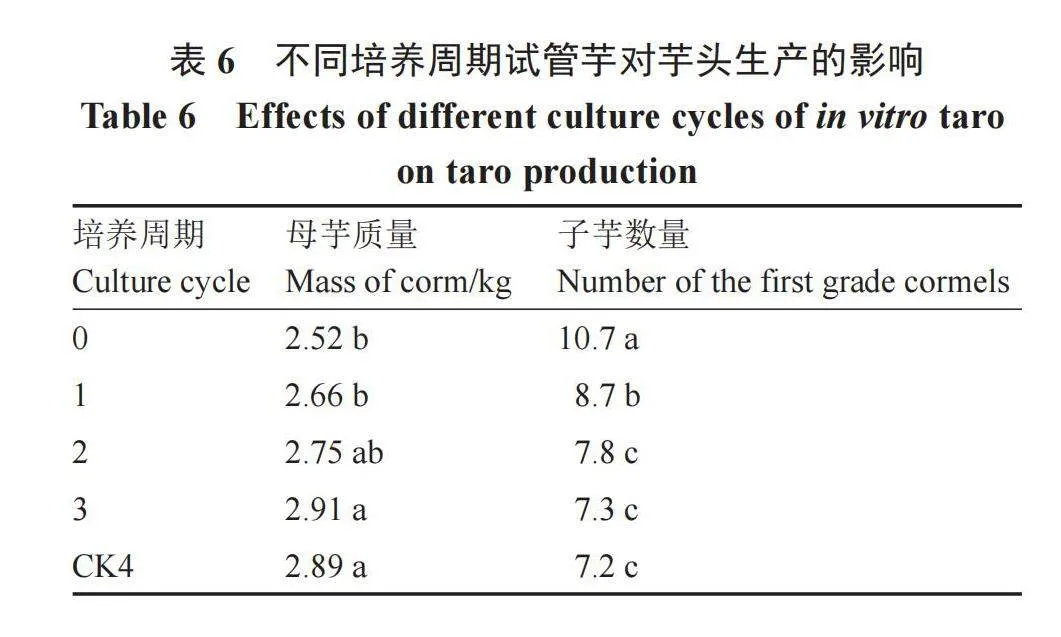
由表6可知,随着在高糖无激素培养基中培养周期的延长,生产出来的芋头母芋质量呈先增大后减小的变化趋势,子芋数量逐渐减少。同常规子芋栽培的芋头相比,未进行高糖无激素培养的试管苗生产出来的母芋质量显著降低,子芋数量显著增加;试管芋培养1个周期后生产出来的母芋质量和子芋数量与常规子芋栽培呈显著差异,但母芋质量与培养2个周期差异不显著;在高糖无激素培养基中培养2个周期或3个周期,生产出来的芋头母芋质量和子芋数量与常规子芋栽培相比,无显著差异。
3 讨论与结论
前人研究结果表明,离体诱导的微器官具有体积小、易移栽、耐贮存等优点,在生产中可替代试管苗,应用潜力巨大[14]。在试管微型器官的诱导研究中,蔗糖浓度是影响最显著的因素之一[15],适当的提高蔗糖浓度有利于微型器官的形成[16]。笔者在前人研究的基础上,利用不同的蔗糖质量浓度对广东炭步文冈槟榔芋进行试管芋的诱导,发现在无植物激素的MS培养基中最佳的蔗糖质量浓度为60 g·L-1,质量浓度过低影响试管芋的膨大,过高则易引发内生菌,影响试管芋生长。刘星月等[10]的研究表明,80 g·L-1的蔗糖浓度最佳,韩晓勇等[11]研究表明,50 g·L-1的蔗糖浓度最佳,这可能与基因型、试管苗的选择和激素的添加有关,笔者选用的是炭步文冈槟榔芋,采用的是可生根的单株苗进行无激素培养,与刘星月等[10]和韩晓勇等[11]的均不同。
前人研究结果表明,离体诱导的微块茎具有体积小、易移栽、耐贮存和繁殖系数高等优点[17],在生产中可替代试管苗,解决育苗移栽成活率低的问题。前期研究结果表明,广东炭步芋头试管苗用园土育苗移栽的成活率在80%左右[3],为提高移栽成活率与幼苗质量,笔者通过诱导试管芋,利用试管芋育苗,在红壤土中成活率可达98.3%,再在红壤土中适当添加疏松透气的基质,成活率可达100%。
为缩短育苗周期,降低生产成本,笔者开展了不同育苗时间对假植苗大小和芋头生产影响的试验,研究结果表明,尽管不同月份进行种苗培育对假植苗的大小影响显著,但对栽培后生长出的母芋大小无显著影响。芋头一般都是用子芋或孙芋进行无性栽培的[5,18],但其主要作用是为芽的萌发和前期生长提供营养,后期便会萎缩或者腐烂,并没有在原球茎上膨大。尽管芋脱毒假植苗前期生长较常规子芋苗慢,但其假植苗根系生长旺盛,定植缓苗一段时间后根系便可以很好地吸收土壤中的养分而生长,且槟榔芋球茎的主要膨大期在7-9月,只要在芋头的整个生长过程中保证水肥供应,同样可以生长出大芋头。因此,为最大程度地缩短育苗时间,降低生产成本,又要避免低温的影响,最合适的育苗时间为11月份。
植物块茎的形成是一个极为复杂的过程,与内源激素的调控有着密切的联系。在离体培养条件下诱导试管微器官,是研究块根发生发育和形成机制的一个重要途径[19]。本研究中随着培养周期的延长,IAA含量呈先上升后下降的趋势,在高糖无激素培养基中培养1个周期时,IAA含量升高,随着培养周期的延长试管芋球茎进一步膨大,IAA含量随之降低。可见,较高水平的IAA可诱导试管芋块茎形成,水平下降可促进块茎膨大,这与李玲玲[20]对菊芋试管块茎的研究结果一致,但与盛玮等[21]对半夏试管块茎的研究结果相反。一般认为细胞分裂素类物质既可促进植株的延伸,又可促进块茎的膨大,盛洁悦[22]和Sarkar等[23]的研究结果表明,低浓度的CTK可促进块茎的发育,而高浓度则抑制发育。本研究结果表明,芋试管苗在高糖浓度中培养1个周期后CTK含量下降,培养2个周期时略有上升,培养3个周期时又下降,但总体呈下降趋势,说明低浓度的CTK含量确实有助于试管芋的发育。李明军等[24]研究表明,ABA含量的升高可促进怀山药试管块茎膨大,与笔者的研究结果一致。在本研究中,随着试管芋球茎的不断膨大,ABA含量呈上升趋势,球茎越大,ABA的含量越高。但也有研究表明,ABA是通过调控赤霉素的含量来影响块茎发育的[25],本研究中ABA与GA并未直接表现出相关性,且GA含量始终处于一个较低的水平。研究表明,油菜素内酯可以促进植物细胞伸长与分裂[26],茉莉酸甲酯及其衍生物可刺激块茎形成和生长。在本研究中,BR和ME-JA含量在不同培养周期之间有波动,培养1个周期时升高,培养2个周期时降低,3个周期时又升高,没有表现出明显的促进或抑制作用,且其含量与GA一样,在培养0~3周期整个过程中始终处于一个较低水平,推测GA、ME-JA和BR可能没有参与炭步文冈槟榔芋试管芋的发育。
槟榔芋的主要食用器官为母芋,在生产过程中子芋数量过多会争夺母芋的营养,且在收获时会增加母芋的伤口,不利于母芋的贮藏。前人研究表明,试管苗植株在继代过程中会发生激素的积累,且在试管苗移栽后,会出现植株生长缓慢、容易形成丛生苗、无法形成地下球茎的问题[10,27]。植物激素是植物组培快繁必不可少的物质,但外源施用植物激素会改变内源激素的水平[28],肖关丽等[29]的研究表明,外源6-BA的添加对内源CTK产生了促进作用。笔者在本研究中的结果表明,试管苗在高糖无激素的培养基中经过多个培养周期后,CTK含量总体呈下降趋势,在培养3个周期时降低超过56%。而试管苗在经过2个周期的高糖无激素培养之后,生产出来的芋头母芋质量和子芋数量与常规子芋栽培相比,差异不显著,因此,为降低生产成本,最佳的高糖无激素培养周期为2个。由此可见,通过高糖无激素培养不仅可以提高脱毒苗的育苗移栽成活率,还可以解决组培过程中激素积累导致的生产后期植株生长缓慢、子芋数量过多的问题。
综上所述,炭步文冈槟榔芋单株试管苗无激素培养的最佳蔗糖质量浓度为60 g·L-1;最佳育苗基质为红壤土、泥炭土、珍珠岩/椰糠/蛭石体积比2∶1∶1,成活率可达100%;试管芋育苗的最佳时间为11月份,此时不仅可以最大程度地保证种苗的大小,降低生产成本,又能避免受冬季低温影响。随着在高糖无激素培养基中培养周期的延长,试管芋显著膨大,ABA、IAA和CTK在试管芋形成过程中起着重要的调控作用;对试管苗进行2个周期的高糖无激素的转接培养,有助于解决组培过程中激素积累导致的生产后期植株生长缓慢、子芋数量过多的问题。
参考文献
[1] 何芳练,刘莉莉,邱祖杨,等.广西芋头产业现状与发展对策[J].中国瓜菜,2023,36(9):151-156.
[2] 谭卫萍,许敏娜,肖熙鸥.广州市文冈香芋发展现状与应对策略[J].南方农业,2011,5(5):77-79.
[3] 魏利国,罗燕羽,刘伟光,等.广东炭步芋头组培快繁技术体系的建立[J].吉林蔬菜,2020(3):58-59.
[4] 李火金.铅山红芽芋茎尖脱毒组培繁育及高产栽培[J].中国蔬菜,2012(3):45-46.
[5] 阙玉林.福鼎槟榔芋脱毒复壮技术研究[J].中国果菜,2020,40(2):64-66.
[6] 何芳练,何青石,邱祖杨,等.芋组培苗浅水育苗及健康种芋夏繁技术[J].中国瓜菜,2020,33(4):97-99.
[7] 毛玉娟.组培海门香沙芋种优点及其栽培技术要点[J].上海蔬菜,2013(2):43-44.
[8] 杨璐,刘希元,张广臣.光周期、蔗糖及6-BA对马铃薯试管薯诱导的影响[J/OL].吉林农业大学学报,[2022-02-13].http://kns.cnki.net/kcms/detail/22.1100.S.20220512.1913.004.html.
[9] 刘玉平,柯卫东,黄新芳,等.试管芋诱导的研究[J].园艺学报,2003,30(1):43-46.
[10] 刘星月,朱强龙,李慧英,等.红芽芋脱毒试管芋诱导及植株再生[J].园艺学报,2020,47(12):2427-2438.
[11] 韩晓勇,王立,殷剑美,等.靖江香沙芋试管芋诱导影响因素研究[J].浙江农业科学,2017,58(10):1766-1769.
[12] 黄新芳,柯卫东.芋种质资源描述规范和数据标准[M].北京:中国农业出版社,2006.
[13] 钟建勇,汤样崧,彭庆平.炭步镇槟榔芋提纯复壮高产栽培技术[J].现代农业科技,2009(14):105-106.
[14] 段佳欣,张双凤,段晴雪,等.不同蔗糖浓度及光周期对栝楼试管苗微块根诱导的影响[J].现代园艺,2021,44(2):5-8.
[15] KHURI S,MOORBY J.Investigations into the role of sucrose in potato cv.Estima microtuber production in vitro [J].Annals of Botany,1995,75(3):295-303.
[16] 高小溪.蔗糖诱导马铃薯(S.tuberosum L.)试管薯形成的转录组分析与关键基因筛选[D].武汉:华中农业大学,2018.
[17] 刘卫红.组培繁殖生姜微型根茎球技术[J].现代农业科技,2013(2):40.
[18] 郭克婷,何金明.张溪香芋茎尖组培快繁技术研究[J].广东农业科学,2015,42(6):25-29.
[19] 严华兵,周慧文,曾文丹.木薯试管块根诱导技术研究[J].热带作物学报,2016,37(9):1708-1713.
[20] 李玲玲.菊芋块茎形成及其与内源激素的关系初步研究[D].南京:南京农业大学,2015.
[21] 盛玮,薛建平,张爱民,等.半夏试管块茎形成过程中内源激素的变化[J].中国中药杂志,2010,35(8):943-946.
[22] 盛洁悦.芋球茎发育及其对外源激素的响应[D].江苏扬州:扬州大学,2021.
[23] SARKAR D,PANDEY S K,SHARMA S.Cytokinins antagonize the jasmonates action on the regulation of potato (Solanum tuberosum) tuber formation in vitro[J].Plant Cell Tissue Organ Culture,2006,87(3):285-295.
[24] 李明军,刘世宇,刘雯,等.怀山药微型块茎形成过程中的生理生化变化[J].植物生理学报,2017,53(5):807-814.
[25] 刘星月.红芽芋脱毒种茎诱导及形成机制初步研究[D].南昌:江西农业大学,2020.
[26] 陈晨,陈虹,倪铭,等.油菜素内酯调控植物生长发育的研究进展[J].林业科学,2022,58(7):144-155.
[27] 殷剑美,韩晓勇,王立,等.靖江香沙芋脱毒组培技术效应及种芋扩繁要点[J].江苏农业科学,2015(8):151-153.
[28] 谷瑞升,蒋湘宁,郭仲琛.植物离体培养中器官发生调控机制的研究进展[J].植物学通报,1999,16(3):238-244.
[29] 肖关丽,杨清辉,李富生,等.外源激素对甘蔗幼苗分化及其内源激素的影响[J].云南农业大学学报,2002,17(2):154-157.
