不同生长阶段香菇栽培料木质纤维素降解利用研究
2024-09-25李顺峰刘丽娜许方方田广瑞崔国梅高帅平魏书信王安建


摘 要:为深入了解香菇生长发育过程中栽培料木质纤维素的变化,对不同生长阶段香菇栽培料中木质纤维素含量及其相关降解酶活性进行了测定,利用傅里叶变换红外光谱(FTIR)、X-射线衍射法(XRD)和显微镜观察研究了木质纤维素微观结构分子基团、纤维素相对结晶度(CrI)和纤维表面形态的变化。结果表明,在香菇生长发育过程中,栽培料中的纤维素、半纤维素和木质素含量显著下降,木质纤维素含量(w,后同)由85.27%降低至52.23%,其与相应的降解酶系活性负相关,木质纤维素降解与纤维破坏程度呈现一定的相关性。FTIR结果显示,不同生长阶段香菇栽培料中木质纤维素特征官能团峰值发生变化,木质素降解速率高于半纤维素、低于纤维素。随着香菇的生长发育,栽培料中CrI显著降低,纤维素晶体结构受到了一定程度的破坏。结果表明,香菇首先利用栽培料中非木质纤维素组分供菌丝生长,同时分泌胞外降解酶破坏纤维结构,将大分子组分降解为小分子组分,从而满足其生长所需,高木质纤维素降解酶活性对应高木质纤维素降解率。该研究结果可为促进香菇栽培料中木质纤维素的降解利用提供依据。
关键词:香菇;木质纤维素;胞外酶;结晶度;红外光谱;纤维形态
中图分类号:S646.1+2 文献标志码:A 文章编号:1673-2871(2024)09-102-07
Study on the degradation and utilization of lignocellulose in cultivation materials of Lentinus edodes at different growth stages
LI Shunfeng, LIU Li’na, XU Fangfang, TIAN Guangrui, CUI Guomei, GAO Shuaiping, WEI Shuxin, WANG Anjian
(Research Center of Agricultural Processing Science and Technology, Henan Academy of Agricultural Sciences, Zhengzhou 450002, Henan, China)
Abstract: In order to deeply understand the characteristics of lignocellulose variation in Lentinus edodes culture during the growth and development periods, the lignocellulose content and its related degrading enzyme activity in cultivation materials of L. edodes at different growth stages were determined. The changes of molecular groups of lignocellulose, relative crystallinity index(CrI)of cellulose and fiber surface morphology were also studied and observed by Fourier transform infrared spectroscopy(FTIR), X-ray diffraction(XRD), and microscope. The results showed that the content of cellulose, hemicellulose and lignin decreased significantly during the growth of L. edodes. The content of lignocellulose decreased from 85.27% to 52.23%, which was negatively correlated with the activity of the corresponding degrading enzyme, and the degradation of lignocellulose showed a certain correlation with the degree of fiber damage. The FTIR results showed that the absorbance of characteristic functional groups of lignocellulose in different growth stages had changed, and the degradation rate of lignin was higher than hemicellulose and lower than cellulose. With the growth of L. edodes, the CrI in cultivated materials decreased significantly, and the crystal structure of cellulose was destroyed to some extent. The results showed that the L. edodes was used the non-lignocellulosic components in cultivation materials for mycelium growth firstly, and secreted extracellular degrading enzymes to destroy the fiber structure and degrade the macromolecular components into small molecular components at the same time, thus meeting its growth needs. The high activity of lignocellulose degrading enzymes corresponds to the high degradation rate of lignocellulose, and the results can provide a basis for improving the degradation and utilization of lignocellulose in L. edodes cultivation materials.
Key words: Lentinus edodes; Lignocellulose; Extracellular enzymes; Crystallinity; FTIR spectra; Fiber morphology
收稿日期:2024-01-06;修回日期:2024-04-17
基金项目:河南省农业科学院自主创新项目(2023ZC079);河南省重点研发专项(231111112500);河南省科技攻关计划项目(232102110278);河南省农业科学院科技创新团队专项(2023TD41)
作者简介:李顺峰,男,副研究员,主要从事食用菌保鲜加工与栽培生理等研究工作。E-mail:lishunfeng2000@163.com
通信作者:王安建,男,研究员,主要从事农产品保鲜与加工研究工作。E-mail:309294051@qq.com
香菇是我国食用菌栽培量和产量最大的食用菌,我国70%以上省份均栽培香菇。香菇是典型的木腐菌,其生长所需营养要靠栽培基质提供,以木屑为主栽料的代料栽培是香菇栽培的最主要形式。香菇栽培基质以木屑为主,辅以麦麸或米糠,这些原料中均含有大量的木质纤维素,其含量接近80%,是香菇生长发育的主要营养源,为香菇生长发育提供必需的大分子碳源,木质纤维素的充分降解和利用对香菇的生长发育至关重要[1-2]。木质纤维素由木质素、半纤维素和纤维素三部分组成,它们相互缠绕形成一道天然屏障,严重阻碍了木质纤维素的降解和利用[3-4]。木质纤维素是大分子物质,只能在被分解成小分子物质后才能被食用菌吸收利用。
食用菌在生长发育过程中菌丝不断向其周围环境中分泌多种胞外酶[5-6],将栽培基质中的纤维素等大分子物质降解成为小分子物质,以便吸收利用。胞外酶是食用菌生长发育的关键因素之一,由于其分泌量有限,且分泌具有阶段性,导致栽培基质的利用率受到一定限制,影响产量的提高。有研究通过添加外源酶类,利用生物转化促进栽培基质降解的,提高食用菌对栽培基质的利用率[7-8]。现有研究多集中在香菇栽培中胞外酶活性的变化方面,鲜见对香菇不同生长阶段的胞外酶活性变化与木质纤维素降解的联合研究报道[9-11]。因此,为了提高栽培基质的生物转化率,笔者通过检测香菇不同生长时期栽培料中木质纤维素的降解以及相关降解酶活性的变化,并采用X-射线衍射检测纤维素结晶度以及电子显微镜对栽培料纤维形态变化进行观察,旨在深入了解不同生长期香菇栽培料中木质纤维素的变化特征,为提高栽培料利用率和解析栽培料中木质纤维素降解利用机制提供理论支持。
1 材料与方法
1.1 材料
栎木屑和香菇CCL10菌种由洛阳双惠菌业有限公司提供;麸皮购自新乡市明阳面粉厂;栽培料配方:木屑78%、麸皮20%、石膏1%、石灰1%,基质含水量55%。
1.2 方法
1.2.1 香菇栽培与取样 按照河南省地方标准《春栽香菇代料栽培技术规程》(DB41/T 2048―2020)和河南省农学会团体标准《香菇全产业链标准化生产 第5部分:优质香菇出菇管理技术规程》(T/HAASS 0006―2023)进行香菇的栽培与管理。香菇栽培试验于2022年3―6月在河南现代农业研究开发基地进行,分别于接种后50 d(菌丝长满菌袋:满袋期,S1)、70 d(完成转色:转色期,S2)、80 d(出现菇蕾:现蕾期,S3)、115 d(第1茬菇采收完成:子实体采收期,S4)4个时期进行取样。在每个生长时期各随机挑选9个栽培袋,每3个栽培袋培养料揉碎混匀后作为1个样品,以灭菌后未接种香菇菌种的栽培料记为S0,用于后续相关指标测定。
1.2.2 木质纤维素含量测定 参照Van等[12]与Van[13]的方法测定并计算纤维素、半纤维素和木质素含量。
1.2.3 X-射线衍射分析 取适量过60目筛网的不同生长阶段香菇栽培料粉末,均匀平铺在有凹槽的玻璃片上,将玻璃片放在X-射线衍射仪的扫描台上,分析纤维素的相对结晶度。使用Cu Kα射线,电压和电流分别为40 kV和40 mA,扫描范围5°~50°,扫描速度为5°·min-1,获得X-射线衍射图[14-15]。采用Segal等[15]的方法计算纤维素相对结晶度(Crystallinity Index,CrI)。
1.2.4 傅里叶变换红外光谱分析 称取过60目筛网的不同生长阶段香菇栽培料粉末各10 mg,与2 g经过干燥的KBr在玛瑙研钵中研磨均匀,压片后用傅里叶红外光谱仪在400~4000 cm-1(仪器分辨率4 cm-1)下扫描采样64次[16]。所得结果用Omnic 9.2软件分析。
1.2.5 木质纤维素酶活性的测定 酶液提取:鲜样冷冻后进行冷冻粉碎,称取2 g样品粉末加入10 mL去离子水,上下振摇30 min,经尼龙过滤后,10 000 r·min-1离心15 min(4 ℃),收集上清液用于酶活性测定[5]。
酶活性测定:按照Huang等[17]的方法测定羧甲基纤维素酶活性,参照管婉等[18]的方法测定β-葡萄糖苷酶活性;参照刘芹等[19]的方法测定木聚糖酶活性、木质素过氧化物酶和锰过氧化物酶活性。
1.2.6 纤维形态观察 将不同生长阶段香菇栽培料放入试管内,加入双氧水和冰醋酸混合液(体积比1∶1),混合液没过试样2 cm左右,置于水浴锅中沸水煮至样品变白,呈透明状。将煮好的试样用蒸馏水冲洗数遍至不呈酸性为止,再加入适量蒸馏水至试管,振荡,使试样全部分离成单根纤维[14,20-21]。吸取此纤维悬浮液滴于载玻片上,利用光学显微镜和MSShot图像处理系统对纤维进行拍照观察。
1.3 数据处理
采用Excel 2019对数据进行整理计算,采用SPSS 25.0对数据进行组间显著性差异分析,结果以平均值±标准差表示。采用OriginPro 2021和Excel 2019作图。
2 结果与分析
2.1 不同生长阶段香菇栽培料的木质纤维素含量
由表1可以看出,与未接种香菇栽培料(S0)相比,不同生长阶段的香菇栽培料中木质纤维素含量均显著降低。从S0至子实体采收(S4),香菇栽培料中纤维素含量降低了29.29%,其降解主要发生在转色期(S2)之前,含量由S0的47.42%降低至S2的38.52%,此时期的纤维素降解率占整个生长周期的64.07%,之后纤维素的降解速率减缓;总纤维素含量变化趋势与纤维素含量一致,其降解主要发生在S2之前;而半纤维素和木质素含量在不同生长阶段呈现出匀速下降的趋势,至S4阶段其含量分别降低了52.00%和49.22%。
2.2 不同生长阶段香菇栽培料的纤维素相对结晶度
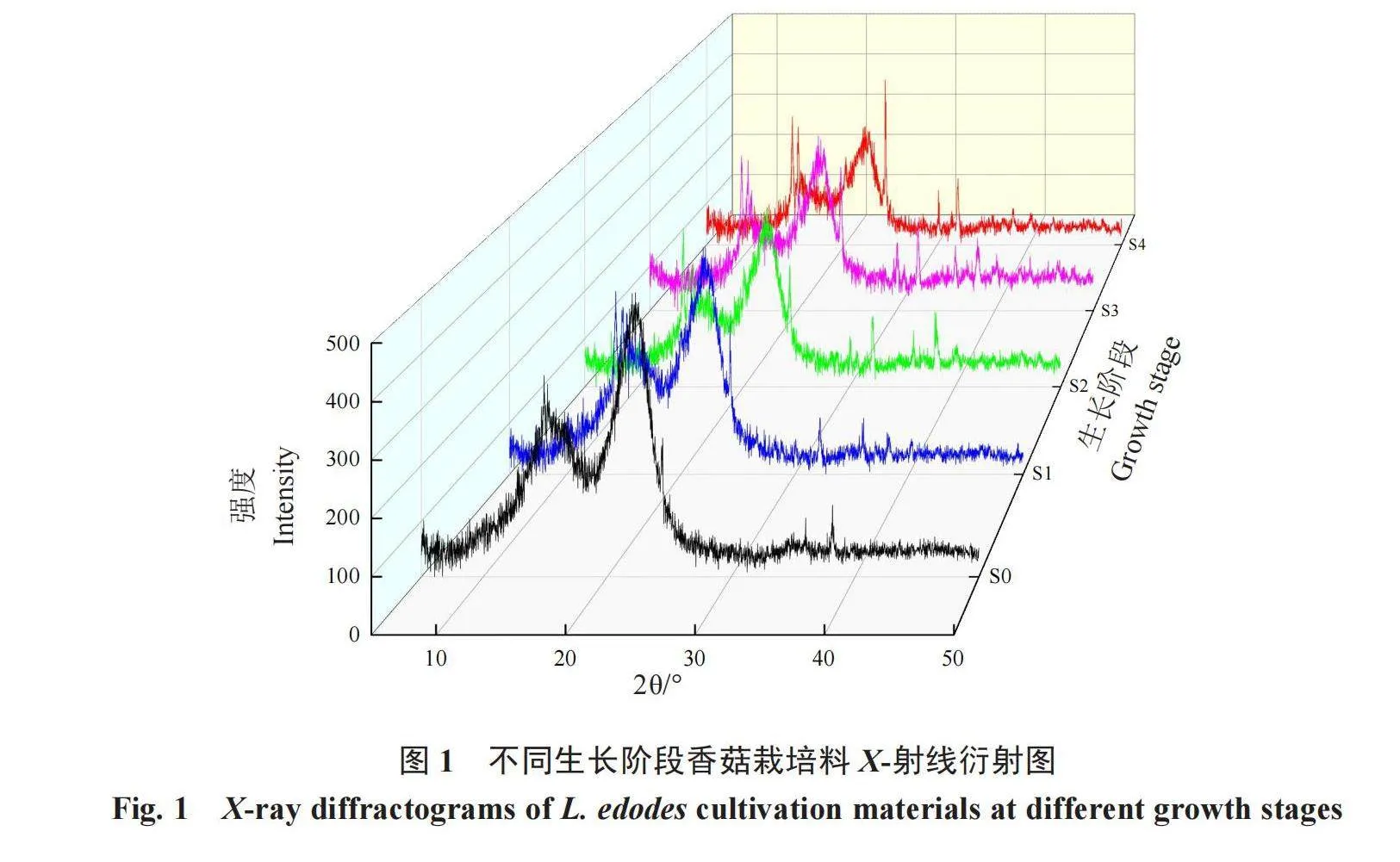
为了更好地反映不同生长阶段香菇栽培料纤维素结构的变化,采用X-射线衍射表征不同生长阶段香菇栽培料纤维素晶型的变化。从图1可以看出,不同生长阶段香菇栽培料均具有典型的纤维素X-射线衍射特征,典型特征晶面(1 0 1)、(1 0 [1])、(0 0 2)和(0 4 [0])分别主要出现在15.1°、16.4°、22.3°和32.2°位置。不同生长阶段香菇栽培料在不同衍射角度有不同的衍射强度,随着香菇的生长,纤维素结晶区(0 0 2)晶面衍射峰的衍射强度呈逐渐降低的趋势,说明栽培后香菇栽培料中纤维素结晶度有所下降,这可能是由于在香菇生长过程中分泌的胞外酶破坏了结晶区的纤维素,进而导致结晶区晶面衍射强度降低。
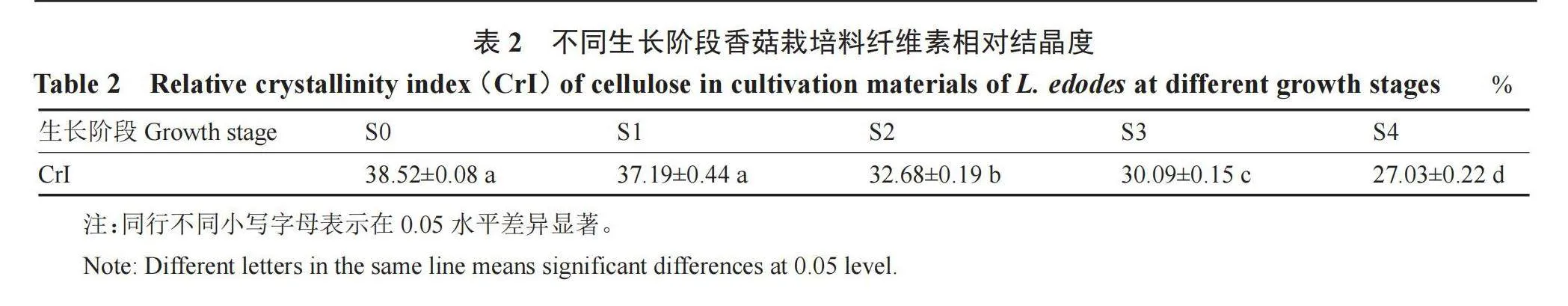
纤维素相对结晶度(CrI)可以较好地反映不同生长阶段香菇栽培料木质结构的变化,由表2可知,不同生长阶段香菇栽培料纤维素相对结晶度随香菇生长而逐渐减小,表明结晶区纤维素被香菇降解和利用。
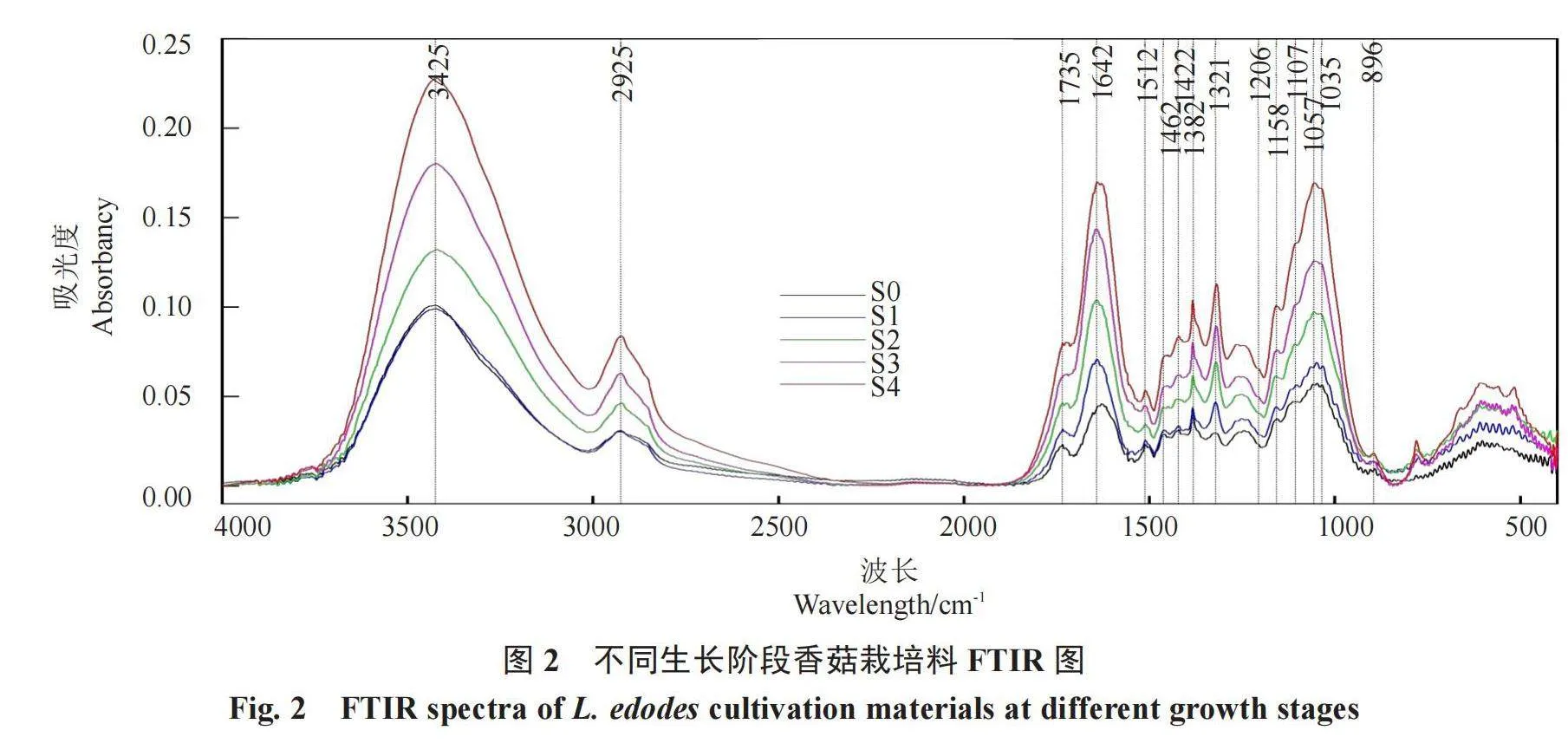
2.3 不同生长阶段香菇栽培料的木质纤维素红外光谱特征
傅里叶变换红外光谱(FTIR)能够提供有关官能团的存在、组成和某些特定结构特征的信息,不同生长阶段香菇栽培料中木质纤维素FTIR如图2所示。从图2可以看出,不同生长阶段香菇栽培料中木质纤维素的FTIR谱带吸光度具有一定的差异,表明木质纤维素结构及含量发生了变化。由于香菇栽培料的复杂性,FTIR指纹区(800~1800 cm-1)的大部分波段对其都有贡献。为了简化FTIR谱带波段的解释及准确地反映木质纤维素变化,采用总纤维素的4个特征吸收波段和木质素的2个特征吸收波段进行分析,具体波段信息为:1735 cm-1为半纤维素C=O伸缩振动、1382 cm-1为纤维素和半纤维素C-H变形振动、1158 cm-1为纤维素和半纤维素的C-O-C伸缩振动、896 cm-1为纤维素C-H变形振动、1512 cm-1为木质素芳香环C=C骨架振动、1206 cm-1为木质素芳香环上C-O伸缩振动。图2显示,与S0相比,随着香菇的生长,栽培料的光谱强度在1735、1382、1158、896、1512、1206 cm-1等波段逐渐增大。
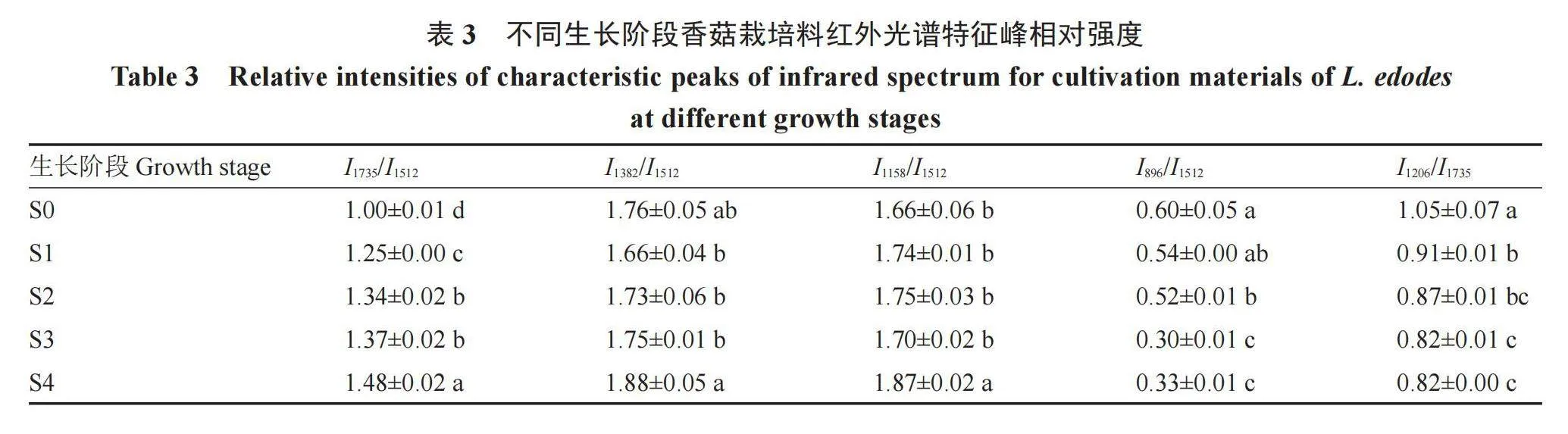
为了明确与香菇栽培料化学成分相关官能团的变化趋势,表3列出了碳水化合物(纤维素和半纤维素)/木质素比值的相对强度。由表3可知,在不同生长阶段香菇栽培料的碳水化合物/木质素(I1382/I1512和I1158/I1512)比值的升高说明总纤维素的降解速率低于木质素,I1735/I1512比值升高、I1206/I1735比值降低说明木质素降解速率高于半纤维素,而I896/I1512比值降低则说明木质素降解速率低于纤维素,且现蕾(S3)后纤维素相对含量相较于木质素无显著变化,说明此时木质素和纤维素降解速率相当。
2.4 不同生长阶段香菇栽培料的纤维形态特征
经显微镜观察,不同生长阶段香菇栽培料放大40倍的纤维形态无明显变化(图3);将纤维放大至100倍观察(图3),S0纤维壁和内腔结构完整、光滑,接种香菇菌种至菌丝满袋(S1)后纤维壁出现裂纹,随着香菇的生长纤维壁上的裂纹逐渐增多且裂口增大。纤维壁裂纹越多、裂口越大,说明纤维受破坏越严重,更易被香菇吸收利用进而促进香菇的生长发育。
2.5 不同生长阶段香菇栽培料的木质纤维素降解酶活性
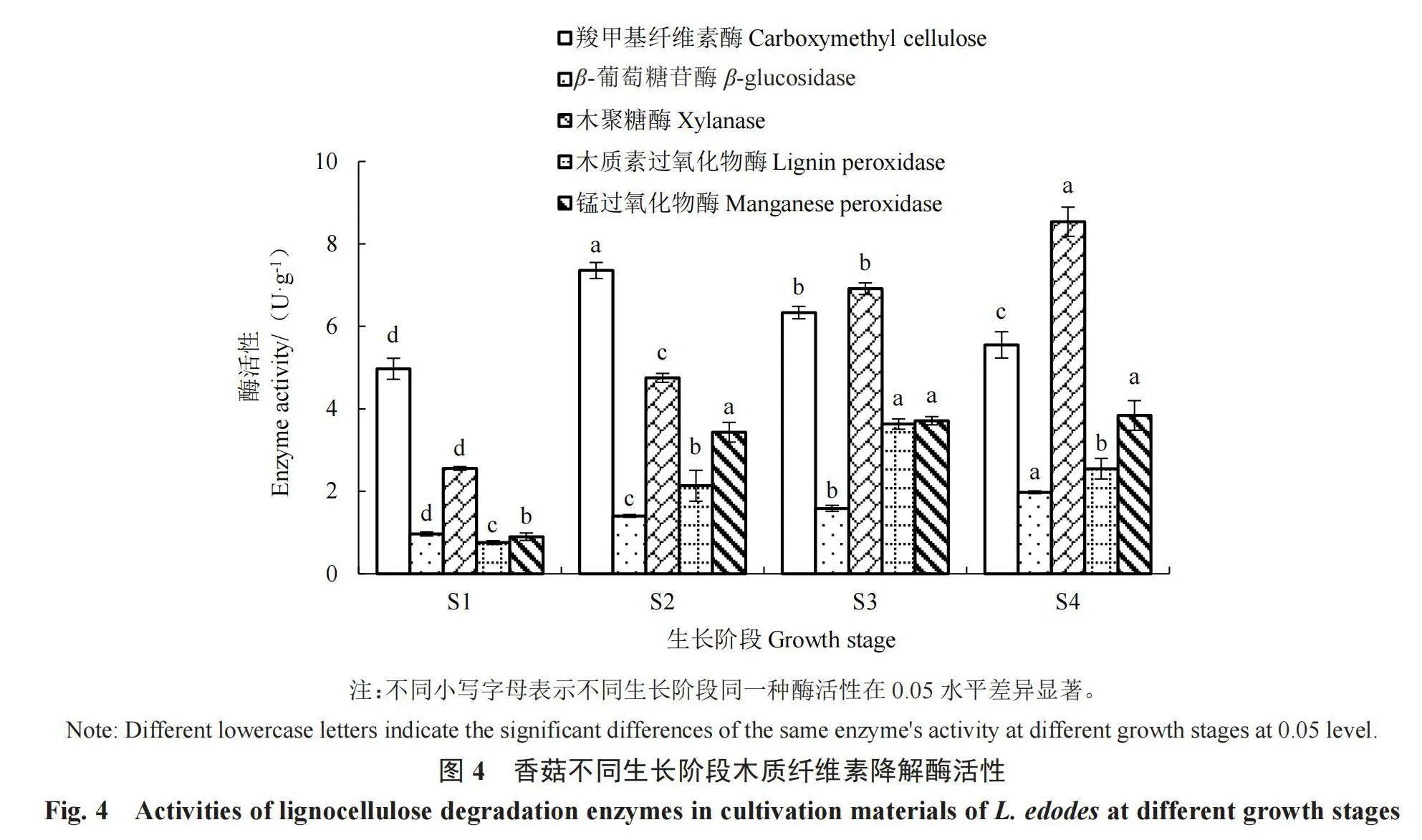
香菇对木质纤维素的降解主要依靠胞外酶的作用来完成,胞外酶种类较多,与香菇栽培料中木质纤维素降解相关的有纤维素酶系、半纤维素酶系和木质素酶系等,其中羧甲基纤维素酶和β-葡萄糖苷酶属于纤维素酶系,木聚糖酶属于半纤维素酶系,木质素过氧化物酶和锰过氧化物酶属于木质素酶系。香菇栽培料中5种酶的活性变化如图4所示。由图4可以看出,香菇各生长发育阶段的胞外酶活性的变化不尽相同。随着香菇菌丝的生长,栽培料中羧甲基纤维素酶活性在S2时达到最高(7.36 U·g-1),之后酶活性逐渐降低,这一结果与纤维素降低率(表1)相关。在香菇生长过程中β-葡萄糖苷酶和木聚糖酶活性逐渐升高,分别由S1时的0.97、2.56 U·g-1显著升高至子实体采收(S4)时的1.98、8.54 U·g-1。木质素过氧化物酶活性在现蕾期(S3)达到最高(3.63 U·g-1),之后显著降低,而锰过氧化物酶活性则在S2时期显著升高(3.43 U·g-1),之后缓慢升高。
3 讨论与结论
代料栽培是香菇栽培的主要形式,香菇栽培料以木屑为主,辅以麸皮,这些原料均含有大量的木质纤维素,经降解后才能被香菇菌丝吸收利用。在本研究中,香菇原始栽培料中木质纤维素含量高达85.27%,经香菇生长发育后木质纤维素含量降低至52.23%,降低了38.75%,说明香菇在生长过程中对纤维素、半纤维素和木质素进行了降解和利用,这一结果与于丹等[22]的结果相似。随着香菇的生长发育,栽培料中纤维素、半纤维素和木质素含量均显著降低,且纤维上的裂纹和裂口逐渐增大,说明纤维被破坏程度与木质纤维素降解呈一定的相关性。纤维素的降解主要发生在转色期(S2)之前,而此时羧甲基纤维素酶活性达到最高(7.36 U·g-1),之后酶活性显著降低,说明纤维素的降解与羧甲基纤维素酶活性正相关;半纤维素含量在不同生长阶段均显著降低,这一变化与木聚糖酶在不同生长阶段的酶活性显著升高一致;木质素在不同生长阶段亦均显著降低,但其对应的木质素降解酶活性变化并未与其变化呈现出一一对应关系,其中木质素过氧化物酶活性在现蕾期(S3)时达到最高,锰过氧化物酶活性在S2时达到较高水平,刘芹等[19]对糙皮侧耳木质纤维素降解酶活性的研究也得到了类似的结果。由此推测,木质素的降解在S2之前主要靠锰过氧化物酶降解,之后则由木质素过氧化物酶和锰过氧化物酶共同作用来完成。总体来看,木质纤维素含量与木质纤维素降解酶活性呈负相关,即维持较高的木质纤维素降解酶活性可以提高木质纤维素的降解率。
FTIR结果表明,香菇不同生长阶段栽培料的光谱强度在1735、1382、1158、896、1512、1206 cm-1等波段逐渐增大,Gallio等[23]在研究白蚁侵袭下巨桉木材的热化学行为时也得到了类似的结果,并指出特征官能团吸光值的增大并非说明波数所代表的成分数量的增加,而是说明化学成分发生了变化,这也进一步说明由于香菇利用栽培料中木质纤维素等成分用于自身的生长发育而导致栽培料中的化学成分发生了变化。木质素与纤维素、半纤维素的特征吸收峰的峰高比值可用来判定木质纤维素相对含量的高低[14],采用I1512/I1735特征峰比值表征木质素相对含量,采用I1735/I1512、I1382/I1512、I1158/I1512和I896/I1512特征峰比值表征纤维素和半纤维素相对含量。在本研究中,I1735/I1512比值升高,I1206/I1735和I896/I1512比值降低,说明半纤维素降解速率低于木质素,纤维素降解速率高于木质素,这一结果与随着香菇生长发育木聚糖酶活性显著升高、纤维素酶系和木质素酶系活性呈先升高后降低的趋势有关。I1382/I1512和I1158/I1512比值升高说明总纤维素的降解速率低于木质素,出现这一结果的原因可能是虽然木质素降解速率高于半纤维素、低于纤维素,但由于纤维素含量高,从而间接降低了总纤维素的降解速率。
纤维素的结构既有结晶区域又有非结晶区域,其分子间的氢键相互作用与范德华力形成了具有独特衍射现象的晶体结构[24]。X-射线衍射结果表明,不同生长阶段香菇栽培料均具有典型的纤维素X-射线衍射特征,说明纤维素结晶区未被完全破坏;纤维素相对结晶度(CrI)由未接种期(S0)的38.52%降低到子实体采收(S4)时的27.03%,且满袋期(S1)时的CrI与S0时无显著差异,CrI的降低主要在S2之后,说明S1时香菇主要利用的是非结晶区的纤维素,而此时木质纤维素各组分的降解率及相应降解酶的活性均较低,由此推断,S1前香菇主要利用的是非木质纤维素成分,促进菌丝体生物量的积累,进而为后期分泌胞外酶、分解大分子木质纤维素奠定生理基础。同时,香菇栽培料中锰过氧化物酶和羧甲基纤维素酶的活性首先达到较高水平,说明香菇生长首先利用木质素和非结晶区的纤维素,破坏结晶区纤维素的保护屏障,进而促进结晶区纤维素的降解,并最终降低纤维素结晶度。
根据以上结果,推测香菇首先以栽培料中非木质纤维素组分供菌丝生长利用,然后分泌胞外木质纤维素降解酶破坏纤维结构,将大分子木质纤维素组分降解为小分子组分,从而满足其生长所需。笔者对香菇不同生长阶段栽培料中木质纤维素降解利用情况进行了研究,所得研究结果可为提高香菇栽培料的利用率和促进栽培料中木质纤维素的降解利用提供理论支撑。
参考文献
[1] 鱼智,李佳奇,米林锋,等.不同枣木基质配比对香菇L808菌株菌丝生长的影响[J].中国食用菌,2023,42(2):82-87.
[2] 崔国梅,路风银,王安建,等.香菇生长条件及新型栽培基质研究进展[J].中国瓜菜,2023,36(1):6-12.
[3] 李顺峰,刘丽娜,许方方,等.不同热预处理对栎木木质纤维素降解的影响[J].中南林业科技大学学报,2023,43(11):185-192.
[4] 史正军.甜龙竹及巨龙竹半纤维素、木质素结构诠释及相互间化学键合机制解析[D].北京:北京林业大学,2013.
[5] MAKARENKOVA G,BALODE V,ZALA D,et al.Effect of pretreated colza straw on the growth and extracellular ligninolytic enzymes production by Lentinula edodes and Ganoderma lucidum[J].Fermentation,2021,7(3):157.
[6] HAN M L,YANG J,MA J J,et al.Extracellular laccase activity among Ganoderma and Coriolopsis species grown on lignocellulosic wastes[J].BioResources,2022,17(3):5049-5064.
[7] 雷雨霞.外源纤维素酶对金针菇生长发育的影响[D].南宁:广西大学,2016.
[8] 辛宇,李长田,荆琴方,等.三种酶制剂的添加量和时间对草菇生长和产量的影响[J].食用菌学报,2014,21(4):39-41.
[9] 司徒成,余天华,宋宇欣.不同食用菌对猕猴桃枝木质纤维素降解的比较[J].北方园艺,2022(5):111-118.
[10] MATA G,SAVOIE J M.Extracellular enzyme activities in six Lentinula edodes strains during cultivation in wheat straw[J].World Journal of Microbiology and Biotechnology,1998,14(4):513-519.
[11] KOBAYASHI N,WADA N,YOKOYAMA H,et al.Extracellular enzymes secreted in the mycelial block of Lentinula edodes during hyphal growth[J].AMB Express,2023,13(1):36.
[12] VAN SOEST P J,WINE R H.Use of detergents in the analysis of fibrous feeds. IV. Determination of plant cell-wall constituents[J].Journal of the Association of Official Analytical Chemists,1967,50(1):50-55.
[13] VAN SOEST P J.Use of detergents in the analysis of fibrous feeds.II.A rapid method for the determination of fiber and lignin[J].Journal of the Association of Official Agricultural Chemists,1963,46(5):829-835.
[14] 邓祥胜,李明蔓,何鹏,等.桉树伐桩分解过程中木质纤维素成分的变化特征[J].中南林业科技大学学报,2022,42(5):160-169.
[15] SEGAL L,CREELY J J,MARTIN A E,CONRAD C M.An empirical method for estimating the degree of crystallinity of native cellulose using the X-ray diffractometer[J].Textile Research Journal,1959,29(10):786-794.
[16] 李顺峰,许方方,崔国梅,等.不同纯化程度香菇柄多糖的乙酰化修饰及降血糖活性[J].食品科学技术学报,2022,40(6):127-133.
[17] HUANG L,SUN N,BAN L T,et al.Ability of different edible fungi to degrade crop straw[J].AMB Express,2019,9:4.
[18] 管婉,储婷,鲍大鹏,等.香菇菌丝转色过程中生理指标检测与分析[J].食用菌学报,2021,28(6):47-52.
[19] 刘芹,胡素娟,崔筱,等.糙皮侧耳对培养料中木质纤维素的降解研究[J].江西农业学报,2022,34(1):202-210.
[20] 陈桂丹,郑佳琪,蒙芳慧,等.6种桉树人工林木材纤维特性及变异规律[J].中南林业科技大学学报,2020,40(10):137-142.
[21] 黄慧,黄小春,王小东,等.6种江西常见速生阔叶材纤维形态及材性比较[J].南方林业科学,2016,44(2):52-55.
[22] 于丹,宋福强,李冲伟,等.香菇栽培前后基质中纤维素结构的变化[J].中国农学通报,2017,33(34):81-85.
[23] GALLIO E,SCHULZ H R,GUERREIRO L,et al.Thermochemical behavior of Eucalyptus grandis wood exposed to termite attack[J].Maderas Cienciay Tecnología,2020,22(2):157-166.
[24] YANG L,RU Y,XU S,et al.Features correlated to improved enzymatic digestibility of corn stover subjected to alkaline hydrogen peroxide pretreatment[J].Bioresource Technology,2021,325:124688.
