外源NO对香菇热胁迫的缓解机制研究
2024-09-25鲁欣欣徐鹏亮邹明谭秀芳刘翼成马海涛靳荣线


摘 要:为探究外源NO对香菇热胁迫的缓解机制,以香菇L135菌株为试验材料,研究外源添加NO对香菇菌丝高温胁迫下氧化损伤的缓解效应。结果表明,高温胁迫明显抑制了香菇菌丝的生长,导致菌丝蜷曲甚至断裂,添加适宜浓度(800 μmol·L-1)的NO供体(SNP)处理可以有效缓解热胁迫条件下的形态伤害;外源添加SNP处理组与未添加处理组相比,菌丝细胞内过氧化氢及丙二醛的含量均显著下降,热激48和72 h分别下降了17.48%、35.24%和16.70%、19.87%,且胞内超氧化物歧化酶、过氧化物酶和过氧化氢酶活性均显著提高。综上,添加800 μmol·L-1的外源NO能够有效缓解香菇热胁迫,为进一步阐明食用菌抗高温胁迫机制奠定了理论基础。
关键词:香菇;一氧化氮;缓解;热胁迫
中图分类号:S646.1+2 文献标志码:A 文章编号:1673-2871(2024)09-096-06
Alleviation mechanism of exogenous nitric oxide on heat stress of Lentinus edodes
LU Xinxin, XU Pengliang, ZOU Ming, TAN Xiufang, LIU Yicheng, MA Haitao, JIN Rongxian
(Institute of Edible Fungi, Xinxiang Academy of Agricultural Sciences, Xinxiang 453000, Henan, China)
Abstract: To investigate the mechanism of exogenous NO alleviating heat stress in Lentinula edodes, L. edodes strain L135 was used as the experimental material to study the alleviating effect of exogenous NO on oxidative damage of L. edodes hyphae under high temperature stress. The results show that high temperature stress significantly inhibited the growth of L. edodes mycelia, caused mycelia curl or even break, SNP treatment with appropriate concentration(800 μmol·L-1)could effectively alleviate the morphological damage caused by heat stress; the levels of H2O2 and MDA content in mycelial cells decreased significantly in the group treated with exogenous SNP compared with the group treated without SNP, heating shock 48 and 72 h decreased by 17.48%, 35.24% and 16.70%, 19.87% respectively, and the intracellular activities of superoxide dismutase(SOD), peroxidase(POD)and catalase(CAT)activity were significantly increased. In conclusion, the addition of 800 μmol·L-1 exogenous NO can effectively alleviate heat stress in L. edodes, laying a theoretical foundation for further elucidating the mechanism of high-temperature stress resistance in edible fungi.
Key words: Lentinula edodes; Nitricoxide; Alleviate; Heat stress
收稿日期:2023-09-25;修回日期:2024-04-22
基金项目:河南省食用菌产业技术体系(HARS-22-08-Z1);新乡市科技攻关计划(GG2021027)
作者简介:鲁欣欣,女,研究实习员,主要从事食用菌新品种选育和栽培技术研究。E-mail:xxl1663@126.com
通信作者:靳荣线,女,副研究员,主要从事菌类栽培和育种研究。E-mail:jinrongxian@163.com
香菇[Lentinula edodes(Berk.)Pegler]又称香蕈、花菇等,隶属真菌界担子菌门蘑菇亚门蘑菇纲蘑菇亚纲蘑菇目类脐菇科微香菇属[1],是我国广泛栽培的食用菌之一,因其口感好、气味香、味道鲜美,具有很高的营养价值和药用功能,越来越受到消费者的喜爱[2-4]。据2022年中国食用菌协会统计,香菇年产量1 295.48万t,占食用菌总产量的30.68%,位居第一位。但香菇的生长发育受温度影响较大[5],菌丝适宜生长温度为24~26 ℃,温度过高容易造成菌丝活力减弱或凋亡甚至导致菌棒腐烂,此外,在高温环境下,还容易导致子实体畸形或继发性不出菇等问题[6],严重影响香菇的产量和品质,损害菇农的经济效益。因此,增强香菇菌丝的耐热性,探究其耐热机制对香菇的栽培生产具有重要意义。
生物体在受到高温胁迫时,会引起活性氧(ROS)大量累积,氧化其生物膜,生成脂质过氧化产物,从而破坏生物体的正常新陈代谢,对细胞产生损伤。丙二醛(MDA)是细胞膜脂过氧化的主要产物,会对生物膜产生严重损伤[7]。为维系胞内的活性氧水平,进化出来一系列的抗氧化系统,其中酶促系统包括一系列抗氧化酶,如超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)等,可以有效清除活性氧,缓解胁迫对细胞造成的损伤[8],但抗氧化酶的响应方向和程度会由于研究的生物种类、组织及其胁迫时间和程度的不同而不同[9]。在植物中,NO是一种重要的信号分子,不仅可以调节植物生长发育,还能调控植物对生物和非生物胁迫的响应[10]。大量研究表明,NO作为一种信号分子能够通过调节抗氧化酶(SOD、POD、CAT等)活性增强植物的抗逆性,如抗高温胁迫,抗盐胁迫等[11-13]。NO在热胁迫下也参与食用菌的热胁迫响应,但与植物相比,NO在真菌中的功能及调控机制的相关研究较少。孟利娟等[14]研究表明,通过外源添加NO可以缓解白灵侧耳的氧化损伤,提高SOD和CAT活性及菌丝耐热性。
近些年热胁迫对食用菌影响的研究受到广泛关注,其中对糙皮侧耳[15]、双孢蘑菇[16]等食用菌报道较多,对香菇的研究极少。笔者以外源添加NO供体SNP对热胁迫下香菇菌丝生长及抗氧化胁迫能力的影响进行研究,以期为进一步阐明食用菌抗高温胁迫机制奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 供试菌株与主要试剂 供试菌株香菇L135,由福建省三明市真菌研究所选育,为低温晚熟型品种,具有菇形圆正、子实体肉厚、菌柄短、易形成花菇等特点。
SNP(NO供体)购自上海碧云天生物技术股份有限公司。
1.1.2 培养基 CYM固体培养基:蛋白胨2 g,酵母粉2 g,MgSO4 0.5 g,KH2PO4 0.4 g,K2HPO4 1 g,葡萄糖20 g,琼脂18 g,水1000 mL;CYM液体培养基:蛋白胨2 g,酵母粉2 g,MgSO4 0.5 g,KH2PO4 0.4 g,K2HPO4 1 g,葡萄糖20 g,水1000 mL。
1.2 试验方法
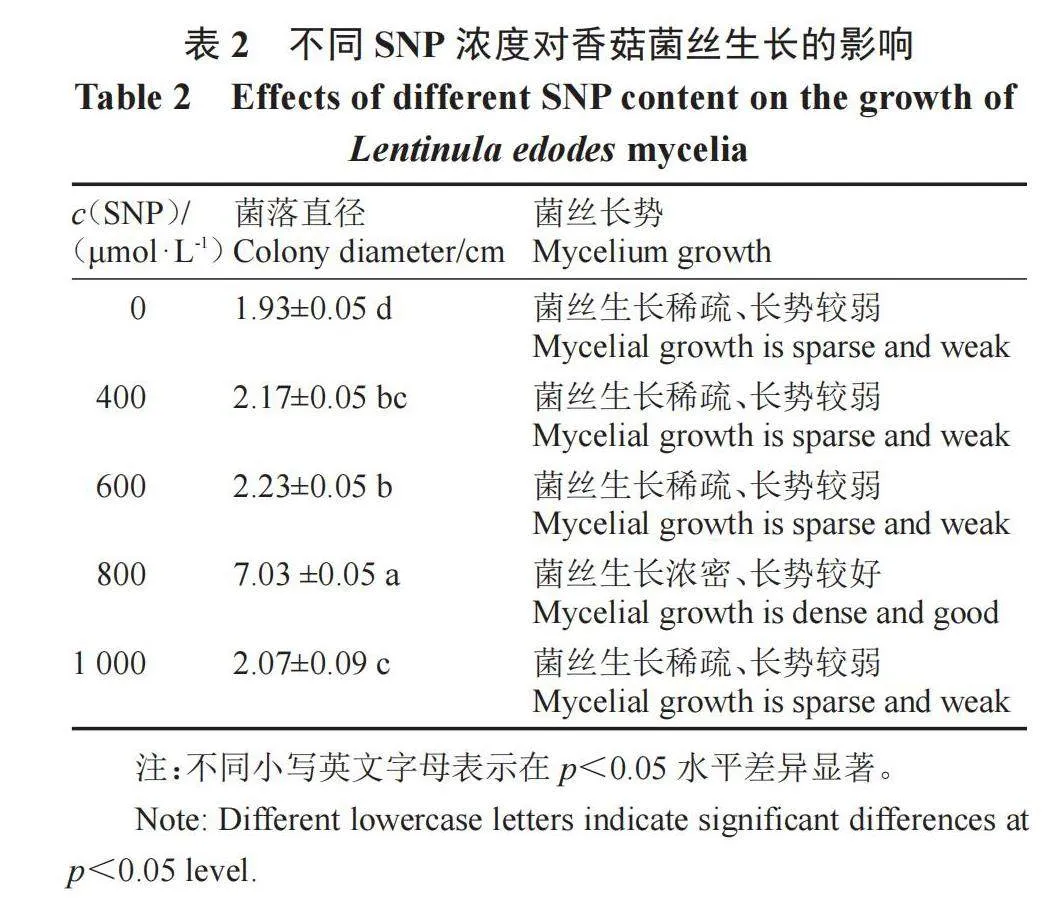
1.2.1 最适SNP浓度筛选 试验于2023年3-6月在新乡市农业科学院食用菌研究所进行。将供试菌株接种于CYM培养基中,分别在不同温度下(30、32、35、38、40 ℃)进行热胁迫处理,观察菌丝生长情况,确定致死温度。然后配制SNP终浓度分别为0、400、600、800、1000 μmol·L-1的CYM培养基,混合均匀后倒平板,每个浓度3次重复,用5 mm打孔器在供试菌株菌落边缘处打孔,接种于固体培养基平板中央,在25 ℃下培养7 d,然后置于致死温度下进行热胁迫处理,观察菌丝生长恢复情况,采用十字交叉法对菌丝生长速度进行测定。
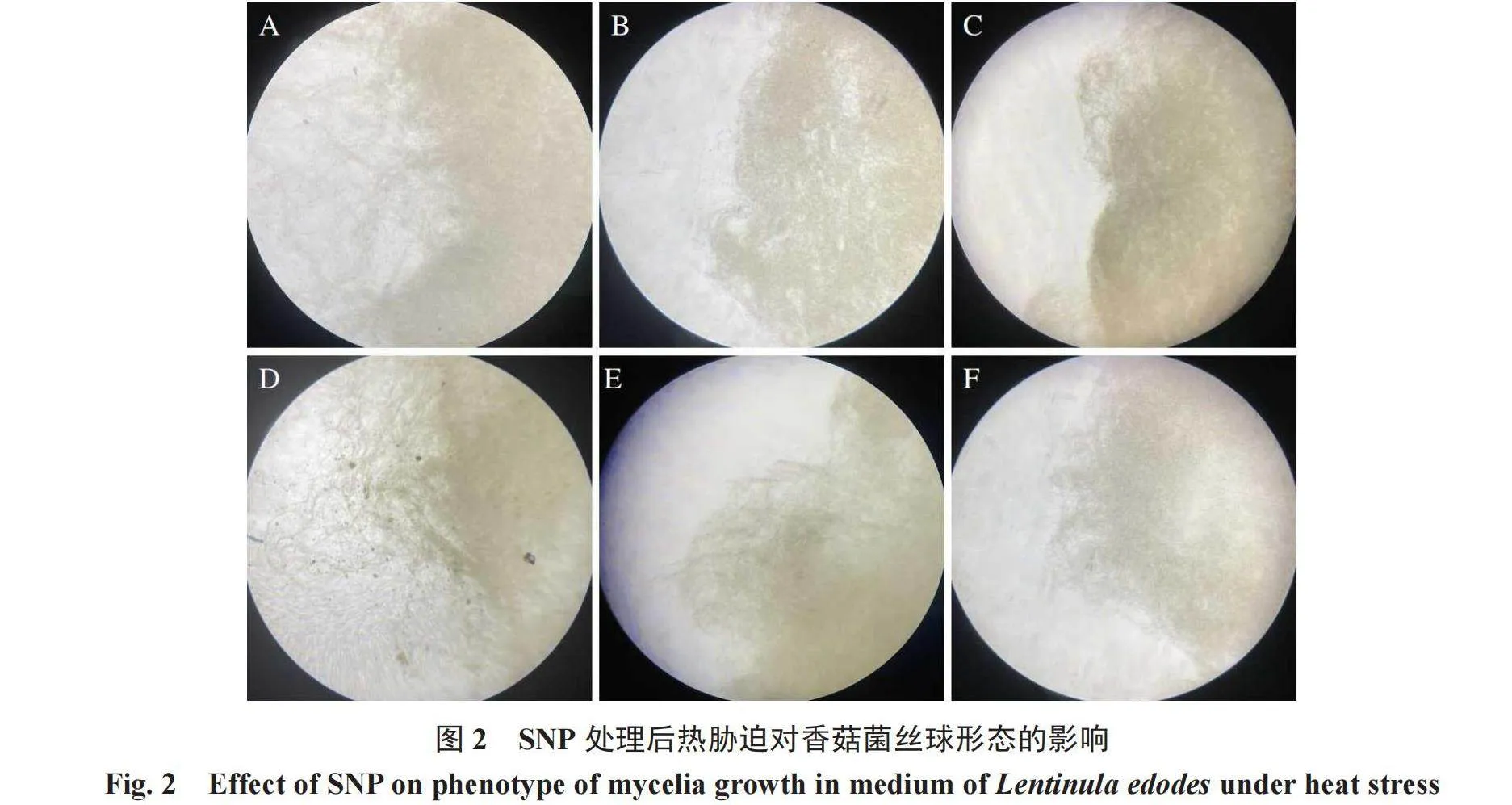
1.2.2 显微镜下香菇菌丝球形态变化 用直径为5 mm的打孔器取6个供试菌株菌块转移至200 mL无菌CYM液体培养基内,在25 ℃恒温培养箱中静置培养2 d,然后在震荡培养箱中25 ℃、140 r·min-1震荡培养7 d,继续在40 ℃下分别震荡培养0、48、72 h,培养结束后收集菌丝球样品,以不添加SNP的培养基为对照组,每个处理设置3个重复,以未经处理(0 h)的样品作为对照,最后将菌丝球样品制片后在光学显微镜下观察其形态变化。
1.2.3 生理指标测定 每个处理分别称取1 g新鲜菌丝后提取粗酶液,按照索莱宝公司提供的检测试剂盒操作说明书分别测定H2O2和MDA含量及SOD、CAT和POD活性。
1.3 数据处理
试验采用完全随机法进行取样,所得数据用IBM SPSS 19.0统计软件进行差异显著性分析和相关性分析,利用EXCEL 2019进行柱状图绘制。
2 结果与分析
2.1 最适SNP浓度筛选
将香菇菌丝接种于CYM培养皿中,25 ℃培养7 d后转移至不同温度(30、32、35、38、40 ℃)下进行热胁迫处理,结果表明,随着温度的升高,菌丝生长速率受到的抑制逐渐增强,在40 ℃时菌丝完全停止生长,因此将40 ℃作为最终热胁迫温度。
将添加不同SNP浓度处理的菌丝在25 ℃培养7 d后进行热胁迫处理(40 ℃、48 h),然后置于25 ℃下进行恢复培养,图1与表2的结果表明,通过外源添加试验,当添加的NO供体SNP浓度为800 μmol·L-1时,香菇菌丝在热胁迫处理后仍可以恢复生长,且此时菌丝洁白浓密,恢复生长状况最好,而在无外源添加SNP及在浓度400、600和1000 μmol·L-1下均不能恢复生长,由此说明添加适量的SNP可以有效缓解热胁迫造成的香菇菌丝形态伤害,因此将NO供体SNP的最适浓度确定为800 μmol·L-1。
2.2 外源NO对热胁迫下香菇菌丝球形态的影响
香菇菌丝球的形态变化能够直观看出香菇的生长状况,在正常温度环境下,菌丝球菌丝强壮茂密、向周围呈发射状。试验结果如图2所示,在无热胁迫的情况下,液体培养下的香菇菌丝球生长状况良好,向外呈发射状生长且菌丝茂密,而随着热胁迫时间的延长,周围菌丝逐渐蜷曲直至完全断裂,说明热胁迫对菌丝球的形态有重要影响,且随着热激时间延长而越来越严重。由图2-E~F可以看出,在添加SNP处理后,菌丝随着热胁迫时间的延长并没有出现严重断裂现象,且对香菇菌丝球形态造成的伤害有所缓解,由此可以看出,外源添加800 μmol·L-1的SNP处理可以有效缓解香菇菌丝形态的蜷曲,使菌丝更强壮,有效抵抗热胁迫造成的伤害,从而说明外源添加NO可以有效缓解热胁迫对香菇菌丝球形态的伤害。
2.3 外源NO对热胁迫下香菇菌丝体内H2O2和MDA含量的影响
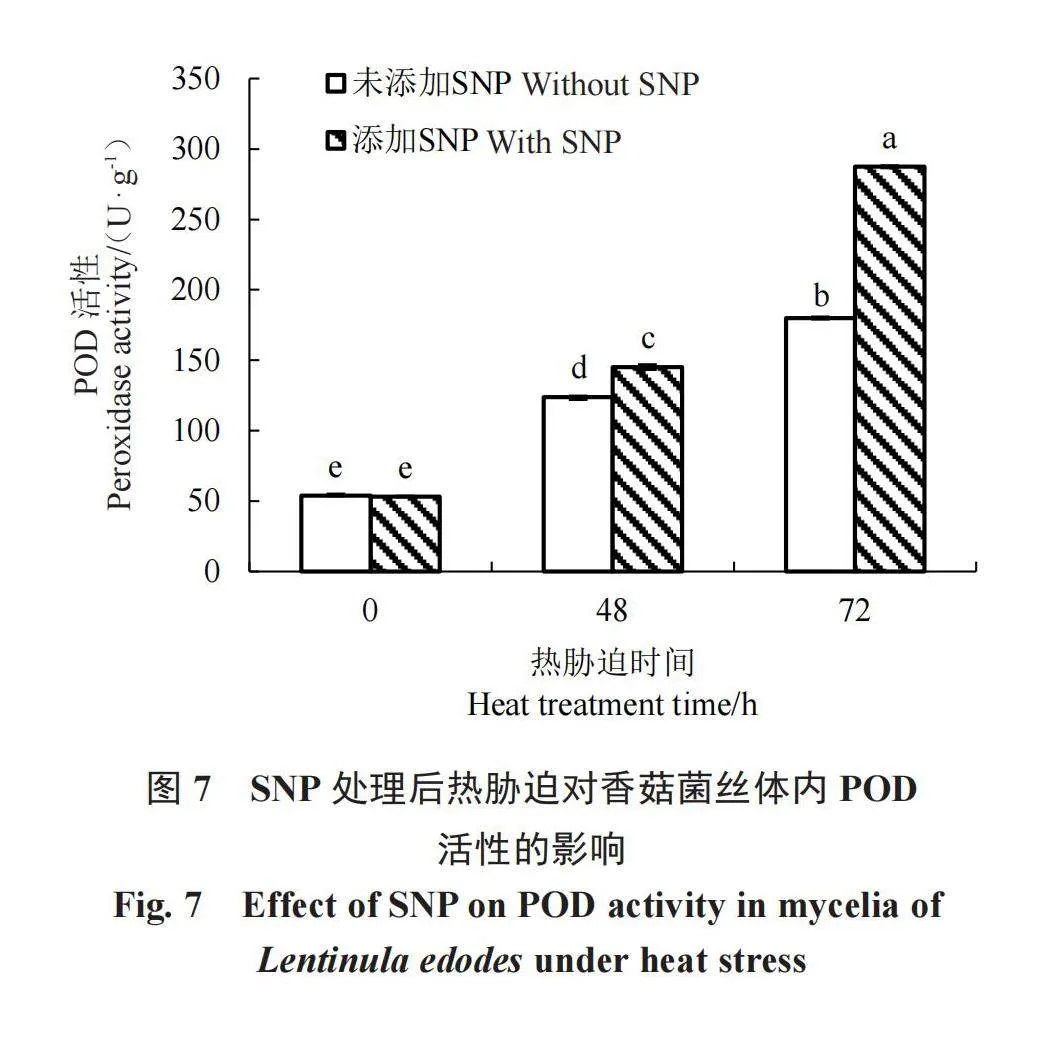
H2O2含量是反映细胞氧化损伤的一个重要指标,由图3可以看出,无论有无添加NO供体SNP,H2O2的含量都随着热胁迫处理时间的延长而显著升高,说明热胁迫后菌丝中ROS出现大量积累,热胁迫会影响H2O2含量,从而使香菇菌丝受到一定程度的氧损伤。而在添加一定浓度的SNP(800 μmol·L-1)后,热激48 h和72 h后H2O2的含量均分别显著下降了17.48%和35.24%,由此可以看出,在NO供体SNP的作用下,热胁迫造成的香菇体内H2O2含量升高受到了显著抑制,能够有效减缓高温热胁迫对香菇菌丝的氧损伤。
香菇菌丝体内MDA的含量变化能够反映出热胁迫后菌丝细胞膜的损伤程度,由图4可以看出,在未添加SNP条件下,菌丝细胞内MDA的含量随着热胁迫时间的延长而大量积累,表明热胁迫可能引起了菌丝细胞膜损伤,而添加SNP处理后,香菇菌丝细胞内MDA积累得到了显著缓解,由此可以看出,添加NO供体SNP可以缓解热胁迫引起的香菇菌丝体的氧损伤,降低由于热激引起的MDA产物的含量,在一定程度上缓解了热胁迫。
2.4 外源NO对热胁迫下香菇菌丝体内抗氧化酶活性的影响
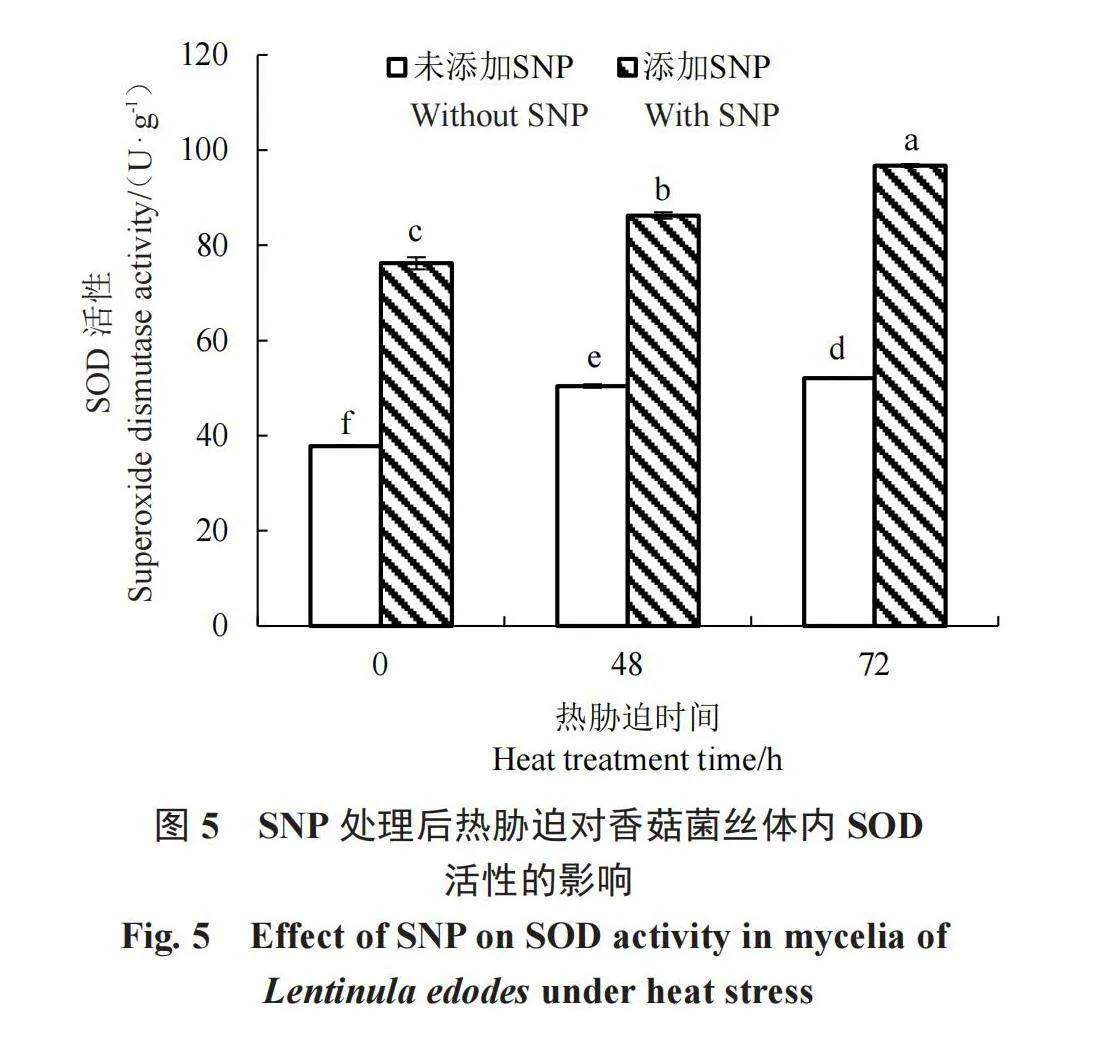
如图5所示,高温胁迫下,对照组和处理组香菇菌丝的SOD活性都随着热胁迫时间延长而显著增强,可能是高温胁迫导致了活性氧的大量产生,由此激活了酶促自由基清除系统,但是增加的幅度存在差异。在没有热激的情况下,添加外源NO的SOD活性是不加NO的2.02倍,可以看出不论有无热胁迫的发生,外源添加NO对SOD活性都有显著促进作用。在不添加外源NO条件下,对照组SOD活性为37.82 U·g-1,热胁迫48 h后,活性提高至50.43 U·g-1,在热胁迫72 h后,活性较48 h时显著提高3.33%;在添加外源NO条件下,对照组酶活性为76.21 U·g-1,热胁迫48 h后,活性比热处理前显著提高13.19%,在热胁迫72 h后,活性较48 h显著提高12.16%。由此可见,添加SNP可以显著提高香菇菌丝体内抗氧化酶的活性,进而增强香菇菌丝耐热性。
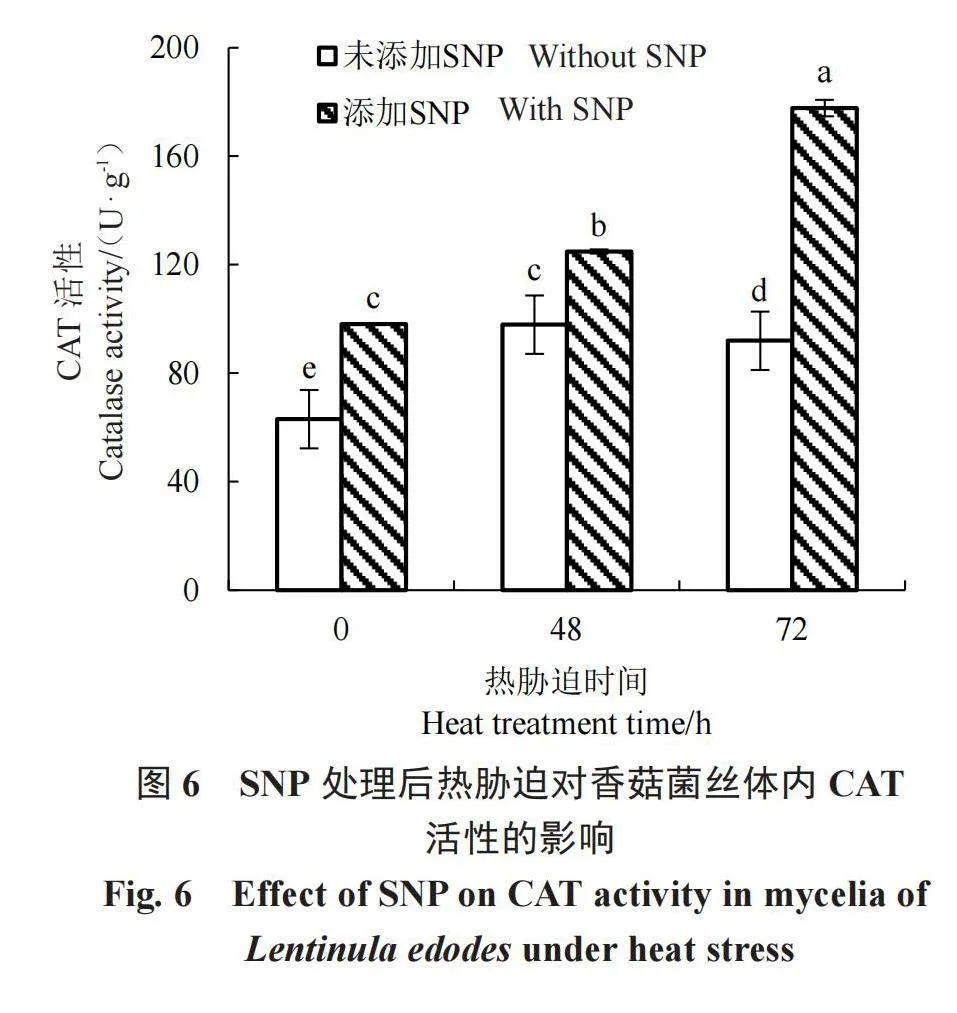
过氧化氢酶是清除活性氧的重要抗氧化酶之一,图6表明,无论有无高温胁迫,添加SNP对SOD活性都有显著的促进作用,高温热胁迫下效果更加明显。在不添加外源NO的条件下,CAT活性随着热胁迫时间的延长呈先上升后下降的趋势,热激48 h和72 h的活性均显著高于未热激,但热胁迫72 h与48 h相比,酶活性显著下降,这说明随着热激时间的持续,香菇菌丝体内的过氧化氢酶活性开始不断降低,对过氧化氢的清除能力也在不断下降;当添加外源NO处理后再进行热胁迫,发现随着热胁迫时间的延长,CAT活性不断显著上升,且幅度高于未添加SNP处理,说明外源NO能够有效保持CAT活性,在一定程度上缓解了香菇热胁迫。
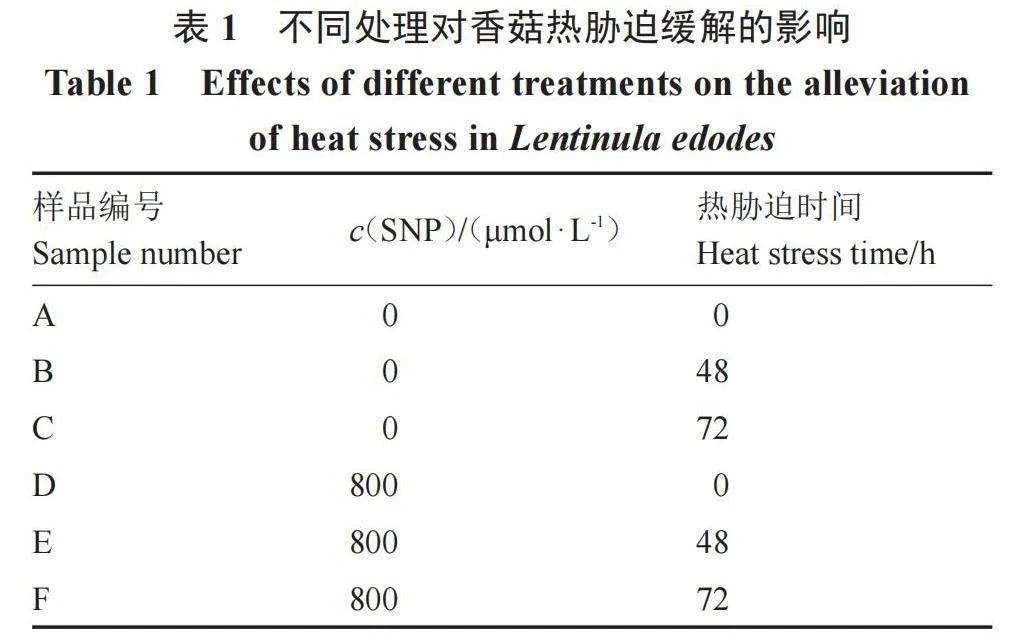
由图7可以看出,在正常温度条件下,有无添加SNP对POD活性影响不大,无显著差异,且POD活性随着热胁迫时间延长呈显著上升的趋势,推测POD活性不断增强可能是高温胁迫导致了活性氧的大量产生,由此激活了酶促自由基清除系统。在添加SNP条件下,热激48和72 h的POD活性分别是未热激的2.72倍和5.39倍,不添加SNP处理的POD活性变化幅度明显比添加组的增加幅度要小,分别为未热激的2.30倍和3.34倍。由此说明SNP释放的NO能够有效增强香菇细胞内POD活性,在缓解香菇热胁迫中发挥重要作用。
3 讨论与结论
高温胁迫会导致生物细胞大量积累活性氧,对其生长发育产生较大影响。由于香菇菌丝体不耐高温,容易受到高温伤害,因此高温是对香菇生产影响最不利的环境因素之一,长时间高温胁迫容易导致菌丝死亡,从而影响出菇。研究表明,在真菌中,NO作为信号分子参与抗氧化过程,同时参与调节抗氧化酶系统,能够调节生物体内抗氧化酶SOD、CAT、POD活性,降低活性氧水平,缓解氧化损伤,提高菌丝的耐热性[17]。Kong等[18]在糙皮侧耳的研究中发现,添加外源NO可以缓解热胁迫导致的菌丝体氧损伤,在一定程度上缓解高温胁迫。
笔者在本试验中进一步探究了NO对香菇热胁迫的缓解作用,证明了通过外源添加一定浓度的NO供体SNP,可以显著提高香菇菌丝体对热胁迫的耐受性。SNP浓度筛选试验结果表明,800 μmol·L-1的SNP对香菇热胁迫的抵抗最有效。从菌丝球的显微形态试验中可以得出,添加SNP后,香菇菌丝球形态的蜷曲得到了显著缓解,菌丝相对于未添加SNP处理变得更加强壮,可以有效抵抗高温胁迫对香菇菌丝造成的伤害。
高温胁迫会造成活性氧过量积累,此时MDA和H2O2的含量增加,导致膜脂过氧化进而引发氧损伤,严重时会对细胞造成伤害甚至死亡。在本研究中,热胁迫48 h和72 h后,SNP处理与单纯热激相比,H2O2和MDA含量均显著下降,说明H2O2和MDA的积累情况得到了显著缓解,表明外源添加SNP释放的NO能够有效降低高温胁迫导致的膜脂过氧化程度,增强香菇对热胁迫的耐受性。外源添加NO可以调节生物细胞内抗氧化酶的活性,对高温胁迫作出应答[19-20],在本研究中,高温胁迫72 h内,SOD、CAT和POD 抗氧化酶活性显著升高,响应高温胁迫,表明外源添加NO供体SNP后,通过释放信号分子NO调节高温胁迫下香菇的抗氧化酶系统,显著提高SOD、CAT、POD活性,缓解氧化损伤,增强菌丝体耐热性,与前人的研究结果一致。
综上所述,高温胁迫明显抑制了香菇菌丝的生长,导致菌丝蜷曲甚至断裂,添加800 μmol·L-1的SNP可以有效缓解热胁迫条件下导致的形态伤害,细胞内H2O2和MDA含量显著下降,而SOD、CAT和POD活性显著提高,表明添加外源NO供体SNP通过激活抗氧化系统能够有效缓解香菇的热胁迫,研究结果对香菇热胁迫生理机制的研究及栽培种植具有重大意义。
参考文献
[1] 李玉,李泰辉,杨祝良,等.中国大型菌物资源图鉴[M].郑州:中原农民出版社,2015.
[2] 陈章娥.香菇的应用价值与前景展望[J].现代食品,2023,29(6):26-28.
[3] 连希希,孙佳宁,孙伶俐,等.香菇多糖的研究进展[J].化学与生物工程,2022,39(2):1-5.
[4] 张淇淇,周良,朱俊豪,等.香菇的药用价值及其产品开发前景[J].长江蔬菜,2020(2):38-43.
[5] 周莎莎,王刚正,罗义,等.生长素及其类似物增强香菇耐高温性的研究[J].菌物学报,2018,37(12):1723-1730.
[6] 曹现涛,边银丙,肖新军,等.高温胁迫对香菇菌丝生长及其抗哈茨木霉能力的影响[J].食用菌学报,2015,22(4):81-85.
[7] 刘宇,宋希强,史佑海,等.高温胁迫下海南杜鹃和白花杜鹃的生理响应比较分析[J].分子植物育种,2018,16(17):5827-5834.
[8] FAN Q J,LIU J H.Nitric oxide is involved in dehydration/drought tolerance in Poncirus trifoliata seedlings through regulation of antioxidant systems and stomatal response[J].Plant Cell Reports,2012,31(1):145-154.
[9] SCHÜTZENDÜBEL A,NIKOLOVA P,RUDOLF C,et al.Cadmium and H2O2-induced oxidative stress in Populus × canescens roots[J].Plant Physiology and Biochemistry,2002,40(6/8):577-584.
[10] SHI H T,LI R J,CAI W,et al.Increasing nitric oxide content in Arabidopsis thaliana by expressing rat neuronal nitric oxide synthase resulted in enhanced stress tolerance[J].Plant and Cell Physiology,2012,53(2):344-357.
[11] 李秀,巩彪,徐坤,等.外源NO对高温胁迫下姜叶片活性氧代谢的影响[J].园艺学报,2014,41(2):277-284.
[12] DOMINGOS P,PRADP A M,WONG A,et al.Nitric Oxide: A multitasked signaling gas in plants[J].Molecular Plant,2015,8(4):506-520.
[13] MANAI J,KALAI T,GOUIA H,et al.Exogenous nitric oxide (NO)ameliorates salinity-induced oxidative stress in tomato (Solanum lycopersicum)plants[J].Journal of Soil Science and Plant Nutrition,2014,14(2):433-446.
[14] 孟利娟,孔维威,邬向丽,等.外源一氧化氮提高白灵侧耳菌丝耐热性生化途径分析[J].菌物学报,2015,34(4):632-639.
[15] 张美敬,刘秀明,邹亚杰,等.侧耳属食用菌高温胁迫条件优化研究[J].菌物学报,2HmWgmTa+jkCVeASBk1vx9g==015,34(4):662-669.
[16] 王倩,黄建春,卜乐男,等.双孢蘑菇对高温胁迫的响应及耐热机理[J].菌物学报,2021,40(6):1400-1412.
[17] 陈一多,张震,姜华,等.真菌中一氧化氮生物合成、降解及功能的研究进展[J].微生物学报,2013,53(1):6-14.
[18] KONG W W,HUANG C Y,CHEN Q,et al.Nitric oxide alleviates heat stress-induced oxidative damage in Pleurotus eryngii var tuoliensis[J].Fungal Genetics and Biology,2012,49(1):15-20.
[19] EGBICHI I,KEYSTER M,LUDIDI N.Effect of exogenous application of nitric oxide on salt stress responses of soybean[J].South African Journal of Botany,2014,90:131-136.
[20] FAN H F,DU C X,DING L,et al.Exogenous nitric oxide promotes waterlogging tolerance as related to the activities of antioxidant enzymes in cucumber seedlings[J].Russian Journal of Plant Physiology,2014,61(3):366-373.
