117份高抗晚疫病马铃薯种质资源遗传多样性分析
2024-09-25孙邦升宋继玲杨梦平邢金月胡尊艳郝智勇李菁华

摘 要:以117份高抗晚疫病马铃薯种质资源为试验材料,通过遗传多样性指数、变异系数及聚类分析等方法,对117份试验材料的26个性状进行分析。结果表明,20个质量性状的遗传多样性指数变化范围为0.35~1.61,6个数量性状变异系数大小排序依次为:主茎数>块茎产量>株高>干物质含量>茎粗>淀粉含量,遗传多样性指数变化范围为0.99~1.50。通过聚类分析,117份试验材料被划分为4类,第Ⅰ类材料多样性丰富,整体性状表现优良,比较符合现有栽培品种的性状特点;第Ⅱ类材料平均产量较高,聚合了我国主栽的4个高抗晚疫病马铃薯品种,可作为晚疫病抗性育种亲本;第Ⅲ类材料主茎数较多,植株整体表现为短日照类型,可作为抗性育种的抗原材料;第Ⅳ类材料包含4份资源,产量最高,可直接用于生产和育种亲本。对117份材料进行R8分子标记检测,其中104份资源含有R8基因,可作为晚疫病抗性基因聚合育种的基础材料。
关键词:马铃薯;晚疫病;遗传多样性;抗性基因
中图分类号:S532 文献标志码:A 文章编号:1673-2871(2024)09-037-10
Genetic diversity analysis of 117 potato germplasm resources with high resistance to late blight
SUN Bangsheng, SONG Jiling, YANG Mengping, XING Jinyue, HU Zunyan, HAO Zhiyong, LI Jinghua
(Keshan Branch of Heilongjiang Academy of Agricultural Sciences, Qiqihar 161005, Heilongjiang, China)
Abstract: This study used 117 potato germplasm resources with high resistance to late blight preserved in the National Potato Germplasm Resource Bank as experimental materials. Through methods such as genetic diversity index, coefficient of variation, and cluster analysis, 26 traits of 117 experimental materials were analyzed. The results showed that the genetic diversity index of 20 qualitative traits ranged from 0.35 to 1.61. The order of variation coefficients for the 6 quantitative traits was: Number of main stems>tuber yield>plant height>dry matter content>stem diameter>starch content. The genetic diversity index ranged from 0.99 to 1.50. Through cluster analysis, 117 experimental materials were divided into 4 categories. The first category of materials has rich diversity and overall excellent performance, which is more in line with the characteristics of existing cultivated varieties. The average yield of Class II materials is relatively high, which aggregates four high resistance potato varieties mainly planted in China and can be used as direct parents for late blight resistance breeding. The third type of material has a larger number of main stems and the overall plant exhibits a short day type, which can be used as antigen materials for resistance breeding. The fourth type of resource contains four resources, with the highest yield performance and can be directly used for production and breeding of parents. Through R8 molecular marker detection on 117 materials, 104 resources contain R8 gene, which can be used as the basic material for late blight resistance gene aggregation breeding.
Key words: Potato; Late blight; Genetic diversity; Resistance gene
收稿日期:2024-03-18;修回日期:2024-06-29
基金项目:国家马铃薯种质资源安全保存项目(19230823);黑龙江省农业创新跨越工程(CX23TS24);黑龙江省农业科学院院级课题(2020YYYF003)
作者简介:孙邦升,男,助理研究员,主要从事马铃薯种质资源研究。E-mail:sunbangsheng0451@163.com
通信作者:宋继玲,女,副研究员,主要从事马铃薯种质资源研究。E-mail:jl_song929@126.com
马铃薯(Solanum tuberosum L.)是茄科茄属的一年生草本块茎植物,别名在我国有20多种,如土豆、洋芋、山药蛋等,染色体基数n=12,包括二倍体(2n=24)、三倍体(3n=36)、四倍体(4n=48)、五倍体(5n=60)、六倍体(6n=72)等系列倍性的种[1]。马铃薯现已成为世界第三大粮食作物,全球有160多个国家和地区种植马铃薯,根据国家统计局2022年的统计,我国2022年马铃薯产量1 798.4万t,总种植面积475.81万hm2,是当今世界上马铃薯第一大生产国[2]。但我国马铃薯单产与世界平均水平相比还比较低,造成这一现象的原因有很多,其中马铃薯晚疫病的危害是主要的原因之一。根据国家统计局、全国植保专业统计资料、中国农业统计资料,在2008-2017年间,马铃薯晚疫病的年平均发生面积超过190万hm2,超出总种植面积的40.66%[3-5],中国马铃薯晚疫病每年发病面积大约17.3万hm2,减产10%~15%,造成的经济损失约20亿元[6-8]。防治马铃薯晚疫病的主要方法包括选育抗病品种、化学药剂防治、建立无病留种田、进行合理的田间管理与轮作4种方式,其中选育抗病品种是最经济有效的防治方法。现阶段我国育成和引进了大量的抗马铃薯晚疫病的种质资源,但随着马铃薯晚疫病生理小种的不断变化,在生产上逐渐失去田间抗性。马铃薯非我国原产作物,晚疫病抗性育种材料主要靠国外引进和改良创新,抗马铃薯晚疫病种质资源来源多元化,亲缘关系复杂,我国马铃薯种质资源库中现保存的马铃薯种质资源有2600余份,晚疫病抗性达到抗病级别以上的马铃薯种质资源345份,来自21个国家和地区,遗传背景复杂,对更好地利用现有资源进行抗马铃薯晚疫病育种、分析晚疫病抗性材料的亲缘关系和寻找具有水平抗性基因的种质资源具有重要意义。随着对晚疫病研究的不断深入,发现在现有晚疫病菌生理小种环境下,含有R基因的群体发病较轻,源自于墨西哥的六倍体野生种Solanum demissum中的晚疫病抗病基因R1~R11,已相继被导入到马铃薯栽培种中,在马铃薯抗晚疫病育种中得到广泛利用,随着生物技术的不断应用,R1、R2、R3a、R3b、R8相继被克隆,并开发了相应的分子标记,应用于分子辅助育种,其中R8基因具有较强的田间抗性,能够显著延迟晚疫病发病时间,并且具有广谱和持久抗性,含有R8基因的品种在欧洲、北美地区抗性表现良好[9-10]。
笔者以高抗马铃薯晚疫病的117份种质资源为试验材料,通过分析我国现有高抗晚疫病种质资源的遗传多样性和R8基因型鉴定2种方式,分析其亲缘关系远近,筛选出具有广谱和持久抗性的高抗马铃薯晚疫病的种质资源,为马铃薯晚疫病遗传育种和分子辅助聚合抗性育种提供遗传材料。
1 材料与方法
1.1 材料
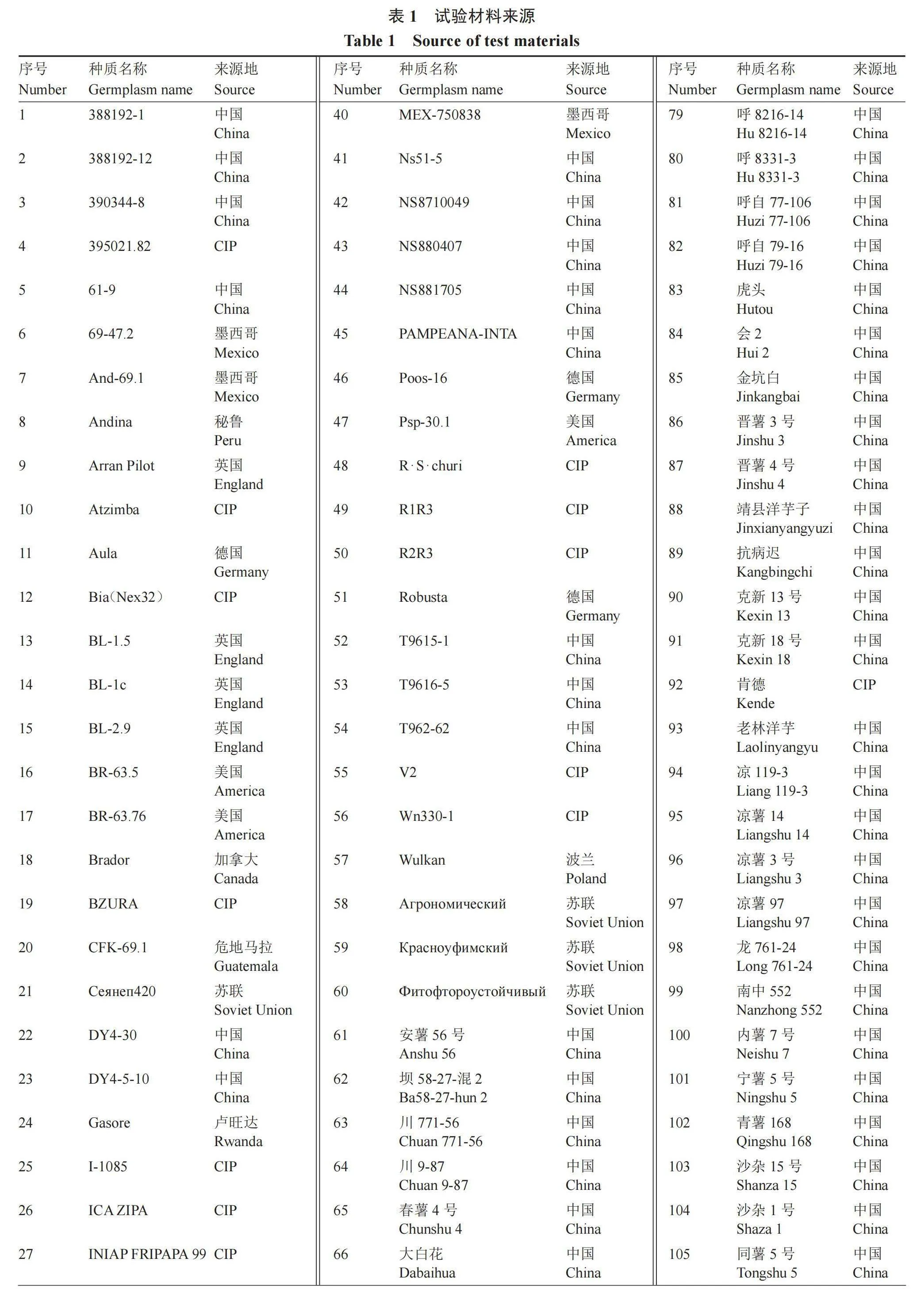
以筛选的117份高抗马铃薯晚疫病种质资源为试验材料,主要包括育成品种、品系及遗传材料(表1)。
1.2 DNA提取
取试管苗新鲜叶片,使用天根DP-320试剂盒进行DNA提取。
1.3 R8基因型检测
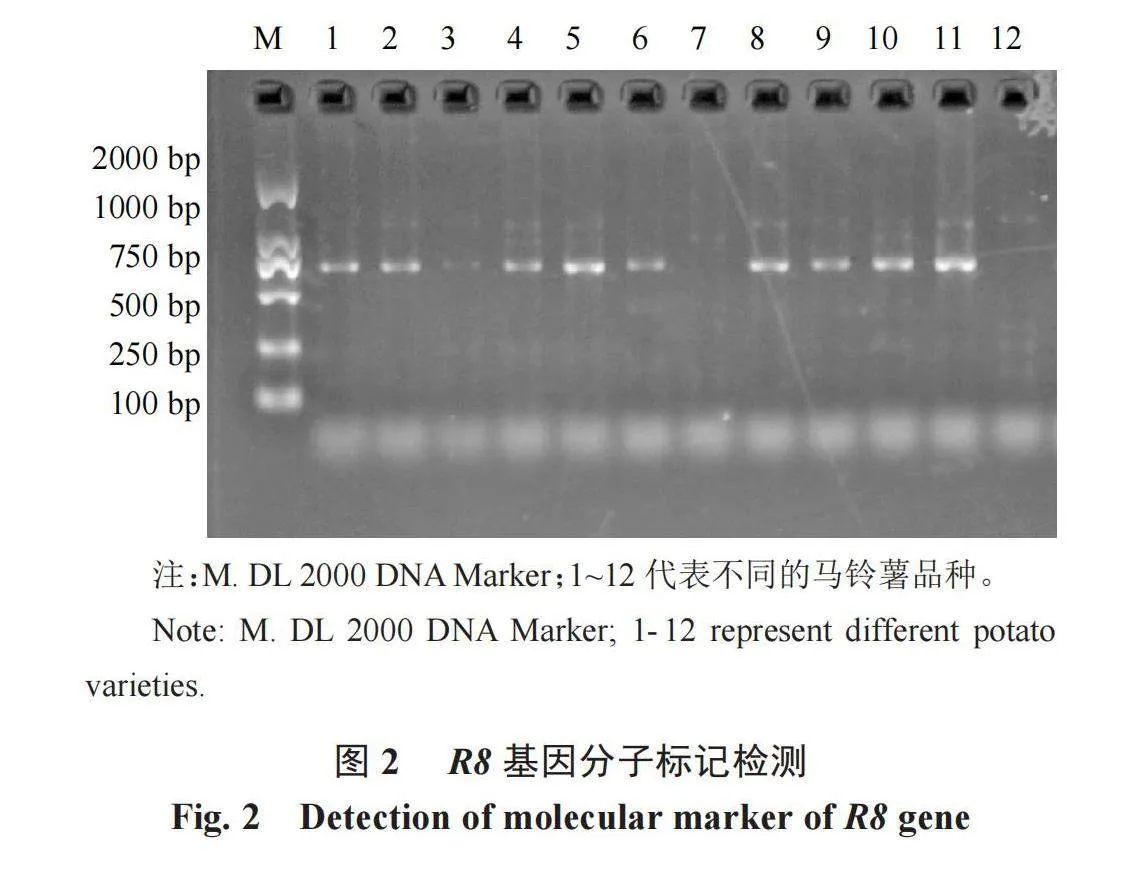
PCR扩增体系10 μL:正向、反向引物(正向序列:CTGGCGCTGGTTTTGCTATGC;反向序列:TCTCTTCGACTTCTTCTTACGAGGTCTA)各0.5 μL,2×Taq PCR Master Mix 5μL,ddH2O 3 μL,模板DNA 1.0 μL;PCR扩增程序:95 ℃预变性3 min,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,35个循环,72 ℃延伸5 min,4 ℃保存。PCR扩增后,琼脂糖电泳检测:上样量为5 μL,琼脂糖凝胶浓度为1.2%,电压120 V,电泳25 min。紫外灯下观察结果并拍照[11]。
1.4 数据采集
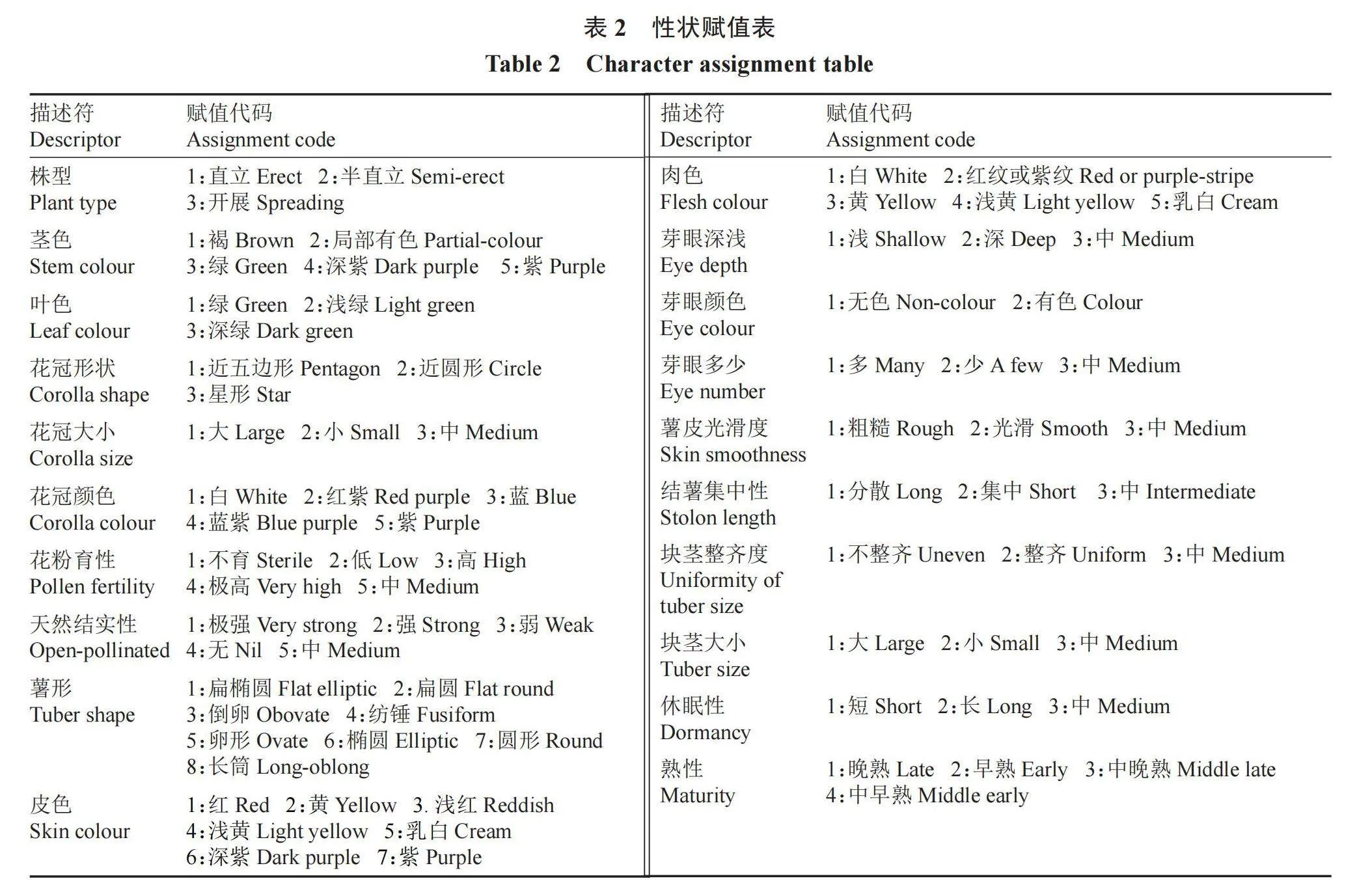
117份试验材料在黑龙江省农业科学院克山分院试验地种植,试验数据采用2007-2022年的多年调查的平均数据,共采集117份高抗晚疫病马铃薯种质资源的26个性状,其中包括20个质量性状和6个数量性状,晚疫病鉴定采用田间自然发病法,植物学鉴定和抗性鉴定方法参照《马铃薯种质资源描述规范和数据标准》[1]执行。利用Spss16.0软件采用组间链接法、欧氏距离进行系统聚类分析,利用Excel软件整理数据,统计分析各个性状的最大值、最小值、标准偏差、平均值,计算变异系数、Shannon-wiener多样性指数,分析其遗传多样性,质量性状对每一个性状进行赋值(表2),数量性状进行质量化处理,即数量性状依均值(X)和标准差(σ)分为10级,1级Xi<X-2σ,10级Xi>X+2σ,中间每级间差0.5σ。Shannon-wiener(H)遗传多样性指数公式:H′=-∑Pi×ln Pi,其中Pi为某一性状第i级别时的频率[12]。
2 结果与分析
2.1 遗传多样性分析
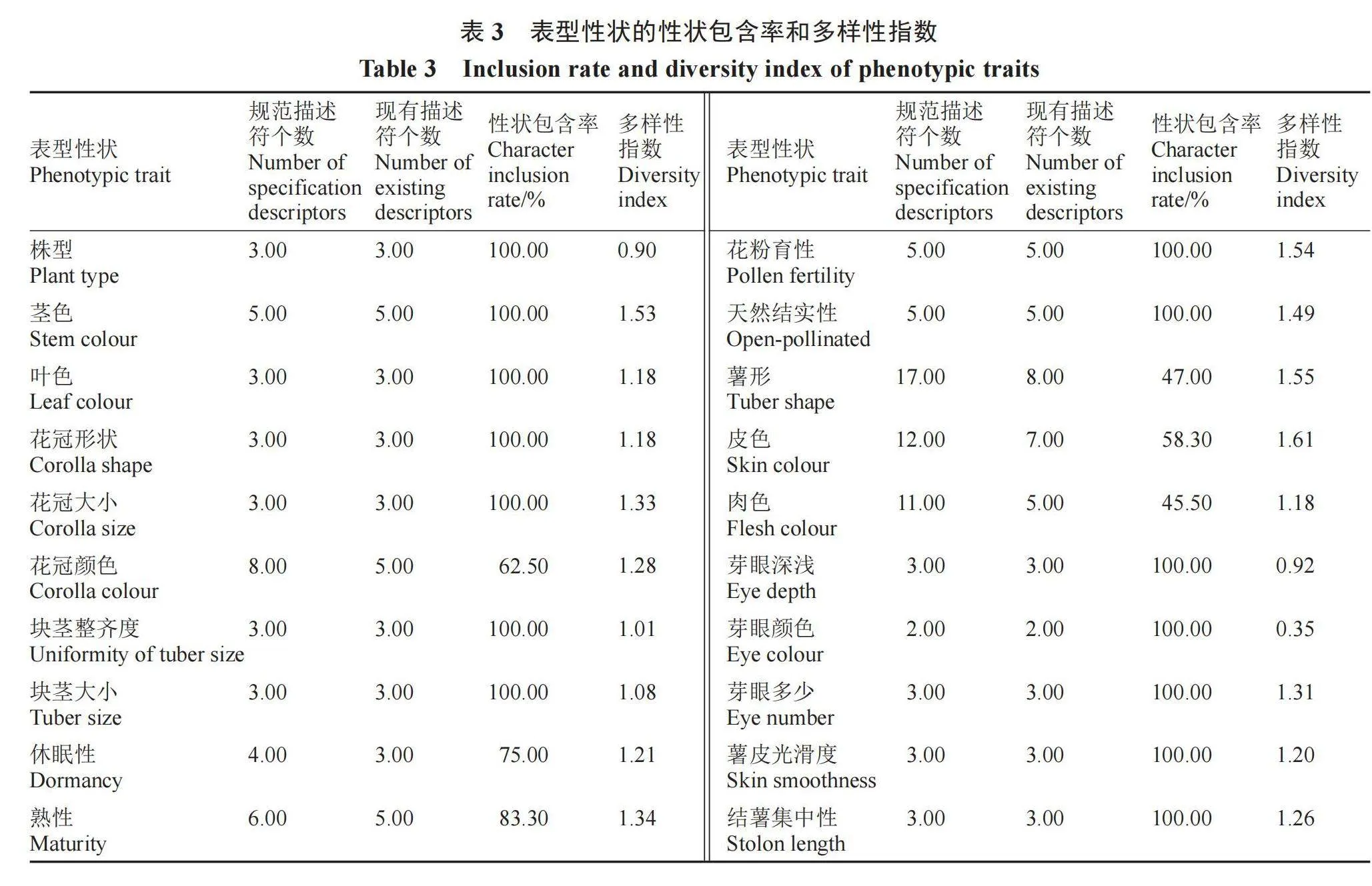
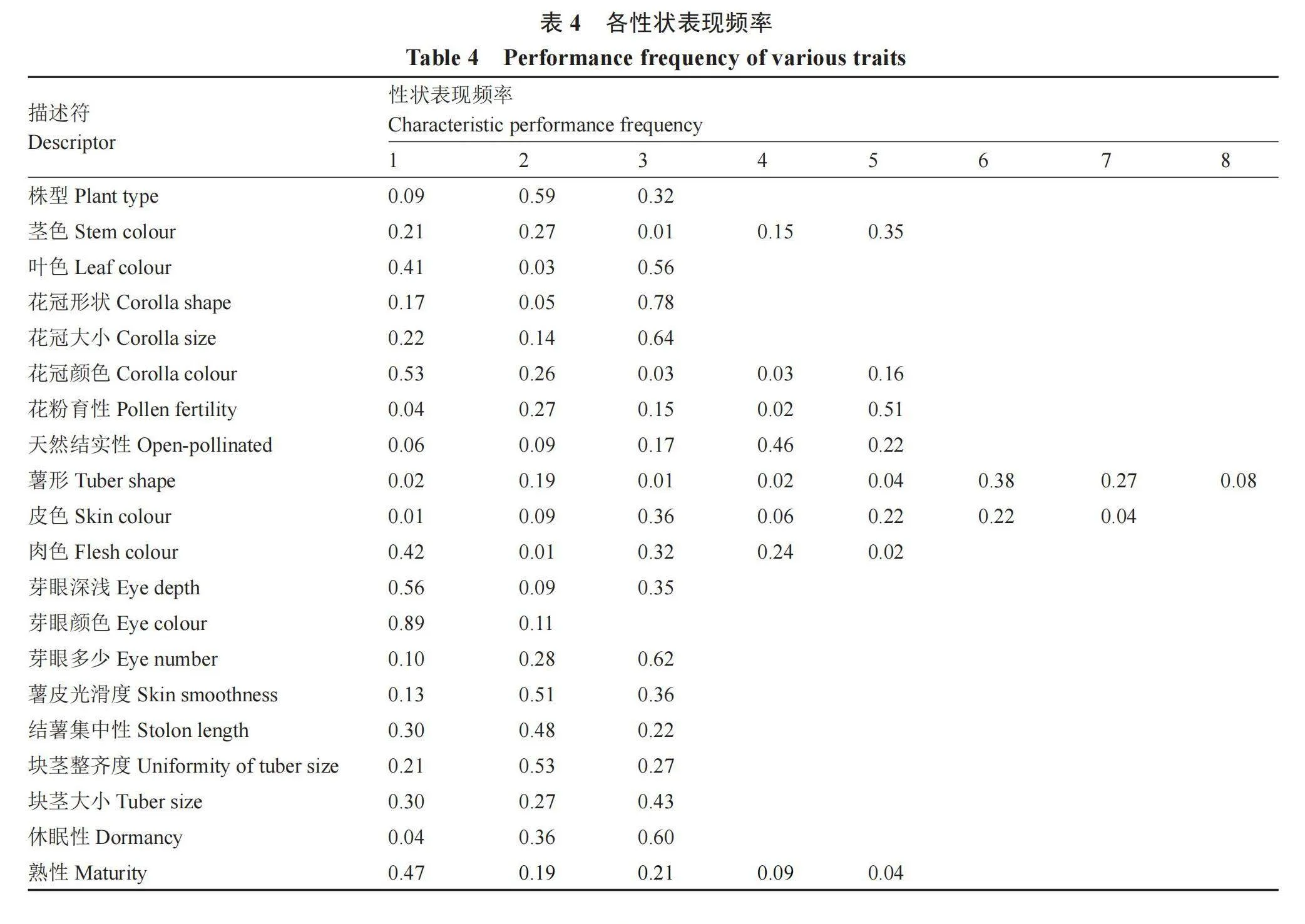
2.1.1 表型性状的遗传多样性分析 对117份马铃薯高抗晚疫病种质资源的20个描述性状进行统计分析,由表3可以看出,20个性状的各级别描述符基本都包括了马铃薯种质资源描述规范内记录的描述符,只有花冠颜色、薯形、皮色、肉色、休眠性和熟性没有包含全部的描述符,性状包含率在45.5%~83.3%之间,20个性状的遗传多样性指数变化范围为0.35~1.61,其中皮色的多样性指数最高,芽眼颜色的多样性指数最低。根据质量性状各级别的表现频率(表4)可知,117份高抗晚疫病种质资源,株型以半直立为主,茎色多为深色茎,叶色深绿,花多为中等大小的星形、白色花序,花粉育性中等,多数不结实,薯形多样,皮色表现从乳白到深紫的过渡色并且分布均匀,肉色较浅,芽眼浅无色,芽眼数中等,块茎光滑,结薯集中且整齐,以中大块茎为主,休眠性中等,多为中晚熟和晚熟品种。
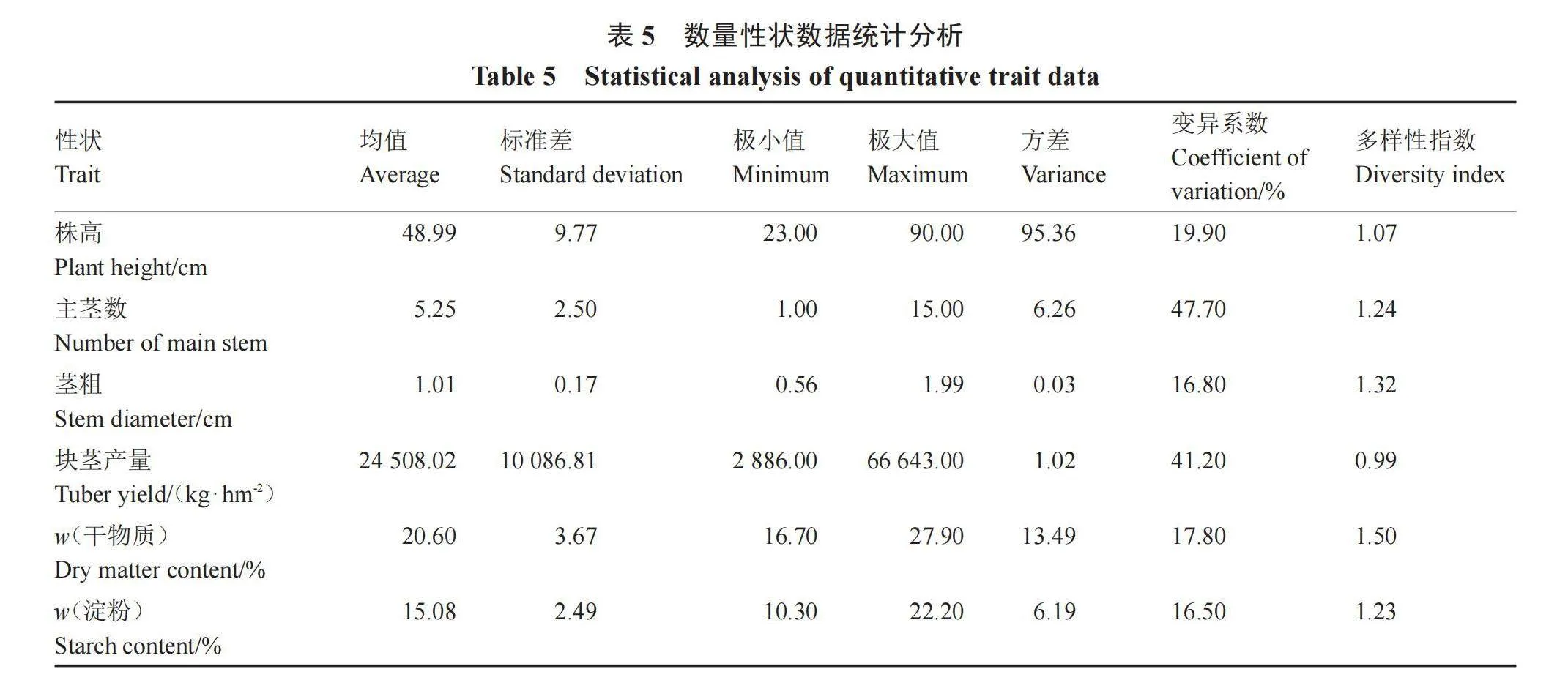
2.1.2 数量性状遗传多样性分析 对117份马铃薯种质资源的6个数量性状进行统计分析(表5),发现6个数量性状均存在不同程度的变异,变异系数范围在16.50%~47.70%,其中主茎数的变异系数最大,淀粉含量的变异系数最小,6个数量性状变异系数大小排序依次为主茎数>块茎产量>株高>干物质含量>茎粗>淀粉含量,遗传多样性指数变化范围为0.99~1.50,其中干物质含量最高,表明该性状的遗传多样性最丰富,块茎产量最低。变异系数和遗传多样性指数在各性状的表现不一致,如块茎产量变异系数较高,但多样性指数最小。
2.2 聚类分析
通过聚类分析(图1),可将整个高抗晚疫病初级核心种质分为4类,第Ⅰ类群共包含74份材料,占总材料的63.25%,主要包含来自国际马铃薯中心(CIP)、苏联、国内育成品种和地方品种,株型直立和半直立,平均株高48.28 cm,平均茎粗1.01 cm,茎色紫色居多,花色白色和紫色,花粉育性中等,天然结实性较低,皮色白色到紫色均有分布,多样性丰富,薯形多为椭圆、圆形和长筒形,肉色乳白或黄色,块茎大小中等,平均产量23 772 kg·hm-2,熟期为中晚熟和晚熟,包含4份中早熟材料,平均干物质含量21.00%,平均淀粉含量15.05%。第Ⅱ类包含19份材料,占总材料的16.24%,主要包含引自国外的品种,株型半直立,平均株高54.35 cm,平均茎粗1.00 cm,茎色多为褐色和紫色,叶色多为深绿色,花色白色和红紫色,薯形圆形和椭圆形,皮色包含红色、乳白和黄色,芽眼浅,薯皮光滑,块茎大小中等、整齐,平均产量35 949 kg·hm-2,熟性以晚熟为主,包含4份中早熟品种,平均干物质含量20.34%,平均淀粉含量14.78%。第Ⅲ类包含20份材料,占总材料的17.09%,包含引自CIP和国内育成品种,株型为半直立或直立,平均株高44 cm,平均茎粗0.99 cm,茎色多为褐色和紫色,叶色深绿色,花色白色和红紫色,薯形椭圆和圆形,皮色以红色和浅红色为主,肉色以黄色为主,芽眼较深,薯皮光滑,结薯分散不整齐,平均产量10yMymS6THU5aO3cwNQ0SkeXLifcqmalgl7jMKkdc9FHo= 099 kg·hm-2,休眠性长,熟性多为晚熟,平均干物质含量21.29%,平均淀粉含量15.54%。第Ⅳ类包含4份材料,分别是引自CIP的2份材料和国内育成的2个品种,占总材料的3.42%,株型为半直立,茎色绿色,叶色绿色,平均茎粗1.11 cm,平均株高57.59 cm,花色白色和紫色,黄皮黄肉,芽眼浅,块茎大并且整齐,平均产量56 923 kg·hm-2,熟性中晚熟,平均干物质含量20.19%,平均淀粉含量14.12%。
2.3 R8分子标记检测
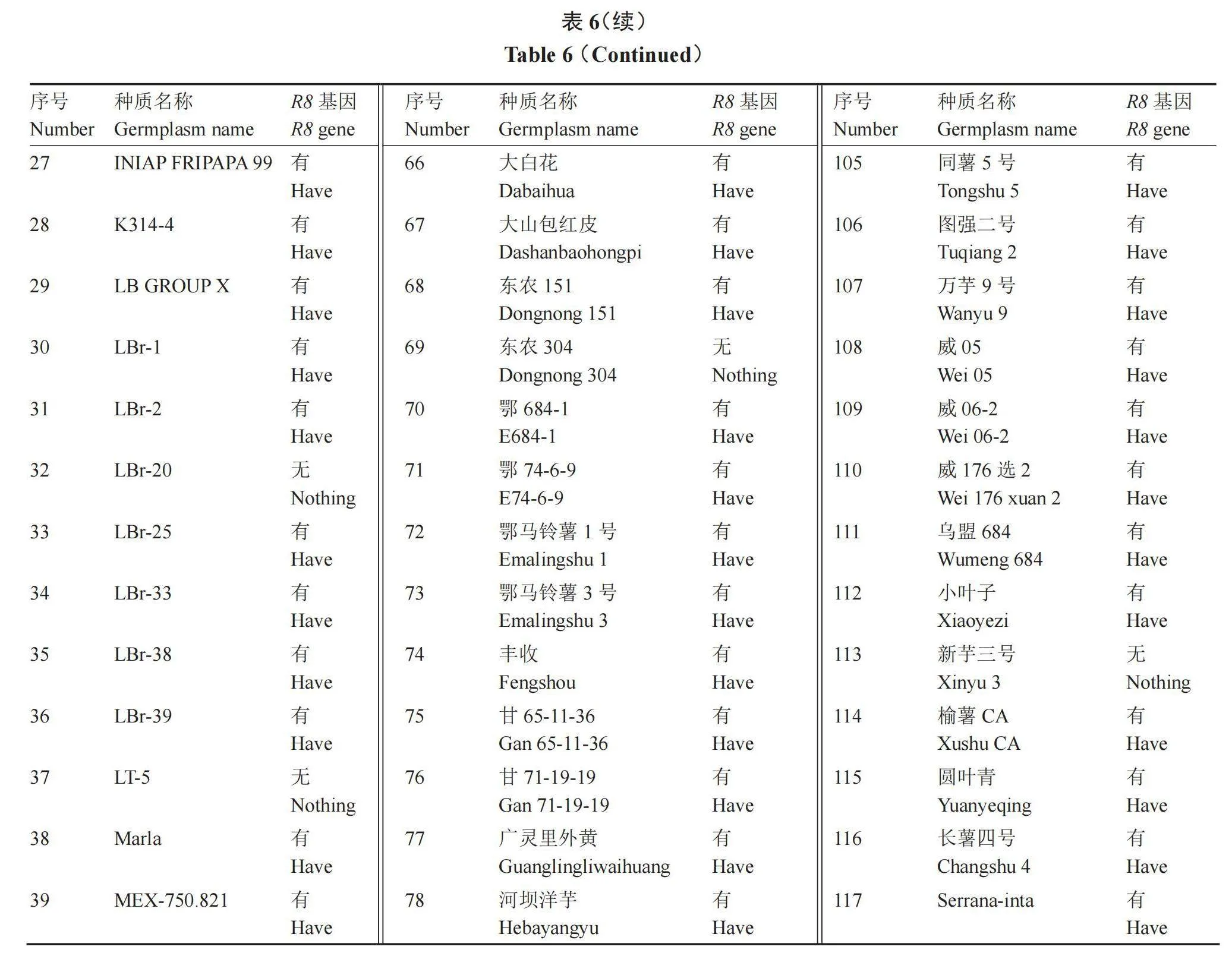
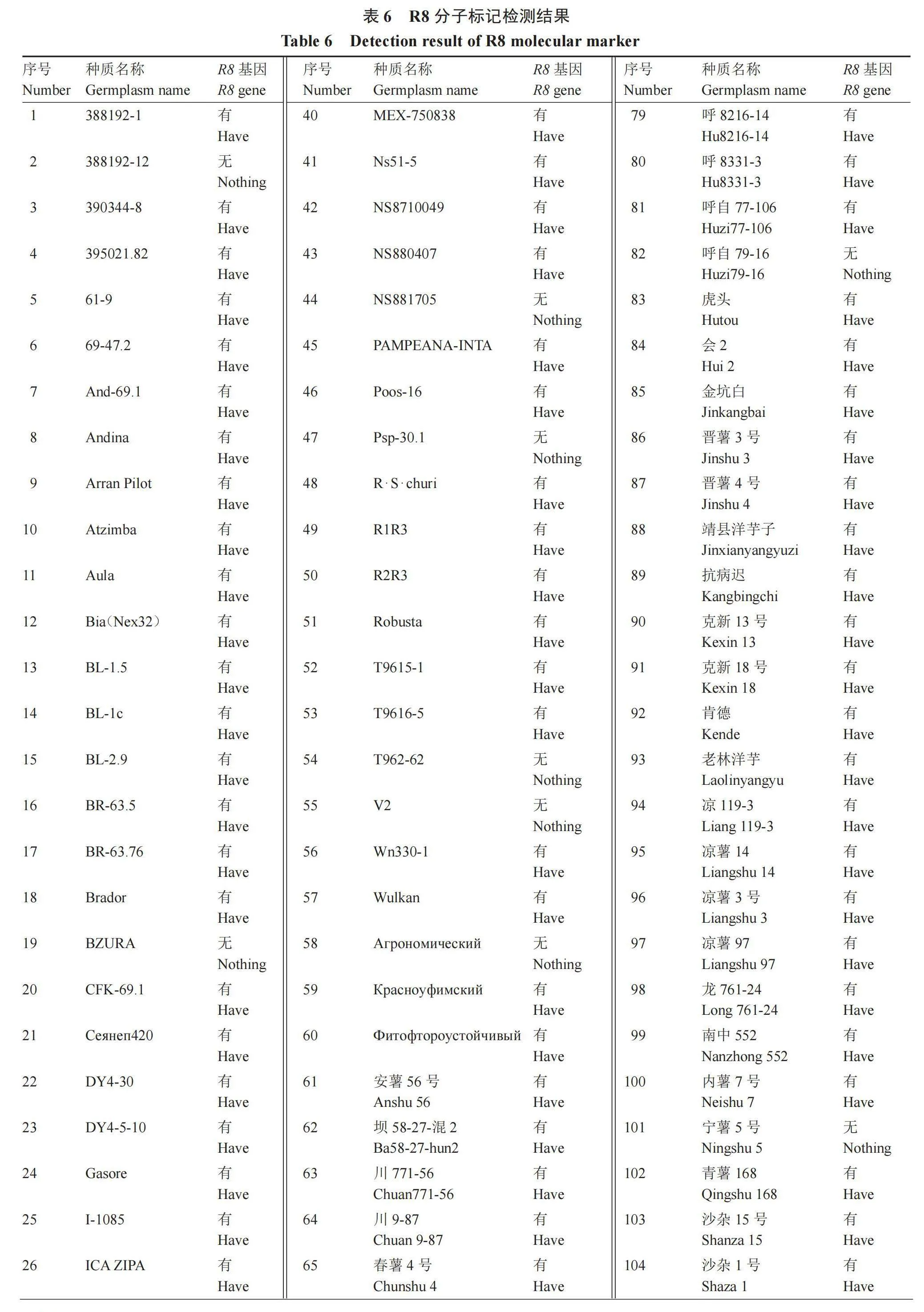
对117份高抗晚疫病马铃薯种质资源进行R8基因检测,发现含有R8分子标记的材料可以扩增出682 bp大小的特异性片段(图2),有13份材料未含有R8基因(表6),与晚疫病田间抗性鉴定结果符合率达到88.89%,说明R8分子标记鉴定结果与田间晚疫病抗性符合程度较高,鉴定结果较准确,同时也表明国内高抗晚疫病马铃薯材料多数含有R8基因,其中不含有R8基因的13份抗性材料,其抗性可能由其他抗性基因决定,有待进一步研究。
3 讨论与结论
笔者通过对117份高抗晚疫病马铃薯种质资源的遗传多样性分析,发现我国现有的高抗晚疫病马铃薯种质资源的性状,包含了马铃薯种质资源描述规范内记录的大多数描述符,只有一些稀缺和特异性状未包含在内,皮色、肉色和薯形性状包含率较低,这是根据育种目标长期人为选择造成的结果。通过性状的表现频率可以看出,我国现有高抗马铃薯晚疫病种质资源性状主要表现为:株型以半直立为主,茎色多为深色茎,叶色深绿,花多为星形、白色花序,花粉育性中等,多数不结实,薯形多样,皮色表现从乳白到深紫的过渡色并且分布均匀,肉色较浅,芽眼浅无色,芽眼数中等,块茎光滑,结薯集中且整齐,以中大块茎为主,休眠性中等,多为中晚熟和晚熟品种。
20个质量性状的遗传多样性指数变化范围为0.35~1.61,平均值为1.22,20个性状中10个性状的多样性指数大于平均值,其中皮色的多样性指数最高,芽眼颜色的多样性指数最低。数量性状的遗传多样性指数变化范围为0.99~1.50,其中干物质含量最高,块茎产量最低,变异系数范围在16.5%~47.7%,其中主茎数和块茎产量的变异系数都在40%以上,表明其受环境影响较大[13],淀粉含量变异系数最小。不同性状的变异系数和遗传多样性指数表现并不一致,如块茎产量多样性指数最低,但变异系数达到41.2%,主要原因是他们反映遗传变异的内涵不同,变异系数反映的是某一性状的变异范围,而多样性指数则指该性状的不同表现等级和数量分布[14]。
通过聚类分析将117份试验材料分为4类,第Ⅰ类包含材料比较丰富,这一类材料以国内外育成品种为主,受育种目标的影响,主要表现株高较矮,薯形规整,块茎整齐,熟性包括中早熟、中晚熟和晚熟品种,淀粉和干物质含量较高,整体性状表现优良,比较符合现有栽培品种的性状特点。第Ⅱ类材料主要表现为植株较高,茎色以紫色为主,产量性状表现较好,我国育成的生产上栽培面积较大的克新18号、青薯168、抗疫白和春薯4号被聚在这一类,可作为晚疫病抗性育种的直接亲本材料。第Ⅲ类资源主要性状表现为植株生长势较弱,主茎数较多,叶片小,晚熟,短日照类型较多,淀粉含量和干物质含量最高,可作为抗性育种的抗原材料。第Ⅳ类包含4份资源,其产量表现最高,可直接用于生产和作为育种亲本材料。通过聚类分析将117份试验材料根据表型特点、地理分布和亲缘关系进行了很好的区分,弥补了凭经验分类或以少数性状进行直观评价的不足,也为马铃薯杂交育种亲本选配提供了参考。
优异抗病种质资源是培育抗病品种的基础,现阶段抗病基因的发掘和多个抗病基因聚合是筛选和创造具有持久抗病性种质资源材料的重要手段,随着R1、R2、R3a、R3b、R8抗病基因的克隆,并开发了相应的分子标记应用于分子标记辅助育种,因此,聚合多个Rpi基因,尤其是广谱 Rpi基因,创造具有广谱抗性的遗传材料成为可能[15-22]。笔者通过对117份高抗晚疫病马铃薯种质资源进行R8基因检测,发现104份资源含有R8基因,与晚疫病田间抗性鉴定结果符合率达到88.89%,明确了104份高抗晚疫病种质资源具有R8抗病基因。田间表现高抗,检测结果不含有R8基因的13份材料,后续将采用多种晚疫病抗性基因进行检测,明确其抗性机制,筛选出含有更多抗性基因的抗晚疫病种质资源,为今后的马铃薯抗晚疫病聚合育种提供优异资源。
综上所述,117份高抗晚疫病马铃薯种质资源包含了马铃薯种质资源描述规范内记录的大多数描述符,质量性状遗传多样性指数变化范围为0.35~1.61,50%性状的多样性指数大于平均值,数量性状遗传多样性指数变化范围为0.99~1.50,变异系数范围在16.50%~47.70%,通过系统聚类将117份高抗晚疫病马铃薯种质资源分为4类,各类型群体特点鲜明,可应用于马铃薯晚疫病抗性育种及大田生产。通过R8抗性基因鉴定,117份试验材料中104份含有R8抗性基因,与晚疫病田间抗性鉴定结果符合率达到88.89%。研究结果可为高抗晚疫病马铃薯种质资源的高效利用提供理论依据。
参考文献
[1] 刘喜才,张丽娟,张文英.马铃薯种质资源描述规范和数据标准[J].北京:中国农业出版社,2006.
[2] 国家统计局[EB/OL].[2024-01-12].https://data.stats.gov.cn/.
[3] 高玉林,徐进,刘宁,等.我国马铃薯病虫害发生现状与防控策略[J].植物保护,2019,45(5):106-111.
[4] 侯忠艳.马铃薯晚疫病症状识别及综合防治措施[J].科技咨询导报,2007(20):247.
[5] 李洁,闫硕,张芳,等.近年来中国马铃薯晚疫病的时空演变特征及防控情况分析[J].植物保护学报,2021,48(4):703-711.
[6] 黄冲,刘万才.近几年我国马铃薯晚疫病流行特点分析与监测建议[J].植物保护,2016,42(5):142-147.
[7] 吴秋云,黄科,刘明月,等.马铃薯晚疫病抗病基因研究进展[J].中国马铃薯,2014,28(3):175-179.
[8] 徐进,朱杰华,杨艳丽,等.中国马铃薯病虫害发生情况与农药使用现状[J].中国农业科学,2019,52(16):2800-2808.
[9] JO K R,ARENS M,KIM T Y,et al.Mapping of the S. demissum late blight resistance gene R8 to a new locus on chromosome IX[J].Theoretical and Applied Genetics,2011,123(8):1331-1340.
[10] LINDQVIST-KREUZE H,GASTELO M,PEREZ W,et al.Phenotypic stability and genome-wide association study of late blight resistance in potato genotypes adapted to the tropical highlands[J].Phytopathology,2014,104(6):624-633.
[11] 刘勋,郑克邪,张娇,等.马铃薯晚疫病抗性基因分子标记检测及抗性评价[J].植物遗传资源学报,2019,20(3):538-549.
[12] 段绍光.马铃薯种质资源遗传多样性评价和重要性状的遗传分析[D].北京:中国农业科学院,2017.
[13] 全成哲,李淑芳,李鹤南,等.吉林省73份审定水稻品种的表型性状遗传多样性研究[J].作物杂志,2024(3):64-75.
[14] CARMANOA S,ALVAREZ J B,CABALLERO L.Genetic diversity for morphological traits and seed storage proteins in Spanish rivet wheat[J].Biology Plantarum,2010,54(1):69-75.
[15] BAB9uW6wlALKGyOhQlfBmoC4dkHARExMYaeNkLwL1zBmY=LLVORA A,ERCOLANO M R,WEISS J,et al.The R1 gene for potato resistance to late blight (Phytophthora infestans) belongs to the leucine zipper/NBS/LRR class of plant resistance genes[J].Plant Journal,2022,30(3):361-351
[16] LOKOSSOU A A,PARK T,ARKEL G V,et al.Exploiting knowledge of R/Avr genes to rapidly cloneanew LZ-NBS-LRRfamily of late blight resistance genes from potato linkage group IV[J].Molecular Plant-Microbe Interactions,2009,22(6):630-641.
[17] HYOUN J K,HEUNG R L,KWANG R J,et al.Broad spectrum late blight resistance in potato differentialset plants Ma R8 and Ma R9 is conferred by multiple stacked R genes[J].Theoretical and Applied Genetics,2012,124(5):923-935.
[18] JIANG R,LI J,TIAN Z,et al.Potato late blight field resistance from QTL dPI09c is conferred by the NB-LRR gene R8[J].Journal of Experimental Botany,2018,69(7):1545-1555.
[19] 李红军.分子标记辅助选择创制聚合晚疫病抗病基因Pta1和R8的马铃薯种质[D].武汉:华中农业大学,2023.
[20] 聂佳惠.R8分子标记辅助选择马铃薯晚疫病抗性单株[D].武汉:华中农业大学,2022.
[21] 李锟.马铃薯广谱Rpi基因分子标记辅助选择及抗性种质创制[D].昆明:云南农业大学,2023.
[22] 刘程,王世尧,史伟玲,等.马铃薯抗晚疫病基因R8、RB和抗病毒病基因Rx1、Ryadg的多重PCR检测[J].园艺学报,2021,48(2):389-396.
