番茄异胡豆苷合成酶基因的全基因组鉴定和表达分析
2024-09-25范冰丽唐光彩马星云贾芝琪高艳娜张世文





摘 要:异胡豆苷合成酶(strictosidine synthetase,STR)作为单萜吲哚类生物碱合成过程的关键酶,对吲哚类生物碱的合成起决定性作用。目前茶树、拟南芥等植物中已有相关研究证明STR基因在逆境胁迫中发挥重要功能,但在番茄中仍未有研究。为研究番茄中STR基因的功能,笔者从番茄基因组中鉴定出14个异胡豆苷合成酶基因(SlSTR1~14),并对其理化性质、基因结构、系统进化及表达模式进行分析。理化分析结果表明,除SlSTR8、9、11、12和14为疏水性蛋白外,其余SlSTR均为亲水性蛋白,亚细胞定位预测显示所有SlSTR均位于液泡中。亲缘关系分析结果表明,番茄、拟南芥、水稻和茶树中的STR家族基因不均匀地分布在6个类群中。顺式作用元件分析表明,SlSTR启动子区含有胁迫和激素响应有关的多种调控元件。基因表达分析结果表明,SlSTR基因主要在番茄茎、叶和花组织中表达。对番茄苗分别进行干旱与高温处理,结果表明,相较于处理前大部分基因在处理后表达量均显著升高,少数基因如SlSTR1、2、8在干旱处理后表达量显著降低,SlSTR8、11和12在高温处理后表达量显著降低,这表明STR基因家族在面对不同逆境胁迫时,其表达模式是不同的。
关键词:番茄;异胡豆苷合成酶;鉴定;表达分析
中图分类号:S641.2 文献标志码:A 文章编号:1673-2871(2024)09-027-10
Genome-wide identification and expression analysis of the strictosidine synthetase genes in tomato
FAN Bingli, TANG Guangcai, MA Xingyun, JIA Zhiqi, GAO Yanna, ZHANG Shiwen
(College of Horticulture, Henan Agricultural University/International Joint Laboratory of Horticulture, Zhengzhou 450046, Henan, China)
Abstract: As a key enzyme in monoterpene indole alkaloids biosynthesis, strictosidine synthetase(STR)plays a decisive role in the synthesis of indole alkaloids. At present, there are some reports about the STR genes function in Camelliasinensis, Arabidopsis thaliana and other plants under adversity stress. But the related studies have not been reported in tomato. In order to study the function of STR genes in tomato, 14 strictosidine synthase genes (SlSTR1-14)were identified from tomato genome, and their physicochemical properties, gene structure, phylogenetic evolution and expression patterns were also analyzed. The result of physicochemical analysis showed that all SlSTR except SlSTR8, 9, 11, 12 and 14, were hydrophilic proteins, and subcellular localization prediction showed that all SlSTR were located in vacuoles. Phylogenetic analysis showed that STR famliy genes were unevenly distributed in VI groups of Solanum lycopersicum, Arabidopsis, Oryzasativa and Camelliasinensis. Cis-acting element analysis showed that the promoter regions of SlSTR genes contain several regulatory elements related to stress and hormone responses. The results of gene expression analysis showed that SlSTR genes were mainly expressed in the stem, leaf and flower tissues of tomato. Drought and high-temperature treatments were applied to tomato seedlings, and the results showed that, compared to before treatment, the expression levels of most genes significantly increased after treatment. However, a few genes such as SlSTR1, 2, and 8 showed significantly decreased expression levels after drought treatment, while SlSTR8, 11, and 12 showed significantly decreased expression levels after high-temperature treatment. This indicates that the expression patterns of the STR gene family are different when facing different adversity stresses. The results of this study identified the physicochemical information of STR genes in tomato, and provided the direction for further research, the specific gene function still needs further verification.
Key words: Tomato; Strictosidine synthetase; Identification; Expression analysis
收稿日期:2024-06-12;修回日期:2024-07-14
基金项目:国家自然科学基金青年基金项目(31902024);河南省科技攻关项目(212102110413);河南农业大学博士启动基金项目(30500495)
作者简介:范冰丽,女,在读硕士研究生,主要从事番茄成熟发育的研究。E-mail:1425296363@qq.com
通信作者:张世文,女,讲师,主要从事番茄成熟发育的研究。E-mail:swzhang@henau.edu.cn
番茄(Solanum lopesicum)属于茄科番茄属,是植物分子遗传学研究的模式植物[1-2],在2011年已经完成基因组全序列测定工作[3]。番茄作为重要的园艺作物,有极高的经济价值,在生长发育过程中易遭受非生物逆境胁迫,严重影响其产量和品质,造成巨大的经济损失。随着全球气候变暖及气候异常现象增多,高温及干旱等逆境胁迫给番茄种植带来的挑战也越来越大,因此挖掘番茄抗逆特别是抗高温、干旱胁迫的基因具有重要意义[4-5]。现已在番茄中发现了多个参与逆境调控的基因家族,如HMA、ZIP和PLC等[6-8],但仍有许多未知基因需要探索。
萜类吲哚生物碱(terpenoid indole alkaloids,TIAs)是由萜类和吲哚类共同组成的重要植物次级代谢产物,是一大类有着重要药用价值的生物碱[9-10]。异胡豆苷合成酶(STR)是单萜吲哚类生物碱合成过程中发挥重要作用的酶类之一,由其转化而来的萜类吲哚生物碱具有极为广泛的生物学活性,各种TIAs在多种酶类的参与下由异胡豆苷转化而来。因此STR是吲哚类生物碱合成途径的重要前提,在TIAs代谢过程中发挥着重要作用[10-11]。
STR基因最早是从萝芙木[12]和长春花[13]中克隆得到并通过原核表达确定了其功能及表征。随后,陆续从茶树、拟南芥、水稻等植物中克隆得到了STR基因,经过一系列的研究表明,STR基因在植物逆境胁迫中发挥重要作用[14-16]。对铁皮石斛STR基因的启动子分析表明,STR基因具有茉莉酸甲酯(MejA)响应元件,对同一生长环境下的铁皮石斛幼苗给予逆境胁迫,发现在处理早期,幼苗中STR基因表达量明显上调。对长春花叶片进行干旱模拟和NaCl处理后,发现STR基因的表达量会随着胁迫时间的延长、胁迫强度的增强而有所提高,但在低温处理条件下则会下调表达[17-19]。周棋赢等[20]研究表明,茶树STR基因的表达受低温、干旱、盐胁迫以及茉莉酸甲酯的调控。目前关于水稻[16]、长春花[17]以及茶树[20]等作物中STR基因的进化关系、理化信息以及调控网络等已经有了较全面的阐释,但还未见从番茄中克隆该基因的相关报道,因此在番茄中开展STR基因的研究具有重要意义。
笔者利用已分离的番茄STR基因编码的氨基酸序列,以及番茄基因组数据库的信息,通过BLAST查找比对,共获得了14个番茄STR基因家族成员,对其进行生物信息学、启动子响应元件、系统进化及表达模式等分析,以期为研究番茄STR基因的结构和功能提供参考信息,也为阐明STR基因家族在番茄生长发育过程中的调控作用奠定理论基础。
1 材料与方法
1.1 材料
试验于2024年2-5月在河南农业大学园艺学院实验平台进行。试验材料栽培番茄Ailsa Craig(AC)由河南农业大学园艺学院茄科作物基因组与分子育种实验室收集保存。番茄苗置于人工气候室长日照培养架(28 ℃,16 h 光照/8 h黑暗)上培养,40株AC苗分为2组,每组20株,分别进行干旱与高温胁迫处理,采取随机区组法取样,每个处理设置3次重复。
1.2 方法
1.2.1 SlSTR基因的鉴定和理化性质分析 根据目前已报道的STR基因序列信息,同时在NCBI网站(https://www.ncbi.nlm.nih.gov/)和SGN数据库(https://Sol genomics Net)中查找STR基因在番茄中的同源序列。合并两次搜索结果,去除重复后共有14个STR基因,利用ExPASy网站(http://web.expasy.org/protparam/)对14个基因的物理特性进行分析。利用pLoc-mPlant(http://www.jci-bioinfo.cn/pLoc- mPlant/)在线工具对SlSTR蛋白的亚细胞定位进行预测。
1.2.2 SlSTR基因多序列比对及系统进化树构建 从基因组数据库网站分别获取拟南芥(https://www.arabi- dopsis.org/)、水稻(https://www.arabidopsis.org/)和茶树(http://.ricedata.cn/gene//)的STR氨基酸序列[20-22]。利用MEGA7软件进行序列分析,采用邻接法(neighbor-joining method)构建系统进化树[23],Bootstrap重复设置为1000次。使用DNAMAN软件进行氨基酸序列比对。
1.2.3 SlSTR基因结构和氨基酸保守结构域分析 应用MEME5.5(https://meme-suite.org/tools/meme)在线工具,对SlSTR氨基酸的保守基序进行预测分析,参数设置为E-value≤0.05,Maximum width=15。根据SGN基因组数据库中SlSTR基因的碱基序列,利用GSDS2.0(https://gsds.gao-lab.org/)在线工具对SlSTR基因的结构进行分析并作图。
1.2.4 SlSTR基因启动子顺式作用元件分析 利用Phytozome(https://Phytozome -next.jgi.doe.gov)获取SlSTR基因起始密码子ATG上游2000 bp的DNA序列。利用TBtools工具对SlSTR基因启动子的顺式作用元件进行分析[24]。
1.2.5 SlSTR基因转录因子的预测 从番茄基因组数据库分别获取14个SlSTR基因起始密码子ATG上游600 bp的DNA序列,使用PlantRegMap(http://plantregmap.cbi.pku.edu.cn/)工具对与之结合的转录因子进行预测分析,设置阈值为p≤1e-5。词云由派森诺基因云在线网站(https://www.gene scloud.cn/)制作而成[25]。
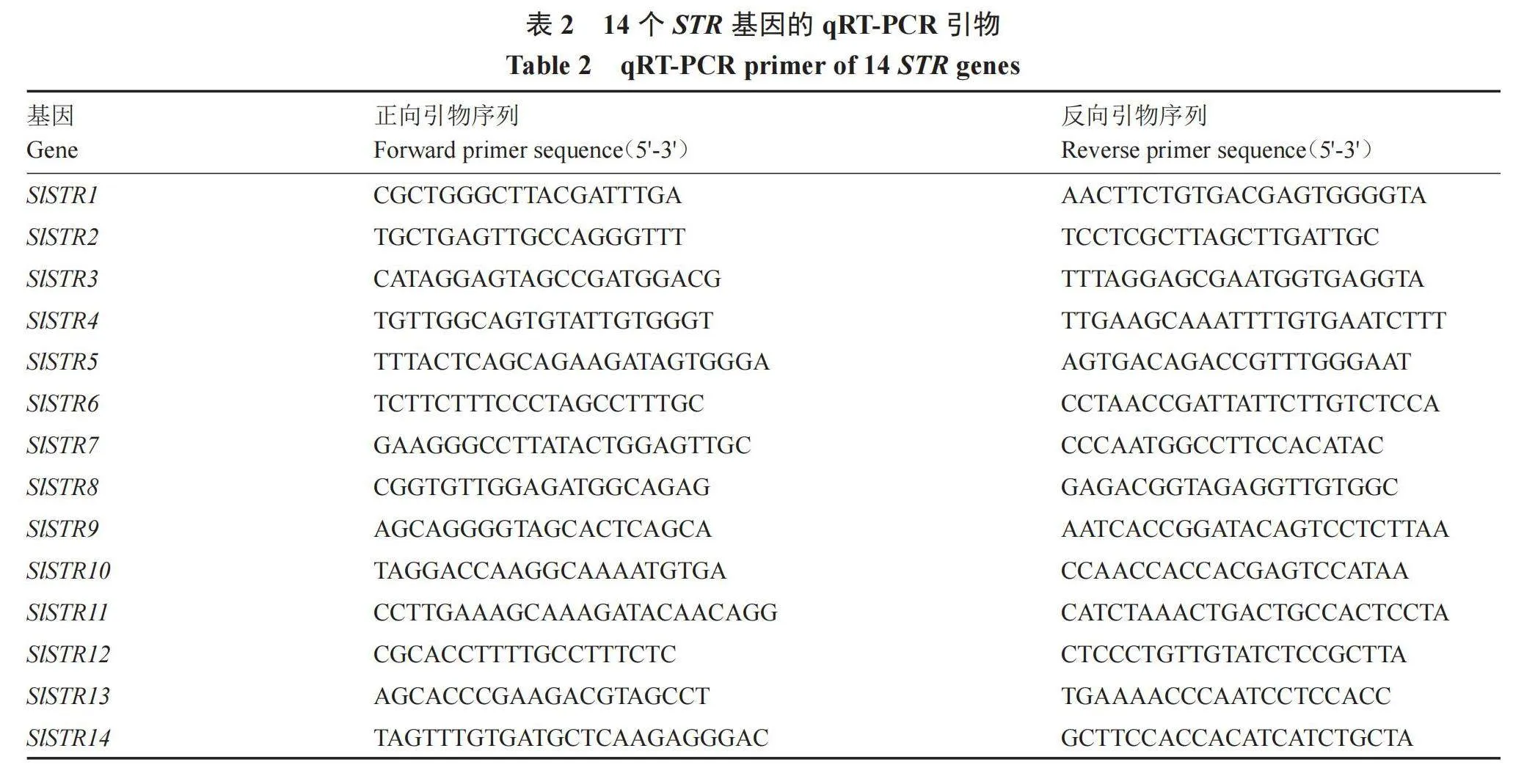
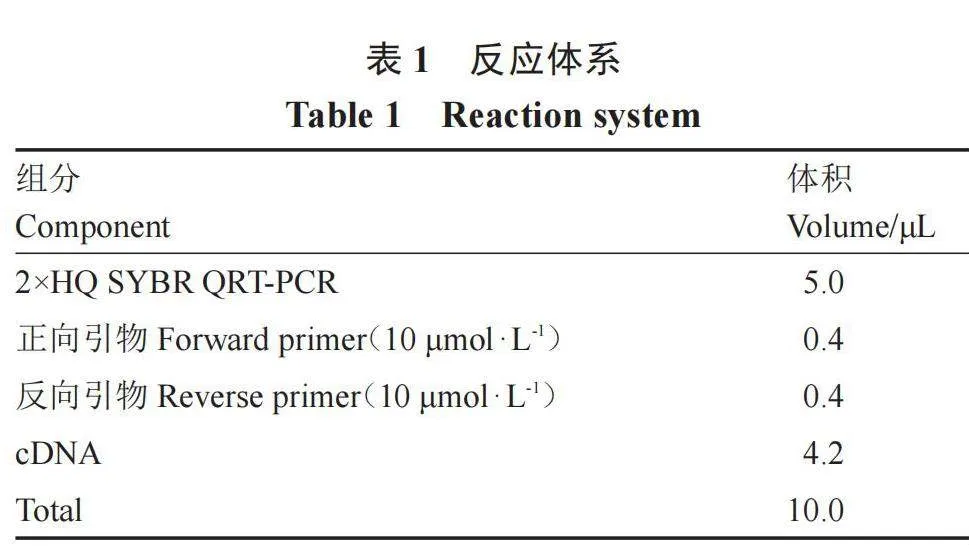
1.2.6 cDNA制备与qRT-PCR定量分析 以长势良好已结果实的AC番茄植株的根、茎、叶、花和绿熟果组织为模板,采用华越洋RNA提取试剂盒(华越洋,北京)提取总RNA,并利用莫纳的反转录试剂(莫纳,苏州)将RNA反转录为cDNA,每次检测设置3个生物学重复和3个技术重复,qRT-PCR反应过程在CFX96(Bio-Rad,美国)仪器上进行。其反应体系见表1,内参引物用Action[26]。利用TBtools工具将结果制作成热图。基因引物信息见表2。
1.2.7 SlSTR基因的表达分析 以AC番茄苗为材料,待幼苗生长至4叶1心时,选择长势一致的番茄幼苗进行胁迫处理。干旱胁迫:将幼苗浇透水后开始控水,期间不浇水,直至出现萎蔫表型;高温胁迫:将幼苗放入50 ℃的烘箱中处理2 h。处理前后分别取3棵不同植株同一部位上的叶片为样品,提取RNA并反转录为cDNA,以cDNA为模板进行qRT-PCR检测,反转录体系和定量引物分别见表1和表2。利用软件GraphPad Prism 8.2绘制柱形图,并利用SPSS软件进行差异显著性分析。
2 结果与分析
2.1 SlSTR基因家族及其分子特征
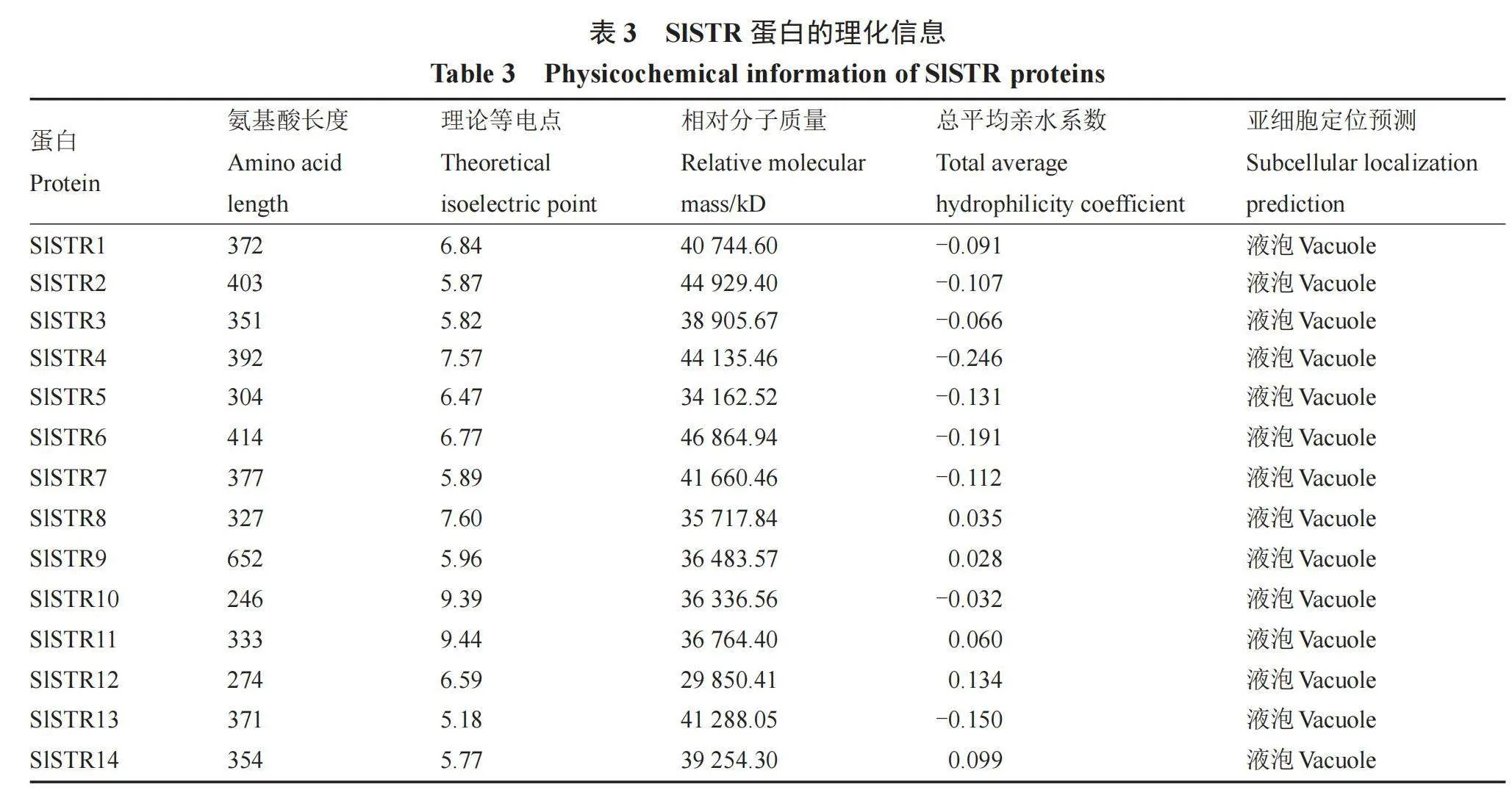
笔者首先对14个STR基因的理化特性进行了分析,结果表明(表3),SlSTR的氨基酸长度最短为246,最长为652,其中SlSTR6相对分子质量最大,SlSTR12最小,分别为2.98 kD和4.68 kD。从等电点的分析结果来看,SlSTR蛋白的等电点大小处于5.18~9.44之间。SlSTR1~7、10和13蛋白的平均亲水系数小于0,表明这些SlSTR蛋白可能为亲水性蛋白;而其他SlSTR蛋白的平均亲水系数大于0,说明这些蛋白可能为疏水性蛋白;亚细胞定位预测的结果表明,SlSTR蛋白都定位于液泡中。
2.2 SlSTR氨基酸的多序列比对及系统进化树构建
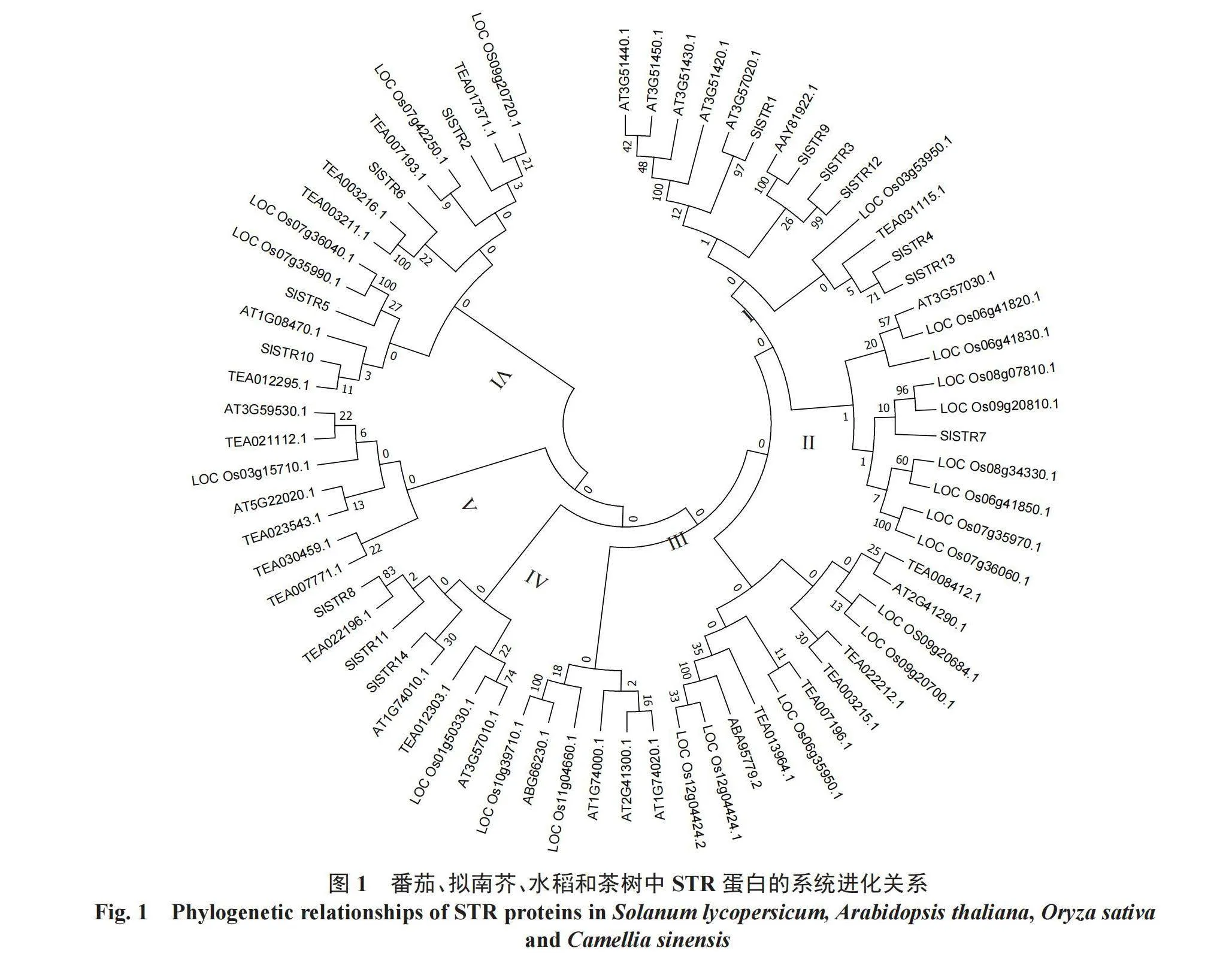
为了进一步了解STR在不同物种中的进化情况,将番茄与拟南芥、水稻和茶树的STR氨基酸序列进行了系统进化树构建。结果如图1所示,STR蛋白分为了六大类群(I~Ⅵ),在类群I~Ⅵ中都有拟南芥和水稻STR的分布,茶树中CsSTR蛋白除了在类群III中没有分布外,在其他类群中均有分布。番茄中的STR蛋白,有6个成员(SlSTR1、3、4、9、12、13)分布在类群I中,有1个成员(SlSTR7)位于类群II中,有3个成员(SlSTR8、11、14)分布在类群IV中,有4个成员(SlSTR2、5、6、10)分布在类群Ⅵ中,从中可以看出,几个物种的STR分布并不集中,物种彼此之间联系密切,为后续研究提供了依据。多序列比对结果如图2所示,14个SlSTR氨基酸序列同源性相对较低,这表明他们之间可能存在进化差异,从而导致功能的差异。
2.3 SlSTR基因结构和氨基酸基序
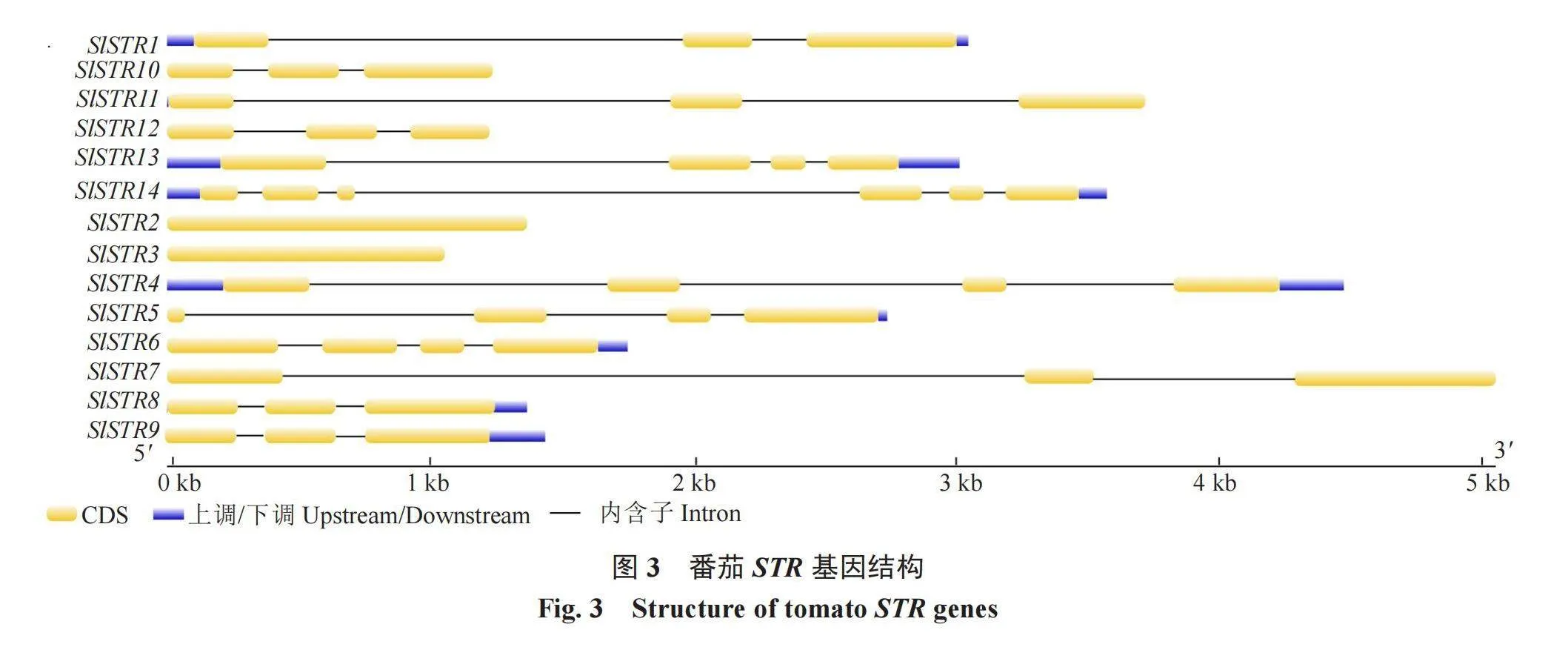
笔者进一步对SlSTR基因结构进行了分析,结果表明(图3),SlSTR2、3、7、10~12基因均不含内含子,除SlSTR14外,其他基因各含有3~4个外显子,其中SlSTR1、SlSTR7~12这几个基因含有3个外显子,SlSTR4、SlSTR5、SlSTR6和SlSTR13这4个基因含有4个外显子。编码区保守基序的分析结果表明(图4),14个SlSTR基因的保守基序类型和数量都不一致,且由于14个基因间的氨基酸序列同源性相对较低,位于同一类群亲缘关系较近的几个基因间的基序类型和数量也存在很大差异,保守基序的排列与出现顺序也不一致,这表明他们可能经历了不同的进化事件,在功能上可能也存在差异。
2.4 SlSTR基因启动子的顺式作用元件
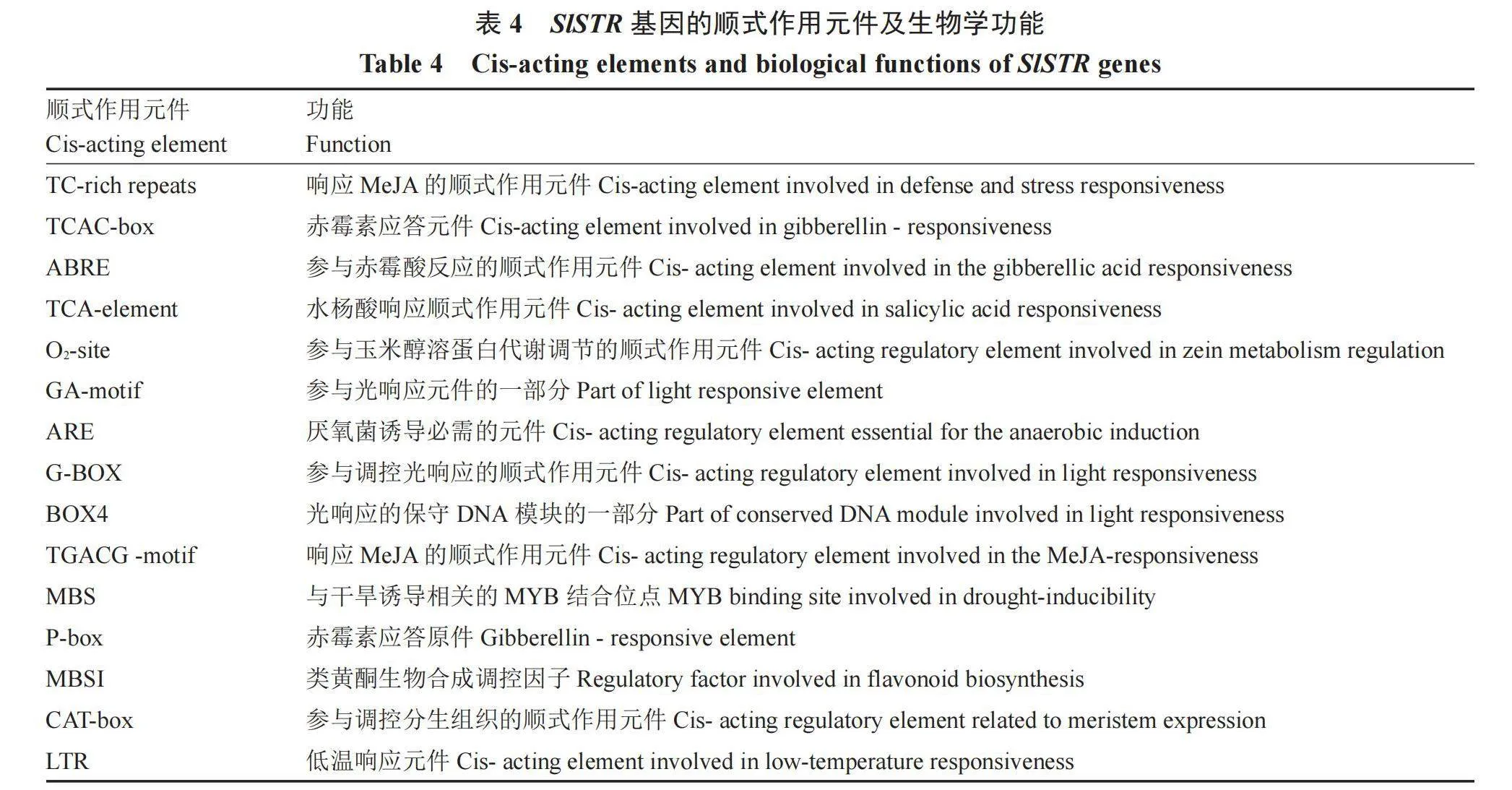
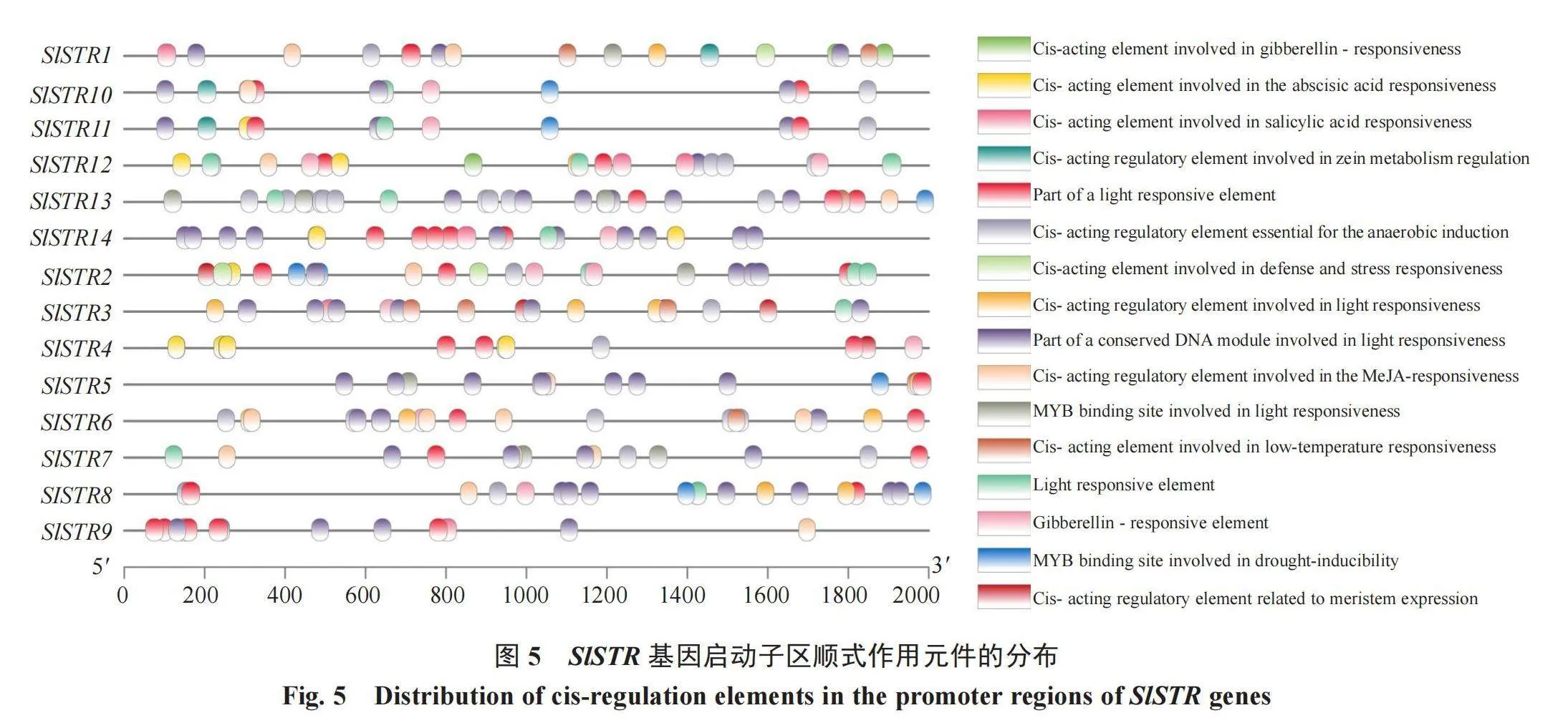
SlSTR基因的启动子区域包含30个不同的顺式作用元件(图5);其中高频率出现的顺式作用元件有18个,如ARE、TGACG、LTR等被报道分别与厌氧菌诱导、MeJA反应和低温响应等调控相关,除此之外,还有一些与激素和逆境相关的元件,如TCAC-box是赤霉素的应答元件(表4)。这些结果也表明SlSTR可能参与了相关路径的功能调控。
2.5 SlSTR转录因子的词云分析
为了进一步找到STR基因的上游转录因子,笔者首先对其转录因子进行了预测(图6),结果表明,与14个番茄STR基因调控相关的转录因子多达23种,MYB、TCP、ERF和BBR-BPC是与其结合较多的几个基因家族,其中以ERF基因家族的数量最多。根据已有报道,TCP、ERF和MYB等在参与调控植物生长发育及胁迫应答等方面发挥功能,这意味着位于其下游的SlSTR基因可能同样在这些路径中发挥重要作用。
2.6 SlSTR基因组织表达分析
为了探究STR基因在番茄各组织中的表达模式,对14个基因在AC番茄植株根、茎、叶、花和绿熟果这5个组织中的表达量进行了分析(图7),从结果可以看出,SlSTR6和SlSTR8基因在叶片中的表达高于其他基因,SlSTR2、SlSTR6、SlSTR10和SlSTR14在茎中的表达量相对较高,SlSTR3、SlSTR4、SlSTR6、SlSTR11和SlSTR12在花中的表达量相对较高,而SlSTR4、SlSTR5和SlSTR6在果实中的表达量相对较高。基因表达量较高的部位预示了其可能在该部位发挥重要功能,不同SlSTR基因在各组织中表达量的不同也说明他们在番茄中可能发挥了不同的调控作用。
2.7 SlSTR基因在逆境胁迫下的表达分析
为了进一步验证14个SlSTR基因是否参与了逆境胁迫,对AC番茄苗分别进行了干旱和高温逆境处理,并对其相对表达量进行分析,其中干旱及高温处理分别以各处理前STR1的相对表达量作为对照。结果表明(图8),干旱处理后SlSTR3~5、7、9~14基因的表达量显著升高,SlSTR1、2、8显著降低,高温处理后SlSTR1~6、9、10和14的表达量显著升高,而SlSTR8、11和12的表达量则显著降低。这表明SlSTR基因家族确实参与了高温及干旱的逆境胁迫,且他们在参与不同逆境胁迫时各基因的表达模式是不同的,说明他们在参与逆境胁迫时可能发挥了不同的功能。
3 讨论与结论
番茄在整个生长过程中会受到各种逆境胁迫的影响。高温胁迫会导致番茄植株萎蔫,影响其开花坐果,进而影响其产量及果实品质,而干旱胁迫是一个世界性问题,威胁着作物的生长和产量,阻碍了现代农业的可持续发展[27-28]。植物中围绕异胡豆苷合成酶基因展开的研究较多,且目前的研究表明,其在植物抗逆中发挥重要功能,但是关于番茄STR(SlSTR)基因家族还没有相关报道,因此,在番茄中研究其生物学功能具有重要意义。
笔者从番茄基因组中共鉴定出14个STR基因,这与模式植物拟南芥中的15个、茶树中的17个以及水稻中的21个STR基因数量非常相近[14-16],这一结果也从侧面表明了STR基因的数目在进化中是较为保守的。通过理化分析和系统进化树构建,发现14个SlSTR氨基酸序列同源性相对较低,几个物种中的STR分布并不集中,物种彼此之间联系密切。亲缘关系较近的几个SlSTR基因,如分布在类群III中的SlSTR8、SlSTR11和SlSTR14,他们的基因结构和氨基酸保守序列并不一致,这表明他们在基因的表达调控上可能存在着一定的差异。亚细胞定位结果预测表明,STR家族14个基因均定位于液泡中,而液泡在调节细胞渗透压、提供结构支持、协助细胞长大等方面发挥重要功能,说明STR基因很可能通过对细胞的调节作用来发挥抗逆功能。
SlSTR基因的启动子区含有许多与逆境胁迫以及生长发育相关的顺式作用元件,且与其结合的上游转录因子在植物生长发育及胁迫应答的调控等方面发挥作用,包括MeJA、MBS和ARE等,这也表明了SlSTR基因可能参与其应答机制[29-30]。SlSTR基因在番茄各组织中的表达量各不相同,主要集中在茎、叶和花这些组织中表达,说明SlSTR基因主要在这些组织中发挥功能。其中SlSTR4和SlSTR6在番茄的花及果实中的表达量较高,且他们的启动子区域大都含有ARE、MBS和LTR等激素响应的元件,这说明他们可能特异地参与番茄花、果实的发育调控,这也是该类基因在以往研究中未曾报道的功能。从词云的分析结果可以看出,SlSTR基因上游具有MYB、ERF和TCP等结合位点,这些转录因子在植物发育过程中发挥着重要作用[30-32]。随着全球气候变暖、气候异常现象增多,高温及干旱逆境胁迫对番茄的生长发育造成了巨大影响,因此笔者重点针对高温及干旱这2种逆境胁迫进行了研究。对AC幼苗进行高温及干旱处理后,发现这14个基因在不同逆境胁迫下表达模式是不同的。干旱处理后SlSTR3~5、7、9~14基因的表达量显著升高,SlSTR1、2、8显著降低,高温处理后SlSTR1~6、9、10和14的表达显著升高,而SlSTR8、11和12的表达量则显著降低,研究结果表明这些基因很可能参与了干旱及高温的调控通路。SlSTR6基因在高温处理后显著升高而在干旱处理后没有发生明显改变,而SlSTR7和13这2个基因与SlSTR6相反,他们在干旱胁迫后表达量显著升高而在高温处理后表达量没有明显改变,说明这几个基因可能单方面参与番茄的高温或干旱逆境胁迫响应。研究结果为后续针对番茄抗高温及干旱胁迫基因的挖掘奠定了基础。
目前有一些已克隆的STR基因,如拟南芥的AT3G51420.1、AT3G51430.1、AT3G51440.1和AT3G51450.1基因处于进化树I类群中,其在防卫反应中发挥着重要功能,水稻LOC_Os03g15710.1基因位于Ⅴ类群中,参与了雄蕊的器官发育[20]。虽然STR是促进TIA合成的关键酶类之一,且在植物的抗逆反应中有重要作用,但其在番茄中的具体生理作用尚不清晰。有哪些基因能够真正促进番茄异胡豆苷的合成?哪些SlSTR基因能够参与番茄逆境反应、花芽及果实发育,其作用机制是什么,如何来发挥功能?这些问题仍需要进一步探索。
综上所述,番茄STR基因家族各基因间在物理信息、氨基酸结构以及顺式作用元件调控等方面都不尽相同,不同SlSTR基因在不同的植物组织中有不同的特异性表达模式,同时在面对干旱和高温逆境胁迫时也有着不同的响应,表明该基因家族内不同基因所发挥的功能也有所差异。番茄STR家族各基因的不同特性为进一步深入探究其基因功能及调控网络奠定了基础。
参考文献
[1] 孟兰环.转录因子SlBEL11调控番茄果实叶绿素代谢和成熟的分子机制研究[D].北京:中国农业大学,2018.
[2] LI Y,CHEN Y,ZHOU L,et al.Microtom metabolic network:Rewiring tomato metabolic regulatory network throughout the growth cycle[J].Molecular Plant,2020,13(8):1203-1218.
[3] 李金昊.番茄SULTR基因家族的鉴定及其表达分析[D].河北邯郸:河北工程大学,2023.
[4] LÜ H M,WANG X W,DONG X N,et al.CRISPR/Cas9 edited SlGT30 improved both drought resistance and fruit yield through endoreduplication[J].Plant Cell and Environment,2024,47:1-15.
[5] 刘佳凤,郭晓青,王桂强,等.番茄SlMYB48基因生物信息学及表达分析[J].中国瓜菜,2024,37(4):27-35.
[6] 赵曜,文朗,骆少丹,等.番茄HMA基因家族的鉴定及SlHMA1镉转运功能研究[J].生物技术通报,2024,40(2):212-222.
[7] 罗少,唐翠明,戴凡炜,等.植物转录因子HD-Zip基因家族参与逆境胁迫的研究进展[J].南方农业,2021,15(35):173-175.
[8] 方远鹏,韦建明,李云洲.番茄PLC基因家族鉴定及抗番茄褐色皱果病毒(ToBRFV)防御反应分析[J].核农学报,2023,37(2):230-240.
[9] 匡雪君,王彩霞,邹丽秋,等.长春花萜类吲哚生物碱生物合成与调控研究[J].中国中药杂志,2016,41(22):4129-4137.
[10] SHAO Y Y,ZHOU Y,YANG L,et al.Genome-wide identification of GATA transcription factor family and the effect of different light quality on the accumulation of terpenoid indole alkaloids in Uncaria rhynchophylla[J].Plant Molecular Biology,2024,114(1):15.
[11] 向蓓蓓,朱晔荣,王勇.长春花吲哚生物碱合成途径的基因工程研究进展[J].生物学通报,2010,45(10):4-8.
[12] KUTCHAN T M.Expression of enzymatically active cloned strictosidine synthase from the higher plant rauvolfia serpentina in Escherichia coli[J].FEBS Letters,1989,257(1):127-130.
[13] TREIMER J F,ZENK M H.Purification and properties of strictosidine synthase,the key enzyme in indole alkaloid formation[J].European Journal of Biochemistry,1979,101(1):225-233.
[14] 马磊,张翔,田永强,等.拟南芥基因组中注释为异胡豆苷合成酶的基因克隆及异源表达[J].应用与环境生物学报,2013,19(2):224-230.
[15] 周棋赢,姜慧敏,李拉拉,等.茶树异胡豆苷合成酶基因的全基因组鉴定和表达分析[J].信阳师范学院学报(自然科学版),2021,34(4):596-605.
[16] 邹挺.几个植物雄性育性控制基因的克隆与功能研究[D].四川雅安:四川农业大学,2017.
[17] 曾俊岚,刘万宏,廖志华,等.长春花生物碱合成途径相关基因表达丰度与MeJA处理后基因表达差异分析[J].基因组学与应用生物学,2017,36(3):1009-1020.
[18] DE BERNONVILLE T D,CARQUEIJEIRO I,LANOUE A,et al.Folivory elicits a strong defense reaction in Catharanthus roseus:Metabolomic and transcriptomic analyses reveal distinct local and systemic responses[J].Scientific Reports,2017,7:40453.
[19] 王晓静,梁立雄,李潞滨,等.铁皮石斛异胡豆苷合成酶基因STR序列结构及表达模式分析[J].生物资源,2020,42(4):404-413.
[20] 周棋赢,李娅菲,郭文利,等.茶树异胡豆苷合酶基因CsSTR1克隆及表达分析[J].西南农业学报,2022,35(10):2296-2302.
[21] 李杰,冯永佳,李培华,等.小麦OXS3基因家族的鉴定及表达模式分析[J].麦类作物学报,2024,44(7):846-854.
[22] 鄂志国,庄杰云,曹永生,等.基于INTERNET的水稻基因数据库信息系统[J].中国水稻科学,2006,20(6):670-672.
[23] ZOU T,LI S C,LIU M X,et al.An atypical strictosidine synthase,OsSTRL2,plays key roles in anther development and pollen wall formation in rice[J].Scientific Reports,2018,7:6863.
[24] 郝青婷,高伟,闫虎斌,等.绿豆WRKY基因家族的全基因组鉴定及生物信息学分析[J].西北农林科技大学学报(自然科学版),2023,51(5):59-71.
[25] 李浩霞,黄稳娥,柳西宁,等.枸杞实时荧光定量RT-qPCR内参基因筛选与验证[J].江苏农业科学,2023,51(9):41-51.
[26] 李金梅,聂兴华,葛婧怡,等.板栗PAT基因家族成员鉴定及不同胁迫响应分析[J].果树学报,2024,41(5):847-860.
[27] CAPPETTA E,ANDOLFO G,GUADAGNO A,et al.Tomato genomic prediction for good performance under high-temperature and identification of loci involved in thermotolerance response[J].Horticulture Research,2021,8(1):212.
[28] 王新军,阎世江.干旱胁迫对番茄幼苗生理特性的影响[J].中国瓜菜,2022,35(6):76-80.
[29] 徐佳宁,徐艳群,严振,等.番茄对非生物胁迫响应机制研究进展[J].山东农业科学,2015,47(12):120-124.
[30] 孙保娟,李涛,游倩,等.茄科植物花青素合成相关的MYB转录因子研究进展[J].中国农学通报,2023,39(36):102-111.
[31] 杨丽萍,李一荻,丁晓月,等.转录因子TCP调控植物生长发育的研究进展[J].吉林师范大学学报(自然科学版),2024,45(1):112-116.
[32] 杜琳颖.小麦转录因子TaERF87与TaDi19-7的鉴定及其在非生物胁迫响应中的功能研究[D].陕西杨凌:西北农林科技大学,2023.
