甜瓜新镰刀菌果腐病病原菌Fusarium asiaticum药剂敏感性测定及田间土壤处理方法的筛选
2024-09-25董文杰郝芳敏臧全宇马二磊丁伟红周飞黄健王毓洪


浙江余姚 315499; 5.宁波康益佳沃科技有限公司 浙江宁波 315100)
摘 要:为了探讨不同药剂对甜瓜新镰刀菌果腐病病原菌Fusarium asiaticum的抑菌效果,明确不同化学药剂和微生物菌剂协同施用对根际土壤微生物群落的影响,采用菌丝生长速率法测定F. asiaticum对不同药剂的敏感性,并利用宏基因组测序分析不同化学药剂和微生物菌剂对根际土壤微生物群落结构的影响。结果表明,50%咪鲜胺锰盐WP对F. asiaticum菌丝生长具有明显抑制效果,其EC50值为0.03 mg·L-1。基于宏基因组测序分析,不同化学药剂和微生物菌剂协同处理使根际土壤微生物的多样性差异显著;同时显著提高放线菌门Actinobacteriota、枝孢菌属Cladosporium等有益菌群丰度。土壤熏蒸剂“棉隆”+聚谷氨酸有机肥+谷乐丰88亿菌微生物菌剂协同处理的根际土壤微生物的丰富度和多样性均有所提高,且在处理组中对病原镰刀菌的田间防治效果最佳。研究结果揭示了不同化学药剂和微生物菌剂协同施用对土壤微生物群落的影响,可为甜瓜田间防治镰刀菌提供参考。
关键词:甜瓜果腐病;药剂敏感性;化学药剂;微生物菌剂;土壤微生物
中图分类号:S652 文献标志码:A 文章编号:1673-2871(2024)09-018-09
Sensitivity determination of Fusarium asiaticum, a pathogen causing fruit rot in melon, and screening of effective treatment method in field
DONG Wenjie1, 2, HAO Fangmin2, 3, ZANG Quanyu2, 3, MA Erlei2, 3, DING Weihong2, 3, ZHOU Fei4, HUANG Jian5, WANG Yuhong2, 3
(1. Zhejiang Wanli University, Ningbo 315199, Zhejiang, China; 2. Ningbo Key Laboratory of Quality Control and Resistance Breeding of Characteristic Horticultural Crops, Ningbo 315040, Zhejiang, China; 3. Ningbo Academy of Agricultural Sciences, Ningbo 315040, Zhejiang, China; 4. Yuyao Agricultural Technology Extension Service Station, Yuyao 315499, Zhejiang, China; 5. Ningbo Kangyi Jiawo Technology Co., Ningbo 315100, Zhejiang, China)
Abstract: To investigate the antibacterial effects of different pesticides on Fusarium asiaticum, the pathogen of fruit rot disease in melon, and to clarify the effects of synergistic application of different chemical and microbial agents on the rhizosphere soil microbial community, the mycelial growth rate method was employed to determine the sensitivity of F. asiaticum to different pesticides, and the effects of different chemical and microbial agents on the structure of rhizosphere soil microbial communities were analyzed using metagenomic sequencing. The results showed that 50% prochloraz manganese salt WP had a significant inhibitory effect on the growth of F. asiaticum hyphae, with an EC50 value of 0.03 mg·L-1. Based on metagenomic sequencing analysis, the synergistic treatment of different chemical and microbial agents resulted in significant differences in the diversity of rhizosphere soil microorganisms, while significantly increasing the abundance of beneficial bacterial communities such as Actinobacteriota and Cladosporium. The synergistic treatment of soil fumigant "Mianlong" + polyglutamic acid organic fertilizer + Gulefeng 8.8 billion microbial agents has improved the richness and diversity of rhizosphere soil microorganisms, and the field control effect on the pathogenic Fusarium spp. is the best in the treatment group. The research results revealed the effects of synergistic application of different chemical agents and microbial agents on soil microbial communities, which can provide reference for the field control of Fusarium spp. in melon.
Key words: Melon fruit rot disease; Drug sensitivity; Chemical agents; Microbial agents; Soil microorganism
收稿日期:2024-05-07;修回日期:2024-06-11
基金项目:多粘类芽孢杆菌菌肥研发及示范应用(2023JH03010033);浙江省西甜瓜良种育繁推科技创新平台(ZJ2019-80);国家西甜瓜产业技术体系(CARS-25)
作者简介:董文杰,女,在读硕士研究生,研究方向为植物保护。E-mail:dongwenjie032020@163.com
通信作者:王毓洪,男,研究员,研究方向为西甜瓜、瓜类砧木育种与栽培。E-mail:yhwangsc@163.com
由镰刀菌Fusarium spp.引起的甜瓜果腐病是危害我国瓜类生产的重要病害之一[1]。该病通常发生在半成熟或成熟的果实上,初期果实表面呈水浸状凹陷斑点,后期斑点逐渐扩大,果实呈黄褐色水渍腐烂;有些病部长出白色或粉红色霉层,延伸到果实内,致使种子带毒[2-3]。引起甜瓜果腐病的镰刀菌种类较多,如腐皮镰刀菌F. solani[4]、砖红镰刀菌F. lateritium[5]和木贼镰刀菌F. equiseti[6]等。
镰刀菌Fusarium spp.是常见的根际土壤真菌[7],采取土壤处理来防治病害,从源头上解决病害发生的可能性,是防治土传病害的重要方法之一。目前,针对甜瓜果腐病的防治方法可分为农业防治、生物防治和化学防治[8]。农业防治包括选育抗病品种、轮作间作等手段。选育抗病品种是治理病害的首选措施,但培育周期长,面临遗传分离等不确定因素。轮作间作可减少土壤中病菌数量,有效防治病害,但管理复杂。生物防治可减少环境污染、对人畜安全无害,但该方法对技术要求高,专一性强。目前,生产中仍依赖于化学防治。该方法优点是见效快、操作简单、不受地域季节的限制,且防治对象广泛。但若长期无节制使用化学药剂,会导致病原菌产生耐药性,危害人畜健康,造成环境污染等。因此,化学药剂的使用应趋向低毒、低残留、环境友好型发展,才能更好地发挥作用[9]。
微生物菌剂是通过一个或多个功能作用菌株经过高密度发酵制作的新型农药,安全高效,还能改善土壤结构,提供养分[10]。但目前微生物菌剂技术尚不成熟,如果将化学药剂和微生物菌剂协同施用,既能减少农药残留、保护环境,又能及时有效防治病害、改善土壤成分。曾涛等[11]研究表明,微生物菌剂配合化学药剂协同施用可有效防控槟榔黄化病。土壤-微生物-植物彼此相互联系,且土壤微生物直接影响植物根系获取土壤中各种营养物质的能力,共同维持植物生长[12-14]。可见土壤微生物对植株的生长起到一定作用,但化学药剂与微生物菌剂协同施用会造成土壤微生物群落改变。目前针对不同化学药剂和微生物菌剂协同处理后土壤微生物群落变化的研究较少。笔者以前期在浙江宁海等地鉴定的造成甜瓜果腐病的亚洲镰刀菌F. asiaticum为研究对象[15],选取市面上7种化学药剂,进行室内抑菌试验。在田间通过不同化学药剂和微生物菌剂的协同处理,改善土壤微生物群落结构,探索镰刀菌的变化情况,以期为甜瓜新镰刀菌F. asiaticum果腐病的田间防治提供科学依据和指导。
1 材料与方法
1.1 材料
供试病原菌:甜瓜新镰刀菌果腐病病原菌 F. asiaticum(菌株Fa-25)于2020年从浙江宁海腐烂的甜瓜果实分离获得[16]。由宁波市农业科学研究院蔬菜所保存。
供试培养基:马铃薯葡萄糖琼脂培养基。
供试药剂:40%百菌清(悬浮剂SC,日本史迪士生物科学株式会社)、46%氢氧化铜(水分散粒剂WG,美国杜邦公司)、80%代森锰锌(可湿性粉剂WP,江苏云帆化工有限公司)、80%恶霉福美双(可湿性粉剂WP,天津绿亨化工有限公司)、80%烯酰吗啉(水分散粒剂WG,陕西上格之路生物科学有限公司)、250 g·L-1吡唑醚菌酯(乳油EC,巴斯夫植物保护有限公司)、50%咪鲜胺锰盐(可湿性粉剂WP,江苏辉丰生物农药股份有限公司)。
供试甜瓜:丰登蜜25,由宁波市农业科学研究院蔬菜所提供。
田间供试药剂和菌剂:土壤熏蒸剂“棉隆”(微粒剂,南通施壮化工有限公司)、聚谷氨酸有机肥(颗粒,南京轩凯生物科技有限公司)、谷乐丰聚谷氨酸微生物菌剂(水剂,南京轩凯生物科技有限公司)、济元复合微生物菌剂(粉剂,浙江道济农业科技发展有限公司)、多粘类芽孢杆菌NBmelon-1菌液(宁波市农业科学研究院蔬菜所提供)、漂白粉(乐平市九江龙化工有限公司)。
1.2 方法
1.2.1 甜瓜新镰刀菌果腐病病原菌F. asiaticum对不同药剂敏感性测定 2023年7月采用菌丝生长速率法测定病原菌对药剂的敏感性。
菌丝生长速率法:将7种药剂分别配制成4个不同质量浓度梯度,与PDA培养基以1∶99混合均匀。空白对照组以等量无菌水代替,每个浓度设3次重复。其中,40%百菌清SC和80%代森锰锌WP终质量浓度为1000、100、10、1 mg·L-1;46%氢氧化铜WG终质量浓度为1000、500、250、125 mg·L-1;80%恶霉福美双WP终质量浓度为100、50、25、12.5 mg·L-1、80%烯酰吗啉WG终质量浓度为2000、200、20、2 mg·L-1;250 g·L-1吡唑醚菌酯EC终质量浓度为25、2.5、0.25、0.025 mg·L-1;50%咪鲜胺锰盐WP终质量浓度为250、125、62.5、31.25 µg·L-1。将培养4~5 d的病原菌Fa-25取直径5 mm的菌饼接种到含药平板中央,置于28 ℃培养箱中黑暗条件下培养3~5 d后采用十字交叉法测量菌落直径,计算抑制率。
抑制率/%=(对照菌落生长直径-处理菌落生长直径)/(对照菌落生长直径-菌饼直径)×100。
1.2.2 甜瓜新镰刀菌果腐病病原菌F. asiaticum田间土壤处理 田间试验地位于浙江省宁波市宁海县静涛果蔬专业合作社,在甜瓜果腐病发生严重的地块进行。试验设置6个处理,(1)CK(T1):普通有机肥;(2)T2:移栽前30 d,每667 m2撒施10 kg漂白粉;(3)T3:土壤熏蒸剂“棉隆”每667 m2埋施20~25 kg(移栽前40 d)+ 667 m2埋施5 kg聚谷氨酸有机肥(移栽前10 d);(4)T4:土壤熏蒸剂“棉隆”每667 m2埋施20~25 kg(移栽前40 d)+ 667 m2埋施5 kg聚谷氨酸有机肥(移栽前10 d)+谷乐丰88亿微生物菌剂,每株50 mL灌根,每隔7 d处理1次,共3次(定植后),分别施用生物菌剂200倍、200倍和100倍液;(5)T5:土壤熏蒸剂“棉隆”每667 m2埋施20~25 kg(移栽前40 d)+ 667 m2埋施5 kg聚谷氨酸有机肥(移栽前10 d)+ 有效活菌数≥108 cfu·mL-1的NBmelon-1菌液原液,每株50 mL灌根,每隔7 d处理1次,共3次(定植后);(6)T6:土壤熏蒸剂“棉隆”每667 m2埋施20~25 kg(移栽前40 d)+ 667 m2埋施5 kg聚谷氨酸有机肥(移栽前10 d)+ 300倍液的济元复合微生物菌剂,每株50 mL灌根,每隔7 d处理1次,共3次(定植后)。
甜瓜种植采用爬地栽培,每个试验小区长58 m,宽5.5 m,面积319 m2,随机区组设计。每个小区种植甜瓜330株,株距大约为35 cm,行距45 cm。定植时间:2023年3月8日;收获、果腐病调查时间:2023年6月5日。甜瓜果腐病发生情况调查:以株为单位,记录发病株数,计算发病率。
1.2.3 根际土壤样品采集 在甜瓜采收期时按照五点取样法采集深度20 cm处根际混合土样。采样时间为2023年6月5日,将土样分为2份,1份放入含有干冰的采样箱中,送至南京集思慧远生物科技有限公司进行根际土壤微生物分析(混合样本,不设重复);1份风干后,去除杂物,研磨、过筛后保存。
1.2.4 数据分析 甜瓜新镰刀菌果腐病病原菌F.asiaticum对药剂敏感性测定数据采用 Microsoft Excel 2023软件计算不同药剂对病原菌的抑制中浓度(EC50)并建立毒力回归方程;用 SPSS 19.0 软件进行单因素方差分析(ANOVA)和回归分析。
2 结果与分析
2.1 不同药剂敏感性测定结果
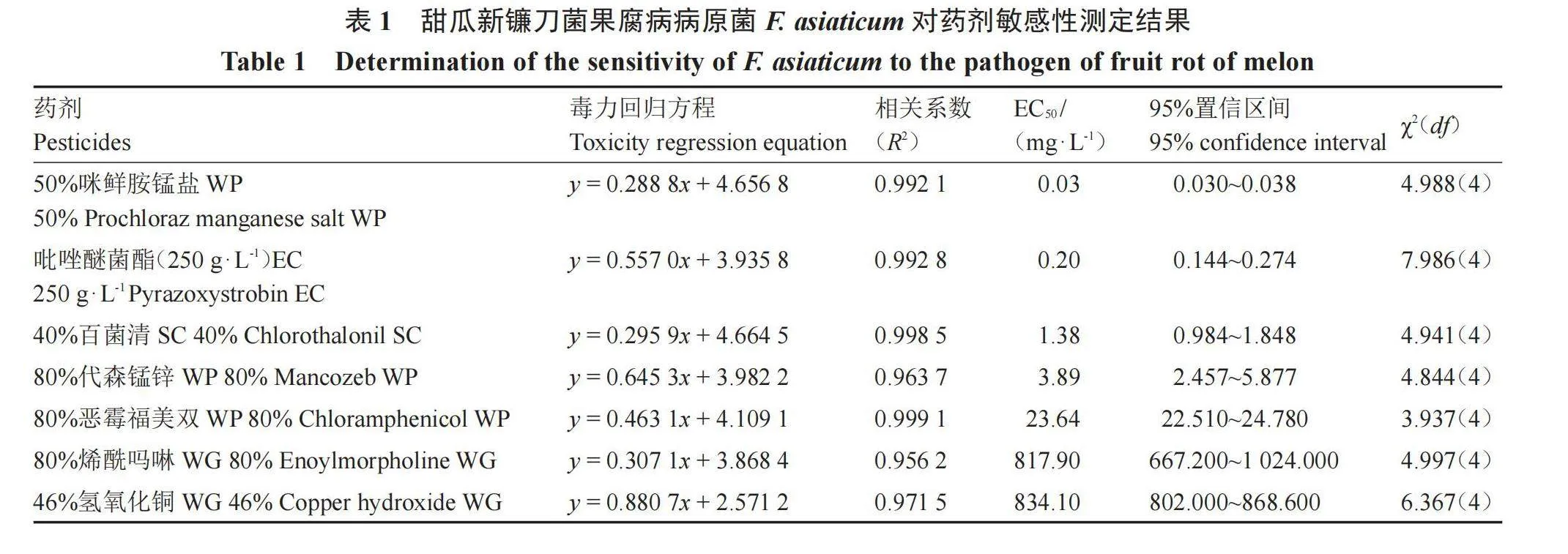
7种供试药剂对甜瓜新镰刀菌果腐病病原菌株Fa-25的抑菌效果差异明显(表1)。通过EC50分析可知,对病原菌抑制效果最好的为50%咪鲜胺锰盐WP和250 g·L-1吡唑醚菌酯EC,EC50分别为0.03、0.20 mg·L-1;这2种药剂的EC50远低于其他5种药剂。其次是40%百菌清SC、80%代森锰锌WP、80%恶霉福美WP,其EC50值分别为1.38、3.89、23.64 mg·L-1;80%烯酰吗啉WG和46%氢氧化铜WG对菌丝生长抑制效果最差,EC50值高达817.9f9/gK3h+FqS5ZOTkV7jBZFF3M1Kqd78v2pTO78AEu24=0、834.10 mg·L-1。
2.2 不同处理对甜瓜果腐病的田间防治效果
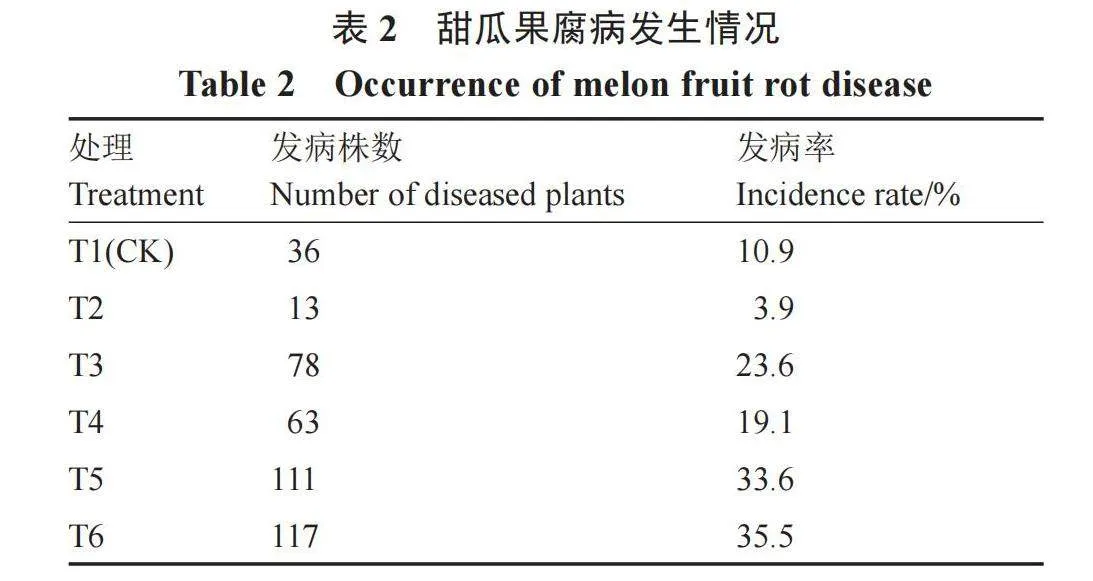
在甜瓜采收时统计发病率。对照组CK发病率为10.9%,T2~T6处理组发病率分别为3.9%、23.6%、19.1%、33.6%、35.5%。其中,漂白粉(T2)的防治效果最佳,发病率仅为3.9%。T3~T6处理组发病率与CK相比升高。在土壤熏蒸剂“棉隆”处理相同条件下(T3~T6),处理组T4防治效果最佳(表2)。
2.3 不同处理对土壤微生物群落多样性及结构的影响
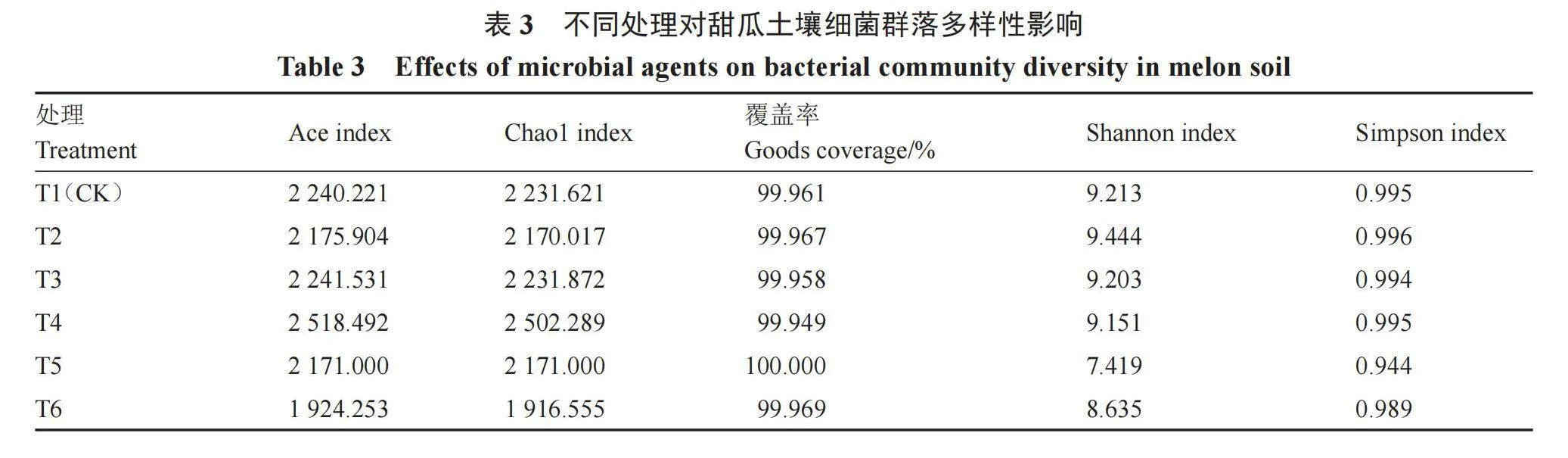
2.3.1 不同处理对土壤微生物群落多样性的影响 Alpha多样性是通过一系列的指数分析样品中物种多样性[17]。Alpha多样性反映土壤细菌物种多样性(表3)。Ace、Chao1指数反映群落丰富度,其值越大,物种丰富度越大。其中,T4处理均高于CK,较CK提高了12.42%和12.13%;T6处理最小,较CK降低了14.10%和14.12%。Shannon和Simpson指数反映群落多样性,其值越大,则物种多样性越丰富。其中T2处理最高,较CK提高了2.51%和0.1%;处理组T5最低,较CK降低了19.47%、5.13%。综合各项指数,除T4处理外,其余处理组较CK相比土壤细菌多样性明显降低,说明不同处理对土壤微生物的丰富度和多样性降低。
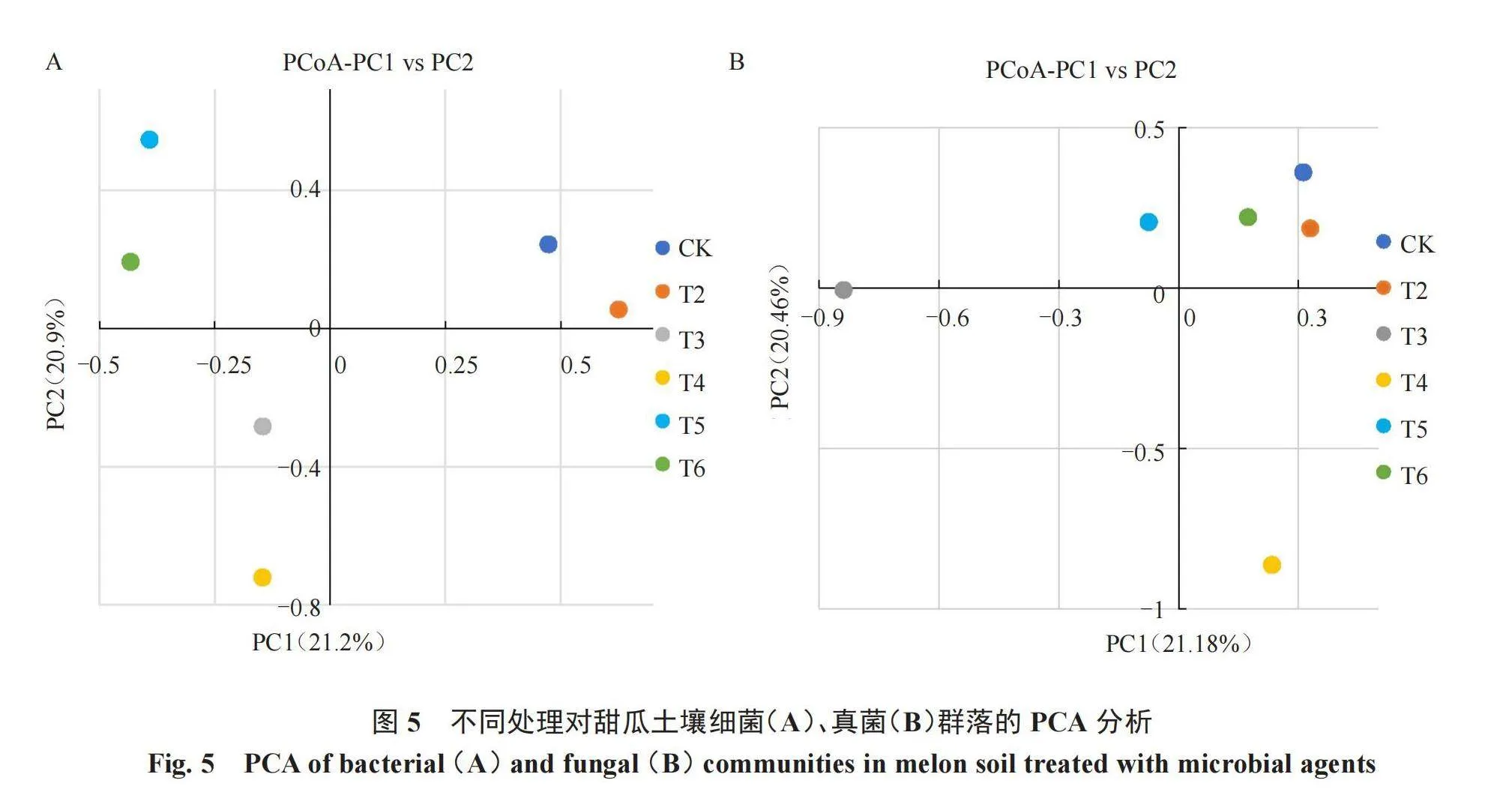
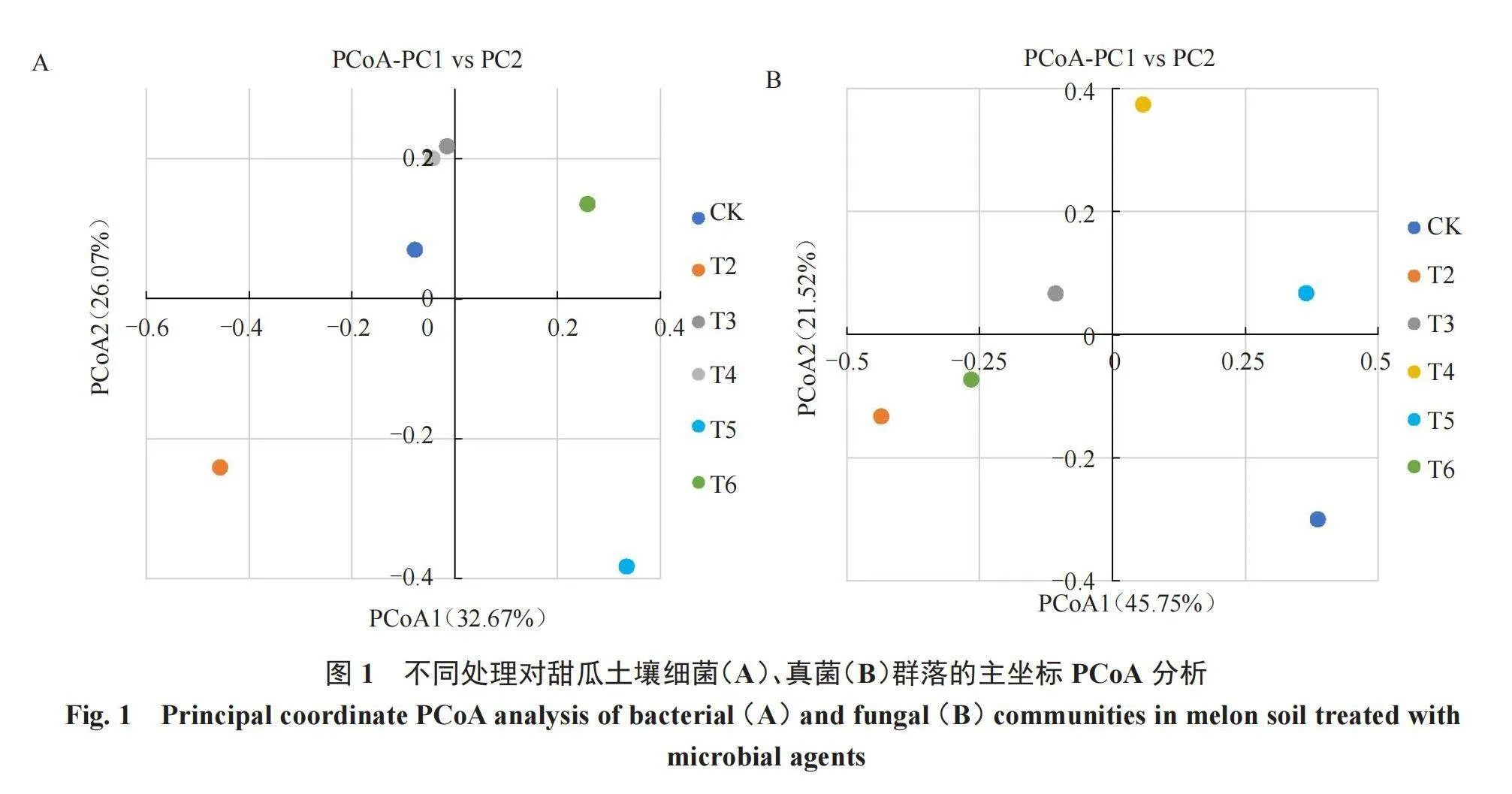
Beta多样性分析不同样品在物种多样性方面的相似程度,采用主坐标分析(PCoA)来展示。PCoA分析展示不同处理对土壤细菌群落多样性的影响(图1-A)。PCoA主成分1和2分别解释了32.67%和26.07%的群落差异。其中,CK(T1)、T3和T4位于第二象限,而T2、T5和T6分别位于第三、第四、第一象限。Beta多样性分析表明CK与T3~T4处理在土壤细菌群落多样性方面差异不大;与其他三组土壤细菌群落多样性差异明显。
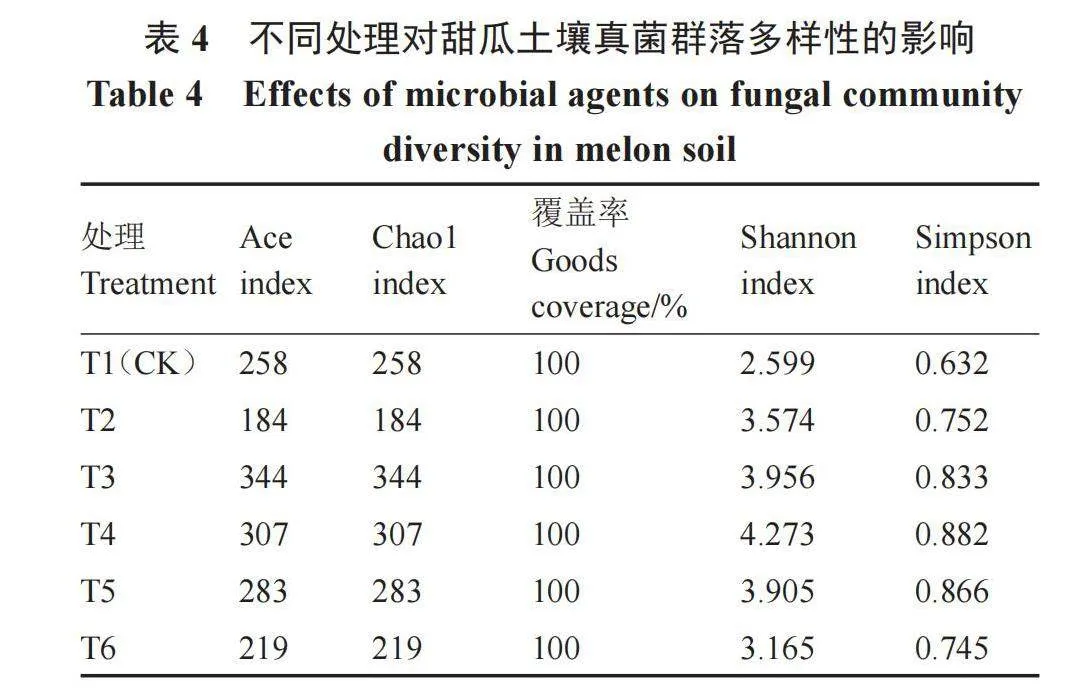
Alpha多样性反映土壤真菌物种多样性(表4)。无论是Ace指数还是Chao1指数,各样品丰富度大小均为T3>T4>T5> CK(T1)>T6>T2。在Shannon和Simpson指数中,CK数值最小;T4处理数值最大,较CK提高了64.41%、39.56%。Beta多样性展示了土壤真菌群落多样性(图1-B)。PCoA主成分1和2分别解释了45.75%和21.52%的群落差异。其中,CK(T1)在位于第四象限,T3位于第二象限,T4和T5位于第一象限,T2和T6位于第三象限。各个处理组与CK分布在不同象限中,说明不同处理下土壤真菌群落多样性差异明显。
2.3.2 不同处理对土壤微生物群落结构的影响 细菌在土壤微生物中占主导地位。图2-A为各样品土壤细菌门水平分类的群落结构分析。在门水平上共检测到39个已知菌门及未确定菌门,其中优势菌门主要为变形菌门Proteobacteria、厚壁菌门Firmicutes、拟杆菌门Bacteroidota、芽单胞菌门Gemmatimonadota和放线菌门Actinobacteriota。其中,变形菌门的丰度最高,占各样本总有效序列30%以上。除T5和T6处理变形杆菌门丰度,分别提高15.20%、1.90%外,其余处理较CK相比均降低。厚壁菌门和放线菌门的丰度大小均为T3>T4>T6> CK(T1)>T2>T5。拟杆菌门的丰度则为T4>T2>T6>CK>T5>T3。芽单胞菌门的丰度除处理组T2为16.09%外,其余处理组丰度均为5%~7%。
土壤真菌在土壤微生物群落中所占的比例较小[18]。根据ASV得到各样品真菌门水平分类的群落结构分析(图2-B),在门水平上共检测到8个真菌门及未知菌门,其中优势菌门主要为子囊菌门Ascomycota、担子菌门Basidiomycota、被孢霉门Mortierellomycota、罗兹菌门Rozellomycota和壶菌门Chytridiomycota。子囊菌门占真菌类群的主导地位;其他处理组与CK相比,子囊菌门丰度分别下降4.63%、5.7%、5.29%、22.37%和0.22%。在被孢霉门中除T6处理的丰度下降0.07%外,其余较CK相比丰度均提高。其中,担子菌门、罗兹菌门和壶菌门处理组的丰度较CK相比均有所提高。
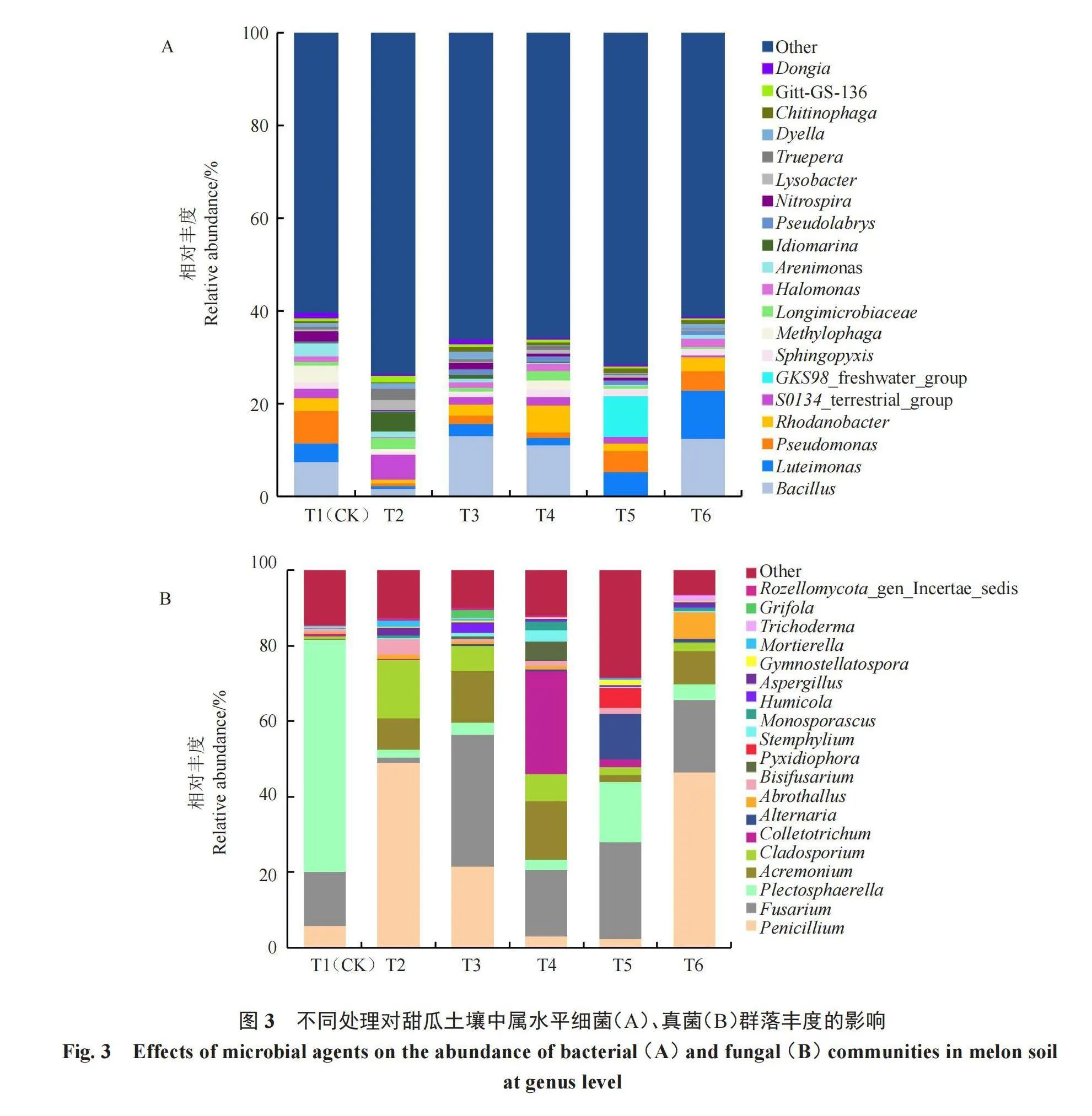
所有处理组土壤细菌相对丰度≥0.5%的属中(图3-A),排名前5的依次为芽孢杆菌属Bacillus、假单胞菌属Pseudomonas、藤黄单胞菌属Luteimonas、噬甲基菌属 Methylophaga、砂单胞菌属Arenimonas,目前约66%的细菌无法分类。除T2和T5处理的芽孢杆菌属丰度降低外,其余处理较CK相比分别增加了5.66%、3.58%、5.06%。藤黄单胞菌属约占4.04%,其余处理组丰度较CK相比均下降或持平,仅T6处理的藤黄单胞菌属丰度增加了6.27%。T2~T6处理的土壤中假单胞菌属、噬甲基菌属、砂单胞菌属的相对丰度均明显降低。
在属水平上(图3-B),所有样品的土壤真菌相对丰度≥5%共有6个,依次为Plectosphaerella、镰刀菌属 Fusarium、青霉菌属Penicillium、Abrothallus、枝孢菌属Cladosporium、炭疽菌属Colletotrichum。除此之外,还有约14.05%的其他真菌。Plectosphaerella在不同处理后丰度均明显下降,分别降低59.59%、58.41%、58.84%、45.52%和57.53%。与此相反,枝孢菌属的相对丰度在处理组中均提高。处理组T3~T4与CK相比,青霉菌属相对丰度降低,炭疽菌属相对丰度提高。
2.3.3 不同处理对土壤中镰刀菌属Fusarium spp.丰度的影响 试验在甜瓜果腐病发生严重的田间进行。对照组CK镰刀菌属丰度为14.33%,T2~T6处理组镰刀菌属丰度分别为1.27%、34.91%、17.65%、25.63%、19.16%(图4)。漂白粉处理的镰刀菌丰度明显下降,这一结果与发病率结果一致。在棉隆处理相同条件下,T3~T6处理组镰刀菌属丰度较CK升高,但谷乐丰88亿菌微生物菌剂(T4)处理的镰刀菌属丰度最低。
2.3.4 菌剂施用对甜瓜土壤微生物群落影响的主成分分析(PCA) PCA分析(principal component analysis)即主成分分析。样本组成越相似,PCA图中距离越近。各处理土壤细菌群落差异PCA分析如图5-A所示。PCA分析显示PC1和PC2对土壤细菌群落差异的解释度为21.2%和20.9%,合计42.1%。CK、T2同时位于PC1正半轴和PC2正半轴,说明CK与T2处理的组成较为相似。T3、T4位于PC1和PC2的负半轴,T5、T6位于PC1负半轴和PC2正半轴,说明处理组T3~T6与CK相比土壤细菌群落组成差异明显。各处理组土壤真菌群落差异PCA分析如图5-B所示。PCA分析显示,PC1和PC2对土壤真菌群落差异的解释度为21.18%和20.46%,合计42.64%。对照组CK、T2、T6处理位于PC1正半轴和PC2正半轴,说明这3组样品的真菌群落组成较为相似。T3位于PC1负半轴和PC2负半轴,T4位于PC1正半轴和PC2负半轴,T5位于PC1负半轴和PC2正半轴,说明T3~T5处理与CK相比土壤真菌群落组成差异明显。
3 讨论与结论
目前,防治由镰刀菌Fusarium spp.引起的甜瓜果腐病最有效的方法为化学防治。为了科学高效地使用化学药剂,选用不同药剂进行敏感性测定,结果表明,7种化学药剂对该病原菌抑制效果差异明显。其中,抑菌效果最好的为50%咪鲜胺锰盐WP,建议推广使用。咪鲜胺锰盐通过抑制甾醇合成而抑制多种作物病害[19]。防治效果最差的为46%氢氧化铜WG,该药剂EC50比其他药剂高出数倍,建议谨慎使用。氢氧化铜主要是产生铜离子附着在植物表面,形成保护膜从而防治病原菌[20-21]。室内试验无植株,故抑菌效果差。通过药剂的作用机制可知,室内试验仅仅是对病原菌菌丝生长抑制效果的展示,而实际田间防治效果可能与植株、土壤等因素有关,该结果可为田间防治提供参考。
甜瓜果腐病可使半成熟或成熟期的甜瓜出现病斑而腐烂,造成严重的经济损失。在发病情况调查时发现,施用漂白粉对甜瓜果腐病防治效果最佳,发病率仅为3.9%。因镰刀菌在强酸强碱环境下孢子菌丝生长受到抑制,而漂白粉具有强碱性,可以杀死土壤中的镰刀菌[22]。在相同条件下的棉隆处理组发病率高于CK,与以往其他学者的研究结果不同,推测与共同添加的土壤熏蒸剂“棉隆”有关。棉隆的效果易受温湿度、使用方法等因素影响[23]。T3~T6处理防治效果差,与人工撒施分布不均导致棉隆残留有关,但其中施用谷乐丰88亿菌微生物菌剂的处理组(T4)防治效果最佳。后续田间防治中,推荐将漂白粉、聚谷氨酸有机肥和谷乐丰88亿菌微生物菌剂协同施用;同时每667 m2在甜瓜果实膨大初期及成熟初期喷洒50%咪鲜胺锰盐可湿性粉剂800~1500倍液或250 g·L-1吡唑醚菌酯15~30 mL;间隔7~14 d施药,共2次,植株表面须喷雾均匀[24]。
土壤微生物在养分转化、抗病、促进植物生长中发挥着重要作用,易受农业措施的影响[25]。万海英等[26]发现,杀菌剂对土壤微生物结构影响较大,可明显降低根际土壤微生物的多样性。在本研究中,除T4外,其他处理组的土壤微生物多样性明显降低,说明化学药剂和微生物菌剂协同施用对土壤微生物的生态造成一定破坏。未施用棉隆的T2处理组土壤微生物多样性降低,且发病率降低。Shen等[27]研究发现,抑制香蕉枯萎病菌的土壤微生物多样性指数明显比有利于病原菌存活的土壤指数高,与本试验结论相悖。主要原因可能是漂白粉具有强碱性而杀死了土壤中多数微生物,多样性降低。在棉隆处理相同条件下,施用谷乐丰88亿菌微生物菌剂(T4)的发病率与土壤微生物多样性呈负相关。由于该微生物菌剂中有效活菌数≥88.0亿·mL-1,一定程度上弥补了因棉隆残留而导致微生物多样性指数降低的情况。
在发病甜瓜的根际土壤微生物中,镰刀菌属Fusarium spp.是占主导地位的优势真菌。不同化学药剂和微生物菌剂的协同施用对镰刀菌丰度的影响不同。马二磊等[28]施用微生物菌剂降低了甜瓜土壤中镰刀菌属群落数量,一定程度上减少镰刀菌属病害的发生。本研究结果表明,未施用棉隆的处理组镰刀菌属的丰度降低,而施用棉隆的处理组镰刀菌属的丰度均显著升高,这一结果与发病率一致,但与前人研究不符。可能与棉隆分解不彻底有关,从而杀死有益菌,为病原菌生长提供有利条件。本研究结果表明,5个处理组共同富集的根际土壤中有益优势微生物群落为放线菌门Actinobacteriota、枝孢菌属Cladosporium、枝顶孢霉属Acremonium、担子菌门Basidiomycota、壶菌门Chytridiomycota,明显消减的群落为Plectosphaerella、子囊菌门Ascomycota。放线菌门Actinobacteriota中多数细菌能产生几丁质酶、过氧化氢酶等土壤酶,分解纤维素、木质素,同时可产生抗生素抑制病害[29-31]。枝孢菌属Cladosporium能够在植物遭受生物或非生物胁迫时发挥积极作用[32]。枝顶孢霉属Acremonium是土壤中有益真菌[33]。担子菌门Basidiomycota和壶菌门Chytridiomycota的大多数真菌可降解纤维素、木质素和几丁质[34-35]。Plectosphaerella在多种葫芦科作物中被发现有较强的致病性[36]。子囊菌门Ascomycota中多数真菌是植物病原体[37]。说明通过化学药剂和微生物菌剂协同施用,有利于土壤中的有机物分解,同时降低植物病害的发生概率,为甜瓜生长提供有利的微生物环境,保护其正常生长。
本研究结果表明,不同药剂对病原菌Fusarium asiaticum抑制效果差异明显,与各药剂的抑菌机制相关,可为田间试验奠定基础。根据宏基因组测序结果,化学药剂和微生物菌剂施用降低了甜瓜根际土壤微生物的多样性和丰度;但提高了土壤中部分有益菌群的丰度,显著降低了部分有害菌群的丰度。但处理后仍存在镰刀菌Fusarium spp.丰度升高、有益菌减少的问题。说明田间情况复杂多变,应在实际生产中采取化学药剂和微生物菌剂协同处理、施用高效化学药剂等多种措施来防治病害。本研究结果为安全高效地防治甜瓜果腐病提供了理论依据。
参考文献
[1] 张亮.甜瓜果斑病抗性鉴定及抗性相关形态和生理研究[D].乌鲁木齐:新疆农业大学,2016.
[2] 王燕,王春伟,王琳,等.甜瓜镰刀菌果腐病新病原菌Fusarium incarnatum的鉴定及生物学特性[J].园艺学报,2019,46(3):529-539.
[3] 柴兆祥,李金花,李敏权,等. 白兰瓜果腐病病原菌的分离鉴定及优势病菌的毒性测定[J].应用与环境生物学报,2004,10(5):671-674.
[4] SHARMA M,GULERIA S,SINGH K,et al.Mycovirus associated hypovirulence,a potential method for biological control of Fusarium species[J].Virusdisease,2018,29(2):134-140.
[5] 柴兆祥,李金花,李敏权,等.白兰瓜果腐病优势病菌鉴定及其产孢条件研究[J].果树学报,2005,22(1):40-43.
[6] 陈贺楠.不同西瓜品种对木贼镰孢果腐病的抗性评价[D].哈尔滨:东北农业大学,2022.
[7] 田丽霞.微生物及气候因子对西洋参品质的影响[D].北京:北京协和医学院,2022.
[8] 曹坳程,刘晓漫,郭美霞,等.作物土传病害的危害及防治技术[J].植物保护,2017,43(2):6-16.
[9] 陈雨姗,尹群,王杰,等.红花玉兰根腐病化学防治药剂的室内筛选及毒力测定[J].东北林业大学学报,2020,48(9):107-113.
[10] 贺善睦,姚拓,雷杨,等.微生物菌剂与化肥减量配施对猫尾草生长的影响[J].草业科学,2024,42:1-10.
[11] 曾涛,芮凯,田威,等.微生物菌剂与化学药剂对槟榔黄化病的协同防效评价[J].农药,2021,60(11): 832-835.
[12] 王占青,王午志,马喆,等.不同禾草生长对甘肃马先蒿群落土壤养分和微生物群落的影响[J].草地学报,2023,31(12):3750-3758.
[13] FANG S Z,LIU D,TIAN Y,et al.Tree species composition influences enzyme activities and microbial biomass in the rhizosphere: A rhizobox approach[J].PLoS One,2013,8(4):e61461.
[14] 孟鹏飞,郭涛,刘文.基于植物-土壤反馈的不同绿肥驯化微生物对玉米生长的影响[J].微生物学通报,2023,50(3):1111-1122.
[15] HAO F M,ZANG Q Y,DING W H,et al.First report of fruit rot of melon caused by Fusarium asiaticum in China[J].Plant Disease,2021,105(4):1225.
[16] 郝芳敏,臧全宇,丁伟红,等.甜瓜新镰刀菌果腐病病原菌Fusarium asiaticum的生物学特性研究及抗病品种筛选[J].中国瓜菜,2023,36(6):16-22.
[17] LI B,ZHANG X X,GUO F,et al.Characterization of tetracycline resistant bacterial community in saline activated sludge using batch stress incubation with high-throughput sequencing analysis[J].Water Research,2013,47(13):4207-4216.
[18] 沙月霞,黄泽阳,李云翔,等.生物菌剂对土壤微生物群落结构和功能的影响[J].农业环境科学学报,2022,41(12):2752-2762.
[19] 夏姗姗,韦沙迪,王爱臣,等.30%咪鲜胺锰盐·多菌灵水分散粒剂的高效液相色谱分析[J].化工设计通讯,2019,45(3):148-151.
[20] 于素梅.杀菌剂氢氧化铜对细菌抗生素敏感性和烟曲霉抗真菌药物敏感性的影响及其机制[D].杭州:浙江大学,2022.
[21] 姚廷山,周彦,周常勇.应用铜制剂防治柑橘溃疡病的研究进展[J].园艺学报,2016,43(9):1711-1718.
[22] 陈慧.马铃薯枯萎病病原菌鉴定及Fusarium oxysporum遗传多样性的研究[D].呼和浩特:内蒙古农业大学,2015.
[23] 方文生,王秋霞,颜冬冬,等.土壤熏蒸剂棉隆防治土传病害研究进展及未来发展趋势[J].植物保护学报,2023,50(1):40-49.
[24] 肖敏,吉训聪,王运勤,等.海南岛甜瓜镰刀菌果腐病药剂防治研究[J].长江蔬菜,2011(2):63-65.
[25] 杨睿,汪琳罗沙,姚迪,等.猕猴桃根际土壤可培养细菌分离及溃疡病拮抗菌筛选[J].安徽农业科学,2023,51(22):98-103.
[26] 万海英,李林,覃章辉,等.杀菌剂及生防菌对白菜根肿病和土壤微生物的影响[J].北方园艺,2023(3):8-15.
[27] SHEN Z Z,RUAN Y Z,XUE C,et al.Soils naturally suppressive to banana Fusarium wilt disease harbor unique bacterial communities[J].Plant and Soil,2015,393(1/2):21-33.
[28] 马二磊,黄芸萍,臧全宇,等.4种微生物菌剂对多年连作甜瓜土壤真菌群落的影响[J].中国瓜菜,2021,34(4):15-20.
[29] FUENTES S,MÉNDEZ V,AGUILA P,et al.Bioremediation of petroleum hydrocarbons:Catabolic genes,microbial communities,and applications[J].Applied Microbiology and Biotechnology,2014,98(11):4781-4794.
[30] POLTI M A,APARICIO J D,BENIMELI C S,et al.Simultaneous bioremediation of Cr (VI) and lindane in soil by actinobacteria[J].International Biodeterioration & Biodegradation,2014,88:48-55.
[31] KIESER T,BIBB M J,BUTTNER M J,et al.Practical streptomyces genetics[J].International Microbiology,2000,3(4):260-261.
[32] 张鹏程.产挥发性抑菌物质功能菌的筛选及其对花生根际微生物的影响[D].山东泰安:山东农业大学,2023.
[33] 李章雷.耐盐碱促生细菌对红小豆的促生作用及其对根际微生态的影响[D].黑龙江大庆:黑龙江八一农垦大学,2021.
[34] ZHOU Y,ZHU H H,FU S L,et al.Variation in soil microbial community structure associated with different legume species is greater than that associated with different grass species[J].Frontiers in Microbiology,2017,8:1007.
[35] SUDOVÁ R,KOHOUT P,RYDLOVÁ J,et al.Diverse fungal communities associated with the roots of isoetid plants are structured by host plant identity[J].Fungal Ecology,2020,45:100914.
[36] CARLUCCI A,RAIMONDO M L,SANTOS J,et al.Plectosphaerella species associated with root and collar rots of horticultural crops in southern Italy[J].Persoonia,2012,28:34-48.
[37] 龙志威.有机肥配施与土壤酸化改良措施的田间应用[D].武汉:华中农业大学,2023.
