甜瓜KASP标记开发及指纹图谱构建
2024-09-25肖玉珍张瑞青张跃星代雪张勇王中元于蓉侯尹婕张显魏春华



摘 要:为丰富甜瓜分子标记类型,并为后续甜瓜种质、品种及种子纯度鉴定提供简便、高效的检测方法,分别在甜瓜每条染色体上挑选6个核心SNP位点,共72个标记,通过KASP技术对11份甜瓜种质进行基因分型,确定了45对具有较好分型效果的标记,标记设计成功率为62.5%。从45对分型较好的标记中挑选25个基因型分簇集中的最优标记,对31份甜瓜种质进行基因分型,明确了各种质在25个SNP位点的多态性,通过聚类分析,分成了3组,并构建了31份甜瓜种质的指纹图谱,为甜瓜种质资源利用和种子纯度鉴定提供了参考。
关键词:甜瓜;KASP;SNP ;指纹图谱
中图分类号:S652 文献标志码:A 文章编号:1673-2871(2024)09-009-09
Development of melon KASP markers and construction of fingerprints
XIAO Yuzhen1, ZHANG Ruiqing1, ZHANG Yuexing1, DAI Xue1, ZHANG Yong1, WANG Zhongyuan1, YU Rong2, HOU Yinjie1, ZHANG Xian1, WEI Chunhua1
(1.College of Horticulture, Northwest A&F University, Yangling 712100, Shaanxi, China; 2. Institute of Horticulture, Ningxia Academy of Agriculture and Forestry Sciences, Yinchuan 750000, Ningxia, China)
Abstract: To enrich spectrum of molecular markers in melon and offer a straightforward and efficient protocol for the subsequent identification of melon germplasm, variety, and seed purity, this investigation identified six pivotal single-nucleotide polymorphism(SNP)loci distributed across the melon genome, encompassing a total of 72 markers. Utilizing the KASP(kompetitive allele-specific PCR)assay, these markers were employed to genotype 11 melon germplasm accessions, resulting in the identification of 45 marker pairs exhibiting superior typing performance. The success rate of marker design reached 62.5%, and from these 45 pairs, the most optimal markers for the 25 identified genetic clusters were selected, and the polymorphisms of 31 muskmelon germplasm were divided into 3 groups, and the fingerprints of 31 muskmelon germplasm were constructed to provide reference for the utilization of muskmelon germplasm resources and seed purity identification.
Key words: Melon; KASP; SNP; Fingerprints
收稿日期:2024-05-29;修回日期:2024-07-19
基金项目:2023年西甜瓜良种联合攻关;宁夏农林科学院高质量发展和生态保护科技创新示范项目(NGSB-2021-7)
作者简介:肖玉珍,女,在读硕士研究生,研究方向为西瓜甜瓜种质资源创新。E-mail:2391367158@qq.com
通信作者:张 显,男,教授,研究方向为西瓜甜瓜种质资源收集、评价与利用。E-mail:zhangxian@nwsuaf.edu.cn
魏春华,男,副教授,主要从事西瓜甜瓜育种研究。E-mail:xjwend020405@nwafu.edu.cn
甜瓜(Cucumis melo L.)不仅营养丰富,而且种植地区广泛、模式多样,栽培历史悠久[1]。在超市里经常看到各种各样的甜瓜品种,其具有解暑和保护肝脏的功能,因此深受人们喜爱[2]。中国甜瓜种质资源丰富,栽培与驯化历史悠久,据考证至少在3000年以上,目前以设施栽培为主[3]。对甜瓜种质资源形态性状的了解程度,将直接影响其育种的进程和水平。
竞争性等位基因特异性PCR(kompetitive allele-specific PCR,KASP)技术是基于SNP和Indel位点开发的一款自动化、高通量检测的分子标记[4]。其基于标记末端位点的差异,采用双色荧光检测1个SNP位点的2种基因型,可对基因组DNA样品中的目标SNP进行精准的双等位基因分型检测[5]。作为新一代的SNP检测技术,KASP基因分型技术具有较高的准确性、较强的位点适应性以及适合大样本检测等优点,在遗传稳定性、准确性、特异性、灵活度、试验成本和检测效率方面都具有一定的优势[6],是国际上动植物遗传育种主流的SNP分型工具之一,先后建立了小麦、水稻等多种作物基因组KASP标记库,这些标记技术在作物遗传育种研究中具有极高的应用价值[7]。陆海燕等[8]研究表明,KASP标记可在玉米种质资源分析、连锁群构建以及杂种优势群划分等方面发挥重要作用。Makhoul等[9]开发了高度可重复、稳定的KASP检测方法,可预测来自高度同源小麦染色体区域的根生物量QTL单倍型。Steele等[10]通过比较120个不同水稻种质的全基因组序列,确定了合适的位点,产生了最佳的KASP设计,作为灵活有效的分析工具,对行业和监管机构的食品真伪测试具有可利用的价值。Cheon等[11]成功构建了包含205个KASP标记的遗传图谱,在81个KASP标记的系统发育分析中,13个韩国粳稻品种表现出密切的遗传关系。Chen等[12]开发了71 311个玉米的KASP-SNP标记,并定位在16 161个基因上。
甜瓜育种近年来由于重复使用骨干亲本、缺乏新的基因资源以及不够规范的市场经营,使甜瓜品种鉴定难度增大,单单依靠田间表型性状鉴定很难区分[13]。分子标记,特别是微卫星或简单重复序列(SSR)在品种鉴定中发挥着重要作用[14]。目前,在甜瓜中,大部分种质资源及品种的指纹图谱由SSR标记构建[15-17],其缺点是多态性低、操作步骤繁琐、不能实现自动化,而且对于大批量样品检测耗费时间长、人工成本高[18]。因此,开发基于KASP技术的SNP标记用于甜瓜品种鉴定和指纹图谱构建具有重要意义。笔者利用KASP技术筛选出一套能够准确鉴别甜瓜品种的核心KASP-SNP分子标记,并构建甜瓜种质的SNP指纹图谱,以期为甜瓜品种保护和鉴定提供技术支持。
1 材料与方法
1.1 材料
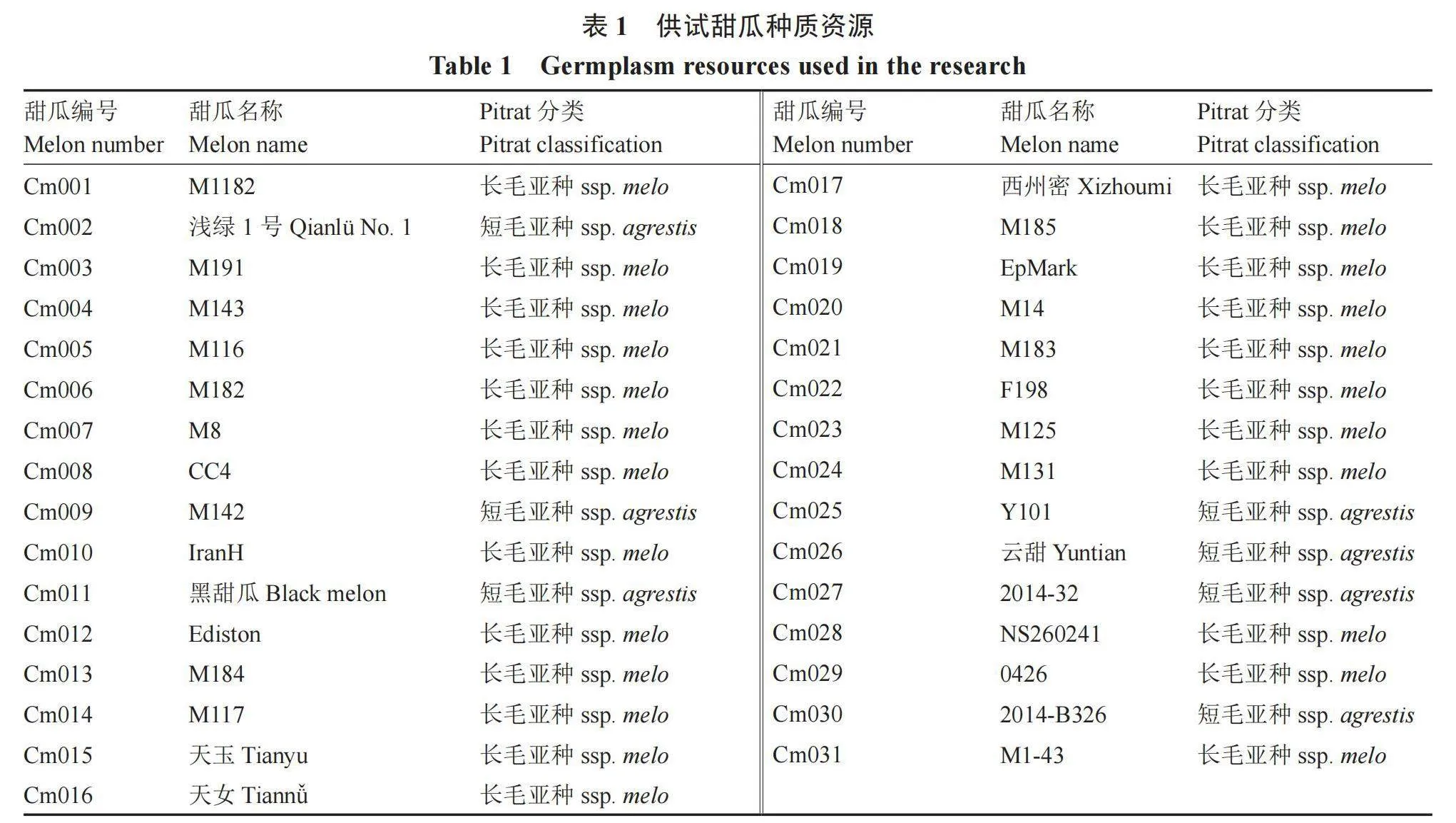
供试的31份甜瓜种质均来自西北农林科技大学西甜瓜种质资源与遗传育种团队,均为自交系。全部甜瓜材料用55 ℃温汤浸种,在25 ℃培养箱中催芽后,于2023年10月播种在西北农林科技大学科研温室50孔穴盘内,每个种质播3粒种子,进行正常的水肥管理,保证能够出芽出苗。甜瓜种质名称如表1所示。
1.2 方法
1.2.1 DNA的提取 待甜瓜幼苗长到2叶1心后,取其嫩叶1 g左右放入冷冻磨样管中,加入1 mL 2% CTAB,放入65 ℃烘箱中加热30 min,加入800 μL体积比为24∶1的氯仿和异戊醇,离心抽取上清液之后再加入2/3体积的异丙醇,上下颠倒之后再离心,用酒精洗涤2次,加入蒸馏水溶解DNA,在4 ℃保存备用。然后使用紫外分光光度计测定每份DNA的浓度,用于PCR反应。
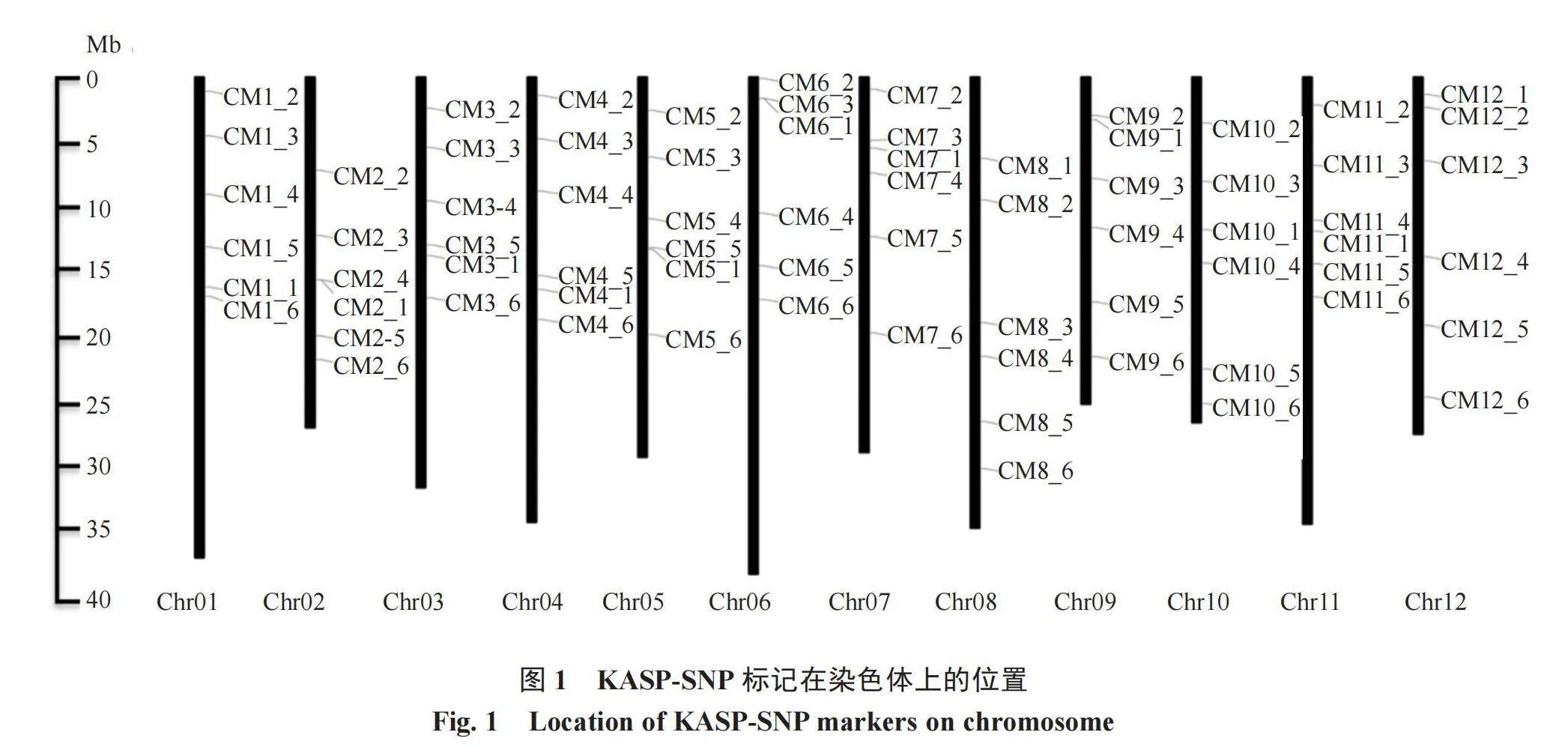
1.2.2 KASP标记的设计 根据西甜瓜种质资源与遗传育种团队甜瓜种质重测序数据和Liu等[19]对297份野生、地方品种和改良甜瓜种质进行重测序获得的2 045 412个优质SNP,利用软件BWA比对到甜瓜基因组DHL92,通过GATK鉴定高质量的SNPs;在甜瓜每条染色体上挑选6个核心SNP位点(在染色体尽量均匀分布),共12条染色体,通过张军利博士开发公布的脚本程序SNP_Primer_Pipeline2-master(https://github.com/pinbo/SNP_Primer _Pipeline)进行KASP引物设计。引物由陕西中科羽瞳生物科技有限公司合成,一套KASP引物包括两条正向竞争性引物(F1/F2)和一条反向通用引物(R)。F1尾部添加能够与FAM荧光结合的特异性序列,F2尾部添加能够与HEX荧光结合的特异性序列。
1.2.3 PCR反应 用蒸馏水溶解稀释引物浓度至 100 μmol·L-1,并且按照如下体系配置引物混合物(Primer Mix):正向引物Forward1和Forward 2各12 μL,反向引物30 μL,加蒸馏水至100 μL,配置完成后保存于4 ℃备用,如果保存较长时间,则在-20 ℃条件下保存。试验采用96孔板,反应孔体系如下:DNA 模板1.00 μL,Primer Mix 0.14 μL,2×KASP Mix(北京嘉程生物科技有限公司产品)5.00 μL,蒸馏水4.00 μL,配置完成后封膜,每组DNA样品中设置2个阴性对照(NTC)。
将加样完成的PCR板放入荧光定量检测仪器中进行荧光定量PCR反应,程序如下:95℃预变性10 min;95 ℃变性15 s,61~55 ℃复性和延伸1 min,10个循环,每循环一次降低0.6 ℃;95 ℃变性15 s,55 ℃退火40 s,35个循环。PCR反应结束后读取数据,若分型不充分,则继续扩增,扩增程序为95 ℃变性20 s,55 ℃退火40 s,每3个循环查看分型情况,直到分型明显。
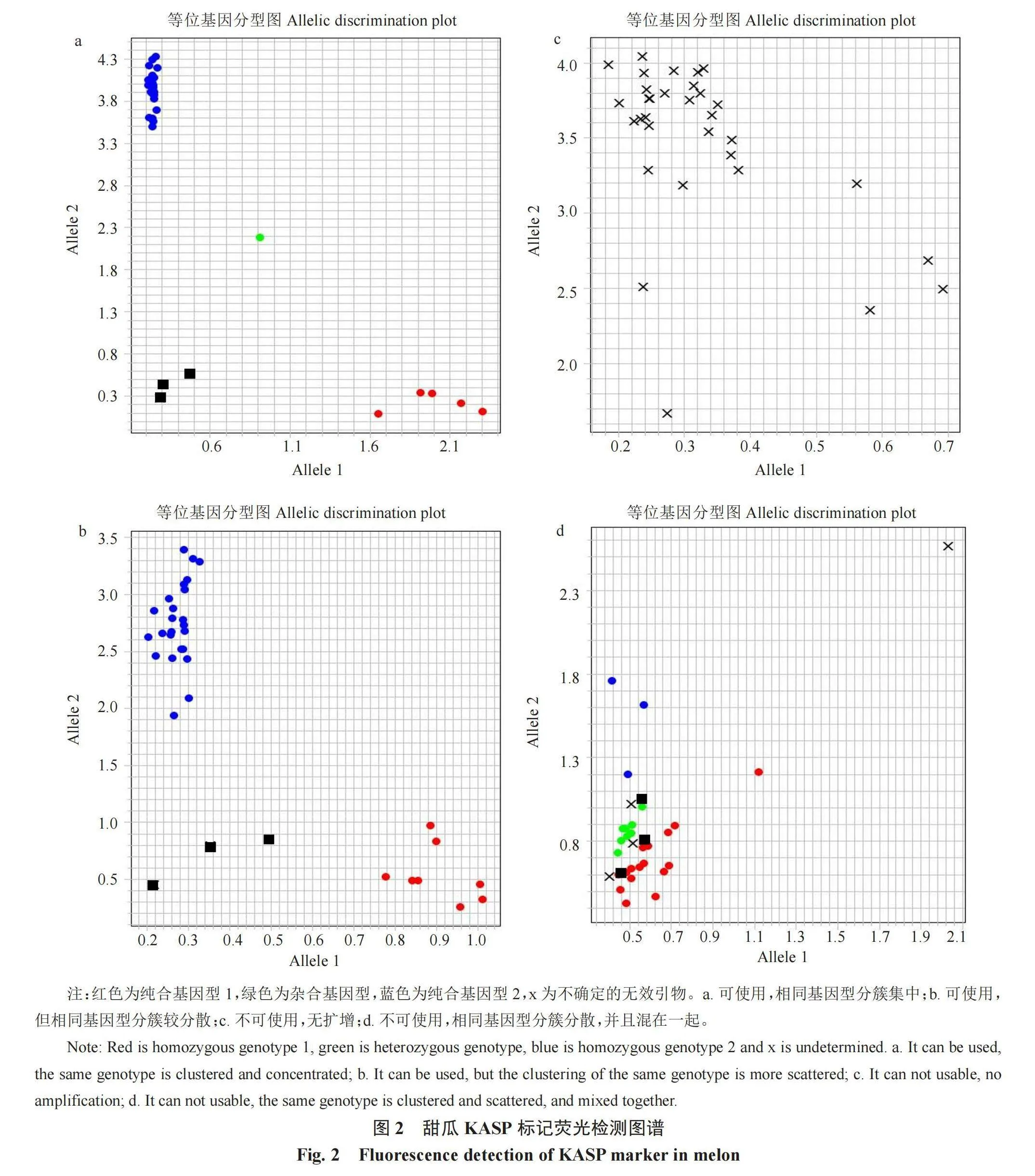
1.2.4 KASP基因分型 荧光定量PCR结束后,使用实时荧光定量PCR仪(QuantStudio 3,赛默飞)进行分型及分析。显示红色、绿色和蓝色的分簇,并且红色和蓝色的分簇分别靠近X轴和Y轴的为有效引物,显示单一黑色的为无效引物。
1.3 数据分析
根据引物信息、荧光信号和分型结果,统计每个SNP位点基因型。使用Excel2010中的插件QR4ofice制作图谱二维码。使用TBtools软件的Show Genes on Chromosome进行标记在染色体位置的分析;采用MEGA X软件10.2.6 wins64版本进行聚类分析。
2 结果与分析
2.1 甜瓜KASP标记的开发
在甜瓜每条染色体上分别设计6个KASP-SNP标记,共72个,其染色体分布如图1所示。在甜瓜全基因组范围共挑选的72个KASP-SNP标记中,所有标记的Tm值在57.018~61.641之间,两条竞争性引物的Tm值差值都为0。引物的序列长度在20~46 bp之间,2条竞争性引物的序列长度差也都为0 bp,GC含量在32.00%~66.67%之间。
2.2 甜瓜KASP标记的验证
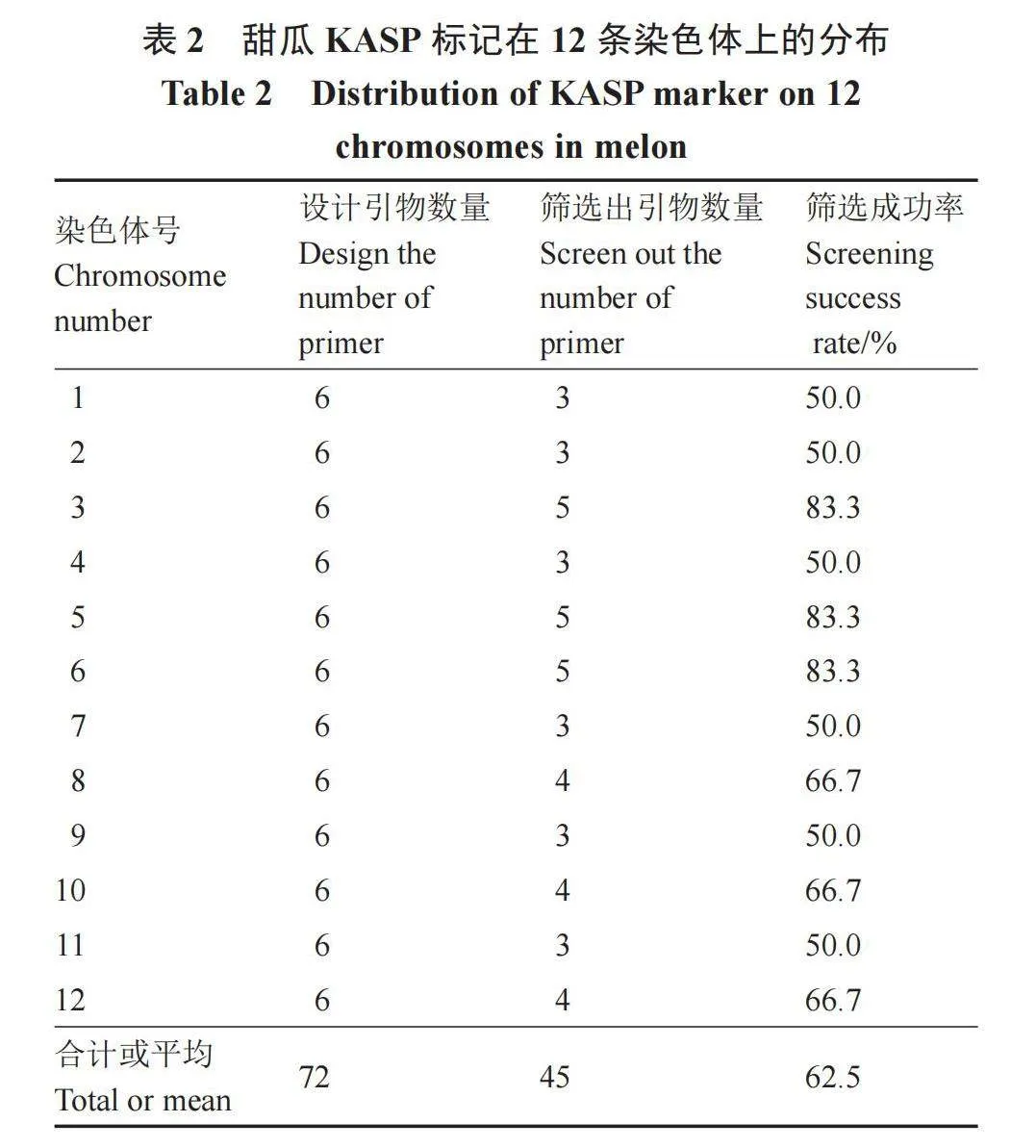
在31个甜瓜种质中初步挑选了11份种质,开展72个KASP标记的分型效果验证。经检测,在72个KASP 标记中,共有45个引物可分型成功,引物设计成功率为62.5%;但每条染色体上的引物成功率也有差异(表2),如5号和6号染色体上引物设计的成功率最高,达到了83.3%,而1号、2号、4号、7号、9号和11号染色体上引物设计的成功率都为50%。
在具有多态性的标记中,有25个相同基因型分簇集中的标记,这类标记为最优标记(图2-a,表3);以及相同基因型分簇较分散的标记(图2-b),虽然扩增之后有更加聚集的趋势,但是这类标记后续进行种质资源或品种材料的遗传多样性分析时存在风险。无扩增的标记在不可使用的标记中的占比最大(图2-c);还有相同基因型分簇分散或者交织在一起的标记(图2-d),这类标记虽然可以将样本聚成3种基因型,但其过于分散或交织,使3种基因型的分型结果彼此之间距离太近,容易产生误判,因此将其归为无法使用;由于所选甜瓜种质资源均为自交系,所以基因型分簇时杂合基因所占比例非常低。
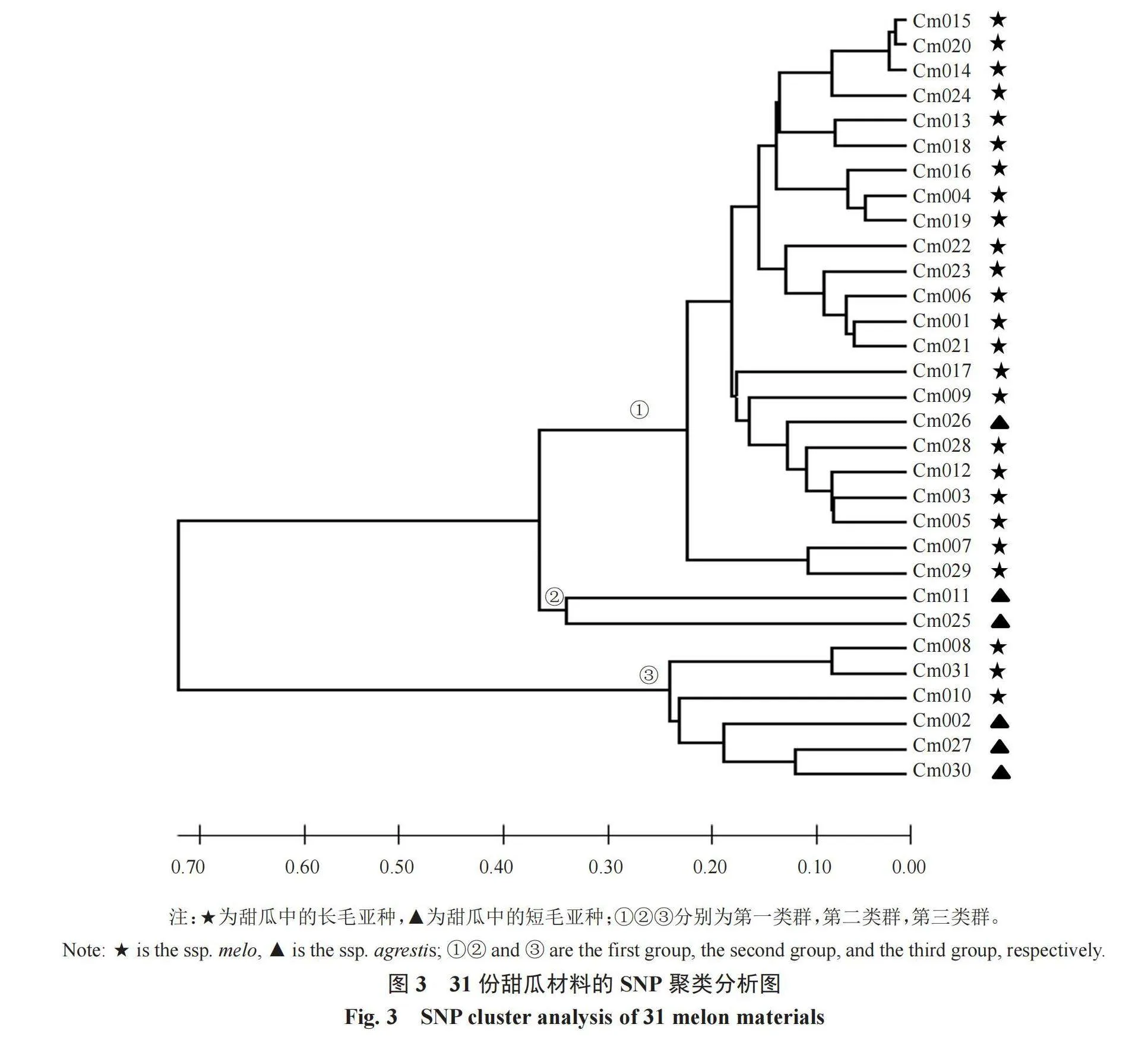
2.3 聚类分析图
根据 KASP 分型结果,笔者将荧光信号转换成不同位点的基因型,运用 MEGA X软件对 31份材料进行进化树分析,结果如图 3所示。在距离为0.2~0.4之间,将参试品种划分为3个类群,第一个类群有23份种质材料,包括天玉(Cm015)、M14(Cm020)、M117(Cm014)等,说明这些种质的遗传关系相近,且除云甜(Cm026)外,其余22份种质都为长毛甜瓜亚种,其幼嫩果皮子房上被密而长的茸毛,包括大部分果型大、耐贮藏的商品甜瓜。第二类群为Y101(Cm025)和黑甜瓜(Cm011),而在选育的时候,他们的育种方向都是短毛甜瓜亚种,这一类群甜瓜的特点为口感鲜美,生长周期短。第三类群为CC4(Cm008)、M1-43(Cm031)、IranH(Cm010)、QianLVNO.1(Cm002)、2014-32(Cm027)和2014-B326(Cm030),而第三类群又被分为了短毛甜瓜亚种和长毛甜瓜亚种2个亚类。
2.4 指纹图谱构建
利用 KASP 分型最优的25个SNP标记构建了甜瓜31个种质的指纹图谱,如表4所示,因所选用的材料都是甜瓜自交系,所以大部分都为纯合基因,在25个SNP标记中,CmSNP10和CmSNP17中除了2个分型失败的种质,其余均为纯合基因,且基因型一致;CmSNP22和 CmSNP25均为纯合基因,但是有两种不同的基因型。CmSNP1、CmSNP2、CmSNP3和CmSNP19中都只有一个杂合基因,其余都为纯合基因。CmSNP18在Cm011中是杂合基因(TC),其他种质在该位点的基因型均为纯合(CC)。CmSNP5和CmSNP6中只有纯合基因型1和杂合基因,没有纯合基因型2。根据位点基因型信息,将每个品种指纹图谱转化为二维码(图4),方便品种的真实性鉴定和推广。
3 讨论与结论
甜瓜栽培历史悠久,早在2000多年前的秦汉时期,已在帝都长安近郊邵平店和湖南长沙马王堆发现了薄皮甜瓜的踪迹[20]。甜瓜育种时,明确种质资源和育种材料的遗传背景至关重要。21世纪初,法国学者Pitrat[21]提出了“栽培甜瓜的种下分类评述”,结合其描述,中国甜瓜材料大致来源于5个变种,包括薄皮甜瓜中的梨瓜变种(var. chinensis)和越瓜变种(var. conomon)、厚皮甜瓜中的粗皮变种(var. cantalupensis)、网纹变种(var. reticulatus)和冬甜瓜变种(var. inodorus)。几年后,Pitrat[22]又在另一篇文章中提出薄皮甜瓜是甜瓜 (Cucumis melo L.)的一种变异类型, 对应于植物学分类的短毛亚种 (ssp. agrestis),而厚皮甜瓜则对应长毛亚种(ssp.melo)。笔者通过对31份甜瓜材料进行聚类分析的结果表明,天玉(Cm015)和M14(Cm020)等都聚在同一个分支,说明这些种质的遗传关系相近,且除了云甜(Cm026)外,都为长毛甜瓜亚种,Y101(Cm025)和黑甜瓜(Cm011)被聚类到同一个分支上,且其都为短毛甜瓜亚种,由此可以证明KASP分子标记技术能初步鉴别甜瓜种质资源,但由于试验甜瓜种质的遗传关系没有足够明确,所以对区分甜瓜种质资源存在可行性,但其实用性还有待进一步检验。徐志红等[23]研究表明,不同类型薄皮甜瓜之间比薄皮甜瓜与厚皮甜瓜之间的亲缘关系更远,新选育的薄皮甜瓜与厚皮甜瓜杂交的品种与传统厚皮甜瓜的亲缘关系近,可划分为厚皮甜瓜,东西方学者根据甜瓜的形态都竞相提出各自的分类系统,分歧甚大[24]。近年来,分子标记技术取得了进步,从限制性片段长度多态性(RFLP)和随机扩增多态性DNA(RAPD) 到扩增片段长度多态性(AFLP)、裂解扩增多态性序列(CAPS)和简单重复序列(SSR)[25-26],而KASP是一种比较新的基因分型测定方法,不仅准确高效,而且试剂价格低廉,在Hao等[27]的研究中,虽然SSR标记依旧有效有用,但是其在试验过程中要么没有目标条带,要么过于复杂而无法识别。与SSR标记相比,KASP因其稳定性、可靠性高和高通量而被广泛使用。赵传超等[28]认为,SSR、插入/缺失标记(InDel)等需要电泳技术进行检测,操作过程较为繁琐,标记数量有限,检测数据整合困难,操作耗时,无法实现大批量的准确检测等问题,正逐渐被SNP标记所取代,主要应用于基因定位和遗传图谱的绘制[29]。叶青静等[30]通过比对常规的PCR标记,KASP-SNP检测数据的读取完全自动化,通过简单的PCR扩增和荧光扫描就能快速获得基因分型结果,不需要经过琼脂糖凝胶电泳分析,从而提高了检测效率,还避免了交叉污染和假阳性的产生。随着育种技术的发展,高效育种的模式需要多个技术的应用,通过第二代测序技术了解育种材料的遗传背景、开发实用的分子标记、进行基因精细定位已经成为常规的研究手段[31],从而使甜瓜育种进入现代分子育种时代。
综上所述,笔者通过KASP技术对11份甜瓜种质进行基因分型,确定了45对具有较好分型效果的标记,并从中挑选25个基因型分簇集中的最优标记,对31份甜瓜种质进行基因分型,构建了31份甜瓜种质的指纹图谱,对后续明确甜瓜种质资源和遗传背景以及鉴定种子纯度等具有重要意义。
参考文献
[1] 刘君璞,马跃.中国西瓜甜瓜发展70年暨科研生产协作60年回顾与展望[J].中国瓜菜,2019,32(8):1-8.
[2] 张琳,闫燊,李琼华,等.2010-2020年中国甜瓜生产成本的县域定点观测数据集[J/OL].中国科学数据(中英文网络版),2021,6(4):171-178.http://dx.doi.org/10.12205/A0017.20210901.20.ds0674.
[3] 胡建斌,马双武,简在海,等.中国甜瓜种质资源形态性状遗传多样性分析[J].植物遗传资源学报,2013,14(4):612-619.
[4] 王倩,任文斌,赵智勇.运旱系列小麦品种(系)品质功能基因KASP标记检测[J].中国粮油学报,2024,39(1):47-53.
[5] BUROW G,CHOPRA R,HUGHES H,et al.Marker assisted selection in sorghum using KASP assay for yhe detection of single nucleotide polymorphism/insertion deletion[J].Methods in Molecular Biology,2019,19(31):75-84
[6] 赵勇,刘晓冬,赵洪锟,等.大豆SNP分型方法的比较[J].分子植物育种,2017,15(9):3540-3546.
[7] 赵越,孙宇峰,徐磊,等.KASP标记技术在作物基因定位中的应用进展[J].北方园艺,2023(19):122-127.
[8] 陆海燕,周玲,林峰,等.基于高通量测序开发玉米高效KASP分子标记[J].作物学报,2019,45(6):872-878.
[9] MAKHOUL M,RAMBLA C,VOSS-FELS K P,et al.Overcoming polyploidy pitfalls:A user guide for effective SNP conversion into KASP markers in wheat[J].Theoretical and Applied Genetics,2020,133(8):2413-2430.
[10] STEELE K,TULLOCH M Q,BURNS M,et al.Developing KASP markers for identification of Basmati rice varieties[J].Food Analytical Methods,2021,14(4):663-673.
[11] CHEON K S,BAEK J,CHO Y,et al.Single nucleotide polymorphism (SNP) discovery and kompetitive allele-specific PCR (KASP) marker development with Korean Japonica rice varieties[J].Plant Breeding and Biotechnology,2018,6(4):391-403.
[12] CHEN Z J,TANG D G,NI J X,et al.Development of genic KASP-SNP markers from RNA-Seq data for map-based cloning and marker-assisted selection in maize[J].BMC Plant Biology,2021,21(1):157.
[13] 吴晶,刘晓宇,伏建国,等.濒危植物黑牡丹KASP鉴定方法的建立[J].安徽农业科学,2024,52(1):98-100.
[14] GAO P,MA H Y,LUAN F S,et al.DNA fingerprinting of chinese melon provides evidentiary support of seed quality appraisal[J].Plos One,2012,7(12):e52431.
[15] 王晋,尤佳,王溪桥,等.甜瓜品种SSR指纹图谱的构建[J].华北农学报,2015,30(增刊1):66-68.
[16] 宋海斌,崔喜波,马鸿艳,等.基于SSR标记的甜瓜品种(系)DNA指纹图谱库的构建[J].中国农业科学,2012,45(13):2676-2689.
[17] 王美荣,许勇,詹永乐,等.厚皮甜瓜品种组合SSR指纹图谱构建[J].中国农学通报,2010,26(20):47-51.
[18] 刘欣,程瑞,徐兵划,等.基于KASP技术的SNP标记用于西瓜品种指纹图谱构建和种子纯度检测[J].江苏农业学报,2022,38(5):1348-1356.
[19] LIU S,GAO P,ZHU Q L,et al.Resequencing of 297 melon accessions reveals the genomic history of improvement and loci related to fruit traits in melon[J].Plant Biotechnology Journal,2020,18(12):2545-2558.
[20] 林德佩.中国栽培甜瓜植物的起源、分类及进化[J].中国瓜菜,2010,23(4):34-36.
[21] PITRAT M,HANELT P,HAMMER K.Some comments on infraspecific class-sification of cultivars of melon[J].Acta Horticulturae Sinica,2000,5(10):29-36.
[22] PITRAT M. Melon[M]//RAJCAN I,VOLLMANN J.Handbook of plant breeding.Berlin:Springer,2008,283-315.
[23] 徐志红,徐永阳,刘君璞,等.甜瓜种质资源遗传多样性及亲缘关系研究[J].果树学报,2008,25(4):552-558.
[24] 姚国新,卢磊,艾娜,等.遗传标记在甜瓜遗传育种中的应用[J].孝感学院学报,2005,25(6):19-22.
[25] BERNARDO,R.Molecular. markers and selection for complex traits in plants:Learning from the last 20 years[J].Crop Science,2008,48(5),1649-1664.
[26] TOAL T W,BURKART-WACO D,HOWELL T,et al.Indel group in genomes (IGG) molecular genetic markers[J].Plant Physiology,2016,172(1),38-61.
[27] HAO X P,YANG T,LIU R,et al.An RNA sequencing transcriptome analysis of grasspea (Lathyrus sativus L.) and development of SSR and KASP markers[J].Frontiers in Plant Science,2017,8:1873.
[28] 赵传超,丛森,梁思怡,等.水稻抗稻瘟病基因Pi2的KASP标记开发与应用[J].华南农业大学学报,2023,44(5):725-734.
[29] 王富强,樊秀彩,张颖,等.SNP分子标记在作物品种鉴定中的应用和展望[J].植物遗传资源学报,2020,21(5):1308-1320.
[30] 叶青静,王荣青,阮美颖,等.番茄枯萎病菌和颈腐根腐病菌KASP-SNP检测技术的建立[J].植物保护学报,2022,49(3):879-889.
[31] 宋正峰,刘树森,夏连芹,等.甜瓜育种技术与方法研究进展[J].中国瓜菜,2022,35(6):1-8.
